2. 上海海洋大学, 水产科学国家级实验教学示范中心, 上海 201306;
3. 中国科学院南海海洋研究所, 中国科学院热带海洋生物资源与生态重点实验室, 广东 广州 510301
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
3. Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China
粒径谱(particle size spectra)作为一种新的生态学方法, 可以反映水生态系统中生物量分布和能量流动过程, 预测生态系统各种生态过程与生产力的变化, 已经成为当今生态学研究尤其是水生生态系统研究的热点[1-3]。2008年欧盟实施的基于生态系统渔业管理(EAFM)办法将鱼类群落粒径结构纳入了《海洋战略框架指导方针》[4] (MSED), 如大型鱼类指标(LFI)[5]作为评估指标之一。目前, 国际上鱼类粒径谱研究与应用已有较多报道[6-12], 而我国在这方面的研究尚处于起步阶段。
大亚湾位于南海北部, 三面环山, 是一个具有亚热带特色的半封闭海湾[13]。海岸线曲折, 生境多样, 是鱼类产卵、索饵和育肥的优良场所和天然种质资源库。然而, 随着社会经济迅速发展, 大亚湾生态系统在人类活动和自然扰动下出现了系统性变化, 生物多样性水平和资源量明显下降[14-15]。20世纪80年代至今, 中国对大亚湾鱼类群落的研究已有大量的报道, 但都是基于分类学等常规研究方法, 而用粒径谱来研究大亚湾鱼类群落特征却未见有报道。本研究根据2016年底拖网调查所获鱼类样品, 构建了春、秋季大亚湾鱼类粒径谱, 以期为大亚湾生态保护和渔业资源的可持续利用提供科学依据。
1 材料与方法 1.1 调查站位结合大亚湾海洋物理特征和生物资源特性, 共设置11个站位进行渔业资源和生态环境调查。其中, 为了研究鱼类生物量粒径谱的空间特征, 湾沿岸设置了S1, S2, S3, S6和S9站点; 湾中部设置了S4, S5, S7和S8站点; 湾口设置S10和S11站点(图 1)。海洋生态环境和渔业资源现场调查、采样、样品保存和实验室分析测试等均按《海洋监测规范》(GB17378-2007)、《海洋调查规范》(GB/T 12763-2007)、《近岸海域环境监测规范》(HJ442-2008)和《海洋渔业资源调查规范》(SC/T 9403-2012)执行。
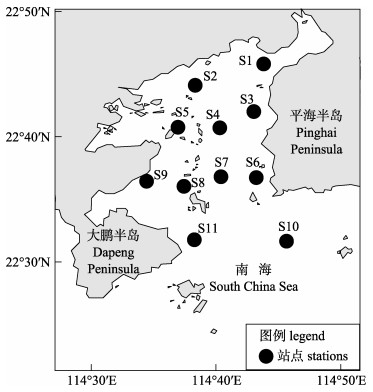
|
图 1 大亚湾海域站位采样示意图 Fig.1 Map of sampling stations in Daya Bay |
采样时间为2016年3月和11月, 分别代表春季和秋季。调查船功率为135 kW, 取样网具为单船有翼单囊底层拖网, 网口周长为102 m, 网衣全长为50 m, 上纲长51 m, 下纲长51 m, 网囊网目尺寸2 cm, 每个站位拖网1次, 每次拖1 h, 平均拖速为3.4 kn。渔获样品在现场进行分类鉴定, 并对各个生物种类进行渔业生物学测定。采样及样品分析均按照《海洋生物调查规范》[16]进行。渔获物的种类鉴定与分类标准主要依据成庆泰[17]、Nelson[18]和李明德等[19]分类系统进行。
1.3 研究方法 1.3.1 Abundance-biomass comparison (ABC)曲线ABC曲线法是由Warwick[20]于1986年提出用来分析渔业资源群落受人类干扰情况的一种方法。在同一坐标系中, 通过比较生物量和数量优势度曲线的变化趋势来分析渔业资源群落的受干扰状况[21]。群落状态主要分为未干扰状态、中等干扰状态和严重干扰状态。其中, 未干扰状态下, 生物量优势度曲线位于数量优势度曲线上方, 群落主要以生长慢且性成熟晚的大型物种为主; 中等干扰状态下, 生物量优势度曲线与数量优势度曲线相交; 严重干扰状态下, 生物量优势度曲线位于数量优势度曲线下方, 群落主要以生长快且性成熟早的小型物种为主[20]。以所有站位物种总数据作为样本来计算各季节及区域ABC曲线, 用W值表示生物量与数量的相对关系统计量[22]:
| $W = \sum\limits_{i = 1}^S {\frac{{{B_i} - {A_i}}}{{50(S - 1)}}} $ |
式中, Ai和Bi分别为ABC曲线中种类序号i对应的数量和生物量的累积百分比, S为总的种类数。
1.3.2 鱼类生物量粒径谱如果最小鱼类物种的大小为V, 那么鱼类粒径谱的第一个粒径级为V~2V, 第2个粒径级为2V~4V, 以此类推, 粒径级的粒径间隔以2为公比成等比数列增长, 将鱼类按照大小分成不同的粒径级[23]。鱼类Sheldon型生物量粒径谱是以log2转换的粒径级上限值来划分粒级作为横坐标, 以log2转换的单位面积上(m2)对应的总生物量作为纵坐标[24]。鱼类标准化生物量粒径谱(normalized biomass size spectrum, NBSS)是以log2转换的粒径级上限值来划分粒级作为横坐标, 以log2转换的单位面积上(m2)对应的生物量与粒径间隔宽度的比值为纵坐标[25]作图。
鱼类Sheldon型生物量粒径谱是用平滑的曲线将各个散点连接起来, 通过曲线上波峰与波谷构成的“峰型”来反映鱼类群落的结构特征[1]。标准化鱼类生物量粒径谱表示鱼类群落生物量在对应粒径间隔上的转化分布, 实质上代表鱼类群落的粒级丰度, 方法上强调异速生长比例, 其在群落稳定状态下, 粒径谱图形呈线性且理论斜率为-1[1, 24];在受外界干扰状态下, 粒径谱图形呈穹顶抛物线型[26-28], 且斜率或曲率的大小与海域的生产状况[29]、鱼类粒径大小[30]、捕捞强度[31]及栖息地环境等因素有关[26]。
1.4 数据处理调查数据经标准化校正后, 用ArcGis10.3软件和SPSS19.0统计分析软件进行处理分析。
2 结果与分析 2.1 ABC曲线春、秋两季大亚湾鱼类资源群落的ABC曲线见图 2。春、秋季鱼类资源群落的数量优势度曲线高于生物量优势度曲线, 均处于严重干扰状态, 其生物量与数量的相对关系统计量W值分别为-0.07和-0.08。
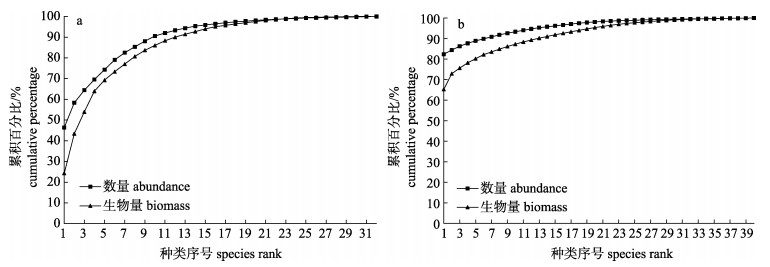
|
图 2 大亚湾海域春季(a)和秋季(b)鱼类群落的ABC曲线 Fig.2 ABC curves of fish community in spring (a) and autumn (b) in Daya Bay |
春、秋季大亚湾海域鱼类Sheldon型生物量粒径谱形状均呈现不规则的锯齿状, 存在明显的季节差异(图 3)和空间差异(图 4)。
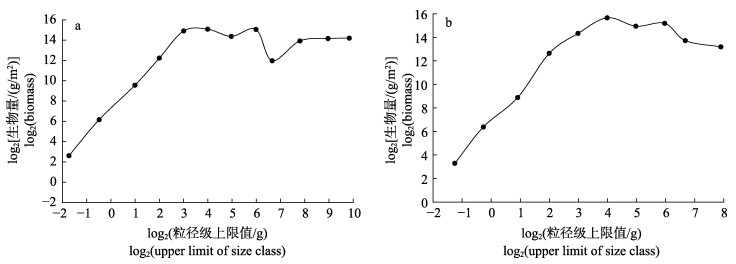
|
图 3 春季(a)和秋季(b)大亚湾海域鱼类Sheldon型粒径谱 Fig.3 Sheldon type particle size spectrum of fish in spring (a) and autumn (b) in Daya Bay |
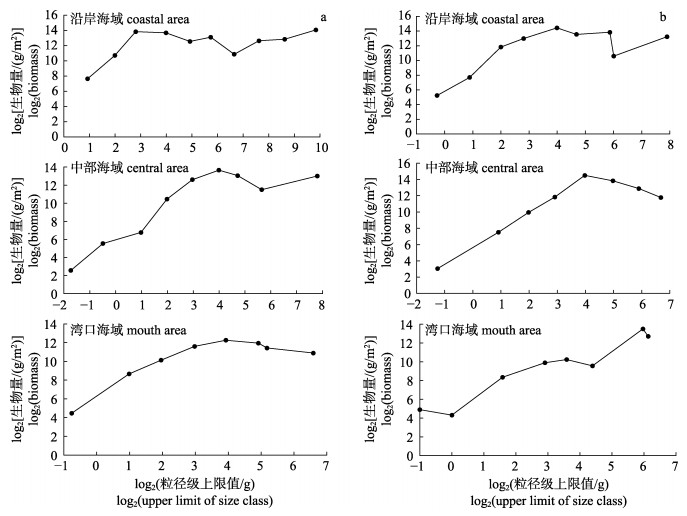
|
图 4 大亚湾海域各区域春季(a)和秋季(b)鱼类Sheldon型生物量粒径谱 Fig.4 Sheldon type biomass particle size spectrum of fish in different areas of Daya Bay in spring (a) and autumn (b) |
季节变化上, 春、秋季鱼类Sheldon型生物量粒径谱大体上呈现单峰模式。其中, 春季波峰和波谷相间分布; 秋季仅有一波峰出现, 而无波谷出现。鱼类粒径范围为–2~10粒径级, 其中, 春季粒径范围大于秋季; 春、秋季最高峰均位于3~4粒径级上, 而春季波谷位于6~7粒径级上(图 3)。
空间变化上, 春、秋季各海区鱼类Sheldon型生物量粒径谱大体上呈现单峰模式。鱼类粒径范围为-2~10粒级, 其中, 春季沿岸和中部海域鱼类粒径范围均高于秋季沿岸和中部海域鱼类粒径范围, 而湾口海域粒径范围则相同。沿岸海域粒径谱波峰与波谷相间分布, 且春季最高峰在9~10粒径级上, 秋季峰值位于3~4粒径级上。中部海域, 最高峰值位于3~4粒径级上。湾口海域, 春季峰值位于3~4粒径级上, 秋季峰值位于5~6粒径级上(图 4)。
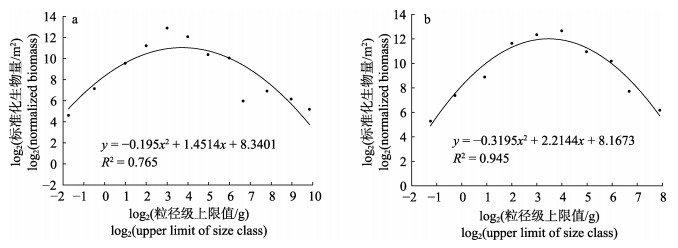
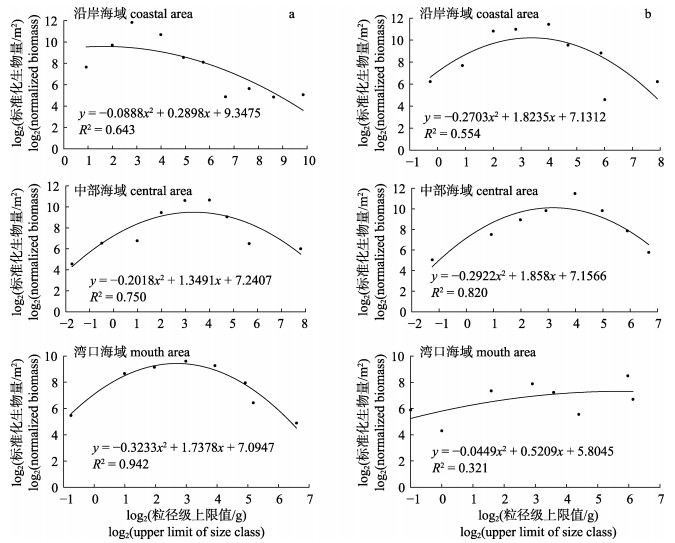
2.3 标准化生物量粒径谱对2个季节的鱼类生物学数据进行分析, 构建了春、秋季鱼类标准化生物量粒径谱图形, 所有的回归结果均具有显著性(P < 0.05), 且存在明显的季节差异(图 5)和空间差异(图 6)。
|
图 5 大亚湾海域鱼类春季(a)和秋季(b)标准化生物量粒径谱 Fig.5 Normalized biomass particle size spectrum of fish in Daya Bay in spring (a) and autumn (b) |
|
图 6 大亚湾海域各区域鱼类春季(a)和秋季(b)标准化生物量粒径谱 Fig.6 Normalized biomass particle size spectra of fish in different regions of Daya Bay in spring (a) and autumn (b) |
季节变化上, 春、秋季鱼类标准化生物量粒径谱的曲率分别为–0.20和–0.32, 且春季曲线弯曲相对平缓, 秋季曲线弯曲较陡峭。春秋季曲线穹顶均位于2~5粒径级范围上。春、秋季回归系数R2分别为0.77和0.95 (图 5)。
空间变化上, 春、秋季鱼类标准化生物量粒径谱存在明显的差异。春季, 曲率范围为-0.32~ -0.09, 其中, 沿岸海域最大, 湾中部海域次之, 湾口海域最小; R2范围为0.64~0.94, 其中, 湾口海域最大, 湾中部海域次之, 沿岸海域最小。秋季, 曲率范围为-0.29~0.04, 其中, 湾口海域最大, 沿岸海域次之, 湾中部海域最小; R2范围为0.32~ 0.83, 其中, 湾中部海域最大, 沿岸海域次之, 湾口海域最小(图 6)。
3 讨论 3.1 ABC曲线ABC曲线特征反映了鱼类群落中不同粒径物种的生物量与数量的变化趋势[21]。春季, 数量百分比位于前三位的是二长棘犁齿鲷(Evynnis cardinalis)、竹荚鱼(Trachurus japonicus)和李氏䲗(Callionymus richardsoni), 生物量百分比位居前三的是二长棘犁齿鲷、斑鰶(Konosirus punctatus)和金钱鱼(Scatophagus argus)。其中, 斑鰶和金钱鱼的生物量百分比高于数量百分比, 平均个体质量较高, 分别为37.3 g和194.4 g, 其他3种平均个体质量均低于9 g。秋季, 数量百分比位居前三的是短吻鲾(Leiognathus brevirostris)、斑鳍白姑鱼(Argyrosomus pawak)和拟矛尾虾虎鱼(Parachae turichthys polynema), 生物量百分比位居前三的是短吻鲾、龙头鱼(Harpodon nehereus)和孔虾虎鱼(Trypauchen vagina), 其中, 龙头鱼和孔虾虎鱼的生物量百分比高于数量百分比, 平均个体质量较高, 分别为48.8 g和36.1 g, 其他3种平均个体质量均低于9 g。春、秋季ABC曲线表明两个季节鱼类群落结构均处于严重干扰状态, 鱼类群落组成主要以生长快且性成熟早的小型物种为主[21-22], 与本次春季鱼类群落组成主要以二长棘犁齿鲷、李氏䲗、斑鰶、和竹荚鱼等粒径小的鱼类为主, 秋季鱼类群落组成以短吻鲾、李氏䲗、斑鳍白姑鱼、矛尾虾虎鱼(Chaeturichthys stigmatias)和基岛䲗 (Callionymus kaianus)等粒径小的鱼类物种为主的结果相吻合。此外, 春季W值大于秋季, 表明春季鱼类群落结构优于秋季。春季, 气温较低, 捕捞压力相对较小; 秋季, 气温升高, 鱼类经过夏季的生长, 体长和体重均大幅增加, 加上休渔期结束后受过度捕捞影响致使大型鱼类资源量下降, 鱼类群落受干扰程度较大, 群落结构劣于春季。
3.2 大亚湾鱼类生物量粒径谱特征 3.2.1 鱼类粒径结构及组成海洋生态系统中的物质与能量流动、生物群落的结构与功能以及理化过程与生物的粒径紧密相关[32-34], 因此生物粒径谱可用来反应生物群落的结构组成[35]。-2~-1粒径级上主要由1尾斑纹舌虾虎鱼(Glossogobius olivaceus)和1尾斑鳍白姑鱼幼鱼组成; -1~0粒径级上主要由2尾斑纹舌虾虎鱼、3尾褐菖鲉(Sebastiscus marmoratus)和3尾斑鳍白姑鱼幼鱼组成; 0~1粒径级上主要由10尾斑纹舌虾虎鱼、4尾矛尾虾虎鱼和8尾斑鳍白姑鱼幼鱼组成; 1~2粒径级上主要由少量个体小的斑纹舌虾虎鱼、二长棘犁齿鲷、拟矛尾虾虎鱼和短吻鲾组成; 2~3粒径级上主要由较多个体小的二长棘犁齿鲷、竹荚鱼、拟矛尾虾虎鱼和短吻鲾组成; 3~4粒径级上由于主要由大量个体小的二长棘犁齿鲷、李氏䲗、竹荚鱼和短吻鲾等鱼类组成; 4~5粒径级上主要由绿斑细棘虾虎鱼(Acentrogobius chlorostigmatoides)、李氏䲗、勒氏短须石首鱼(Umbrina russelli)和短吻鲾等鱼类组成; 5~6粒径级上主要由较多斑鰶幼体和龙头鱼幼体组成; 6~7粒径级上主要由单尾个体大的星点东方鲀(Takifugu niphobles)、黑鲷(Sparus macrocephalus)、杂食豆齿鳗(Pisoodonophis boro)和6尾龙头鱼组成; 7~8粒径级上主要由单尾个体大的艾氏蛇鳗(Ophichthus evermanni)、鳗鲇(Plotosus lineatus)和4尾金钱鱼(Scatophagus argus)组成; 8~9粒径级上由单尾个体大的金钱鱼和二长棘犁齿鲷组成; 9~10粒径级上由单尾个体较大的矛尾虾虎鱼组成。
3.2.2 鱼类粒径谱特征分析鱼类物种粒径的大小影响鱼类运动[36-37]、捕食[38-40]、繁殖[41]和死亡[42], 主要受海域生产力水平[29]、物种补偿比率[43]、海域生态环境[44]和捕捞强度[45](尤其是过度捕捞[46])的影响, 且粒径谱曲线随捕捞强度的增大而更加陡峭[1]。春季, 大亚湾生产力水平相对较低, 斑鰶、竹荚鱼、带鱼(Trichiurus haumela)等产卵鱼类开始大量产卵, 以鱼卵和幼鱼居多[13], 人类捕捞压力较小, 且捕获了1尾体质量大的矛尾虾虎鱼(915 g)和1尾二长棘犁齿鲷(498 g)使得8~10粒径级上生物量相对较高, 而最小粒径级(-2~-1)上主要鱼类物种为斑纹舌虾虎鱼幼体, 生物量较低, 从而导致鱼类标准化生物量粒径谱曲线较平缓。秋季, 大亚湾生产力水平较高, 且鱼类经过休渔期及夏季的生长, 鱼类体质量和粒径增加(春、秋季鱼类平均体重分别为9 g和27 g), 但休渔期一结束, 8月16日起进入开捕期, 人类捕捞强度增大致使海域鱼类资源量骤减, 尤其是粒径大的鱼类物种减少, 使得鱼类粒径整体上减小, 粒径范围小于春季, 标准化生物量粒径谱曲线变得陡峭, 鱼类群落组成以短吻鲾和李氏䲗等小型鱼类物种为主, 且小型化和低值化趋势显著。
通常在粒径小的物种和粒径大的物种处形成波峰, 在二者交汇处形成波谷[47]。本研究波峰所在粒径物种组成主要以丰度高粒径小的鱼类为主, 波谷处于小型粒径和大型粒径物种交汇处, 且群落组成中特殊物种的出现对生物量粒径谱图形有着重要的影响。春季, 在3~4粒径级上捕获了大量二长棘犁齿鲷、李氏䲗和竹荚鱼等粒径小的鱼类, 使其生物量最高形成波峰; 而在6~7粒径级上捕获了1尾星点东方鲀和较多当年生斑鰶幼体, 生物量低于5~6和7~8粒径级上鱼类物种生物量, 致使在6~7粒径级上形成波谷; 此外, 捕获到少量粒径大具有洄游习性的金钱鱼, 致使春季出现9~10粒经级, 粒径范围大于秋季, 粒径结构优于秋季。秋季, 捕获了大量粒径小的短吻鲾, 且在3~4粒径级上短吻鲾的尾数百分比和质量百分比分别占粒径组总渔获量的68.59%和71%, 致使3~4粒径级上生物量最高, 从而形成波峰。同时, 春季捕获了少量粒径大的常年定居性鱼种二长棘犁齿鲷和季节洄游性鱼种鳗鲇, 使得8~10粒径级上生物量较高, 秋季捕获了少量粒径大的常年定
居性鱼种龙头鱼使得5~8粒径级上生物量较低, 从而致使海域标准化生物量粒径谱的曲线变得陡峭且曲率下降。沿岸海域, 由于秋季在3~6粒径级上捕获了大量当年生的短吻鲾幼鱼和粒径小的勒氏短须石首鱼, 生物量均较高, 致使鱼类标准化生物量粒径谱曲线变的陡峭且曲率减小。中部海域, 由于秋季捕获了少数粒径较大的杂食豆齿鳗和龙头鱼, 致使5~7粒径级上生物量最低, 鱼类标准化生物量粒径谱的曲线相对陡峭且曲率减小。湾口海域, 由于秋季捕获了少数粒径较大的龙头鱼, 使得6~7粒径级上生物量较低, 且最小粒径级上鱼类组成的生物量较高, 导致鱼类标准化生物量粒径谱的曲线相对平缓且曲率增大。
3.3 展望由于海域生态系统受自然干扰和人类活动的影响, 尤其是人类捕捞活动的影响, 造成大亚湾海域生态环境恶化, 栖息地遭到破坏, 大型经济鱼类资源量剧减, 鱼类组成以小型鱼类为主[14], 致使大亚湾鱼类粒径谱形状呈“单峰”模式, 这反映了大亚湾海域生态系统对外界干扰状态下的适应性响应, 表明鱼类群落已偏离稳定状态, 鱼类粒径结构处于不平衡状态。本次调查采用底拖网, 由于受大亚湾地形、利用现状影响及湾中多岛礁不易进行拖网捕捞, 致使部分区域不能调查;同时, 受采样网目尺寸限制, 捕捞最小粒径-2~0物种较少, 导致渔获鱼类粒径范围分布不均匀, 对该海域鱼类粒径谱的研究带来一定的缺陷, 不能很好地体现鱼类群落的粒径结构特征;此外, 采样调查及数据测量过程中, 势必会存在一定误差, 这对研究鱼类群落粒径结构也带来一定影响;在与以往比较上, 由于具有可比性历史资料不多, 无法获取以往原始数据, 且对大亚湾鱼类生物量粒径谱的研究未有报道, 这在一定程度上也影响对大亚湾鱼类粒径结构及其生态特征演变进行准确判断。因此, 在今后研究中, 应加大调查力度和范围以便渔获粒径分布范围广泛的鱼类样品, 同时研发新技术, 尽可能减少误差, 进行连续性研究, 以便客观的反映大亚湾鱼类生物量粒径谱特征。
现今, 人们正在充分开发利用鱼类粒径谱模型来监测生态假设, 例如, 捕捞[48]、繁殖策略[49]或不同环境变化[50]等对鱼类群落的响应。同时, 人们也认识到了鱼类群落物种多样性结构对海洋生态系统的功能和恢复力具有重要的影响, 这也促使了基于粒径特性的鱼类粒径谱的发展[51]。在今后的研究过程中, 我们应不断地完善和发展鱼类粒径谱方法, 以便更好地应用和服务于海洋渔业资源的开发和保护。
| [1] |
Guo J Z, Chen Z Z, Xu S N. Advances in fish particle size spectra study[J]. Marine Fisheries, 2017(5): 582-591. [郭建忠, 陈作志, 徐姗楠. 鱼类粒径谱研究进展[J]. 海洋渔业, 2017(5): 582-591. DOI:10.3969/j.issn.1004-2490.2017.05.012] |
| [2] |
Sheldon R W, Parsons T R. A continuous size spectrum for particulate matter in the sea[J]. Journal of the Fisheries Re-search Board of Canada, 2011, 24(5): 909-915. |
| [3] |
Zhou L B, Tan Y H, Huang L M, et al. The advances in the aquatic particle/biomass size spectra study[J]. Acta Ecologica Sinica, 2010, 30(12): 3319-3333. [周林滨, 谭烨辉, 黄良民, 等. 水生生物粒径谱/生物量谱研究进展[J]. 生态学报, 2010, 30(12): 3319-3333.] |
| [4] |
MSFD. Directive 2008/56/EC of the European Parliament and the Council of 17 June 2008 Establishing a Framework for Community Action in the Field of Marine Environmental Policy (Marine Strategy Framework Directive)[J/OL]. Official Journal of the European Union, 2008, 164: 19-40[2018- 04-10]. https: //eur-lex.europa.eu/legal-content/EN/TXT/?uri=pi_com: C(2017)2842.
|
| [5] |
Greenstreet S P R, Rogers S I, Rice J C, et al. Development of the EcoQO for fish communities in the North Sea[J]. ICES Journal of Marine Science, 2011, 68: 1-11. DOI:10.1093/icesjms/fsq156 |
| [6] |
Macpherson E, Gordoa A, Garcia R A. Biomass size spectra in littoral fishes in protected and unprotected areas in the NW Mediterranean[J]. Estuarine Coastal and Shelf Science, 2002, 55(5): 777-788. DOI:10.1006/ecss.2001.0939 |
| [7] |
Emmrich M, Brucet S, Ritterbusch D, et al. Size spectra of lake fish assemblages:Responses along gradients of general environmental factors and intensity of lake-use[J]. Freshwater Biology, 2011, 56(11): 2316-2333. DOI:10.1111/j.1365-2427.2011.02658.x |
| [8] |
Borgmann U. Particle-size-conversion efficiency and total animal production in pelagic ecosystems[J]. Canadian Jour-nal of Fisheries and Aquatic Sciences, 1982, 39(5): 668-674. DOI:10.1139/f82-096 |
| [9] |
Banse K, Mosher S. Adult body mass and annual produc-tion/biomass relationships of field populations[J]. Ecological Monographs, 1980, 50(3): 355-379. DOI:10.2307/2937256 |
| [10] |
Zwanenburg K C T. The effects of fishing on demersal fish communities of the Scotian Shelf[J]. ICES Journal of Marine Science, 2000, 57(3): 503-509. DOI:10.1006/jmsc.2000.0744 |
| [11] |
Blanchard J L, Andersen K H, Scott F, et al. Evaluating targets and trade-offs among fisheries and conservation objectives using a multispecies size spectrum model[J]. Journal of Applied Ecology, 2014, 51(3): 612-622. DOI:10.1111/1365-2664.12238 |
| [12] |
Graham N, Dulvy N K, Jennings S, et al. Size-spectra as indicators of the effects of fishing on coral reef fish assem-blages[J]. Coral Reefs, 2005, 24(1): 118-124. DOI:10.1007/s00338-004-0466-y |
| [13] |
Xu G Z. Environments and Resources of Daya Bay[M]. Hefei: Anhui Science & Technology Publishing House, 1989: 245-272. [徐恭昭. 大亚湾环境与资源[M]. 合肥: 安徽科学技术出版社, 1989: 245-272.]
|
| [14] |
Wang X H, Du F Y, Qiu Y S, et al. Variations of fish species diversity, faunal assemblage, and abundances in Daya Bay in 1980-2007[J]. Chinese Journal of Applied Ecology, 2010, 21(9): 2403-2410. [王雪辉, 杜飞雁, 邱永松, 等. 1980-2007年大亚湾鱼类物种多样性、区系特征和数量变化[J]. 应用生态学报, 2010, 21(9): 2403-2410.] |
| [15] |
Chen P M, Yuan H R, Jia X P, et al. Changes in fishery resources of Yangmeikeng artificial reef area in Daya Bay[J]. South China Fisheries Science, 2013, 9(5): 100-108. [陈丕茂, 袁华荣, 贾晓平, 等. 大亚湾杨梅坑人工鱼礁区渔业资源变动初步研究[J]. 南方水产科学, 2013, 9(5): 100-108. DOI:10.3969/j.issn.2095-0780.2013.05.016] |
| [16] |
National Standardization Administration AQSIQ. Ocean Investigation Standards Part 6: Marine Biological Survey[S]. Beijing, 2007. [国家标准化委员会国家质检总局.海洋调查规范第6部分: 海洋生物调查[S].北京, 2007.]
|
| [17] |
Cheng Q T. Chinese Fish System Search[M]. Beijing: Sci-ence Press, 1987: 248-513. [成庆泰. 中国鱼类系统检索[M]. 北京: 科学出版社, 1987: 248-513.]
|
| [18] |
Nelson J S. Fishes of the World[M]. 4th Edition. Hoboken: John Wiley & Sons, 2006: 334.
|
| [19] |
Li M D. Fish Taxonomy[M]. Beijing: China Ocean Press, 1998: 28-47. [李明德. 鱼类分类学[M]. 北京: 海洋出版社, 1998: 28-47.]
|
| [20] |
Warwick R M. A new method for detecting pollution effects on marine macrobenthic communities[J]. Marine Biology, 1986, 92(4): 557-562. DOI:10.1007/BF00392515 |
| [21] |
Yemane D, Field J G, Leslie R W. Exploring the effects of fishing on fish assemblages using Abundance Biomass Comparison (ABC) curves[J]. ICES Journal of Marine Science, 2005, 62(3): 374-379. DOI:10.1016/j.icesjms.2005.01.009 |
| [22] |
Yan L, Tan Y G, Yang B Z, et al. Comparison on resources community of stow-net fishery before and after fishing off season in Huangmaohai Estuary[J]. South China Fisheries Science, 2016, 12(6): 1-8. [晏磊, 谭永光, 杨炳忠, 等. 基于张网渔业休渔前后的黄茅海河口渔业资源群落比较[J]. 南方水产科学, 2016, 12(6): 1-8. DOI:10.3969/j.issn.2095-0780.2016.06.001] |
| [23] |
Sheldon R W, Prakash A, Sutcliffe W H. The size distribu-tion of particles in the ocean[J]. Limnology & Oceanography, 1972, 17(3): 327-340. |
| [24] |
Jung S, Houde E D. Fish biomass size spectra in Chesapeake Bay[J]. Estuaries and Coasts, 2005, 28(2): 226-240. DOI:10.1007/BF02732857 |
| [25] |
Sprules W, Munawar M. Plankton size spectra in relation to ecosystem productivity, size, and perturbation[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1986, 43(9): 1789-1794. DOI:10.1139/f86-222 |
| [26] |
Sprules, W G, Stockwell, J D. Size-based biomass and production models in the St Lawrence Great Lakes[J]. ICES Journal of Marine Science, 1995, 52(3-4): 705-710. DOI:10.1016/1054-3139(95)80083-2 |
| [27] |
Duplisea D E, Kerr S R. Application of a biomass size spe-ctrum model to demersal fish data from the Scotian Shelf[J]. Journal of Theoretical Biology, 1995, 177(3): 263-269. |
| [28] |
Kerr S R, Dickie L M. The Biomass Spectrum[M]. New York: Columbia University Press, 1893: 110-128.
|
| [29] |
Macpherson E, Gordoa A. Biomass spectra in benthic fish assemblages in the Benguela System[J]. Marine Ecology Progress Series, 1996, 138(1-3): 27-32. |
| [30] |
Trebilco R, Baum J K, Salomon A K, et al. Ecosystem ecology:Size-based constraints on the pyramids of life[J]. Trends in Ecology & Evolution, 2013, 28(7): 423-431. |
| [31] |
Rochet M J, Benoît E. Fishing destabilizes the biomass flow in the marine size spectrum[J]. Proceedings:Biological Sciences, 2012, 279(1727): 284-292. DOI:10.1098/rspb.2011.0893 |
| [32] |
Ray S, Bereca L, Strakrabaa M, et al. Optimization of exergy and implications of body sizes of phytoplankton and zooplankton in an aquatic ecosystem model[J]. Ecological Modelling, 2001, 140(3): 219-234. DOI:10.1016/S0304-3800(01)00322-2 |
| [33] |
Belgrano A, Brown J H. Oceans under the macroscope[J]. Nature, 2002, 419(6903): 128-129. DOI:10.1038/419128a |
| [34] |
Li W K W. Macroecological patterns of phytoplankton in the northwestern North Atlantic Ocean[J]. Nature, 2002, 419(6903): 154-157. DOI:10.1038/nature00994 |
| [35] |
Marquet P A, Quiñones R A, Abades S, et al. Scaling and power-laws in ecological systems[J]. Journal of Experimental Biology, 2005, 208(9): 1749-1769. DOI:10.1242/jeb.01588 |
| [36] |
Bainbridge R. The speed of swimming of fish as related to size and to the frequency and amplitude of the tail beat[J]. Journal of Experimental Biology, 1958, 35(1): 109-133. |
| [37] |
Ware D M. Bioenergetics of pelagic fish:theoretical change in swimming speed and ration with body size[J]. Journal of the Fisheries Research Board of Canada, 1978, 35(2): 220-228. DOI:10.1139/f78-036 |
| [38] |
Cohen J E, Pimm S L, Yodzis P, et al. Body sizes of animal predators and animal prey in food webs[J]. Journal of Ani-mal Ecology, 1993, 62(1): 67-78. DOI:10.2307/5483 |
| [39] |
Lundvall D, Svanbäck R, Persson L, et al. Size-dependent predation in piscivores:Interactions between predator foraging and prey avoidance abilities[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1999, 56(7): 1285-1292. DOI:10.1139/f99-058 |
| [40] |
Scharf F S, Juanes F, Rountree R A. Predator size-prey size relationships of marine fish predators:interspecific variation and effects of ontogeny and body size on trophic-niche breadth[J]. Marine Ecology Progress, 2000, 208(1): 229-248. |
| [41] |
Woodward G, Bo E, Emmerson M, et al. Body size in eco-logical networks[J]. Trends in Ecology & Evolution, 2005, 20(7): 402-409. |
| [42] |
Peterson I, Wroblewski J S. Mortality rate of fishes in the pelagic ecosystem[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2011, 41(7): 1117-1120. |
| [43] |
Jennings S, Reynolds J D. Body size, exploitation and con-servation of marine organisms[M]. England: Cambridge University Press, 2007: 266-285.
|
| [44] |
Qiu Y S. The regional changes of fish community on the northern continental shelf of South China Sea[J]. Journal of Fisheries of China, 1988, 12(4): 303-313. [邱永松. 南海北部大陆架鱼类群落的区域性变化[J]. 水产学报, 1988, 12(4): 303-313.] |
| [45] |
Wang Y Z, Sun D R, Jia X P, et al. Influence of fishing pressure and climate change on filefish catches in East China Sea[J]. South China Fisheries Science, 2013, 9(1): 8-15. [王跃中, 孙典荣, 贾晓平, 等. 捕捞压力和气候变化对东海马面鲀渔获量的影响[J]. 南方水产科学, 2013, 9(1): 8-15. DOI:10.3969/j.issn.2095-0780.2013.01.002] |
| [46] |
Fenberg P B, Roy K. Ecological and evolutionary conse-quences of size-selective harvesting:How much do we know?[J]. Molecular Ecology, 2008, 17(1): 209-220. |
| [47] |
Schwinghamer P. Characteristic size distributions of integral benthic communities[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1981, 38(10): 1255-1263. DOI:10.1139/f81-167 |
| [48] |
Bianchi G, Gislason H, Graham K, et al. Impact of fishing on size composition and diversity of demersal fish communities[J]. ICES Journal of Marine Science, 2000, 57(3): 558-571. DOI:10.1006/jmsc.2000.0727 |
| [49] |
Andersen K H, Beyer J E, Pedersen M, et al. Life-history constraints on the success of the many small eggs reproductive strategy[J]. Theoretical Population Biology, 2008, 73(4): 490-497. DOI:10.1016/j.tpb.2008.02.001 |
| [50] |
Mézo P L, Lefort S, Séférian R, et al. Natural variability of marine ecosystems inferred from a coupled climate to ecosystem simulation[J]. Journal of Marine Systems, 2016, 153: 55-66. DOI:10.1016/j.jmarsys.2015.09.004 |
| [51] |
Blanchard J L, Law R, Castle M D, et al. Coupled energy pathways and the resilience of size-structured food webs[J]. Theoretical Ecology, 2011, 4(3): 289-300. DOI:10.1007/s12080-010-0078-9 |
 2019, Vol. 26
2019, Vol. 26

