2. 武昌理工学院 生命科学学院, 湖北 武汉 430223
2. College of Life Science, Wuchang University of Technology, Wuhan 430223, China
鲟是中国重要的淡水养殖品种之一, 在中国淡水养殖业中具有重要地位[1]。中国鲟养殖主要集中在山东、湖北、云南、四川、浙江、贵州、北京等省(直辖市)。据统计, 2015年全国鲟总产量为9.08万t, 比2014年产量增长19.64%, 在淡水养殖主要鱼类中产量增值幅度排名第二, 呈快速发展势头[2]。施氏鲟(Acipenser schrenckii Brandt, 1869)是中国重要的鲟养殖品种之一, 在中国北方地区野生资源量丰富[3]。随着施氏鲟南移驯养获得成功, 其养殖范围与规模的不断扩大, 经济效益显著。然而, 随着施氏鲟养殖规模与集约化程度的不断提高, 施氏鲟病害问题日益突出, 给养殖业造成重大经济损失, 目前已成为威胁中国施氏鲟养殖业健康发展的主要因素[4]。
国外开展鲟病原性疾病研究已有较长的历史, 目前已发现多种可感染鲟的病毒病原[5]。迄今为止, 国内尚未发现养殖鲟的病毒性疾病的报道, 但已发现危害养殖鲟的多种细菌性病原, 如嗜水气单胞菌(Aeromonas hydrophila, Ah)、温和气单胞菌(Aeromonas sobria)、致伤弧菌(Vibrio vulnificus)、鲁氏耶尔森菌(Yersinia ruckeri)、类志贺邻单胞菌(Plesiomonas shigelloide)和分枝杆菌(Mycobacterium)等, 其中, 嗜水气单胞菌感染最为普遍, 危害最为严重[5]。嗜水气单胞菌隶属于单胞菌科(Aermonadaceae)气单胞菌属, 广泛分布于淡水、污水及土壤中, 能感染多种水产养殖动物导致疾病[6-7]。鲟细菌性败血症, 由嗜水气单胞菌引起, 主要症状为腹部、口腔周围、骨板基部出血, 肛门红肿, 鳃丝颜色较淡; 剖检有淡红色腹水, 肌肉、肾脏、性腺充血, 后肠出血发炎, 并充满泡沫状黏液物质, 可引起鲟大规模死亡[4, 8-10]。长期以来, 主要依赖抗生素对鲟细菌性败血症进行治疗, 但是随着病原菌耐药性产生, 水产品质量安全问题日渐显现, 研究新的防疫方法已成为养殖鲟病害防控技术研究的热点。免疫预防技术已被证实是预防鱼类疾病发生与流行最为有效的途径[11-12]。本研究用福尔马林灭活的嗜水气单胞菌作为免疫原, 免疫健康的施氏鲟, 通过测定施氏鲟外周血的免疫指标和相对保护率, 初步查明了疫苗免疫施氏鲟的免疫应答反应过程与免疫保护效力, 旨在为养殖鲟细菌性疾病的免疫预防技术研究奠定前期基础。
1 材料与方法 1.1 实验鱼健康施氏鲟采集自长江水产研究所鲟养殖实验基地, 体长为(15±2) cm, 体重为(12±3) g, 鱼体体色正常、体表无损伤。实验前于室内500 L塑料水族箱中暂养2周, 水温控制在(23±1)℃, 每天投喂2次商品化鲟饲料。
1.2 菌种与培养嗜水气单胞菌(CCTCC NO: M 2016555)分离自患病施氏鲟脾脏, 由本实验室分离鉴定与保存[4]。将嗜水气单胞菌划线于BHI固体培养基上, 37℃培养12~16 h, 挑取单菌落接种于1 mL BHI液体培养基中, 200 r/min, 37℃培养12~16 h。取上述培养产物500 μL加入到50 mL BHI液体培养基中, 同等条件培养12~16 h。将培养后的菌液用平板计数法确定培养菌液的浓度。金黄色葡萄球菌(Sta phylococcus aureus)为本实验室保存, 培养方式与嗜水气单胞菌培养方式相同[13]。
1.3 嗜水气单胞菌半数致死量测定用PBS 10倍梯度稀释纯培养的嗜水气单胞菌, 浓度分别为103 CFU/mL、104 CFU/mL、105 CFU/mL、106 CFU/mL、107 CFU/mL、108 CFU/mL, 共6个浓度梯度。将210尾健康鲟随机分为7组, 每组各30尾, 采用腹腔注射途径, 用不同浓度菌液注射感染健康施氏鲟, 每尾注射剂量为0.1 mL, 设置PBS组作为对照。攻毒后连续观察14 d, 记录施氏鲟的死亡情况, 用Reed- Muench法计算半数致死量(LD50)[14]。
1.4 免疫原和吞噬原制备采用福尔马林灭活法制备免疫原。于纯培养的嗜水气单胞菌菌液中添加福尔马林溶液(分析纯, 国药集团化学试剂有限公司), 终浓度为0.3%, 37℃灭活48 h。将灭活后的嗜水气单胞菌于5000 r/min离心10 min沉淀菌体, PBS悬浮菌体后再离心沉淀菌体, 反复3次。将PBS重悬后的菌体按灭活前的菌浓度调整至1.0×108 CFU/mL, 即为嗜水气单胞菌灭活疫苗, 置4℃冰箱中备用。
采用上述相同的方法制备金黄色葡萄球菌吞噬原, 置4℃冰箱中备用。
1.5 安全性检验 1.5.1 无菌检验取100 μL嗜水气单胞菌灭活疫苗, 涂布于BHI固体培养基上, 37℃恒温培养72 h, 观察有无细菌生长。
1.5.2 实验鱼安全性检验将嗜水气单胞菌灭活疫苗经腹腔注射30尾健康的施氏鲟, 剂量为0.2 mL/尾。另取健康施氏鲟30尾腹腔注射等剂量PBS作为对照组。注射后, 连续观察14 d, 记录其活动及存活情况。
1.6 免疫与血液样本采集将嗜水气单胞菌灭活疫苗经腹腔注射免疫90尾健康的施氏鲟, 免疫剂量为0.2 mL/尾。另取健康施氏鲟90尾腹腔注射等剂量PBS作为对照组。免疫接种后第1、4、7、14、21、28天分别从各组中随机取8尾施氏鲟, 断尾取血。其中4尾鱼血液混合并加肝素钠抗凝剂, 用于红细胞和白细胞计数、白细胞分类计数、吞噬活性和吞噬指数测定; 另外4尾鱼血液取出后, 置于4℃冰箱5~ 6 h, 4000 r/min离心, 10 min, 取上清, 即为鱼血清, 用于酸性磷酸酶活力、溶菌酶活力和血清抗体效价测定。实验重复3次。
1.7 免疫指标检测 1.7.1 血细胞计数用Dacie氏稀释液将抗凝血稀释200倍, 用Wright-Giemsa染液对抗凝血涂片进行混合染色, 冲洗晾干, 油镜下随机观察100个白细胞, 根据白细胞中单核细胞、嗜中性粒细胞和淋巴细胞不同形态, 记录其所占的百分比。
1.7.2 吞噬活性在0.1 mL抗凝血中加入25 μL灭活的金黄色葡萄球菌, 充分混匀置于28℃水浴锅中孵育60 min后, 1000 r/min离心3 min。弃除上清后, 沉淀用0.2 mL DPBS重悬。将重悬液涂片后, 用Wright-Giemsa染液对涂片进行染色, 油镜随机观察100个白细胞, 记录结果。吞噬活性以吞噬百分比和吞噬指数表示[15]。
1.7.3 酸性磷酸酶活力测定取50 μL血清, 按照酸性磷酸酶检测试剂盒(南京建成生物工程研究所)操作说明进行测定, 按以下公式计算酸性磷酸酶活力:
酸性磷酸酶(U/100 mL)=(测定管OD值/标准管OD值)×标准管酚的含量(0.005 mg)×(100 mL/ 0.05 mL)
1.7.4 溶菌酶活力检测取20 μL血清, 按照溶菌酶检测试剂盒(南京建成生物工程研究所)操作说明进行测定, 按以下公式计算溶菌酶活力:
溶菌酶活力(μg/mL)=[(测定管OD2–测定管ODl)/(标准管OD2–标准管ODl)×标准管浓度(200 U/mL)×样本测试前稀释倍数
1.7.5 血清抗体效价采用96孔血凝板法进行血清抗体效价测试。取100 μL血清, 用PBS 2倍稀释后, 加入等体积的灭活疫苗, 置于恒温培养箱中37℃孵育1 h, 4℃条件下过夜, 显微镜观察血清凝集反应的强度。
1.8 疫苗免疫保护率测定在免疫后第21天, 从免疫组和对照组中随机各取30尾施氏鲟, 每尾鱼腹腔注射0.1 mL嗜水气单胞菌(菌浓度为100倍LD50), 观察14 d, 统计各组的死亡率, 计算出相对免疫保护率(relative percent survival, RPS)。
1.9 实验数据分析实验数据通过SPSS 17.0进行生物学统计分析, 采用t检验对各项指标进行差异显著性检验。
2 结果与分析 2.1 嗜水气单胞菌感染性用10倍系列稀释后的嗜水气单胞菌腹腔注射施氏鲟, 每尾注射剂量为0.1 mL, 对照组腹腔注射等剂量的PBS, 连续观察14 d, 各组施氏鲟死亡数情况如表 1所示。根据Reed-Muench法计算出嗜水气单胞菌的半数致死量为(2.73±0.15)× 104 CFU/mL。
|
|
表 1 不同浓度嗜水气单胞菌感染施氏鲟死亡结果 Tab.1 The mortality of Amur sturgeon infected with Aeromonas hydrophila at different concentrations |
将嗜水气单胞菌灭活疫苗涂布于BHI固体培养基上, 37℃培养72 h后未观察到细菌菌落生长, 说明嗜水气单胞菌已被完全灭活。在14 d观察期内, 腹腔注射免疫原的施氏鲟正常, 未出现患病症状和死亡, 表明所制备的疫苗安全性好, 可用于后续实验。
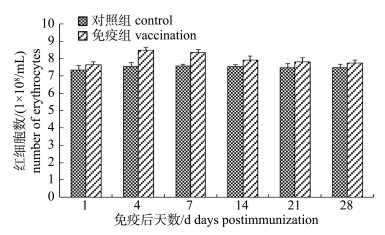
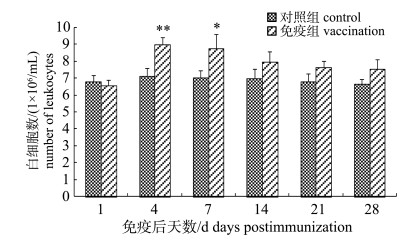
2.3 血细胞计数免疫接种4 d后, 免疫组红细胞达到峰值(8.50±0.17)×108个/mL(图 1)。随后免疫组红细胞数量逐渐下降, 但在免疫后第28天仍然高于对照组。对照组红细胞数量保持在7.50×108个/mL左右。免疫组外周血白细胞变化趋势与红细胞相似, 在免疫接种4 d后免疫组白细胞达到峰值(8.96± 0.44)×106个/mL, 极显著高于对照组(P < 0.01), 随后白细胞数量逐渐减少, 但在免疫后28 d仍高于对照组白细胞数(图 2)。
|
图 1 FK-Ah免疫后施氏鲟外周血红细胞数量变化 Fig.1 The variation in erythrocyte numbers in peripheral blood of immunized Acipenser schrenckii |
|
图 2 FK-Ah免疫后施氏鲟外周血白细胞数量变化 *表示免疫组与对照组差异显著(P < 0.05); **表示免疫组与对照组差异极显著(P < 0.01). Fig.2 The variation in leucocytes numbers in peripheral blood of immunized Acipenser schrenckii * denotes significant difference between vaccination and control (P < 0.05); ** denotes extremely significant difference between vaccination and control (P < 0.01). |
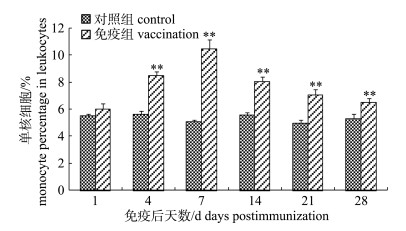
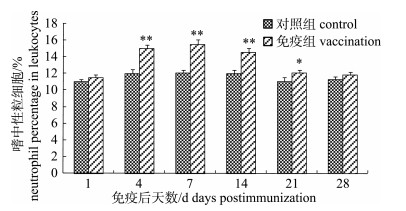
嗜水气单胞菌灭活疫苗免疫后, 免疫组施氏鲟外周血白细胞中单核细胞、嗜中性粒细胞和淋巴细胞分类百分比明显增加。其中单核细胞升高较快, 在免疫后第7天达到峰值10.50%, 极显著高于对照组(P < 0.01)。第7天后开始缓慢减少, 但至免疫后第28天仍高于对照组(图 3)。嗜中性粒细胞分类百分比变化趋势与单核细胞相似, 在免疫后第7天达到峰值15.53%, 极显著高于对照组(P < 0.01)。随后开始缓慢减少, 在免疫后28天仍高于对照组数值(图 4)。免疫组淋巴细胞分类百分比在免疫后第1~21天之间缓慢升高, 在第21天达峰值73.51%, 但与对照组差异不显著(P > 0.05)。在免疫后第28天淋巴细胞分类百分比开始下降, 虽仍高于对照组, 但与对照组差异不显著(P > 0.05, 图 5)。
|
图 3 FK-Ah免疫后施氏鲟外周血单核细胞分类百分比变化 **表示免疫组与对照组差异极显著(P < 0.01). Fig.3 The variation of monocyte percentage in peripheral blood of immunized Acipenser schrenckii ** denotes extremely significant difference between vaccination and control (P < 0.01). |
|
图 4 FK-Ah免疫后施氏鲟外周血嗜中性粒细胞分类百分比的变化 *表示免疫组与对照组差异显著(P < 0.05); **表示免疫组与对照组差异极显著(P < 0.01). Fig.4 The variation of neutrophil percentage in peripheral blood of immunized Acipenser schrenckii * denotes significant difference between vaccination and control (P < 0.05); ** denotes extremely significant difference between vaccination and control (P < 0.01). |
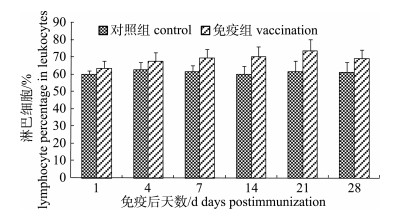
|
图 5 Fig.5 The variation of lymphocyte percentage in peripheral blood of immunized Acipenser schrenckii |
嗜水气单胞菌灭活疫苗免疫后, 免疫组施氏鲟外周血细胞吞噬指数和吞噬百分率变化趋势大致相同。免疫后, 免疫组吞噬指数迅速升高, 在第4天达到峰值, 吞噬指数为4.53, 显著高于对照组(P < 0.05);从第7天开始逐渐降低, 但至免疫后第28天仍高于对照组(图 6)。吞噬百分比在免疫后第4天达到峰值30%, 极显著高于对照组(P < 0.01), 随后开始逐渐降低, 但在免疫后28 d内一直高于对照组(图 7)。
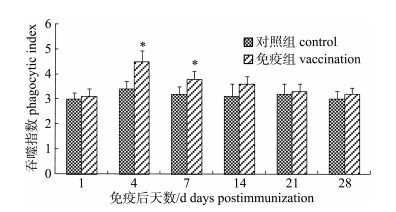
|
图 6 FK-Ah免疫后施氏鲟外周血细胞吞噬指数的变化 *表示免疫组与对照组差异显著(P < 0.05). Fig.6 The variation of phagocytic index of phagocytes in peripheral blood of immunized Acipenser schrenckii * denotes significant difference between vaccination and control (P < 0.05). |
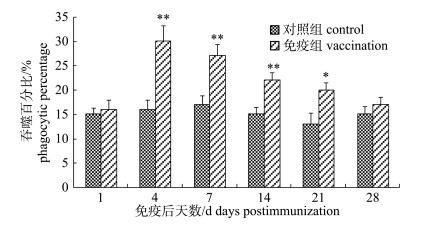
|
图 7 FK-Ah免疫后施氏鲟外周血细胞吞噬百分比变化 *表示免疫组与对照组差异显著(P < 0.05); **表示免疫组与对照组差异极显著(P < 0.01). Fig.7 The variation of phagocytic percentage of phagocytes in peripheral blood of immunized Acipenser schrenckii * denotes significant difference between vaccination and control (P < 0.05); ** denotes extremely significant difference between vaccination and control (P < 0.01). |
嗜水气单胞菌灭活疫苗免疫后, 免疫组施氏鲟的酸性磷酸酶活力逐渐增强(图 8), 第14天时达到峰值30.21 U/mL, 极显著高于对照组(P < 0.01), 随后逐渐下降, 但整体水平明显一直高于对照组。
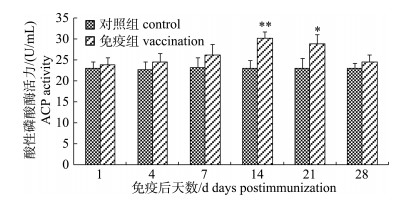
|
图 8 FK-Ah免疫后施氏鲟血清中酸性磷酸酶活性变化 *表示免疫组与对照组差异显著(P < 0.05); **表示免疫组与对照组差异极显著(P < 0.01). Fig.8 The variation of alkaline phosphatase (ACP) in serum of immunized Acipenser schrenckii * denotes significant difference between vaccination and control (P < 0.05); ** denotes extremely significant difference between vaccination and control (P < 0.01). |
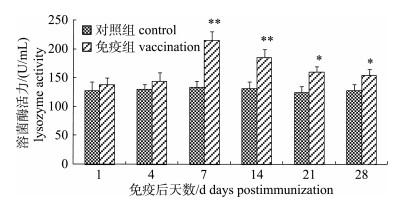
嗜水气单胞菌灭活疫苗免疫后, 免疫组施氏鲟血清中溶菌酶活力在免疫后第7天达到峰值为214.65 U/mL, 极显著高于对照组(P < 0.01), 随后溶菌酶活力逐渐下降, 但一直保持在高于对照组的水平(图 9)。
|
图 9 FK-Ah免疫后施氏鲟血清中溶菌酶活性变化 *表示免疫组与对照组差异显著(P < 0.05); **表示免疫组与对照组差异极显著(P < 0.01). Fig.9 The variation of lysozyme in serum of immunized Acipenser schrenckii * denotes significant difference between vaccination and control (P < 0.05); ** denotes extremely significant difference between vaccination and control (P < 0.01). |
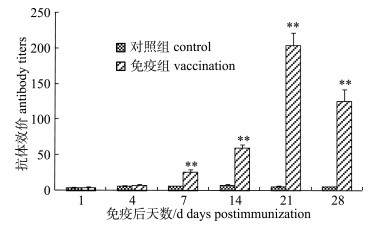
嗜水气单胞菌灭活疫苗免疫后, 免疫组施氏鲟血清抗体效价在免疫后逐渐上升, 免疫后第21天达到最大值, 效价单位为1 : 203, 极显著高于对照组(P < 0.01)。而对照组的血清抗体效价一直低于1 : 8 (图 10)。
|
图 10 FK-Ah免疫后施氏鲟血清抗体效价变化 **表示免疫组与对照组差异极显著(P < 0.01). Fig.10 Changes of antibody titer in serum of immunized Acipenser schrenckii ** denotes extremely significant difference between vaccination and control (P < 0.01). |
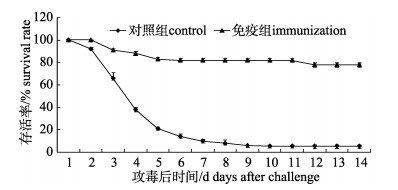
免疫接种后第21天, 用浓度为100倍LD50 (约3.0×106 CFU/ mL)的嗜水气单胞菌对免疫组和对照组施氏鲟进行攻毒感染实验。攻毒感染后第14天, 免疫组存活率为78%, 而对照组存活率为5%, 嗜水气单胞菌灭活疫苗对施氏鲟的相对免疫保护率为76.84% (图 11)。
|
图 11 嗜水气单胞菌攻毒后施氏鲟存活情况 Fig.11 Survival curves of immunized Amur sturgeon after Aeromonas hydrophila challenge |
鱼类免疫学研究结果表明, 几乎所有的硬骨鱼类都具备细胞免疫、体液免疫和局部黏膜免疫功能[16-17]。鱼体接种疫苗后, 可产生非特异性和特异性的免疫应答反应, 从而防御病原微生物感染[18]。鱼类外周血细胞是机体体液免疫和细胞免疫的重要组成部分[19-20]。本研究用嗜水气单胞菌灭活疫苗免疫施氏鲟后, 外周血中红、白细胞数量及单核细胞和嗜中性粒细胞百分比增加明显, 这与青鱼(Mylopharyngodon piceus)和中华倒刺鲃(Spinibarbus sinensis Bleeker)免疫接种细菌灭活疫苗后, 其外周血细胞变化趋势相似[21-22]。鱼体脾脏增殖的淋巴细胞, 经血液循环进入外周血[23], 因此施氏鲟免疫嗜水气单胞菌灭活疫苗后外周血淋巴细胞分类百分比上升比较缓慢, 峰值时间较滞后。由此可见, 施氏鲟接种疫苗后, 白细胞中的单核细胞和嗜中性粒细胞参与免疫应答发挥作用的时间早于淋巴细胞。
吞噬作用是水产动物主要的非特异性免疫机制之一[24]。鱼体主要的吞噬细胞包括单核细胞和嗜中性粒细胞[24]。本研究结果显示, 用嗜水气单胞菌灭活疫苗免疫施氏鲟后可观察到嗜中性粒细胞和单核细胞吞噬多个金黄色葡萄球菌的现象, 其吞噬百分率和吞噬指数均在免疫后第4天达到峰值, 与对照组有显著性差异。该结果表明, 施氏鲟的早期免疫可通过增强吞噬细胞的吞噬作用来抵御微生物的感染。
酸性磷酸酶是巨噬细胞溶酶体的标志酶, 也是巨噬细胞最有代表性的水解酶之一[25]。毛会丽等[26]对鲫免疫嗜水气单胞菌灭活疫苗后发现, 免疫后第14天, 免疫鲫的酸性磷酸酶活力显著高于对照组, 免疫后第21天, 酸性磷酸酶活力达到峰值。本研究发现, 免疫后施氏鲟酸性磷酸酶活力在免疫后14 d达到峰值, 与对照组呈极显著差异, 实验结果与毛会丽等人相似, 表明嗜水气单胞菌疫苗对施氏鲟酸性磷酸酶活力有一定促进作用[27]。溶菌酶是广泛存在于鱼类黏液、血清和巨噬细胞中的一种水解酶, 其活力是决定吞噬细胞能否杀灭所吞噬的致病菌的物质基础之一[27]。毛会丽等[26]对鲫接种嗜水气单胞菌灭活疫苗后, 血清溶菌酶活力有不同程度的增强。李园园等[10]研究表明, 嗜水气单胞菌灭活疫苗免疫西伯利亚鲟后, 其血清溶菌活力明显增强。本研究结果显示, 施氏鲟免疫后第7天血清中溶菌酶活力明显增强。这可能由于免疫后施氏鲟头肾白细胞的吞噬活性增强, 使得吞噬细胞合成和释放了更多的溶菌酶[28]。
血清中存在多种免疫因子, 血清抗体效价可反映鱼体特异性体液免疫水平[29]。李园园等[10]将嗜水气单胞菌灭活疫苗免疫西伯利亚鲟后, 第35天免疫组血清抗体效价比对照组高42.5%。本研究中, 免疫后第7天, 免疫组施氏鲟血清抗体效价显著与高于对照组, 第21天达到峰值, 随后开始下降, 但在第28天仍然显著高于对照组。由此推断, 在免疫后期, 施氏鲟主要通过特异性体液免疫来保护机体。免疫后第21天对施氏鲟进行的攻毒实验结果显示, 嗜水气单胞菌灭活疫苗相对免疫保护率为76.84%, 高于西伯利亚鲟源嗜水气单胞菌灭活疫苗的相对免疫保护率[10], 其原因可能是不同来源的嗜水气单胞菌的感染性与抗原结构差异所致, 但有待进一步的比较研究。
本研究结果表明, 将嗜水气单胞菌灭活疫苗免疫施氏鲟后, 能够显著诱导施氏鲟体内的免疫应答反应, 增强鱼体的免疫保护能力。本研究结果为深入研究养殖鲟的细菌性疾病的免疫预防技术奠定了前期基础。
| [1] |
Yang W, Li A. Isolation and characterization of Streptococcus dysgalactiae, from diseased Acipenser schrenckii[J]. Aquaculture, 2009, 294(1): 14-17. |
| [2] |
Fishery Bureau of Ministry of Agriculture. China Fishery Statistics Yearbook[M]. Beijing: China Agriculture Press, 2016: 31. [农业部渔业局编制. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2016: 31.]
|
| [3] |
Sun D J, Qu Q Z, Zhang Y, et al. Sturgeon aquaculture in China[J]. Chinese Journal of Fisheries, 2011, 24(4): 67-70. [孙大江, 曲秋芝, 张颖, 等. 中国的鲟鱼养殖[J]. 水产学杂志, 2011, 24(4): 67-70. DOI:10.3969/j.issn.1005-3832.2011.04.018] |
| [4] |
Meng Y, Xiao H B, Zeng L B. Isolation and identification of the hemorrhagic septicemia pathogen from Amur sturgeon, Acipenser schrenckii[J]. Journal of Applied Ichthyology, 2011, 27(2): 799-803. DOI:10.1111/j.1439-0426.2011.01717.x |
| [5] |
Jiang N, Fan Y D, Zhou Y, et al. Overview of sturgeon pathogenic disease research[J]. Journal of Hydroecology, 2016, 37(2): 1-9. [江南, 范玉顶, 周勇, 等. 鲟病原性疾病研究现状概述[J]. 水生态学杂志, 2016, 37(2): 1-9.] |
| [6] |
Chopra A K, Houston C W, Peterson J W, et al. Cloning, expression, and sequence analysis of a cytolytic enterotoxin gene from Aeromonas hydrophila[J]. Canadian Journal of Microbiology, 1993, 39(5): 513-523. DOI:10.1139/m93-073 |
| [7] |
Aguilera-Arreola M G, Hernández-Rodrı́Guez C, Zúöiga G, et al. Aeromonas hydrophila, clinical and environmental ecotypes as revealed by genetic diversity and virulence genes[J]. FEMS Microbiology Letters, 2005, 242(2): 231-240. DOI:10.1016/j.femsle.2004.11.011 |
| [8] |
Yang Z G. Isolation and identification of Aeromonas hydrophila form sturgeon[J]. Freshwater Fisheries, 2001, 31(5): 40-41. [杨治国. 鲟鱼嗜水气单胞菌的分离鉴定[J]. 淡水渔业, 2001, 31(5): 40-41. DOI:10.3969/j.issn.1000-6907.2001.05.017] |
| [9] |
Si L N, Li S W, Wang D, et al. The isolation and drug sensitive tests of pathogens found in sturgeon epizootic disease[J]. Chinese Journal of Fisheries, 2010, 23(4): 18-22. [司力娜, 李绍戊, 王荻, 等. 养殖鲟鱼暴发病病原菌分离及药敏实验[J]. 水产学杂志, 2010, 23(4): 18-22. DOI:10.3969/j.issn.1005-3832.2010.04.005] |
| [10] |
Li Y Y, Cao H P, He S, et al. Isolation and identification of Aeromonas hydrophila strain X1 from Acipenser baerii and its antibiotic sensitivity[J]. Microbiology, 2008, 35(8): 1186-1191. [李圆圆, 曹海鹏, 何珊, 等. 鲟源致病性嗜水气单胞菌X1的分离鉴定与药敏特性研究[J]. 微生物学通报, 2008, 35(8): 1186-1191. DOI:10.3969/j.issn.0253-2654.2008.08.004] |
| [11] |
Plant K P, LaPatra S E. Advances in fish vaccine delivery[J]. Developmental & Comparative Immunology, 2011, 35(12): 1256-1262. |
| [12] |
Sommerset I, Krossøy B, Biering E, et al. Vaccines for fish aquaculture[J]. Expert Review of Vaccines, 2005, 4(1): 89-101. DOI:10.1586/14760584.4.1.89 |
| [13] |
Yang X, Liu W Z, Xiao H B, et al. Immune responses in the peripheral blood and protection of giant salamander (Andrias davidianus) immunized with a killed Aeromonas hydrophila vaccine[J]. Journal of Fishery Sciences of China, 2014, 21(3): 621-628. [杨星, 刘文枝, 肖汉兵, 等. 嗜水气单胞菌灭活疫苗免疫后大鲵外周血免疫指标的变化[J]. 中国水产科学, 2014, 21(3): 621-628.] |
| [14] |
Reed L J, Muench H. A simple method of estimating fifty percent endpoints[J]. American Journal of Epidemiology, 1938, 27(3): 493-497. DOI:10.1093/oxfordjournals.aje.a118408 |
| [15] |
Zhang L L, Ma J, Fan Y, et al. Immune response and protection in gibel carp, Carassius gibelio, after vaccination with β-propiolactone inactivated cyprinid herpesvirus 2[J]. Fish and Shellfish Immunology, 2016, 49: 344-350. DOI:10.1016/j.fsi.2016.01.003 |
| [16] |
Li F L, Li Z X, Zhai Y X, et al. Adaptive immune system in fish[J]. Fisheries Science, 2012, 31(4): 240-244. [李风铃, 李兆新, 翟毓秀, 等. 鱼类适应性免疫系统研究概述[J]. 水产科学, 2012, 31(4): 240-244. DOI:10.3969/j.issn.1003-1111.2012.04.012] |
| [17] |
Sun D W, Zhan Y, Xu Z R. Progress of the immune system in fish[J]. Journal of Hydroecology, 2002, 22(6): 17-19. [孙德文, 詹勇, 许梓荣. 鱼类免疫系统的研究进展[J]. 水生态学杂志, 2002, 22(6): 17-19.] |
| [18] |
Zhou Y, Jiang N, Ma I, et al. Protective immunity in gibel carp, Carassius gibelio, of the truncated proteins of cyprinid herpesvirus 2 expressed in Pichia pastoris[J]. Fish and Shellfish Immunology, 2015, 47(2): 1024-1031. DOI:10.1016/j.fsi.2015.11.012 |
| [19] |
Li Y N, Chen Q Z, Shao J Z, et al. Advances in research of fish immunology[J]. Zoological Research, 1995(1): 83-94. [李亚南, 陈全震, 邵健忠, 等. 鱼类免疫学研究进展[J]. 动物学研究, 1995(1): 83-94.] |
| [20] |
Feng L K, Yin D, Liu Y B, et al. The study on immunity functions of fish red blood cells[J]. Fish Diseases, 1992(1): 11-12. [冯来坤, 尹栋, 刘玉斌. 鱼类红细胞免疫功能的初步研究[J]. 鱼类病害研究, 1992(1): 11-12.] |
| [21] |
Zhang B, Zeng L B, Luo X S, et al. Responses of immune parameters in periphery blood of black carp (Mylopharyngodon piceus) immunized with three vaccines of Aeromonas hydrophila[J]. Journal of Huazhong Agricultural University, 2012, 31(1): 100-105. [张波, 曾令兵, 罗晓松, 等. 嗜水气单胞菌3种疫苗免疫的青鱼外周血免疫指标的变化[J]. 华中农业大学学报, 2012, 31(1): 100-105. DOI:10.3969/j.issn.1000-2421.2012.01.018] |
| [22] |
Luo F, Zhang Q Z, Feng H R, et al. Changes of immune parameters in periphery blood of Spinibarbus sinensis Bleeker immunized with formalin-killed Aeromonas sobria[J]. Journal of Fisheries of China, 2010, 34(4): 626-634. [罗芬, 张其中, 冯汉茹, 等. 灭活菌苗免疫的中华倒刺鲃外周血免疫指标的变化[J]. 水产学报, 2010, 34(4): 626-634.] |
| [23] |
Jirillo E, Passantino L, Ribaud M R, et al. Fish immunology. Fish erythrocytes release cytokine-like factors that modulate autologous macrophage function[J]. Anantomia Histologia Embryologia, 2005, 34(s1): 23-24. |
| [24] |
Yakhnenko V M, Klimenlov I V. Specific features of blood cell composition and structure in fishes from the pelagial and coastal zones of Lake Baikal[J]. Biology Bulletin, 2009, 36(1): 46-54. |
| [25] |
Cheng T C. The role of lysosomal hydrolases in molluscan cellular response to immunologic challenge[M]. Boston: Sprmger-Verlag, 1978: 59-71.
|
| [26] |
Mao H L, Guan J Y, He W X, et al. Immune effect of Aeromonas hydrophila inactivated vaccine on carassius gibelio[J]. Chinese Journal of Immunology, 2014, 30(11): 1499-1503, 1507. [毛会丽, 关建义, 贺文旭, 等. 嗜水气单胞菌灭活疫苗对银鲫的免疫效果研究[J]. 中国免疫学杂志, 2014, 30(11): 1499-1503, 1507. DOI:10.3969/j.issn.1000-484X.2014.11.013] |
| [27] |
Chen S C, Yoshida T, Adams A, et al. Immune response of rainbow trout to extracellular products of Mycobacterium spp.[J]. Journal of Aquatic Animal Health, 1996, 8(3): 216-222. DOI:10.1577/1548-8667(1996)008<0216:IRORTT>2.3.CO;2 |
| [28] |
Kaattari S L. Fish B lymphocytes: defining their form and function[J]. Annual Review of Fish Diseases, 1992, 2: 161-180. DOI:10.1016/0959-8030(92)90062-3 |
| [29] |
Zhang Y A, Nie P. Humoral immune factors of fish: a review[J]. Journal of Fisheries of China, 2000, 24(4): 376-381. [张永安, 聂品. 鱼类体液免疫因子研究进展[J]. 水产学报, 2000, 24(4): 376-381.] |
 2018, Vol. 25
2018, Vol. 25

