2. 中国水产科学研究院 长江水产研究所, 湖北 武汉 430223
2. Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China
中国大鲵(Andrias davidianus)又被称为“娃娃鱼”, 是世界上现存最大的珍稀名贵两栖动物, 不仅具有较高的科研与营养价值, 而且具有较高的药用及保健价值。由于市场的需要, 近些年来大鲵人工养殖发展十分迅速, 随着人工养殖规模的不断扩大, 大鲵的各种病害问题日益突出[1-4]。其中, 由大鲵虹彩病毒(Chinese giant salamander iridovirus, GSIV)感染养殖大鲵导致养殖大鲵的大量死亡, 死亡率最高可达100%, 严重阻碍了大鲵养殖业的健康发展[5-7]。
免疫预防被认为是预防与控制水产养殖动物传染性疾病最有效的途径[8-10], 因此近些年来大鲵的免疫预防成为研究的热点。孙建滨等[11]的研究显示, 大鲵虹彩病毒灭活疫苗具有较好的免疫原性, 对免疫后的大鲵具有较高的保护率。同时Liu等[12]的研究也表明, 被大鲵虹彩病毒灭活疫苗免疫后的大鲵, 其血清的中和抗体效价显著上升。此外, 曾宪辉等[13]的研究显示, 免疫组大鲵的相对免疫保护率可达73.3%。虽然疫苗免疫对于大鲵虹彩病毒病具有较好的免疫效果, 但由于目前疫苗的制备方式落后, 导致无法进行疫苗的工业化生产, 从而一直制约着大鲵养殖业的发展。近年来, 一些新型的悬浮培养技术得到快速发展, 例如搅拌式生物反应器系统、灌注式生物反应器系统, 同时各种应用型微载体也被广泛开发, 例如实心微载体、多孔微载体、液体微载体、超微载体。目前, 在实际中应用广泛的是固体微载体, 市面上最常见的是Cytodex系列, 其中1型和2型均带有较强的阳性电荷, 不利于难贴壁细胞的吸附粘贴, 一般用于已建立的细胞系, 而3型其表面不带有电荷且具有一层变性胶原包被, 有助于细胞的吸附粘贴, 一般适用于贴壁不紧或需要获得最大活性与完整性的细胞[14-16]。目前, 微载体悬浮培养哺乳动物细胞的技术已经相当成熟, 并且该技术在国内外的疫苗生产中已得到广泛实施, 让疫苗的规模化生产成为可能, 如狂犬病疫苗、流感疫苗等[17-18]。此外, 在狂犬病疫苗的制备中, 孙燕等[17]建立了无血清培养基培养Vero细胞的工艺, 大大降低了疫苗的生产成本。但是目前悬浮培养技术在水产动物细胞上尚未取得良好效果及应用, 因此本实验选取大鲵细胞和病毒来进行微载体悬浮培养工艺的研究, 不仅可以为大鲵虹彩病的预防和治疗提供保证, 同时也可以为水产动物疫苗的产业化生产提供重要的技术保障。
本实验主要探究了在Cytodex 3悬浮培养系统中, 对于影响GSM细胞贴壁效率及细胞增殖效率的各种条件, 并对各条件进行了进一步优化。此外, 本实验还利用Cytodex 3培养的GSM细胞大量增殖了GSIV病毒, 不仅有利于大鲵虹彩病的预防和治疗, 同时也使水产动物疫苗产业化生产突破了瓶颈。
1 材料与方法 1.1 材料 1.1.1 细胞与病毒大鲵肌肉组织细胞系(GSM)由中国科学院水生生物研究所张奇亚惠赠, 培养条件:含10%新生牛血清的M199, pH 7.0~7.2, 温度25℃。GSIV由本实验室从湖北荆州患病大鲵中分离鉴定并保存[1]。
1.1.2 主要试剂与仪器M199(Hyclone公司)、新生牛血清(杭州四季青公司); 胰蛋白酶(AmRESCO公司); 微载体Cytodex 3(GE生物工程有限公司); 搅拌瓶为双侧臂细胞培养瓶(Wheaton, 美国), 容积为4.0 L; 磁力搅拌装置为Micro-Stir低速磁力搅拌器(Wheaton, 美国); 倒置显微镜(Nikon, 日本)。
1.2 方法 1.2.1 种子细胞与病毒培养GSM种子细胞在T-75培养瓶(Corning)中传代培养。以感染复数(multiplicity of infection, MOI)为0.5的剂量接种GSIV病毒至单层的GSM细胞中, 当细胞病变效应(cytopathic effect, CPE)至90%左右时收获病毒, –80℃反复冻融3次, 4℃条件下5000 g离心30 min, 去除细胞碎片, 病毒上清于–80℃保存备用。
1.2.2 Cytodex 3微载体预处理将干燥的微载体在无Ca2+和Mg2+的磷酸缓冲液(DPBS)中室温浸泡膨胀至少3 h, 每克Cytodex 3微载体加50~ 100 mL DPBS。膨胀后弃上清液, 用新鲜的DPBS洗涤微载体, 每克Cytodex 3微载体加30~50 mL DPBS。洗涤后弃上清, 每克Cytodex 3微载体加入50~100 mL DPBS, 121℃高压蒸汽灭菌30 min, 冷却后置4℃冰箱备用。
1.2.3 间歇搅拌方式对GSM细胞贴壁的影响将处理好的Cytodex 3微载体用M199培养基洗涤1次, 吸弃上清后, 添加200 mL含10% FBS的M199培养基, 接种50 mL浓度为1.6×106 cells/mL的GSM细胞, 于25℃培养箱中, 按表 1中贴壁期间歇搅拌条件进行培养。测定不同间歇搅拌条件下的最佳贴壁效果, 分别于间歇搅拌培养2 h、4 h、6 h、8 h、10 h时取样观察GSM细胞在微载体上的贴附情况, 计算GSM在Cytodex 3微载体上的贴附率, 并绘制贴附曲线, 贴附10 h后补加250 mL培养基, 于25℃培养箱中继续培养观察。
|
|
表 1 细胞贴壁期间歇搅拌条件 Tab.1 Agitation conditions during cell attachment stage |
根据已测定的最佳贴附时长, 在细胞的间歇搅拌贴附期, 分别用含0、5%、10%、15%新生牛血清的M199培养液, 经10 h贴附后分别取样并测定细胞的贴壁率。
1.2.5 最佳微载体用量的确定微载体浓度分别设置为1 g/L、2 g/L、3 g/L, 细胞接种密度为1.2×105 cells/mL, 接种细胞后, 于25℃培养箱中搅拌悬浮培养, 逐日取样观察GSM细胞在微载体上的贴壁和生长情况, 并进行细胞计数, 绘制细胞生长曲线, 确定Cytodex 3的最佳用量。
1.2.6 最佳细胞接种密度的确定微载体的用量为2 g/L, 以0.6×105 cells/mL、1.2×105 cells/mL、1.6×105 cells/mL的密度接种细胞, 在25℃培养箱中搅拌悬浮培养, 每日定时取样观察GSM细胞在Cytodex 3上的吸附和生长情况, 并进行细胞生长曲线的绘制, 确定最佳细胞接种密度。
1.2.7 最佳搅拌速度的确定Cytodex 3用量2 g/L, 以1.2×105 cells/mL的浓度接种GSM, 经10 h间歇搅拌贴壁后, 分别以转速15 r/min、25 r/min、35 r/min进行连续搅拌培养, 逐日取样观察细胞在Cytodex 3的生长情况, 并采用台盼蓝计数法进行计数, 从而比较不同搅拌速度时GSM细胞在Cytodex 3表面的生长状况, 以确定最佳搅拌速度。
1.2.8 细胞计数及形态观察将细胞悬浮培养装置置于无菌超净台中, 在25 r/min连续搅拌的悬浮状态下, 吸取微载体细胞, 消化后对细胞进行计数。同样方法取样, 用2.5%的戊二醛固定细胞2 h后, 分别在倒置显微镜及扫描电子显微镜下观察细胞在Cytodex 3上的生长状态。
1.2.9 病毒感染及电镜观察GSM培养24 h后, 在Cytodex 3上长成单层, 静置一段时间待微载体沉降至底部, 弃上层培养液, 以MOI=0.5接种GSIV, 每15 min摇晃1次促进病毒吸附, 1 h后补加2%的维持液至终体积500 mL, 并且继续以25 r/min进行连续搅拌培养。分别在感染GSIV 24 h、48 h、72 h、96 h时取样固定, 并置于倒置显微镜及扫描电子显微镜下观察细胞病变效应。
1.2.10 病毒增殖动态GSM培养细胞24 h后, 按上述方法接种GSIV, 分别在接种病毒后1 h、2 h、4 h、8 h、12 h、24 h、48 h、72 h、96 h时取细胞培养液0.5 mL, 于–80 ℃反复冻融3次, 4℃条件下5000 r/min离心30 min去除细胞碎片, 用Reed-Muench法在GSM细胞上进行TCID50的测定, 设3次重复测定实验, 绘制病毒增殖动态曲线。
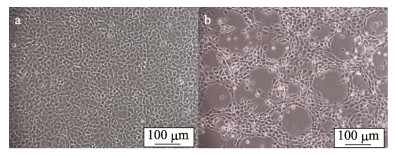
2 结果与分析 2.1 GSM细胞静置培养的形态与细胞病变效应正常GSM细胞形态均一, 排列紧密, 传代后可快速形成稳定的细胞层(图 1a)。而接种GSIV病毒后, GSM细胞48 h后即出现了明显的CPE, 此时细胞开始出现收缩、变圆、发亮, 72 h后细胞层呈现典型的破鱼网状, 且细胞培养液中出现大量的悬浮细胞(图 1b)。当CPE达90%左右时收取病毒, 测定病毒滴度TCID50为10–9.0±0.30/mL。
|
图 1 静置培养条件下GSIV感染GSM细胞的细胞病变效应 a.正常GSM细胞; b. GSM细胞感染GSIV 72 h. Fig.1 Cytopathic effect of GSM cells infected with GSIV in stilling culture a. Normal GSM cells; b. GSM cells infected with GSIV at 72 h post infection. |
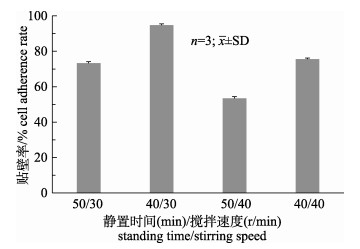
不同的间歇搅拌方式对细胞的贴壁率的影响如图 2所示。B组(间歇2 min、搅拌40 min, 搅拌速度30 r/min)GSM细胞贴壁率最高, 为95%左右, 且细胞在微载体表面分布均匀。A组与D组的贴壁率比较相近, 均明显低于B组。此外, A组出现部分微载体黏附在一起的现象, 而D组细胞在微载体表面分布不均匀。C组的细胞贴壁率最低, 且细胞在微载体上分布很不均匀, 部分细胞呈现成团生长的现象, 空载率较高。因此确定B组为GSM细胞贴附期的最佳间歇搅拌条件。
|
图 2 搅拌方式对GSM细胞贴壁率的影响 Fig.2 Effects of stirring method on the attachment efficiency of GSM cells |
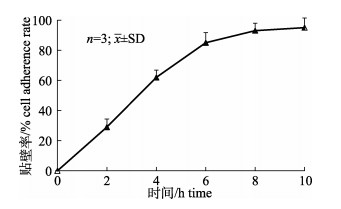
在最佳贴壁期间歇搅拌条件下, 不同贴附时长的细胞贴附率如图 3所示, 随着贴附时间的增长, GSM细胞在Cytodex 3微载体上的贴附率逐步上升, 贴附10 h时贴附率达95%, 随后贴附率趋于稳定, 因此选择10 h为最佳贴附时长。
|
图 3 GSM在微载体上的贴附曲线 Fig.3 Curve of GSM cells attachment to microcarriers |
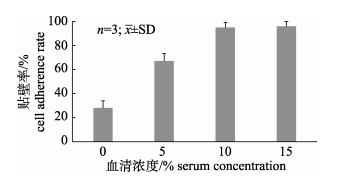
将细胞分别接种于不同血清浓度的悬浮培养系统中, 10 h后分别取样测定GSM的贴壁率, 结果如图 4所示, 随着血清浓度的提高, GSM的贴壁率有明显的上升趋势, 而当血清浓度高于10%时, 细胞贴壁率没有明显变化, 均在90%左右, 且镜下观察15%血清浓度组GSM在Cytodex 3上的贴附状态与10%血清组没有明显差异。因此选取10%的血清浓度为GSM细胞贴壁期的最适浓度。
|
图 4 血清浓度对GSM在微载体上贴壁率的影响 Fig.4 Effect of different FBS concentrations on GSM attachment efficacy |
不同Cytodex 3浓度对细胞生长影响的结果如图 5所示。结果显示, GSM在Cytodex 3生长的趋势基本相同, 随着Cytodex 3浓度的升高, 细胞最大密度也随之增大。Cytodex 3浓度分别为1g/L、2 g/L、3 g/L时所达到的最高细胞密度分别为13.5×105 cells/mL、18.9×105 cells/mL、19.4× 105 cells/mL。Cytodex 3浓度为2 g/L时与浓度为3 g/L时, 细胞的生长趋势及最大密度相近, 但是浓度为3 g/L组中培养液中细胞碎片较多, 在细胞贴附期间微载体空载率较高, 因此选择2 g/L为最适微载体浓度。
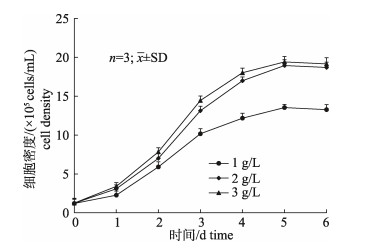
|
图 5 不同微载体浓度下GSM细胞生长曲线 Fig.5 Growth curves of GSM cells with different microcarrier concentrations |
不同细胞接种密度在Cytodex 3上的生长曲线如图 6所示。当Cytodex 3用量为2 g/L、细胞接种密度为0.6×105 cells/mL时, 单个微载体上分布的细胞过少, Cytodex 3的空载率较高, 且GSM细胞接种6 d后生长依然速度较慢, 细胞的最大密度也最低。当细胞接种密度为1.6×105 cells/mL时, 虽然单个微载体上的细胞数较高, 但GSM细胞在Cytodex 3上出现聚团生长, 导致微载体抱团, 随着聚集数量的增多, 成团生长的微载体开始沉于底部, 不利于细胞生长。当细胞接种密度为1.2×105 cells/mL时, GSM均匀分布于Cytodex 3表面, 在接种3 d后细胞开始进入稳定生长期, 5 d后细胞密度达到最高, 为18.9×105 cells/mL。因此, Cytodex 3培养GSM细胞时的最佳接种密度确定为1.2×105 cells/mL。
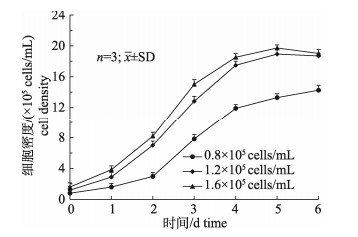
|
图 6 不同细胞接种密度对微载体培养GSM细胞生长的影响 Fig.6 Effect of cell densities on the growth of GSM cells on microcarriers |
将细胞按照上述确定的贴附条件进行培养后, 将搅拌速度分别设置为15 r/min、25 r/min、35 r/min, 观察并测定不同搅拌速度下细胞的增殖状况。结果显示, 当速度为15 r/min时, GSM在Cytodex 3表面生长不均匀, 大量细胞成团聚集在Cytodex 3表面, 且少量微载体黏附于搅拌瓶底部; 当搅拌速度为25 r/min时, 细胞接种3 d后即可在Cytodex 3表面形成紧密的细胞层; 当搅拌速度为35 r/min时, 部分微载体出现破损, 已贴附细胞出现脱落现象, 导致上清液中的细胞开始增多, GSM细胞的生长状态不佳。在整个Cytodex 3悬浮培养过程中, GSM的生长趋势也有所不同, 当转速由15 r/min提高到25 r/min时, GSM的生长速度不仅得到有效提高, 细胞的生长状态也得到了明显改善; 而当转速为35 r/min时, GSM的增殖效率却明显下降(图 7)。综合以上因素, 最终选择25 r/min为GSM细胞生长期最佳的搅拌转速。
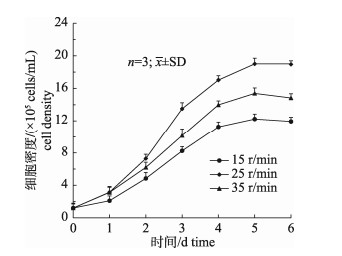
|
图 7 不同搅拌速度下GSM细胞生长曲线 Fig.7 Growth curves of GSM cells at different stirring speed |
在倒置显微镜及扫描电镜下观察GSM在Cytodex 3上贴壁生长, 结果显示GSM细胞在Cytodex 3表面具有较好的贴壁性(图 8)。GSM接种30 min后开始黏附于Cytodex 3上; 10 h后GSM已经大部分贴附于Cytodex 3表面, 细胞状态类似于细胞方瓶培养, GSM细胞呈梭形或不规则扁平状紧密贴附在Cytodex 3上(图 8a, 8d); 24 h后细胞在Cytodex 3上开始快速生长, 细胞已经在Cytodex 3表面形成单层(图 8b, 8e); 72 h部分细胞贴附于首层细胞之上, 开始在Cytodex 3上形成多层生长, 同时部分Cytodex 3之间出现“架桥”现象(图 8c, 8f)。
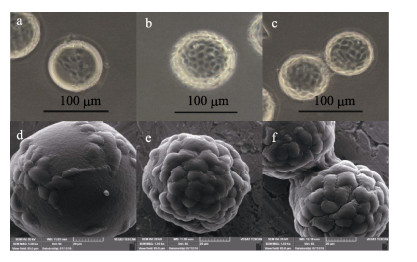
|
图 8 GSM细胞在Cytodex 3微载体表面的形态观察 倒置显微镜观察: a. 10 h, b. 24 h, c.72 h; 扫描电镜观察: d. 10 h, e. 24 h, f. 72 h; c, f.细胞“架桥”. Fig.8 Morphology of GSM cells growth on Cytodex 3 microcarriers Inverted microscopy: a. 10 h, b. 24 h, c. 72 h; Scan electron microscopy: d. 10 h, e. 24 h, f. 72 h; c, f. Cell "bridge". |
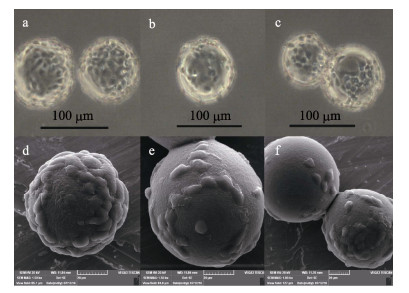
GSM细胞在Cytodex 3培养系统中培养24 h后, 按MOI=0.5接种GSIV, 逐日观察细胞病变效应, 结果如图 9所示。GSM细胞感染24 h后细胞表现为折光率增加; 48 h后细胞出现明显的CPE, 并开始逐渐收缩、变圆, Cytodex 3上的细胞层开始被破坏并逐渐从表面脱落(图 9a, 9d); GSIV接种72 h后大多数细胞开始从Cytodex 3上脱落, 同时扫描电镜下可见在Cytodex 3表面上出现大量细胞碎片(图 9b, 9e), 此外在感染期间微载体之间形成的架桥开始断裂(图 9c, 9f)。
|
图 9 GSM细胞在Cytodex 3微载体表面的细胞病变效应 倒置显微镜下观察: a. 48 h, b. 72 h, c.细胞“架桥”断裂; 扫描电镜下观察: d. 48 h, e. 72 h, f.细胞“架桥”断裂. Fig.9 Cytopathic effects of GSM cells on microcarrier infected with GSIV Inverted microscopy: a. 48 h, b. 72 h, c. cell "bridge" rupture; Scan electron microscopy: d. 48 h, e. 72 h, f. cell "bridge" rupture. |
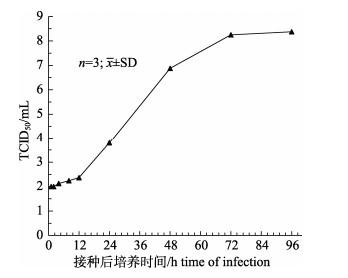
微载体培养条件下GSIV的增殖动态如图 10所示。GSIV感染GSM细胞8 h后, 病毒开始缓慢增殖, 此后进入对数生长期迅速增殖, 48 h后增殖速度缓慢下降, 至72 h时GSIV的滴度达到最高, TCID50为10–8.50±0.20/mL, 之后趋于稳定。
|
图 10 GSIV在微载体培养条件下的增殖动态 Fig.10 Proliferation dynamic of GSIV in microcarrier culture system |
大鲵虹彩病毒病是近些年在全国大鲵主养区域中新出现的一种高度传染性疾病, 呈现广泛发生、传播迅速且死亡率高的特征, 对大鲵养殖产业的健康发展构成严重威胁。由于缺少有效治疗大鲵虹彩病毒病的药物, 免疫预防被认为是预防与控制大鲵虹彩病毒病的有效途径。近年来, 中国学者开展了大鲵细胞疫苗、DNA疫苗等研究, 但传统的疫苗生产方式需要消耗大量的人力、物力, 且实现疫苗的规模化制备较为困难[14-16]。微载体悬浮培养技术具有单位表面积大、细胞培养密度高、成本低廉等优点, 应用新型细胞悬浮培养工艺制造动物疫苗抗原是当前中国动物疫苗的主流发展趋势之一[19]。
在Cytodex 3悬浮培养系统中, 细胞在Cytodex 3表面的贴附过程是决定细胞生长和增殖的重要环节[20-21]。本实验采用静置40 min、35r/min转速搅拌2 min的间歇搅拌方式促进细胞贴壁, 培养10 h后贴附率达95%, 随后贴附率趋于稳定。在比较不同血清浓度下GSM细胞在Cytodex 3上的贴壁情况时, 无血清条件下细胞的贴附率明显较低, 可能是因为贴附只能依靠物理吸附作用, 从而导致无血清时细胞贴附率较低; 而添加血清的条件下, 细胞的贴附率明显提高, 推测可能是由于血清中含有纤黏连蛋白、层黏连蛋白、胶原等各种促进细胞贴壁的因子[22-24]。在Cytodex 3微载体悬浮培养系统中, Cytodex 3与初始细胞量的比例对细胞扩大培养的速度和倍数有着十分重要的影响[25-26]。本实验中, 以0.6×105 cells/mL接种细胞时, 单个Cytodex 3上分布的GSM细胞过少, 且细胞接种后生长缓慢、最大细胞密度最低, 可能是由于细胞接种量过少, 导致细胞无法迅速进入对数增长期; 而以1.6×105 cells/mL接种细胞时, Cytodex 3上表现出聚团生长或有部分GSM细胞悬于培养液中未贴壁, 此时细胞大量聚集在微载体上, 导致多个微载体粘附在一起沉于培养瓶底部, 不利于细胞增长。此外, 高密度接种细胞时, 未贴壁的细胞游离在培养基中逐渐死亡, 容易产生细胞毒性效应。在一定的细胞接种量下, 随着Cytodex 3浓度的提高, 细胞的最大密度也有所增加。本研究中, Cytodex 3浓度为1 g/L、2 g/L、3 g/L时所能达到的最大细胞密度分别为13.5× 105 cells/mL、18.9×105 cells/mL、19.4×105 cells/mL。Cytodex 3浓度为1 g/L时, 细胞生长缓慢且密度较低, 可能是由于微载体表面贴附面积有限, 导致细胞生长空间不足。Cytodex 3浓度为2 g/L时与浓度为3 g/L时, 细胞的生长趋势及最大密度相近, 但是浓度为3 g/L时培养液中细胞碎片较多, 这可能是由于高浓度的微载体使得微载体之间相互碰撞, 导致细胞受损几率增大[27]。同时在细胞贴附期间微载体空载率较高, 微载体的利用率较低, 因此最终选择2 g/L为最适微载体浓度。
在Cytodex 3微载体悬浮培养GSM细胞的增殖过程中搅拌速度对实验结果有很大的影响, 若转速低于15 r/min, 容易导致Cytodex 3悬浮不均, 部分微载体沉于底部, 不利于细胞的生长。当转速高于35 r/min时, 容易产生较大的搅拌剪切力, 不仅直接造成细胞损伤, 同时也造成载体之间的碰撞, 不利于细胞的增殖[28]。因此, 本实验条件下25 r/min对GSM细胞的增殖最为理想。
为了进一步直观地观察到GSM细胞在Cytodex 3微载体上的增殖情况, 本实验对GSM在Cytodex 3上不同生长时段的形态及分布情况进行了倒置显微镜及扫描电子显微镜的观察。倒置显微镜仅可观察到细胞是否在Cytodex 3表面贴附, 无法观察到细胞在Cytodex 3表面的生长形态; 而扫描电子显微镜具有放大范围广、分辨率高、制样过程简单等特点, 可以清楚地观察细胞在Cytodex 3上的形态变化及发生过程, 对观察规模化培养GSM细胞及接种病毒后细胞状态极其重要。结果显示, GSM细胞呈梭形或不规则扁平状, 易形成紧密的细胞层贴附于Cytodex 3上, 且细胞在Cytodex 3上分裂增殖速度快, 可在短时间内获得大量细胞。GSIV感染48 h后细胞开始逐渐收缩、变圆、形状不规则并崩解从微载体上脱落下来, 在微载体表面形成大量细胞碎片。为了进一步探究Cytodex 3微载体增殖GSIV的效果, 本研究进一步测定了GSIV的动态增殖曲线。结果表明接种GSIV 8 h后, 病毒可以快速进入对数增长期, 48 h后病毒的增殖速度缓缓减慢, 72 h时病毒量达到最高, 滴度TCID50为10–8.50±0.20/mL, 随后趋于稳定。本研究所得GSIV的滴度明显高于周小愿等[29]研究中的TCID50 =10–5.35/mL。
本研究通过对大鲵细胞和虹彩病毒微载体悬浮培养工艺中的各项参数进行比较与优化, 初步建立了稳定的大鲵细胞与大鲵虹彩病毒的微载体规模化培养工艺, 为大鲵虹彩病毒疫苗的规模化与产业化奠定了前期基础。
| [1] |
Gao Z Y, Zeng L B, Xiao H B, et al. Studies on the physical, chemical and biological characteristics of giant salamander iridovirus[J]. Freshwater Fisheries, 2012, 42(5): 17-21. [高正勇, 曾令兵, 肖汉兵, 等. 大鲵虹彩病毒理化及生物学特性研究[J]. 淡水渔业, 2012, 42(5): 17-21. DOI:10.3969/j.issn.1000-6907.2012.05.004] |
| [2] |
Deng J, Wang Z Q, Zhang H X, et al. Disease prevention and treatment of the giant salamander Andrias davidanus[J]. Hebei Fisheries, 2014(12): 36-40. [邓捷, 王中乾, 张红星, 等. 大鲵的疾病防治[J]. 河北渔业, 2014(12): 36-40. DOI:10.3969/j.issn.1004-6755.2014.12.014] |
| [3] |
Yin W L, Zuo M L, Pan X Y, et al. Research progress of Andrias davidiniuas diseases[J]. Journal of Agricultural Catastrophology, 2015(7): 24-27. [尹文林, 左梦丽, 潘晓艺, 等. 大鲵病害的研究进展[J]. 农业灾害研究, 2015(7): 24-27.] |
| [4] |
Wang H, Chen C, Liu J R, et al. The research progress of viral diseases in giant salamander[J]. Agricultural Service, 2014, 31(8): 175-176. [王海, 陈诚, 刘峻嵘. 大鲵病毒性疾病的研究进展[J]. 农技服务, 2014, 31(8): 175-176. DOI:10.3969/j.issn.1004-8421.2014.08.129] |
| [5] |
Geng Y, Wang K Y, Li C W, et al. PCR detection and electron microscopic observation of bred Chinese giant salamander infected with ranavirus associated with mass mortality[J]. Chinese Veterinary Science, 2010(8): 817-821. [耿毅, 汪开毓, 李成伟, 等. 蛙病毒感染致养殖大鲵大规模死亡的电镜观察及PCR检测[J]. 中国兽医科学, 2010(8): 817-821.] |
| [6] |
Geng Y, Wang K Y, Li C W, et al. Pathological changes of cultured Chinese giant salamanders (Andrias davidianus) naturally infected with ranavirus[J]. Chinese Journal of Veterinary Science, 2011, 31(11): 1640-1644. [耿毅, 汪开毓, 李成伟, 等. 养殖大鲵蛙病毒自然感染的病理形态学观察[J]. 中国兽医学报, 2011, 31(11): 1640-1644.] |
| [7] |
Dong W, Zhang X, Yang C, et al. Iridovirus infection in Chinese giant salamanders, China, 2010[J]. Emerging Infectious Diseases, 2011, 17(12): 2388-2389. DOI:10.3201/eid1712.101758 |
| [8] |
Singh S M, Alkie T N, Abdelaziz K T, et al. Characterization of immune responses to an inactivated avian influenza virus vaccine adjuvanted with nanoparticles containing CpG ODN[J]. Viral Immunology, 2016, 29(5): 269-275. DOI:10.1089/vim.2015.0144 |
| [9] |
Holbrook B C, Kim J R, Blevins L K, et al. A novel R848-conjugated inactivated influenza virus vaccine is efficacious and safe in a neonate nonhuman primate model[J]. Journal of Immunology, 2016, 197(2): 555-564. |
| [10] |
Tang L, Kang H, Duan K, et al. Effects of three types of inactivation agents on the antibody response and immune protection of inactivated IHNV vaccine in rainbow trout[J]. Viral Immunology, 2016, 29(7): 430-435. DOI:10.1089/vim.2016.0035 |
| [11] |
Sun J B, Zeng L B, Zhang H, et al. Studies on the method of inactivating giant salamander iridovirus with β-propiolactone[J]. Freshwater Fisheries, 2013, 43(3): 66-71. [孙建滨, 曾令兵, 张辉, 等. 大鲵虹彩病毒β-丙内酯灭活方法的研究[J]. 淡水渔业, 2013, 43(3): 66-71. DOI:10.3969/j.issn.1000-6907.2013.03.012] |
| [12] |
Liu W, Xu J, Ma J, et al. Immunological responses and protection in Chinese giant salamander Andrias davidianus immunized with inactivated iridovirus[J]. Veterinary Microbiology, 2014, 174(3-4): 382-390. DOI:10.1016/j.vetmic.2014.10.028 |
| [13] |
Zeng X H, Zeng L B, Zhou Y, et al. Construction and immune efficacy of an MCP-containing DNA vaccine for Chinese giant salamander iridovirus[J]. Journal of Fishery Sciences of China, 2015, 22(5): 1055-1067. [曾宪辉, 曾令兵, 周勇, 等. 大鲵虹彩病毒主衣壳蛋白MCP基因DNA疫苗的构建及其免疫效果[J]. 中国水产科学, 2015, 22(5): 1055-1067.] |
| [14] |
Trabelsi K, Majoul S, Rourou S, et al. Development of a measles vaccine production process in MRC-5 cells grown on Cytodex1 microcarriers and in a stirred bioreactor[J]. Applied Microbiology & Biotechnology, 2012, 93(3): 1031-1040. |
| [15] |
Rozwadowska N, Malcher A, Baumann E, et al. In vitro culture of primary human myoblasts by using the dextran microcarriers Cytodex3®[J]. Folia Histochemica Et Cytobiologica, 2016, 54(2): 81-90. |
| [16] |
Thomassen Y E, Rubingh O, Wijffels R H, et al. Improved poliovirus D-antigen yields by application of different Vero cell cultivation methods[J]. Vaccine, 2014, 32(24): 2782-2788. DOI:10.1016/j.vaccine.2014.02.022 |
| [17] |
Sun Y, Zhang X L, Chen J, et al. Development of a procedure for preparation of rabies virus by culture of Vero cells in serum-free medium[J]. Chinese Journal of Biologicals, 2016, 29(10): 1099-1103. [孙燕, 张香玲, 陈军, 等. 无血清培养基培养Vero细胞制备狂犬病病毒工艺的建立[J]. 中国生物制品学杂志, 2016, 29(10): 1099-1103.] |
| [18] |
Huang D, Peng W J, Ye Q, et al. Serum-free suspension culture of MDCK cells for production of influenza H1N1 vaccines[J]. PLoS ONE, 2015, 10(11): e0141686. DOI:10.1371/journal.pone.0141686 |
| [19] |
Frazzati-Gallina N M, Paoli R L, Mourão-Fuches R M, et al. Higher production of rabies virus in serum-free medium cell cultures on microcarriers[J]. Journal of Biotechnology, 2001, 92(1): 67-72. DOI:10.1016/S0168-1656(01)00362-5 |
| [20] |
Castro R, Fernandes P, Laske T, et al. Production of canine adenovirus type 2 in serum-free suspension cultures of MDCK cells[J]. Applied Microbiology and Biotechnology, 2015, 99(17): 7059-7068. DOI:10.1007/s00253-015-6636-8 |
| [21] |
Reisinger K S, Block S L, Izu A, et al. Subunit influenza vaccines produced from cell culture or in embryonated chicken eggs: comparison of safety, reactogenicity, and immunogenicity[J]. Journal of Infectious Diseases, 2009, 200(6): 849-857. DOI:10.1086/599178 |
| [22] |
Lam A T L, Li J, Chen A K L, et al. Improved human pluripotent stem cell attachment and spreading on xeno-free laminin-521-coated microcarriers results in efficient growth in agitated cultures[J]. Bioresearch Open Access, 2015, 4(1): 242-257. DOI:10.1089/biores.2015.0010 |
| [23] |
Li Y, Powell S, Brunette E, et al. Expansion of human embryonic stem cells in defined serum-free medium devoid of animal-derived products[J]. Biotechnology & Bioengineering, 2005, 91(6): 688-698. |
| [24] |
Jiang D D, Hu J B, Zhou Y, et al. Optimization of attachment conditions for rabbit mesenchymal stem cell in Cytodex 3 microcarrier culture systems[J]. Journal of Biomedical Engineering, 2007, 24(4): 884-888. [蒋丹丹, 胡静波, 周燕, 等. 兔骨髓间充质干细胞在Cytodex 3微载体悬浮培养系统中的贴附条件优化[J]. 生物医学工程学杂志, 2007, 24(4): 884-888. DOI:10.3321/j.issn:1001-5515.2007.04.037] |
| [25] |
Bock A, Sann H, Schulze-Horsel J, et al. Growth behavior of number distributed adherent MDCK cells for optimization in microcarrier cultures[J]. Biotechnology Progress, 2009, 25(6): 1717-1731. |
| [26] |
Bock A, Schulze-Horsel J, Schwarzer J. High-density microcarrier cell cultures for influenza virus production[J]. Biotechnology progress, 2011, 27(1): 241-250. DOI:10.1002/btpr.v27.1 |
| [27] |
Genzel Y, Olmer R M, Schafer B, et al. Wave microcarrier cultivation of MDCK cells for influenza virus production in serum containing and serum-free media[J]. Vaccine, 2006, 24(35-36): 6074-6087. DOI:10.1016/j.vaccine.2006.05.023 |
| [28] |
Sun X, Zhang Y, Tan W, et al. Attachment kinetics of Vero cells onto CT-3 microcarriers[J]. Journal of Bioscience and Bioengineering, 2000, 90(1): 32-36. DOI:10.1016/S1389-1723(00)80030-4 |
| [29] |
Zhou X Y, Zhang X L, Han Y H, et al. Condition optimization for large-scale cultivation of Chinese giant salamander iridovirus by rotary bottle[J]. Journal of Mountain Agriculture & Biology, 2015, 34(1): 32-35. [周小愿, 张星朗, 韩亚慧, 等. 大鲵虹彩病毒转瓶规模化培养条件研究[J]. 山地农业生物学报, 2015, 34(1): 32-35. DOI:10.3969/j.issn.1008-0457.2015.01.006] |
 2018, Vol. 25
2018, Vol. 25

