资源评估是渔业资源现状评价的主要途径之一。当前, 科学组织多采用基于渔获量数据的渔业资源评估方法, 如产量模型, 综合模型, 延迟差异模型等[1], 并将种群状态判别结果作为渔获量管理规则的建立依据。然而, 为了规避管理风险和特定利益的诉求, 渔获量统计通常存在“过高”或“过低”的虚报现象, 譬如在TAC管理体系下, 为了获得最大利益, 渔民通常会低报渔获产量, 或者为了追求高产值的目标种类, 在渔业生产中抛弃低值渔获物; 而在政府间渔业管理组织配额转让制度中, 为了能够分配到更多的许可捕捞额度, “过高”的产量扭曲现象也随之发生。此外, 当鱼类种群濒临衰竭时, 禁止捕捞、渔业保护区划定等渔业养护政策也将导致产量数据的有限性。国际海洋开发理事会(ICES)数次指出捕捞产量数据的扭曲降低了评估结果的可信度, 并直接影响到到渔业管理者的决策能力和实施效力[2]。
渔业调查被认为是较为可靠的数据来源之一, 因此, 基于调查数据的资源评估为种群状态判别提供了科学有效的方法。欧盟Fisboat项目组在2004―2007年提出了通过专业资源调查数据开展资源评估、状态诊断和管理策略模拟的技术框架[3], 其中指标测度方法是其核心内容。该方法整合了种群不同动态属性的一系列指标, 包括生物学特征、种群变化、空间特征等, 应用多变量统计方法评价并诊断种群长时间序列的变化趋势, 并在北海鳕(Gadus morhua)[4]、比斯开湾狭鳕(Merluccius merluccius)[5]等鱼类进行实证分析, 认为基于指标的评价方法能够充分地诊断和判别种群变化。
小黄鱼(Larimichthys polyactis)是东海区重要的经济鱼种之一, 长期被拖网、流刺网和张网渔业捕捞, 当前捕捞产量维持在13~14万t左右。虽然经历过历史的低迷, 然而, 在较高的捕捞强度开发之后, 小黄鱼和带鱼(Trichiurus japonicus)在底拖网渔业中的资源密度仍然占到总资源的50%以上, 尤其是伏季休渔政策实施以来, 小黄鱼资源虽然没有能够得到根本扭转或者恢复, 但资源恶化的趋势得以缓解, 甚至是达到短期的稳态平衡。鉴于小黄鱼在东海区重要的经济地位, 该鱼种一直是渔业管理者和科研人员重点关注的鱼种之一, 相关的保护措施和研究范畴也较为广泛, 并在基础生物学、开发利用等方面得出了共同的结论, 如低龄化、性成熟提前、处于过度捕捞水平等[6-8]。然而, 小黄鱼资源现状的判别研究仍然是基于资源量、开发率、生物学特征等单一指标[9], 多种指标的融合分析较少涉及[10]。本研究将整合个体特征、种群属性、空间动态、开发利用等多个指标, 利用多元分析方法探讨小黄鱼种群的年际变化模式, 识别影响主模式的主导因素, 以期为今后小黄鱼渔业资源的科学管理和合理利用提供理论依据。
1 材料方法 1.1 数据来源2000―2015年, 在东海区长期开展了底拖网渔业资源监测和调查, 调查范围为27°00'~ 34°00'N, 机轮拖网禁渔线至127°00'E, 站位设置方式为栅格分布, 空间分辨率为30'×30'。调查时间为春季(5月)和秋季(8―9月), 春季为小黄鱼繁殖期, 渔获群体年龄均在1龄以上, 认为个体全部达到性成熟[11], 通过扫海面积可计算出亲体的资源密度; 秋季为小黄鱼渔业起始时间, 渔获群体由剩余群体和补充群体组成, 渔获群体体长结构分化明显, 呈多个正态分布类型, 通过混合分布模型分解技术可获得剩余群体和补充群体组成比例[12], 从而得到小黄鱼补充量。
调查船主机功率, 网具网目为100目×4 m, 网口周长400 m, 网具总长度130 m, 囊网网目25 mm。调查时拖速为2 kn/h, 每站拖网1 h。每个调查站位拖网渔获物取1箱(每箱约15 kg, 不足1箱则全部取回), 做好渔捞记录和编号后置于鱼舱冰鲜保存, 带回实验室鉴定分析, 记录每一种类的数量(ind/h)和质量(kg/h), 对主要经济种类进行生物学测定。
1.2 生物学指标内秉增长率r是总丰度随时间变化的梯度, 代表种群的自我恢复能力, 可间接表征捕捞对种群的影响程度, 基本模型为Nt=Nt–1er。对数转换后可通过线性回归解析r值, lgNt=β0+rt, 此时r反映了多年时间序列平均波动。当需要获得年间种群变化, 只需调整时间间隔t。
体长指标:有7种, 以小黄鱼捕捞群体的不同分位数所对应体长表示。分位数在网具选择性研究范畴代表了特定体长组被捕捞的概率, 而当网具结构相同时, 可以反映捕捞群体的个体大小。本研究以春季25%体长L25S、50%体长L50S、平均体长LmeanS, 75%体长L75S, 以及秋季25%体长L25A、50%体长L50A、75%体长L75A, 分别代表小型、中型和大型个体。体长指标受到补充强度、生长的影响, L25与小型个体的数量有关, 因此补充量较低的年份会导致L25增大; L75与高年龄组有关, 由于选择性较低, 对捕捞强度增加具有较快的响应, 而当捕捞强度较低时, 由于生长和年龄混合的关系, 响应时间较为缓慢。
生物量指标:有2种, 为调查站位单位捕捞努力量渔获量(catch per unit effort, CPUE), 即单位捕捞努力量渔获量, 标准化为kg/h, 这里选择春季CPUES, 秋季CPUEA。生物量指标主要和丰度、长度、营养状况等因素有关。时间序列分析中, CPUE均来自相同季节, 以消除季节变化中洄游、捕食、性腺发育等因素的影响。
肥满度和异速生长指标:有4种, 分别为春季肥满度(ConditionS)、春季异速生长系数(BS)、秋季肥满度(ConditionA)、秋季异速生长系数(BA), 肥满度是反映鱼类个体营养状况和繁殖适合度的指标。肥满度低意味着饵料保障不足, 进而可能引起性成熟滞后甚至跳过产卵, 降低繁殖力, 增加自然死亡等。异速生长系数用来判断是否处于等速生长, 反映了营养条件和不同体重的差异。可通过异速生长方程计算, 公式为W=aLb, 对数转换后可对lgW和lgL线性回归, 获得截距项lga和斜率b, 时间序列分析时, 肥满度采用(a-a)/a标准化处理。
性比:性比是衡量种群结构和稳定性的一个重要指标, 小黄鱼性别和体长有显著关系, 雄性个体较小, 雌性个体较大。较高的选择性捕捞会减少雌性群体数量, 从而导致雌雄配比失衡。
1.3 捕捞强度指标总死亡系数Z表示同一世代个体从资源群体中消失的状况, 死亡程度的高低决定了资源群体数量的下降速度。通过渔业初期和渔业末期资源尾数变化计算, 即Z=–log(Nt–1/Nt)。Nt–1和Nt分别为秋季和翌年春季时的资源尾数, 由于CPUE是反映资源密度大小的良好指标, 计算时以CPUE均值代替。
1.4 空间指标 1.4.1 重心重心(centre of gravity, CG)为渔场位置的重要参数, 代表种群分布的重心位置, 以站点密度和面积为权重分别计算经度重心和纬度重心[5], 计算方式如下。
| $ \text{CG}=\frac{\sum\limits_{i=1}^{N}{{{x}_{i}}{{s}_{i}}{{c}_{i}}}}{\sum\limits_{i=1}^{N}{{{s}_{i}}{{c}_{i}}}} $ |
式中, CG为重心位置, xi为经度或纬度坐标; si为取样站点的面积, 这里设置为1, 即每个站点的取样面积均为1个单位; ci为取样站点密度。
1.4.2 铺展面积铺展面积(spreading area, SA)是描述种群空间分布面积的测度指标。定义方法如下[5]:假定T为种群各出现区域的累计面积; Q(T)为对应区域的累计丰度, Q为总丰度(以面积为权的密度之和)。SA定义为函数(Q-Q(T))/Q在变量T区间上的2倍积分, 即:
| $ \text{SA}=2\int{\frac{Q-Q\left( T \right)}{Q}}\text{d}T $ |
计算时各站点取样面积均设定为1, 即忽略每个站点面积的影响, SA则代表了物种的相对分布面积。
1.5 多变量分析 1.5.1 有效变量选择为选择对种群分析具有代表性的指标, 减少冗余指标数量, 将每个调查指标标准化为均值为0, 方差为1的标准化变量, 依据时间结构对各变量进行滞后距为1的变异函数分析, 并根据时间相关性对各指标排序, 选择变异值小于1的较高时间持续性变量为初始选择指标。
计算方式如下:
| $ r\left( x, h \right)=\frac{1}{2N\left( h \right)}{{\sum\limits_{N\left( h \right)}{\left[ Z\left( x \right)-Z\left( x+h \right) \right]}}^{2}} $ |
式中, r(x, h)为变异值, h为时间滞后距, 这里为1; N(h)为1阶配对样本数; Z(x)定义为在一维轴上时间序列变量, 则Z(x)和Z(x+h)分别为Z(x)在x和x+h处的变量值。
1.5.2 最小/最大自相关因子分析最小/最大自相关因子分析(min/max autocorrelation factors, MAF)是将多个变量通过线性变换重新组合的一种多元统计方法, 各线性构造函数的变量之间在同步时间序列和给定时滞时间序列上均不相关。MAF方法的理念与主成分分析(principal component analysis, PCA)相似, 不同的是MAF方法以自相关最大化取代了PCA的方差最大化, 即提取出具有显著自相关性的分量和具有弱相关性的分量, 分量之间无相关性。因此, 第一分量(the first component of MAF, MAF1)代表了首要的共同趋势变化, 第二分量(the second component of MAF, MAF2)为次要共同趋势变化。
为防止变量的过度拟合, 并增加MAF的显著性和稳定性, 采用了稳健的MAF计算方法, 即在估算MAF前对变量矩阵进行中心标准化, 并增加随机误差ε, ε~N[0, 0.1×Nindicators/(Nyears–1)], 重复1000次计算, 取中位数为最终的MAF载荷值。
连续指数可以表征各个变量的时间序列是否发生显著性变化, 可以通过时间序列结构分量进行构建, 即各变量的连续指数通过前k个MAF分量载荷和1阶滞变异值计算, 计算方式为
采用突变t检验循序算法(sequential t-test analysis of regime shift, STARS)诊断主分量MAF1和MAF2的跃变节点, 分析位相变化。设定显著性检验置信水平P=0.1, 跃变的切断长度L=10, Huber权重参数H=2。利用自定义的差值累积和(cumulative sum of the difference, CSD)分析主分量的趋势变化, 即先计算相邻数据的差值, 然后对差值累积求和。
2 结果与分析 2.1 有效指标选择收集19个指标用于小黄鱼种群的时间序列分析, 其中生物学指标13个, 资源丰度指标2个, 捕捞强度指标1个, 空间指标3个, 这些指标均在一定程度上表征了小黄鱼个体或种群的生物属性。各指标一阶滞变异值及排序见图 1。以变异值1为分组标准, 可将各指标值分为2组, 其中小于1代表时间相关程度较高, 共有7个指标, 分别为生殖群体的性比组成、纬度分布重心(latitude center of gravity, YCG)、异速生长系数、扩散面积、资源密度、条件因子和75%体长, 1阶变异值范围为0.46~0.99。因此采用时间相关度较高的7个指标分析MAF的时间趋势变化, 并提取变化主分量。各指标在主分量的载荷见表 1, 第一主分量和第二主分量的1阶变异值分别为0.16、0.19。取前两个主分量计算各指标的连续性指数Cj, 并依据值的大小按秩序排列, 结果见图 2, 依次为生殖群体的纬度分布重心、异速生长系数、性比、扩散面积、75%体长、条件因子、资源密度, 后3个指标的连续性指数极小, 均低于0.05, 因此选择前4个指标作为有效指标, 分析各指标与MAF主分量趋势变化之间的关联性。
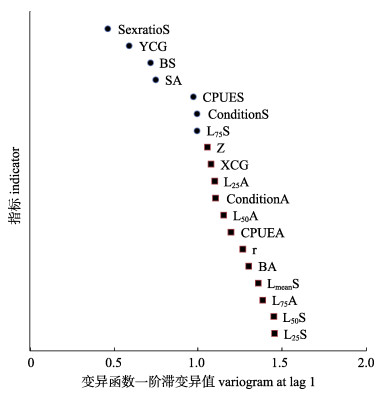
|
图 1 东海小黄鱼各指标一阶滞变异值排序 L75S、L50S、L25S为春季小黄鱼捕捞群体75%、50%、25%分位数对应体长, L75A、L50A、L25A为秋季小黄鱼捕捞群体75%、50%、25%分位数对应体长, SexratioS为春季性比, YCG为纬度重心, BS为春季体长-体重关系异速生长系数, SA为铺展面积, CPUES为春季单位捕捞努力量渔获量, ConditionS为春季条件因子, ConditionA为秋季条件因子, XCG为经度重心,BA为秋季体长-体重关系异速生长系数. Fig.1 Orders of the one-lag variogram for each indicator of Larimichthys polyactis in East China Sea L75S, L50S, L25S mean length at which fish have 75%, 50%, 25% probability to be caught for populations in spring, respectively. L75A, L50 A, L25 A means length at which fish have 75%, 50%, 25% probability to be caught for populations in autumn, respectively. SexratioS means sex ratio in spring. YCG means the latitude centre of gravity. BS mean allometric growth coefficient in spring. SA means spreading area. CPUES means catch per unit effort in spring. ConditionS means condition factor in spring. ConditionA means condition factor in autumn. XCG means the longitude centre of gravity. BA means mean allometric growth coefficient in autumn. |
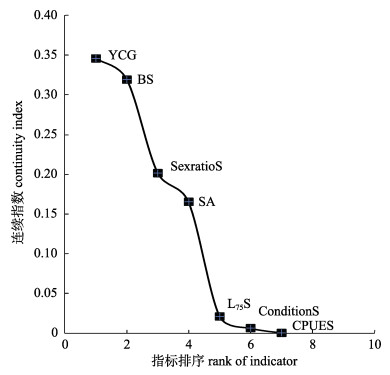
|
图 2 东海小黄鱼各指标连续性指数排序 L75S为春季小黄鱼捕捞群体75%分位数对应体长, CPUES为春季单位捕捞努力量渔获量, ConditionS为春季条件因子, SexratioS为春季性比, BS为春季体长-体重关系异速生长系数, YCG为纬度重心, SA为铺展面积. Fig.2 Indicators rank according to their continuity index for Larimichthys polyactis in East China Sea L75S means length at which fish have a 75% probability to be caught for population in spring, CPUES means catch per unit effort in spring, ConditionS means condition factor in spring, SexratioS means sex ratio in spring, BS means allometric growth coefficient in spring, YCG means the latitude centre of gravity, SA means spreading area. |
|
|
表 1 东海小黄鱼各指标在MAF第一分量和第二分量的载荷 Tab.1 Loadings on MAF 1 and MAF 2 for the selected indicators of Larimichthys polyactis in East China Sea |
MAF第一主分量和第二主分量可用于描述小黄鱼种群在特定时间阶段的变化趋势, 如图 3所示。从位相上, 2000―2015年MAF1可划分为3个状态, 分别为2000―2002年、2003―2012年、2013―2015年; 从趋势上, MAF1并不是单调变化, 而是表现出间隔相对较长年份的周期变动, 可分为2个阶段, 2007年之前为递增趋势, 随后下降, 直至2015年。MAF2也可以划分2个位相, 分别为2000―2007年和2010―2014年; 从趋势上, 短期变动明显, 可分为4个阶段, 2000―2003年较为扁平, 为小幅波动阶段; 2004―2006年为下降阶段; 2007―2012年为增长阶段, 2013年之后重新开始下降, 直至2015年。
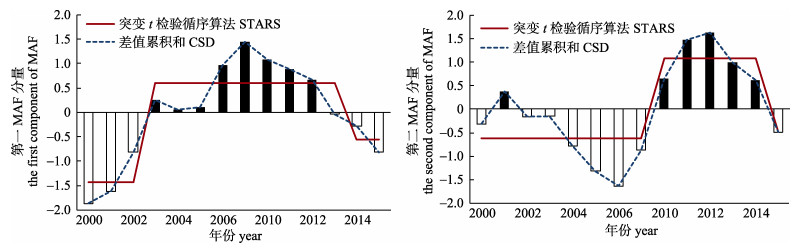
|
图 3 2000—2015年东海小黄鱼各指标MAF第一和第二分量的年际变化及突变诊断 Fig.3 Inter-annual variations of the first two MAFs and regime shift from the selected indicators of the Larimichthys polyactis in East China Sea over the period 2000–2015 |
载荷值表明了各个指标对MAF主分量时间变化趋势的贡献度, 对第一主分量贡献度最高的指标是生殖群体的纬度分布重心(–0.756)和异速生长系数(–0.609), 对趋势变化均为负相关; 对第二分量贡献度最高的指标有生殖群体的性比组成(0.590)、异速生长系数(0.539)和扩散面积(–0.606), 其中性比、异速生长系数对趋势变化有正相关的作用, 扩散面积为负相关作用。
通过贡献度较高指标的年际变化特征(图 4), 可以解释MAF主分量的变化趋势(图 3)。MAF1为长周期变动, 与纬度分布重心和异速生长系数变化的周期有密切关系。纬度分布重心的变化主要有两个周期, 分别为2000—2010年下降阶段和2010—2015年上升阶段; 异速生长系数的变化同样表现为两个周期, 分别为2000—2006年下降阶段和2006—2015年的上升阶段。由于纬度分布重心、异速生长系数和MAF第1主分量均为负相关, 因此第1主分量表现出先增加后降低的变化趋势, 但这种变化的节点与上述指标略有差异, 转折期节点(2007年)略早于纬度分布重心(2010年), 而晚于异速生长因子指数(2006年)。生殖群体的性比组成、异速生长系数和扩散面积是影响MAF第2主分量变化的主要指标, 性比、异速生长系数在增长期(2006—2012年)的变化趋势与第二分量几乎趋同, 并在2012年之后表现为相同的下降趋势, 而扩散面积主要为波动状态, 变化趋势与MAF2不尽相同, 显示了不同属性的指标在时间尺度也表现出不同的差异。
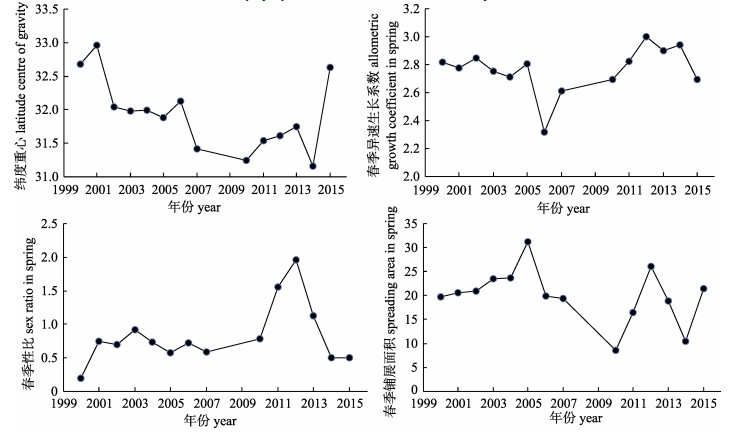
|
图 4 2000—2005年东海小黄鱼分布纬度重心、春季异速生长系数、春季性比和春季铺展面积的年际变化 Fig.4 Inter-annual variation of selected indicators with the highest continuity on the MAF which are latitude centre of gravity, allometric growth coefficient in spring, sex ratio in spring and spreading area in spring for the Larimichthys polyactis in East China Sea over the period 2000–2015 |
测度法可以用来描述鱼类种群的现状和趋势变化, 也可以用于群落结构或生态系统的状况的诊断。长期以来, 基于不同层次的参数指标被提出并在理论和实践中得到发展, 其中在群落和生态系统中的应用更为广泛。这些指标并不是随意的选择, 既要有可靠的数据信息支撑, 更要考虑到选择指标的生态理论意义。指标测度方法的数据基础主要是源自专业的科学调查, 或者是代表性的渔业监测; 在指标的判读上要结合可解释性和生态意义, 普遍采用的指标如相对丰度、体长或年龄结构、营养级、物种多样性等, 上述指标在捕捞和气候变化对渔业资源的影响等研究方面已有诸多应用。Trenkel等[9]较系统地阐述了不同指标的计算方式、假设检验、统计功效, 并对各指标的优缺点进行了评判分析。Rochet等[10]采用种群和群落层次的指标对法国沿海渔业群落的变化趋势进行了定性研究, 选用的指标包括单物种的丰度、平均体长、群落的总生物量、总丰度、平均体质量、长度谱截距和斜率等。刘尊雷等[11]采用长度谱截距和斜率以及非目标种类比例的变化研究了1988—2006年江苏南部沿岸海域鱼类群落结构的变化。在单种类方面, 指标测度方法更多地应用于物种生活史特征进化或资源养护方面的研究, 如性成熟体长演变[12-13]、资源密度-分布-生活史变化等综合研究[14-16]。本研究在指标选择时采用了3个方面的依据和判别标准, 包括种群属性、捕捞压力、栖息地利用。种群属性主要表现在资源数量、个体表型、种群结构的变化特征, 如资源密度、体长、体质、內秉增长率、性比组成等; 捕捞压力以捕捞死亡系数为代表; 栖息地利用以生殖群体的空间聚集位置和分布面积为指标。这3类指标内容能够充分描述小黄鱼种群的资源水平、生物动态、空间分布的变化以及捕捞干扰程度。然而, 无论是物种还是群落水平的指标分析, 大多数的研究仍然是采用了独立的统计或者定性定量比较, 不能清晰阐述预先选择指标的代表性, 当选择的指标较多时, 指标的相互干扰或异质性也会混淆物种的内在变化。本研究采用一阶滞变异值时间相关性较大的变量为初始变量, 并对选择的变量用于最小/最大自相关因子分析, 获取主分量的时间序列变化特征及各指标的载荷, 通过一阶滞变异值和载荷得到连续指数, 从而在一系列指标中捕获承载主要变化信号的有效变量。因此, 本研究所采用的指标具有相互独立、时间自相关性高、时间变化特征明显的优点; 同时MAF方法能较好地解决指标之间存在线性相关性且在时间结构上自相关的问题, 第一主分量在时间序列上有最大的连续性, 最后的主分量的连续性最小, 从而获得各指标集合组成的时间变化模式。
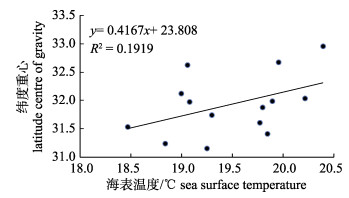
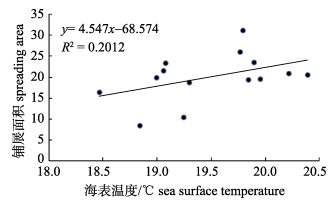
小黄鱼在第一主分量和第二主分量的1阶变异值分别为0.16、0.19, 而Woillez[4]对北海鳕和比斯开湾鳀(Engraulis encrasicolus)的研究中发现, 两个种类分别为0.029、0.178和0.094、0.183, 小黄鱼种群变化表现出了相对较弱的时间连续性, 在第一主分量尤为显著, 可能与鱼种的生活史特征及对干扰变化的敏感性有关。虽然小黄鱼为底层鱼类, 已发现生活史最大寿命可达23龄[17], 但当前生殖群体仍以1龄为主, 资源状况极易受到补充强度的影响[6]; 此外, 小黄鱼种群结构简单, 个体小型化、低龄化现象严重[18], 对捕捞和环境的抵抗力和稳定性较差, 在年际变化上则表现出更为剧烈的波动状态。根据最小/最大自相关因子分析结果, 主分量MAF1和MAF2表现出了较为明显的周期性变化趋势, 对MAF1变化贡献率较高的指数为异速生长系数和纬度重心。异速生长系数代表了鱼类个体的生长维度, 在不同的生长阶段、不同环境条件甚至是捕捞压力下均有明显的差异性。在对黄海北部-渤海群系和黄海南部群系小黄鱼研究中, 李忠炉等[19]认为在相对较低的捕捞压力下, 个体的体质量生长速度提高, 异速生长因子也会升高; 当遭受的捕捞压力较大, 导致体长比体质量生长更快, 呈负异速生长[19]。FAO从捕捞压力的角度, 分析了韩国在东黄海小黄鱼的捕捞产量变化情况[20], 20世纪90年代初到21世纪初期, 小黄鱼遭受了较为严重的过度捕捞, 捕捞产量崩塌式急剧下降, 2003年最低产量仅为1992年的18%, 2003年之后, 小黄鱼资源逐渐恢复, 到2011年已经超过90年代初期的水平。小黄鱼渔获量的变化趋势在一定程度上代表了资源的演变过程, 即从资源衰退到资源恢复, 这种变化与异速生长系数也表现出较好的一致性。然而, 异速生长系数对捕捞活动的响应只能从长期的时间序列进行论证, 由于鱼类的体态变化既体现了生长过程的累积效应, 还对短时期的行为活动较为敏感(如摄食量、生殖活动等), 因此该指标的变化容易受到多方面因素的干扰。纬度重心与MAF1线性拟合结果显示(图 5), 两者呈显著负相关(F=16.46, P < 0.01), 表明生殖群体的分布位置会影响到资源的状态变化。结合东海海域的海表温度变化, 发现海表平均温度对重心的纬度有一定的影响(图 6), 但未达到显著水平(F=2.85, P=0.12), 海表平均温度每增加1℃, 生殖群体的分布重心将向北部迁移0.42°。小黄鱼属暖温性生态特征, 温度升高可能会扩大适宜栖息地面积, 这体现了暖温性鱼种对生态环境的适应性。温度升高导致鱼类向极地方向迁移的研究已有广泛的认知, Cheung等[21]从全球尺度分析了1066种鱼类和2050种无脊椎生物对气候变化的分布响应, 发现大多数种类的分布重心和极地边界向极地方向迁移, 中上层组别的迁移速率高于底层组别。而在北海海洋鱼类中[22], 接近2/3的种类在平均纬度或者深度上发生转移, 半数种类的南部或北部分布边界随温度升高而变化, 即分布边界向北部扩展。为进一步验证小黄鱼分布范围的扩散特征, 对铺展面积和海表平均温度做散点图并做线性拟合分析(F=3.02, P=0.11), 结果见图 7, 铺展面积随温度的上升而增加, 表明小黄鱼的分布范围并非随着温度升高而整体向北部迁移, 而是通过扩大适宜栖息面积获取更大的生存空间, 温度每上升1℃, 小黄鱼的相对分布面积将增加4.55个单位。然而, 本研究对空间分布属性的指标仅探讨了重心位置和铺展面积, 并没有对北部和南部的分布边界的变化特征进行分析。根据“理想自由分布”理论, 物种总是选择能使其适合度达到最大的栖息地, 密度增加时, 部分个体会转向利用质量较差的栖息地[23], 形成边际分布区域, 因此, 物种对边际栖息地的环境变化极为敏感。为进一步判别小黄鱼种群变动, 有关边界栖息区域的生境变化以及对小黄鱼资源现状和时空分布模式的影响仍需要进一步探讨。

|
图 5 纬度重心和MAF第一分量线性拟合关系 Fig.5 Linear regression between the latitude centre of gravity and MAF1 |
|
图 6 海表温度和纬度重心线性拟合关系 Fig.6 Linear regression between the sea surface temperature and latitude centre of gravity |
|
图 7 海表温度和铺展面积线性拟合关系 Fig.7 Linear regression between the sea surface temperature and spreading area |
| [1] |
Quinn T J, Deriso R B. Quantitative Fish Dynamics[M]. Oxford: Oxford University Press, 1999: 542.
|
| [2] |
Mesnil B, Cotter J, Fryer R J, et al. A review of fishery-independent assessment models, and initial evaluation based on simulated data[J]. Aquatic Living Resources, 2009, 22: 207-216. DOI:10.1051/alr/2009003 |
| [3] |
Fisboat. Fisheris independent survey-based operational assessment tools[R/OL]. documents available online at http://www.ifremer.fr/drvecohal/fisboat/[R], 2007.
|
| [4] |
Woillez M, Rivoirard J, Petitgas P. Using min/max autocorrelation factors of survey-based indicators to follow the evolution of fish stocks in time[J]. Aquatic Living Resources, 2009, 22: 193-200. DOI:10.1051/alr/2009020 |
| [5] |
Woillez M, Poulard J C, Rivoirard J, et al. Indices for capturing spatial patterns and their evolution in time, with application to European hake (Merluccius merluccius) in the Bay of Biscay[J]. ICES Journal of Marine Science, 2007, 64: 537-550. DOI:10.1093/icesjms/fsm025 |
| [6] |
Yan L P, Liu Z L, Zhang H, et al. On the evolution of biological characteristics and resources of small yellow croaker[J]. Marine Fisheries, 2014, 36(6): 481-488. [严利平, 刘尊雷, 张辉, 等. 小黄鱼生物学特征与资源数量的演变[J]. 海洋渔业, 2014, 36(6): 481-488. DOI:10.3969/j.issn.1004-2490.2014.06.001] |
| [7] |
Liu Z L, Yan L P, Yuan X W, et al. Stock assessment of small yellow croaker in the East China Sea based on multi-source data[J]. Journal of Fishery Sciences of China, 2013, 20(5): 1039-1049. [刘尊雷, 严利平, 袁兴伟, 等. 基于多源数据的东海小黄鱼资源评估与管理[J]. 中国水产科学, 2013, 20(5): 1039-1049.] |
| [8] |
Lin L S, Cheng J H, Ren Y P, et al. Analysis of population biology of small yellow croaker Pseudosciaena polyactis in the East China Sea region[J]. Journal of Fishery Sciences of China, 2004, 11(4): 333-338. [林龙山, 程家骅, 任一平, 等. 东海区小黄鱼种群生物学特性的分析[J]. 中国水产科学, 2004, 11(4): 333-338. DOI:10.3321/j.issn:1005-8737.2004.04.010] |
| [9] |
Trenkel V M, Rochet M J. Performance of indicators derived from abundance estimates for detecting the impact of fishing on a fish community[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2003, 60: 67-85. DOI:10.1139/f02-163 |
| [10] |
Rochet M J, Trenkel V M, Bellail R, et al. Combining indicator trends to assess ongoing changes in exploited fish communities:diagnostic of communities off off the coasts of France[J]. ICES Journal of Marine Science, 2005, 62: 1647-1664. DOI:10.1016/j.icesjms.2005.06.009 |
| [11] |
Liu Z L, Cheng J H, Li S F, et al. Changes of fish community structure in Jiangsu, China offshore areas[J]. Journal of Fishery Sciences of China, 2009, 16(2): 274-281. [刘尊雷, 程家骅, 李圣法, 等. 江苏近岸海域鱼类群落结构的变化[J]. 中国水产科学, 2009, 16(2): 274-281. DOI:10.3321/j.issn:1005-8737.2009.02.016] |
| [12] |
Roos A M, Boukal D, Persson L, et al. Evolutionary regime shifts in age and size at maturation of exploited fish stocks[J]. Proceedings of the royal Royal society Society B-Biological Sciences, 2013, 273: 1873-1880. |
| [13] |
Pukk L, Kuparinen A, J rv L, et al. Genetic and life-history changes associated with fisheries-induced population collapse[J]. Evolutionary Applications, 2013, 6(5): 749-760. DOI:10.1111/eva.12060 |
| [14] |
Francis M P, Roberts J, MacGibbon D J. Indicator based analysis of the status of eight shark and chimaera species in New Zealand waters[R]. New Zealand Fisheries Assessment Report, 2016/65.
|
| [15] |
Probst W N, Kloppmann M, Kraus G. Indicator-based status assessment of commercial fish species in the North Sea according to the EU Marine Strategy Framework Directive (MSFD)[J]. ICES Journal of Marine Science, 2013, 70(3): 694-706. DOI:10.1093/icesjms/fst010 |
| [16] |
Greenstreet S, Rossberg A G, Fox C J, et al. Demersal fish biodiversity:species-level indicators and trends-based targets for the Marine Strategy Framework[J]. ICES Journal of Marine Science, 2012, 69(10): 1789-1801. DOI:10.1093/icesjms/fss148 |
| [17] |
Fishery Bureau of Ministry of Agriculture. Investigation and zonation of fishery resources of the East China Sea[M]. Shanghai: East China Normal University Press, 1987: 339-356. [农牧渔业部水产局. 东海区渔业资源调查和区划[M]. 上海: 华东师范大学出版社, 1987: 339-356.]
|
| [18] |
Liu Z L, Xie H Y, Yan L P, et al. Comparative population dynamics of small yellow croaker Larimichthys polyactis in Southern Yellow Sea and East China Sea[J]. Journal of Dalian Ocean University, 2013, 28(6): 627-632. [刘尊雷, 谢汉阳, 严利平, 等. 黄海南部和东海小黄鱼资源动态的比较[J]. 大连海洋大学学报, 2013, 28(6): 627-632. DOI:10.3969/j.issn.2095-1388.2013.06.021] |
| [19] |
Li Z L, Jin X S, Shan X J, et al. Inter-annual changes on body weight-length relationship and relative fatness of small yellow croaker (Larimichthys polyactis)[J]. Journal of Fishery Sciences of China, 2011, 18(3): 602-610. [李忠炉, 金显仕, 单秀娟, 等. 小黄鱼体长-体质量关系和肥满度的年际变化[J]. 中国水产科学, 2011, 18(3): 602-610.] |
| [20] |
FAO. Fishstat plus: universal software for fishery statistical time series. Capture production: 1950-2014. FAO Fisheries Department, Fishery Information, Data and Statistics Unit, 2014.
|
| [21] |
Cheung W W L, Lam V W Y, Sarmiento J L, et al. Projecting global marine biodiversity impacts under climate change scennarios[J]. Fish and Fisheries, 2009, 10: 235-251. DOI:10.1111/faf.2009.10.issue-3 |
| [22] |
Perry A L, Low P J, Ellis J R, et al. Climate change and distribution shifts in marine fishes[J]. Science, 2005, 308: 1912-1914. DOI:10.1126/science.1111322 |
| [23] |
Dai Q, Gu H J, Wang Y Z. Theories and models for habitat selection[J]. Zoological Research, 2007, 28(6): 681-688. [戴强, 顾海军, 王跃招. 栖息地选择的理论与模型[J]. 动物学研究, 2007, 28(6): 681-688. DOI:10.3321/j.issn:0254-5853.2007.06.017] |
 2018, Vol. 25
2018, Vol. 25

