2. 福建农林大学动物科学学院, 福建 福州 350002;
3. 莆田市水产科学研究所, 福建 莆田 351100;
4. 福建省水产研究所, 福建 厦门 361013
2. Animal Science College, Fujian University of Agriculture, Fuzhou 350002, China;
3. Putian Institute of Fishery Sciences, Putian, 351100, China;
4. Fujian Fisheries Research Institute, Xiamen, 361013, China
刺激隐核虫(Cryptocaryon irritans)又称海水白点虫, 隶属前口纲、前管目、隐核虫科、隐核虫属(Cryptocaryon)[1], 广泛分布于热带和亚热带海洋中, 除黄斑蓝子鱼(Siganus oramin)之外[2], 几乎所有的海水硬骨鱼都可以成为其宿主[3-4], 是海水中最具破坏性的寄生原虫之一[5-6]。其生命周期是由宿主生活阶段和自由生活阶段两部分组成, 并不需要中间宿主, 生活史主要分为3个阶段, 即:寄生在鱼体表面的滋养体阶段, 发育成熟后成为包囊前体, 成熟的包囊前体离开宿主形成附着在池壁底部的包囊阶段, 进而由包囊孵化成感染期的纤毛幼虫阶段[7]。繁殖温度为10~30℃, 最适水温为25~30℃, 整个生命周期约1到2周时间[8]。刺激隐核虫病感染的主要特征是鱼体表面会出现大量白点, 故俗称“白点病”[5]。
由于刺激隐核虫的适宜生存水温范围广泛, 无中间宿主, 繁殖周期短, 繁殖率高, 且在高密度集约化的养殖模式下, 一旦鱼体感染, 便会引发大面积死亡造成巨大的经济损失[8-10]。目前对刺激隐核虫的防治方法主要分为化学防治, 物理防治, 免疫防治三大类。化学防治包括浸泡高锰酸钾、福尔马林、氯酸钠、硫酸铜以及中草药治疗[5, 11-15]。物理防治主要是通过移除包囊、淡水浸泡以及用紫外线或臭氧对养殖水体进行杀菌来实现[12, 16-18]。然而,前两种方法有诸多缺点, 化学防治容易对养殖环境造成破坏, 难以在大面积开放水体中使用, 且对鱼体有毒副作用或有药物残留。物理防治则易对病鱼造成较强的应激反应。近年来的研究发现用天然的刺激隐核虫体做抗原能诱发宿主鱼产生先天性和获得性的免疫反应[19], 这给刺激隐核虫感染的免疫诊断方法和免疫预防措施的开发提供了理论依据。越来越多的证据表明制备刺激隐核虫疫苗来免疫寄主鱼能够有效保护寄主鱼免受刺激隐核虫侵染[20-21], 因此筛选有效抗原是研发刺激隐核虫的亚单位疫苗的关键。
微管蛋白的种类主要有: α-微管蛋白, β-微管蛋白以及γ-微管蛋白。α-微管蛋白和β-微管蛋白通过GTP结合位点聚合形成α/β-异二聚体构成微管骨架[22]。微管蛋白是真核生物细胞骨架等亚细胞器的重要组成部分, 也是原生动物纤毛和鞭毛的主要成分, 它在保持细胞形态, 参与细胞分裂、胞内运输、纤毛和鞭毛的运动中起到重要作用[23]。早在1995年, Balaban等[24]研究表明锥虫的膜下微管可以作为治疗锥虫病的特殊非突变靶位点。随后的时间里, 越来越多的研究者对微管蛋白作为原生动物潜在抗原进行研究证实。Rasooly和Balaban [25]利用布氏锥虫(Trypanosoma brucei)的一种微管结合蛋白MAP p15免疫小鼠, 发现可以100%的保护宿主免受多种异株布氏锥虫侵染。Li等[26]研究表明体外构建重组载体原核表达伊氏锥虫(Trypanosoma evansi)微管蛋白能够诱导小鼠对锥虫产生免疫反应。然而, 目前关于刺激隐核虫微管蛋白抗原性的研究较少。因此, 寻找刺激隐核虫的微管蛋白验证其免疫原性并作为潜在靶抗原疫苗是本研究的主要目的。
1 材料与方法 1.1 实验材料本研究使用的包囊收集自暴发刺激隐核虫病害的宁德海区。将收集的包囊用斜带石斑鱼(Epinephelus coioides)传代培育获得滋养体和纤毛幼虫, 保存于液氮中。
1.2 总RNA提取及cDNA第一条链的合成采用Total RNA kitⅡ (OMEGA, 美国)试剂盒, 分别抽取滋养体、包囊、纤毛虫的总RNA。使用ND-1000分光光度计来确定获得的RNA纯度和浓度。对提取的RNA溶液进行琼脂糖凝胶电泳, 进一步验证RNA的质量。获得的RNA样品于–80℃保存备用。按照RevertAid First Strand cDNA Synthesis Kit (Thermo Scientific, Lithuania)试剂盒说明书以20 μL体系逆转录反应合成cDNA第一条链, 反应体系为:总RNA1 μg, 5×Reaction Buffer 4 μL, Random Hexamer Primer (0.2 μg/μL) 1 μL, dNTP Mix (10 mmol/L) 2 μL, RevertAid Reverse Transcriptase 1 μL, RiboLock RNase Inhibitor 1 μL, RNase Free dH2O定容至20 μL。反应条件为25℃ 10 min, 42℃ 45 min, 70℃ 15 min, 16℃ 15 min, 逆转录反应结束后置于−20℃保存。
1.3 α-微管蛋白基因cDNA全长片段的扩增、克隆和序列测定根据实验室已有的刺激隐核虫转录组数据库, 筛选获得与其他原生动物的基因具有90%以上一致性的α-微管蛋白基因部分序列。为验证该序列的准确性, 利用Primer Premier 5. 0软件设计特异性上游引物tubulin-F1和下游引物tubulin-R1(表 1)。PCR反应程序: 95℃变性5 min; 95℃ 30 s, 55℃ 30 s, 72℃ 30 s, 35个循环; 72℃延伸3 min。产物经琼脂糖凝胶电泳检测。使用琼脂糖凝胶DNA回收试剂盒(Promega, USA)回收目的片段并连接于pMD19-T载体, 将其转化到Escherichia coli DH5α感受态细胞, 挑取阳性单克隆送往生工生物工程(上海)股份有限公司测序。
以刺激隐核虫纤毛虫阶段样品总RNA逆转录分别制备3′RACE和5′RACE cDNA模板, 方法参考刘春云等[27]。根据SMARTⅡ Oligonucleotide, 运用Primer 5.0软件, 在已有中间序列测序结果的基础上, 设计3′RACE引物outer-F1和inner-F2, 5′RACE基因特异性引物outer-R1和inner-R2(表 1)。根据巢式PCR原理, 进行第一轮Outer PCR和第二轮Inner PCR, 具体反应步骤参考刘春云等[27]。用上述方法挑取阳性单克隆送往生工生物工程(上海)股份有限公司测序。所有引物均由铂瑞生物技术(厦门)有限公司合成。
|
|
表 1 用于α-微管蛋白基因cDNA克隆和实时荧光定量PCR的引物序列 Tab.1 Primers used for α-tubulin gene cDNA cloning and qRT-PCR |
利用SequencherTM软件将测序结果进行拼接, 对拼接获得的核酸序列用ORF Finder程序(https://www.ncbi.nlm.nih.gov/orffinder/)确定开放阅读框(Open Reading Frame, ORF); BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)对推导的氨基酸序列进行同源性分析; 使用ExPASy(http://web.expasy.org/compute_pi/)预测等电点及分子量; SMART程序(http://smart.embl-heidelberg.de/)预测蛋白质的结构域; SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)预测信号肽; TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜区预测; ProtScale (http://web.expasy.org/protscale/)预测蛋白的亲/疏水性; 使用PBIL的在线分析工具SOPMA预测氨基酸序列的二级结构(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html); 使用SWISS-MODEL (http://swissmodel.expasy.org/)进行蛋白质三级结构构建。通过BioEdit软件进行序列的多重比对, 使用MEGA 7.0软件构建系统进化树。
1.5 α-微管蛋白基因的原核表达及鉴定 1.5.1 重组载体pET30a/α-tubulin的构建及鉴定根据大肠杆菌(Escherichia coli)密码子的偏好性, 利用MaxCodonTM Optimization Program (V13)软件对α-微管蛋白基因序列的密码子进行优化, 送往德泰生物科技(南京)有限公司进行全基因合成; 并在目的基因片段的两端加入限制性酶切位点Nde Ⅰ和Hind Ⅲ, 通过此二酶切位点将目的基因插入到表达载体pET30a中, 之后将构建的重组质粒pET30a/α-tubulin导入大肠杆菌BL21(DE3)感受态细胞中。再利用限制性酶切位点Xho Ⅰ和Xba Ⅰ双酶切验证重组质粒pET30a/α-tubulin是否构建成功。将含有重组质粒pET30a/α-tubulin的BL21 (DE3)菌液送往生工生物工程(上海)股份有限公司进行测序, 以确定最终表达载体的准确性。
1.5.2 重组载体pET30a/α-tubulin的表达及鉴定将构建成功的重组质粒pET30a/α-tubulin导入大肠杆菌表达菌株BL21(DE3)和Rosetta(DE3)感受态细胞中, 挑选单克隆分别接种于LB培养液(含50 μg/mL的硫酸卡那霉素)和TB培养液(含50 μg/mL的硫酸卡那霉素)中。单克隆菌液BL21(DE3)/ pET30a/α-tubulin和Rosetta(DE3)/pET30a/α-tubulin作为实验组, 用相同的方法得到空载体单克隆菌液BL21(DE3)/pET30a和Rosetta(DE3)/pET30a作为阴性对照组。待培养至OD600为0.5~0.8, 向培养液中加入终浓度0.1 mmol/L IPTG, 分别置于15℃和37℃, 200 r/min, 诱导表达16 h。最后, 用SDS-PAGE分析鉴定诱导表达结果。
1.6 刺激隐核虫α-微管蛋白基因在不同生活史的mRNA表达水平将滋养体、包囊、纤毛虫的总RNA按照刘春云等[27]方法制备定量PCR模板。利用荧光实时定量PCR技术(qRT-PCR)在LightCycler480实时定量PCR仪(罗氏, 美国)对α-微管蛋白基因在不同生活史的表达水平进行检测。tubulin-F2和tubulin-R2为α-微管蛋白基因定量PCR引物(引物序列见表 1), 18S-F和18S-R为内参基因18S rRNA的引物(引物序列见表 1)。具体反应体系参照刘春云等[27]: 95℃, 1 min; 95℃ 15 s, 59℃ 10 s, 72℃ 10 s, 40个循环, 每个生活史分别设置4个平行样品。根据Roche 480实时定量PCR仪自动给出每个样品的Cp值计算RQ值(2–ΔΔCt, ΔCt=样品目的基因的Ct值-内参基因18S Ct值, ΔΔCt=每一个样品的ΔCt值-基准样品的ΔCt值)。基因表达水平均用RQ平均值±标准误(x±SE)来表示, 并通过SPSS 18.0软件检测样品间的显著性差异, P < 0.05为显著性差异。
2 结果与分析 2.1 刺激隐核虫α-微管蛋白基因全长cDNA序列分析以验证成功的1073 bp中间序列为基础, 采用RACE方法获得α-微管蛋白基因3ʹ和5ʹ端。经软件SequencherTM拼接得到全长为1602 bp的cDNA序列。经ORF Finder分析, 该序列ORF为1356 bp, 编码451个氨基酸, 5ʹUTR为51 bp, 3ʹUTR为195 bp。ExPASy预测该基因所编码的氨基酸蛋白分子量为49.78 kD, 等电点为4.9 (图 1)。

|
图 1 刺激隐核虫α-微管蛋白基因核苷酸序列及推导的氨基酸序列 加粗体为起始密码子ATG; *为终止密码子TAG; 单下划线部分为GTP酶结合区; 双划线部分为C端结构域; 阴影部分为GTP核苷酸结合位点(GGGTGSG). Fig.1 Nucleotide and deduced amino acids sequences of α-tubulin in Cryptocaryon irritans The bold fonts indicated the start codon (ATG); asterisk indicated the stop codon (TGA); the GTPase domain is single underlined; the C-terminal domain is double underlined; GTP nucleotide binding site (GGGTGSG) is outlined in gray. |
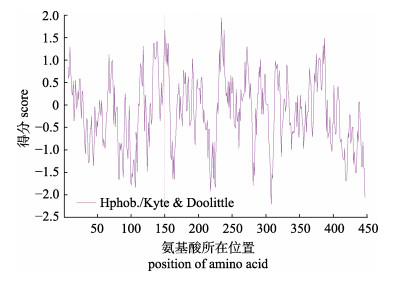
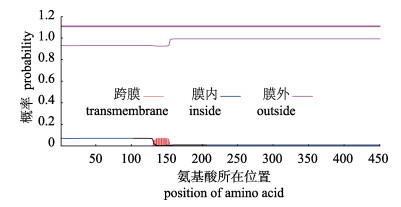
使用ProtScale预测刺激隐核虫α-微管蛋白的亲/疏水性, 结果显示亲水性氨基酸残基所占面积大于疏水性氨基酸残基, 推测其属于亲水性蛋白质(图 2)。使用TMHMM预测α-微管蛋白序列跨膜域, 结果显示其蛋白序列的肽链跨膜的概率低于0.5, 且预测跨膜螺旋中的氨基酸残基数为1.59个, 表明α-微管蛋白不具有明显的跨膜结构(图 3)。使用SignalP预测发现α-微管蛋白不存在信号肽, 预测其不是分泌型蛋白。
|
图 2 刺激隐核虫α-微管蛋白疏水性/亲水性分析 Fig.2 The hydrophobicity/hydrophilicity analysis of α-tubulin in Cryptocaryon irritans |
|
图 3 刺激隐核虫α-微管蛋白跨膜区分析 Fig.3 Prediction analysis of transmembrane region of α-tubulin in Cryptocaryon irritans |
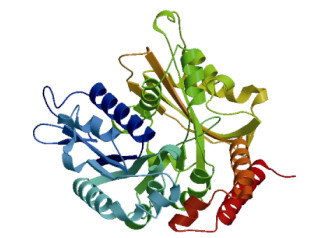
通过ScanProsite软件对α-微管蛋白的氨基酸序列进行结构预测分析, 结果表明在第142至148位氨基酸序列区域内, 存在特有的保守区域—GTP核苷酸结合位点GGGTGSG。用SMART预测α-微管蛋白有2个显著的结构域家族, Phe49-Gly246位氨基酸为Tubulin/FtsZ家族GTP酶结构域; Leu248-His393位氨基酸为Tubulin/FtsZ家族C-末端结构域(图 1)。使用PBIL的在线分析工具SOPMA对氨基酸序列的二级结构进行预测, SWISS-MODEL软件的同源建模构建蛋白质三级结构, 结果显示α-微管蛋白是由45.01%的α-螺旋, 28.60%的无规卷曲, 16.63%的延伸链和9.76%的β-转角组成(图 4)。
|
图 4 预测的刺激隐核虫α-微管蛋白的三级结构 Fig.4 Predicted three-dimensional structure of the α-tubulin in Cryptocaryon irritans |
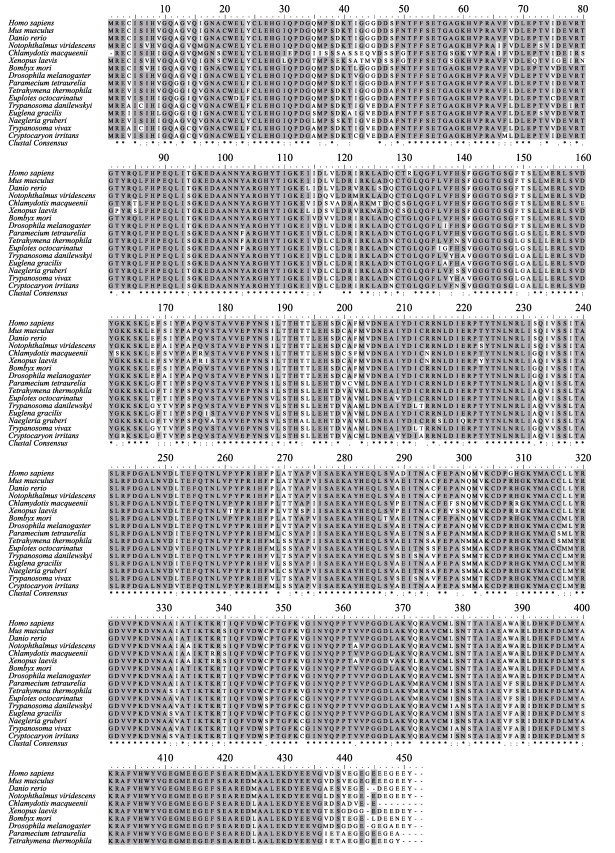
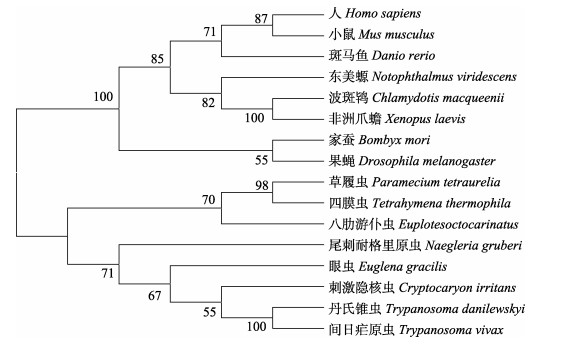
经过BLAST分析, 发现刺激隐核虫α-微管蛋白与尾刺耐格里原虫(Naegleria gruberi)、眼虫(Euglena gracilis)α-微管蛋白氨基酸序列的一致性最高, 为95%;与间日疟原虫(Trypanosoma vivax)、丹氏锥虫(Trypanosoma danilewskyi)、八肋游仆虫(Euplotes octocarinatus)一致性也高达94%;使用BioEdit软件将刺激隐核虫α-微管蛋白氨基酸序列分别与人(Homo sapiens)、小鼠(Mus musculus)、斑马鱼(Danio rerio)、东美螈(Notophthalmus viridescens)、家蚕(Bombyx mori)和丹氏锥虫等动物的16条α-微管蛋白序列进行同源性比对分析(表 2), 结果显示刺激隐核虫α-微管蛋白的氨基酸序列与其他物种的α-微管蛋白的氨基酸序列具有较高一致性(图 5), 表明α-微管蛋白具有较高的保守性。使用MEGA7.0软件以NJ法构建17种生物α-微管蛋白氨基酸序列的分子系统进化树(图 6)。进化树结果表明, 脊椎动物中哺乳类人和小鼠、鸟类波斑鸨(Chlamydotis macqueenii)、两栖类东美螈和非洲爪蟾(Xenopus laevis)以及鱼类斑马鱼聚为一支; 无脊椎动物中环节动物家蚕、节肢动物果蝇(Drosophila melanogaster)以及头索动物亚门的文昌鱼(Branchiostoma floridae)聚为一支; 刺激隐核虫与原生动物草履虫(Paramecium tetraurelia)、四膜虫(Tetrahymena thermophila)、八肋游仆虫、丹氏锥虫、眼虫、尾刺耐格里原虫、间日疟原虫聚为一支(图 6)。由17个代表物种的α-微管蛋白氨基酸序列所反映的系统发育关系与生物在进化上的地位关系相一致。
|
|
表 2 刺激隐核虫α-微管蛋白氨基酸序列多重比对和系统进化树所用物种信息 Tab.2 Species information for multiple sequence alignment and phylogenetic analysis for α-tubulin of Cryptocaryon irritans |
|
图 5 刺激隐核虫与其他物种的α-微管蛋白序列多重比对 Fig.5 Multiple alignment of the α-tubulin amino acid sequence between Cryptocaryon irritans and other species |
|
图 6 刺激隐核虫α-微管蛋白基因氨基酸序列的系统进化树 Fig.6 Phylogenetic tree analyses of the α-tubulin amino acid sequence in Cryptocaryon irritan |
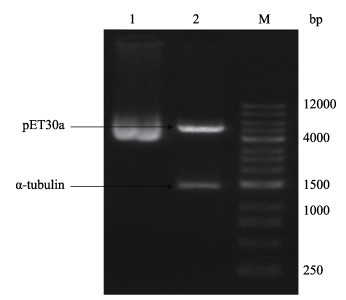
将已构建好的重组质粒pET30a/α-tubulin通过Xho Ⅰ和Xba Ⅰ双酶切鉴定表达载体构建的准确性, 结果显示, 酶切下的基因片段大小与目的基因大小1356 bp一致(图 7)。在此基础上, 将含有重组质粒pET30a/ α-tubulin的BL21(DE3)菌液送往生工生物工程(上海)股份有限公司进行测序。测序结果显示, 含有1356 bp的α-微管蛋白基因ORF片段成功插入到pET30a表达质粒上且序列正确。说明α-微管蛋白基因成功亚克隆到pET30a表达载体上。可以进行下一步原核表达蛋白。
|
图 7 pET30a/α-tubulin重组质粒双酶切鉴定 M:标准分子量DNA; 1:超螺旋的重组质粒pET30a/α-tubulin; 2: pET30a/α-tubulin经Xho Ⅰ和Xba Ⅰ双酶切后的结果. Fig.7 Identification of the recombinant plasmid pET30a/α-tubulin by double restriction digestion M: DNA ladder; 1: Recombinant plasmid pET30a/α-tubulin of supercoiling; 2: Recombinant plasmid pET30a/α-tubulin digested by both XhoⅠ and XbaⅠ. |
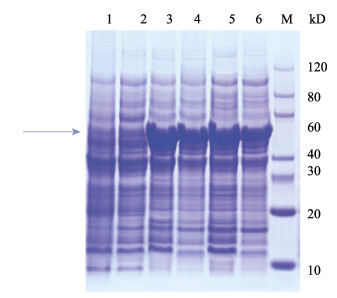
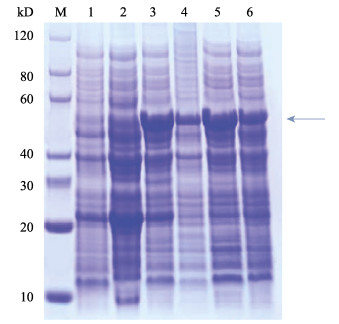
将pET30a/ α-tubulin转化至BL21(DE3)和Rosetta(DE3)表达感受态细胞, 诱导16 h可以获得较好的蛋白表达量。对重组蛋白SDS-PAGE电泳图(图 8, 图 9)分析发现, 诱导表达的重组蛋白分子量约为50 kD (箭头所示), 与软件预测的蛋白分子量大小相一致, 说明α-微管蛋白诱导表达成功。进一步分析发现在BL21(DE3)表达菌株中15℃与37℃下诱导表达的重组蛋白电泳条带相差不大(图 8), 说明在BL21(DE3)表达菌株中15℃和37℃诱导表达的效果相近。但在Rosetta(DE3)表达菌株中15℃下诱导表达的重组蛋白电泳条带颜色明显较37℃深(图 9), 说明在Rosetta(DE3)表达菌株中15℃条件下诱导表达效果更好。而使用LB培养液或TB培养液培养表达菌体对重组蛋白的诱导表达影响不大。
|
图 8 SDS-PAGE分析α-微管蛋白在BL21(DE3)中的表达 M:蛋白质分子量标准; 1:阴性对照(BL21(DE3)/ pET30a诱导16 h); 2:阴性对照(未加IPTG诱导剂); 3: 15℃, 0.1 mmol/L IPTG诱导BL21(DE3)/ pET30a /α-tubulin表达16 h, LB培养液; 4: 37℃, 0.1 mmol/L IPTG诱导BL21(DE3)/ pET30a /α-tubulin表达16 h, LB培养液; 5: 15℃, 0.1 mmol/L IPTG诱导BL21(DE3)/ pET30a /α-tubulin表达16 h, TB培养液; 6: 37℃, 0.1 mmol/L IPTG诱导BL21(DE3)/ pET30a /α-tubulin表达16 h, TB培养液. Fig.8 SDS-PAGE analysis of the prokaryotic expression of α-tubulin in Escherichia coli BL21(DE3) M: protein marker; 1: the negative control BL21(DE3)/pET30a induced for 16 h); 2: the negative control (not add IPTG revulsant); 3: BL21(DE3)/pET30a/α-tubulin induced by 0.1 mmol/L IPTG for 16 h at 15℃, LB medium; 4: BL21(DE3)/pET30a/ α-tubulin induced by 0.1 mmol/L IPTG for 16 h at 37℃, LB medium; 5: BL21(DE3)/pET30a /α-tubulin induced by 0.1 mmol/L IPTG for 16 h at 15℃, TB medium; 6: BL21(DE3)/pET30a/α-tubulin induced by 0.1 mmol/L IPTG for 16 h at 37℃, TB medium. |
|
图 9 SDS-PAGE分析α-微管蛋白在Rosetta (DE3)中的表达 M:蛋白质分子量标准; 1:阴性对照(Rosetta (DE3)/pET30a诱导16 h); 2:阴性对照(未加IPTG诱导剂); 3: 15℃, 0.1 mmol/L IPTG诱导Rosetta (DE3)/pET30a/α-tubulin表达16 h, LB培养液; 4: 37℃, 0.1 mmol/L IPTG诱导Rosetta (DE3)/pET30a /α-tubulin表达16 h, LB培养液; 5: 15℃, 0.1 mmol/L IPTG诱导Rosetta (DE3)/pET30a/α-tubulin表达16 h, TB培养液; 6: 37℃, 0.1 mmol/L IPTG诱导Rosetta (DE3)/pET30a/α-tubulin表达16 h, TB培养液. Fig.9 SDS-PAGE analysis of the prokaryotic expression of α-tubulin in Escherichia coli Rosetta (DE3) M: protein marker; 1: the negative control Rosetta (DE3)/pET30a induced for 16 h); 2: the negative control (not add IPTG revulsant); 3: Rosetta (DE3)/pET30a/α-tubulin induced by 0.1 mmol/L IPTG for 16 h at 15℃, LB medium; 4: Rosetta (DE3)/pET30a/α-tubulin induced by 0.1 mmol/L IPTG for 16 h at 37℃, LB medium; 5: Rosetta (DE3)/pET30a/α-tubulin induced by 0.1 mmol/L IPTG for 16 h at 15℃, TB medium; 6: Rosetta (DE3)/pET30a/α-tubulin induced by 0.1 mmol/L IPTG for 16 h at 37℃, TB medium. |
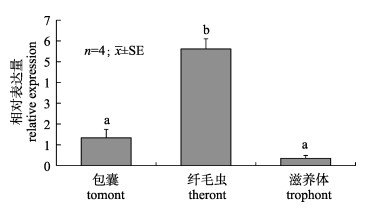
以18S为内参基因, qRT-PCR结果显示(图 10), α-微管蛋白基因在刺激隐核虫3个生活史时期均有表达, 其中在纤毛幼虫时期的表达量显著高于包囊和滋养体时期(P < 0.05)。
|
图 10 qRT-PCR检测刺激隐核虫在3个生活史时期α-微管蛋白基因相对表达量 柱上不同小写字母表示不同时期存在显著差异(P < 0.05). Fig.10 The relative expression levels of α-tubulin in Cryptocaryon irritans during the three phases of life history by qRT-PCR. Histogram bars with different small letters indicate significant differences (P < 0.05). |
微管蛋白是细胞微管骨架, 纤毛和鞭毛的重要组成部分, 参与胞内运输、细胞分裂以及纤毛和鞭毛的运动等生命活动[28]。Kim等[29]研究发现水滴伪康纤虫(Pseudocohnilembus persalinus) β-微管蛋白具有较好的免疫原性, 可作为靶抗原疫苗预防海水鱼类的纤毛虫病。Plouffe等[30]发现丹氏锥虫的α、β-微管蛋白均具有免疫原性, 微管蛋白可能作为靶位分子控制鱼的锥虫病。本研究克隆得到的刺激隐核虫基因编码451个氨基酸。在氨基酸序列第142~148位处存在一个微管蛋白特有的保守区域: GTP核苷酸结合位点α-微管蛋白(GGGTGSG), 它是α、β-微管蛋白结合形成二聚体的重要结构[31]。通过BLAST分析, 发现刺激隐核虫α-微管蛋白氨基酸序列与尾刺耐格里原虫、间日疟原虫、锥虫等原生动物的序列一致性高达94%~95%;与人、小鼠、斑马鱼等非原生动物序列一致性达78%~86%, 说明α-微管蛋白具有较高的保守性。
刺激隐核虫的纤毛幼虫时期以纤毛作为运动细胞器在海水中自由游动, 寻找并侵染宿主鱼。Bai等[32]研究表明, 以刺激隐核虫纤毛幼虫时期制备的抗原疫苗比包囊和滋养体时期的疫苗能使宿主鱼获得更好的免疫保护。Mai等[33]研究发现刺激隐核虫纤毛幼虫、包囊以及滋养体蛋白分别与相应的兔抗血清进行免疫杂交, α/β微管蛋白只在纤毛幼虫时期检测出来, 表明微管蛋白可能是纤毛幼虫时期的特异性抗原成分。本实验结果显示纤毛幼虫时期的α-微管蛋白基因相对表达量显著高于包囊和滋养体时期, 结合Bai[34]和Mai[35]等研究结果,推测刺激隐核虫纤毛幼虫时期的α-微管蛋白基因可作为潜在的靶抗原疫苗。
本研究成功诱导重组表达载体pET30a/α- tubulin在表达菌株BL21(DE3)和Rosetta(DE3)中原核表达。Katzenback等[34]研究首次将体外重组表达的丹氏锥虫微管蛋白作为疫苗对金鱼(Carassius auratus L.)进行腹腔注射活体实验, 发现原生动物寄生虫类微管蛋白对金鱼具有刺激免疫作用。Kurup等[35]研究表明制备伊氏锥虫微管蛋白基因DNA疫苗能够诱导小鼠产生保护性免疫反应。这些研究为刺激隐核虫微管蛋白用于养殖生产上的实用型疫苗提供了理论依据,本研究后续还将对此α-微管蛋白进行大量的原核表达和蛋白纯化, 进一步地通过对宿主鱼体内活体注射检测以及体外ELISA检测等实验多角度全方位地验证α-微管蛋白具有免疫原性, 为深入研究微管蛋白基因的功能以及制备“白点病”疫苗奠定基础。
| [1] |
Shen C, Zhou M X, Zhou S M, et al. Electron microscopic observation of artificial infection of theront of Cryptocaryon irritans in vitro[J]. Journal of Biology, 2017, 34(2): 104-107. [沈晨, 周旻曦, 周素明, 等. 体外人工感染的刺激隐核虫幼虫的电镜观察[J]. 生物学杂志, 2017, 34(2): 104-107. DOI:10.3969/j.issn.2095-1736.2017.02.104] |
| [2] |
Wang F H, Xie M Q, Li A X. A novel protein isolated from the serum of rabbitfish (Siganus oramin) is lethal to Cryptocaryon irritans[J]. Fish & Shellfish Immunology, 2010, 29(1): 32-41. |
| [3] |
Burgess P, Matthews R. Fish host range of seven isolates of Cryptocaryon irritans (Ciliophora)[J]. Journal of Fish Biology, 1995, 46(4): 727-729. |
| [4] |
Diggles B K, Adlard R D. Intraspecific variation in Cryptocaryon irritans[J]. Journal of Eukaryotic Microbiology, 1997, 44(1): 25-32. DOI:10.1111/jeu.1997.44.issue-1 |
| [5] |
Colorni A, Burgess P. Cryptocaryon irritans Brown 1951, the cause of 'white spot disease' in marine fish:an update[J]. Aquarium Sciences and Conservation, 1997, 1(4): 217-238. DOI:10.1023/A:1018360323287 |
| [6] |
Huang W, Ma Y, Li A X. Ultrastructural study on Cryptocaryon irritans throughout the life cycle of artificially infecting Trachinotus blochi[J]. Journal of Fisheries of China, 2005, 29(5): 635-642. [黄玮, 马跃, 李安兴. 人工感染的刺激隐核虫各期虫体的超微结构[J]. 水产学报, 2005, 29(5): 635-642.] |
| [7] |
Lui Z Y, Xie Y Q. The observation of the lifehistory of Cryptocaryon irritans[J]. Journal of Fujian Fisheries, 2010(1): 46-48. [刘振勇, 谢友佺. 刺激隐核虫生活史的观察[J]. 福建水产, 2010(1): 46-48. DOI:10.3969/j.issn.1006-5601.2010.01.014] |
| [8] |
Luo X, Xie M, Zhu X, et al. Some characteristics of host-parasite relationship for Cryptocaryon irritans isolated from South China[J]. Parasitology Research, 2008, 102(6): 1269-1275. DOI:10.1007/s00436-008-0904-9 |
| [9] |
Yambot A V, Song Y L, Sung H H. Characterization of Cryptocaryon irritans, a parasite isolated from marine fishes in Taiwan[J]. Diseases of Aquatic Organisms, 2003, 54(2): 147-156. |
| [10] |
Cheng Q, Pan L D. Review on the biological characteristics of Cryptocaryon irritans and the diagnosis and treatment of cryptocaryoniosis[J]. Chinese Fishery Quality and Standards, 2014, 4(5): 16-23. [成奇, 潘连德. 刺激隐核虫生物学和刺激隐核虫病临床诊治的研究进展[J]. 中国渔业质量与标准, 2014, 4(5): 16-23.] |
| [11] |
Herwig N. Notes on the treatment of Cryptocaryon[J]. Drum and Croaker, 1978, 18(1): 6-12. |
| [12] |
Wilkie D W. Outbreak of cryptocaryoniasis in marine aquaria at Scripps Institute of Oceanography[J]. California Fish and Game, 1969, 55: 227-236. |
| [13] |
Cai Z P, Li M. Prevention and cure of white spot disease in red snapper, Lutjanus argentimaculatus[J]. Marine Sciences, 2001, 25(8): 10-11. [蔡泽平, 李沫. 紫红笛鲷白点病的防治试验[J]. 海洋科学, 2001, 25(8): 10-11. DOI:10.3969/j.issn.1000-3096.2001.08.004] |
| [14] |
Fan H P, Lin Y, Zhong Q F, et al. Insecticidal efficacy of Chinese herbal medicine on Cryptocryon irritans[J]. Fujian Agricultural Science and Technology, 2016, 47(3): 12-14. [樊海平, 林煜, 钟全福, 等. 中草药对刺激隐核虫幼虫的杀灭效果[J]. 福建农业科技, 2016, 47(3): 12-14.] |
| [15] |
Wang Y G, Liu Z W, Lin C Y, et al. Cryptocaryoniosis in cultured turbot and its treatment[J]. Journal of Fisheries of China, 2011, 35(7): 1105-1112. [王印庚, 刘志伟, 林春媛, 等. 养殖大菱鲆隐核虫病及其治疗[J]. 水产学报, 2011, 35(7): 1105-1112.] |
| [16] |
Colorni A. Biology of Cryptocaryon irritans and strategies for its control[J]. Aquaculture, 1987, 67(1/2): 236-237. |
| [17] |
Gratzek J, Gilbert J P, Lohr A L, et al. Ultraviolet light control of Ichthyophthirius multifiliis Fouquet in a closed fish culture recirculation system[J]. Journal of Fish Diseases, 1983, 6(2): 145-153. DOI:10.1111/jfd.1983.6.issue-2 |
| [18] |
Hirazawa N, Oshima SI, Hara T, et al. Antiparasitic effect of medium-chain fatty acids against the ciliate Cryptocaryon irritans infestation in the red sea bream Pagrus major[J]. Aquaculture, 2001, 198(3): 219-228. |
| [19] |
Bryant M S, Lee R P, Lester R J G, et al. Anti-immunoglobulin antisera used in an ELISA to detect antibodies in barramundi Lates calcarifer to Cryptocaryon irritans[J]. Diseases of Aquatic Organisms, 1999, 36(1): 21-28. |
| [20] |
Luo X C, Xie M Q, Zhu X Q, et al. Protective Immunity in Grouper (Epinephelus coioides) following exposure to or injection with Cryptocaryon irritans[J]. Fish & Shellfish Immunology, 2007, 22(4): 427-432. |
| [21] |
Dan X M, Li A X, Lin X T, et al. Immune response and immunoprotection of pompanos (Trachinotus ovatus) against Cryptocaryon irritans[J]. Acta Hydrobiologica Sinica, 2008, 32(1): 13-18. [但学明, 李安兴, 林小涛, 等. 卵形鲳鯵对刺激隐核虫的免疫应答和免疫保护研究[J]. 水生生物学报, 2008, 32(1): 13-18. DOI:10.3321/j.issn:1000-3207.2008.01.003] |
| [22] |
Downing K H, Nogales E. Tubulin and microtubule structure[J]. Current Opinion in Cell Biology, 1998, 10(1): 16-22. DOI:10.1016/S0955-0674(98)80082-3 |
| [23] |
Fuchs M A, Ryan L A, Chambers E L, et al. Differential expression of liver fluke β-tubulin isotypes at selected life cycle stages[J]. International Journal for Parasitology, 2013, 43(14): 1133-1139. DOI:10.1016/j.ijpara.2013.08.007 |
| [24] |
Balaban N, Waithaka H K, Njogu A R, et al. Intracellular antigens (microtubule-associated protein copurified with glycosomal enzymes)-possible vaccines against trypanosomiasis[J]. Journal of Infectious Diseases, 1995, 172(3): 845-850. DOI:10.1093/infdis/172.3.845 |
| [25] |
Rasooly R, Balaban N. Trypanosome microtubule-associated protein p15 as a vaccine for the prevention of African sleeping sickness[J]. Vaccine, 2004, 22(8): 1007-1015. DOI:10.1016/j.vaccine.2003.08.041 |
| [26] |
Li S Q, Fung M C, Reid S, et al. Immunization with recombinant beta-tubulin from Trypanosoma evansi induced protection against T. evansi, T. equiperdum and T. b. brucei infection in mice[J]. Parasite Immunology, 2007, 29(4): 191-199. DOI:10.1111/pim.2007.29.issue-4 |
| [27] |
Lui C Y, Fu M J, Zhang Z P, et al. Molecular cloning and expression analysis of Sp-PHGPx in Scylla paramamosain[J]. Journal of Fisheries of China, 2015, 39(2): 161-173. [刘春云, 傅明骏, 张子平, 等. 拟穴青蟹PHGPx基因的克隆及其表达分析[J]. 水产学报, 2015, 39(2): 161-173.] |
| [28] |
Qian Y, Zhang Y, Gu F K. The cytoskeletal proteins and functional modules in protozoa[J]. Chinese Journal of Cell Biology, 2004, 26: 558-560. [钱雨, 张莹, 顾福康. 原生动物的细胞骨架蛋白及其功能组件[J]. 细胞生物学杂志, 2004, 26: 558-560.] |
| [29] |
Kim S M, Lee E H, Kwon S R, et al. Preliminary analysis of recombinant β-tubulin of Pseudocohnilembus persalinus (Ciliophora:Scuticociliatida) as a vaccine antigen candidate against scuticociliatosis[J]. Aquaculture, 2006, 260(1-4): 21-26. DOI:10.1016/j.aquaculture.2006.06.016 |
| [30] |
Plouffe D A, Belosevic M. Antibodies that recognize α-and β-tubulin inhibit in vitro growth of the fish parasite Trypanosoma danilewskyi, Laveran and Mesnil, 1904[J]. Developmental & Comparative Immunology, 2006, 30(8): 685-697. |
| [31] |
Menéndez M, Rivas G, Díaz J F, et al. Control of the structural stability of the tubulin dimer by one high affinity bound magnesium ion at nucleotide N-site[J]. Journal of Biological Chemistry, 1998, 273(1): 167-176. DOI:10.1074/jbc.273.1.167 |
| [32] |
Bai J S, Xie M Q, Zhu X Q, et al. Comparative studies on the immunogenicity of theronts, tomonts and trophonts of Cryptocaryon irritans in grouper[J]. Parasitology Research, 2008, 102(2): 307-313. |
| [33] |
Mai Y Z, Li Y W, Li R J, et al. Proteomic analysis of differentially expressed proteins in the marine fish parasitic ciliate Cryptocaryon irritans[J]. Veterinary Parasitology, 2015, 211(1): 1-11. |
| [34] |
Katzenback B A, Plouffe D A, Haddad G, et al. Administration of recombinant parasite β-tubulin to goldfish (Carassius auratus L.) confers partial protection against challenge infection with Trypanosoma danilewskyi Laveran and Mesnil, 1904[J]. Veterinary Parasitology, 2008, 151(1): 36-45. DOI:10.1016/j.vetpar.2007.09.030 |
| [35] |
Kurup S P, Tewari A K. Induction of protective immune response in mice by a DNA vaccine encoding Trypanosoma evansi beta tubulin gene[J]. Veterinary Parasitology, 2012, 187(1): 9-16. |
 2018, Vol. 25
2018, Vol. 25

