2. 浙江省近岸水域生物资源开发与保护重点实验室, 浙江 温州 325005
2. Zhejiang Key Laboratory of Exploitation and Preservation of Coastal Bio-resource, Wenzhou 325005, China
凡纳滨对虾(Litopenaeus vannamei)俗称南美白对虾, 原产于中南美洲太平洋沿岸, 20世纪90年代作为中国明对虾(Fenneropenaeus chinensis)的替代种引入中国, 是对虾养殖业的主导种类。但近些年养殖排塘率一直居高不下, 除了养殖技术和病害, 虾苗种质退化是主要原因。目前国内的育苗亲虾除了从国外进口, 其他主要是养虾塘选留的“菜虾”。由于没有经过系统选育, 育苗时群体近交几率大增, 其子代的生长和抗逆性状通常表现较差。对虾近交衰退研究发现, 近交系数每增加10%, 日本囊对虾(Penaeus japonicus)生长性状的衰退系数为-3.34%[1], 中国明对虾的体重衰退系数-7.3%[2], 凡纳滨对虾养成存活率衰退系数-3.8%[3]。而中国的凡纳滨对虾选育品种通常基础群体来源单一, 如果选育方案控制不好, 几代近交后优势性状也会逐渐衰退, 因此自主选育品种在国内亲虾市场的占有率一直不高。如何复壮和提升凡纳滨对虾的养殖性状已成为目前产业发展的瓶颈。
对此, 本研究选择了2个群体:群体一源自中南美洲厄瓜多尔海区野生虾苗群体的群选F1群体(EC), 群体二亲本源于自建家系, 通过全同胞兄妹交配获得近交群体, 近交系数0.25(ZG)。以这2个群体作为亲本进行杂交和自交, 对4个子代群体的仔虾(以下简称4个群体)进行急性低盐度、亚硝酸盐暴露下的存活率和急性微囊藻毒素(MC-LR)暴露下的抗氧化酶活性分析, 同时进行养殖生长性状测试。目前, 有关凡纳滨对虾不同群体杂交和自交的研究多集中于对生长和存活的影响[4-7], 对抗逆性的影响研究相对较少, 张嘉晨等[8]研究了凡纳滨对虾养殖密度对杂交和自交子代生长与成活的影响, 杨章武等[9]对凡纳滨对虾选育群体子代的免疫性能进行了分析, 而野生群体的引入对种质衰退群体杂交子代的性状影响研究尚未见报道。通过本研究, 以了解“远源”群体的引入对近交群体子代性状的影响, 为中国凡纳滨对虾的家系构建和种质复壮提升提供参考。
1 材料与方法 1.1 实验材料凡纳滨对虾亲虾引进隔离、保种促熟、苗种培育和抗逆、生长性状测试都在浙江省乐清市清江试验场进行。亲虾引进后移入隔离场, 经第三方检验无特异性病毒后, 移入40 m2 (5 m×8 m× 1.5 m)的保种水泥池, 用英伟Breed-S亲虾饲料和经抽检无病毒的沙蚕、深海鱿鱼进行强化促熟。两周后, 灼烧剪除雌虾的单侧眼柄, 一周后挑选性腺成熟的雌虾入雄虾池诱导交配产卵, 等雌虾性腺成熟率达到20%, 交配率达到30%后开始构建实验用群体。亲虾保种期间盐度30.1±0.4、pH (8.1±0.3)、溶解氧(5.1±0.4) mg/L、雌虾虾池水温(29.2±0.3)℃、雄虾池水温(28.1±0.3)℃。
实验构建的4个群体分别为: EC♂×EC♀(EE)、ZG♂×ZG♀(GG)、EC♂×ZG♀(EG)、ZG♂×EC♀(GE)。群体构建同步进行, 连续交配产卵孵化3 d, 并以此作为每个子代群体的3个平行。苗种幼体培育在40 m2 (5 m×8 m×1.5 m)水泥育苗池进行, 育苗前期主要投喂角毛藻, 后逐渐过渡投喂卤虫无节幼体(脱壳消毒)和虾片直到仔虾达到P12~ P15结束, 经检测无病毒后作为实验用虾苗。苗种培育期间水温(30.7±0.7)℃、pH (7.9±0.3)、溶解氧(4.8± 0.5) mg/L, 到糠虾后盐度由30.1±0.4逐渐降到22.3±0.3。实验前仔虾规格分别为: EE体长(11.73±1.54) mm, 体重(0.0073±0.0019) g/尾; GG体长(11.38±1.73) mm, 体重(0.0064±0.0022) g/尾; EG体长(11.35±1.92) mm, 体重(0.0067± 0.0020) g/尾; GE体长(11.25±1.60) mm, 体重(0.0059±0.0018) g/尾。
1.2 实验方法 1.2.1 环境暴露下的仔虾抗逆性4个群体仔虾的抗逆性实验包括低盐度、亚硝酸盐和MC-LR暴露。实验在1L烧杯中进行, 烧杯放入加水的塑料方盘中电热棒水浴保温。4个群体的每个处理设置3个平行, 每个烧杯中放50尾虾苗。将虾苗从培育池移入实验烧杯并开始计时, 并定时统计处理组的成活率。实验期间每12 h时换水一次, 换水量100%。实验水温(29.7±0.6)℃, 实验用海水盐度22.1±0.2、pH (8.0±0.2)、溶解氧(5.1± 0.3) mg/L。其中:急性低盐度暴露处理组盐度为2.0, pH (7.9±0.1)、溶解氧(4.9±0.2) mg/L, 在0 h、3 h、6 h、12 h、24 h、30 h、36 h和48 h统计存活率, 实验期间每6 h投喂卤虫无节幼体一次; 虾苗死亡判定, 以虾苗侧躺不动为准; 急性亚硝酸盐暴露处理组浓度为35 mg/L, pH (8.4±0.3)、溶解氧(4.6±0.3) mg/L, 在0 h、12 h、24 h、36 h、48 h和60 h统计存活率, 实验期间每6 h投喂卤虫无节幼体一次, 虾苗死亡判定标准同上; MC-LR暴露处理组浓度为8 mg/L, pH (8.1±0.2)、溶解氧(5.0±0.1) mg/L, 在0 h、12 h、24 h、36 h、48 h、60 h和72 h每个平行取5尾虾苗做混合样, 快速放入液氮冷冻后转移到超低温冰箱低温保存, 用南京建成生物公司的快速检测试剂盒测定虾苗的谷胱甘肽S-转移酶(GST)、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽还原酶(GR)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性, 实验期间在0 h、12 h、24 h、36 h、48 h、60 h和72 h实验开始或取样后各投喂卤虫无节幼体一次。
1.2.2 生长性状测试凡纳滨对虾的生长性状测试在面积20 m2 (5 m×4 m×1.5 m)的水泥池中进行, 每池放苗3000尾, 每个群体设3个平行池。养殖期间水深70~110 cm, 每平方布置0.5个气头, 并定时排污换水。待所有群体平均体重都达到10 g以上的商品规格时结束, 共养殖83 d。养殖期间水温度(27.8±2.7)℃、盐度22.9±1.6、pH (7.8±0.5)、亚硝酸氮(0.0~2.2) mg/L、氨氮(0.0~1.5) mg/L。养殖期间根据规格依次投喂正大0号、1号和2A号饲料, 并定时测量对虾体重。测量时每个平行取样30尾对虾, 用电子秤测体重(精度0.01 g)。
1.2.3 数据处理与分析数据用Excel和SPSS18软件进行统计分析和制图, 用平均值±标准差表示统计结果, 以P < 0.05作为差异显著性标志。
杂交组合的杂种优势率H(%)计算公式:
| $ H(\% ) = \frac{{{{\bar F}_1} - \frac{1}{2}({{\bar P}_1} + {{\bar P}_2})}}{{\frac{1}{2}({{\bar P}_1} + {{\bar P}_2})}} $ |
其中, F1、P1、P2分别表示杂交子一代、亲本1自交子一代、亲本2自交子一代的性状平均值, H(%)表示F1的杂种优势率。
2 结果与分析 2.1 急性低盐度暴露下4个群体的成活率由图 1可知, 在急性低盐(盐度2)暴露下, 4个群体的存活率都在3 h时显著到低点(P < 0.05), 其中EE群体在此后保持稳定, 变化不显著(P > 0.05), 而EG、GG和GE群体的存活率在此后急速下降, 在12~24 h显著下降到低位(P < 0.05), 并在此后保持稳定(P > 0.05); 4个群体中, 低盐度暴露3 h时EE群体的存活率最高, GE群体和EG群体次之, GG群体的存活率最低, 但EE和GE群体、GE和EG群体间的差异性并不显著(P > 0.05);但暴露24 h时, 4个群体间的存活率都存在显著差异(P < 0.05)。
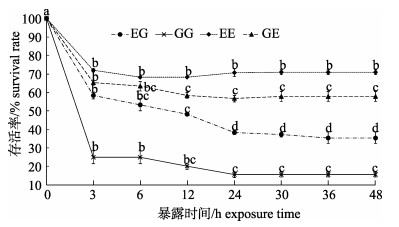
|
图 1 急性低盐度暴露下凡纳滨对虾自交和杂交群体的存活率变化 群体内不同暴露时间下字母不同代表差异显著(P < 0.05), 相同则差异不显著(P > 0.05); EG: EC♂×ZG♀; GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC:厄瓜多尔野生群体F1; ZG:近交群体. Fig.1 Survival rates of Litopenaeus vannamei inbred and hybrid populations under acute low salinity exposure Different letters indicate the survival rates of different populations are significant different (P < 0.05); the same letter indicates no significant difference (P < 0.05). EG: EC♂×ZG♀; GG: ZG♂× ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC: ecuador wild population F1; ZG: inbreeding population. |
35 mg/L的急性亚硝酸盐暴露下, 4个群体的存活率都呈显著下降趋势(P < 0.05)(图 2), 但4个群体的存活率下降趋势明显不同。在暴露36~48 h内, EE群体和GE群体的存活率整体呈下降缓慢, 此后群体存活率快速下降(P < 0.05)。而EG群体和GG群体的存活率下降则呈现先急后缓的趋势, 暴露12 h内, 存活率急速下降(P < 0.05), 此后下降速度放缓, 但也达到显著水平(P < 0.05)。EE和GE群体间在相同的暴露时间内, 存活率差异并不显著(P > 0.05), 而EG群体和GG群体间除了在12 h、24 h和60 h时间点差异显著外(P < 0.05), 其余统计时间点差异不显著(P > 0.05)。
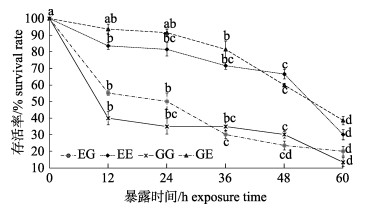
|
图 2 急性亚硝酸氮暴露下凡纳滨对虾自交和杂交群体的存活率变化 群体内不同暴露时间下字母不同代表差异显著(P < 0.05), 相同则差异不显著(P > 0.05); EG: EC♂×ZG♀, GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC:厄瓜多尔野生群体F1; ZG:近交群体. Fig.2 Survival rates of Litopenaeus vannamei inbred and hybrid populations under acute nitrite treatment Different letters indicate the survival rates of different populations are significant different (P < 0.05); the same letter indicates no significant difference (P < 0.05). EG: EC♂×ZG♀; GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC: ecuador wild population F1; ZG: inbreeding population. |
MC-LR暴露下, 4个群体的SOD活性随时间轴总体呈先强诱导后诱导减弱的趋势(图 3), 在暴露12 h时SOD活性即显著上调(P < 0.05), 并且都在24 h显著达到峰值(P < 0.05)。随后总体出现下降趋势。72 h时, EE群体和GE群体的活性虽然高于初始值, 但诱导并不显著(P > 0.05), 而GG群体和EG群体的活性仍然被显著诱导(P < 0.05)。
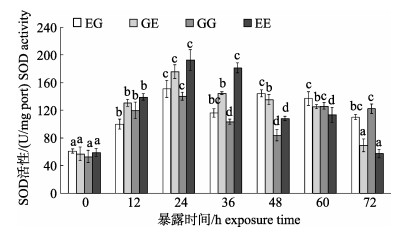
|
图 3 MC-LR暴露下凡纳滨对虾自交和杂交群体的SOD活性变化 群体内不同暴露时间下字母不同代表差异显著(P < 0.05), 相同则差异不显著(P > 0.05); EG: EC♂×ZG♀; GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC:厄瓜多尔野生群体F1; ZG:近交群体. Fig.3 Superoxide dismutase (SOD) activity of Litopenaeus vannamei inbred and hybrid populations under MC-LR treatment Different letters indicate the survival rates of different populations are significant different (P < 0.05); the same letter indicates no significant difference (P < 0.05). EG: EC♂×ZG♀; GG: ZG♂× ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC: ecuador wild population F1; ZG: inbreeding population. |
MC-LR暴露下, 4个群体的CAT活性随时间轴的变化同SOD类似(图 4), 暴露12 h除GG群体外都被显著诱导(P < 0.05), 36 h时显著上调到最高点(P < 0.05), 随后活性诱导减弱, 72 h时GG群体出现诱导增强的趋势, EG群体仍被显著性诱导(P < 0.05)。而EE群体和GE群体的活性虽然高于初始值, 但诱导并不显著(P > 0.05)。
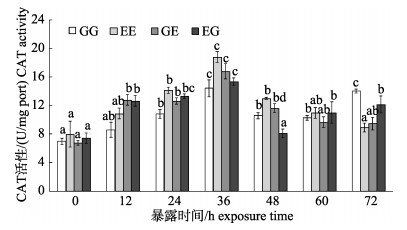
|
图 4 MC-LR暴露下凡纳滨对虾自交和杂交群体的CAT活性变化 群体内不同暴露时间下字母不同代表差异显著(P < 0.05), 相同则差异不显著(P > 0.05); EG: EC♂×ZG♀; GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC:厄瓜多尔野生群体F1; ZG:近交群体. Fig.4 Catalase (CAT) activity of Litopenaeus vannamei inbred and hybrid populations under MC-LR treatment Different letters indicate the survival rates of different populations are significant different (P < 0.05); the same letter indicates no significant difference (P < 0.05). EG: EC♂×ZG♀; GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC: ecuador wild population F1; ZG: inbreeding population. |
4个群体的GST活性总体呈先持平后升高再降低最后升高的趋势(图 5)。在MC-LR暴露初期(12~24 h)活性被诱导, 但变化不显著(P > 0.05), 随着暴露时间的延长, 在36 h时都显著升高(P < 0.05)。此后(36~72 h) GST活性呈波浪状变化, 并维持在高位, 除EE群体的48 h观测值外, GST活性显著高于初始值(P < 0.05); EG群体在60 h时GST活性达到峰值, 并在暴露72 h时出现抑制的趋势(P < 0.05), 但仍显著高于初始(0~24 h)活性(P < 0.05), 而其他群体的诱导峰值都出现在72 h。
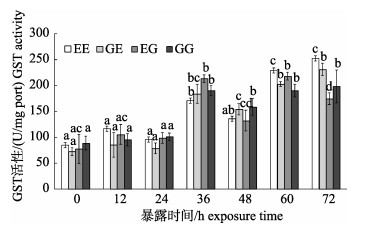
|
图 5 MC-LR暴露下凡纳滨对虾自交和杂交群体的GST活性变化 群体内不同暴露时间下字母不同代表差异显著(P < 0.05), 相同则差异不显著(P > 0.05); EG: EC♂×ZG♀; GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC:厄瓜多尔野生群体F1; ZG:近交群体. Fig.5 Glutathione-S-transferase (GST) activity of Litopenaeus vannamei inbred and hybrid populations under MC-LR treatment Different letters indicate the survival rates of different populations are significant different (P < 0.05); the same letter indicates no significant difference (P < 0.05). EG: EC♂×ZG♀; GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC: ecuador wild population F1; ZG: inbreeding population. |
图 6可见, 4个群体的GPx活性在暴露时间内总体呈逐渐升高的趋势, 其中, EG群体的GPx活性在12 h时即被显著性诱导(P < 0.05), 此后随暴露时间的延长逐渐升高, 60 h时显著升高至峰值(P < 0.05), 并维持在高位; GG群体的GPx活性变化复杂, 呈波动升高趋势, 在12 h时显著升高(P < 0.05), 24 h时又显著下降(P < 0.05), 但仍显著高于初始值(P < 0.05), 此后逐渐升高, 并在60 h时显著达到峰值(P < 0.05), 而在72 h时又显著下降(P < 0.05); EE和GE群体的GPx活性变化趋势类似, 分别在36 h和24 h被显著性诱导(P < 0.05), 此后逐渐上高, 并在72 h时显著性达到峰值(P < 0.05)。
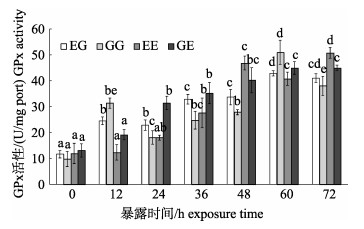
|
图 6 MC-LR暴露下凡纳滨对虾自交和杂交群体的GPx活性变化 群体内不同暴露时间下字母不同代表差异显著(P < 0.05), 相同则差异不显著(P > 0.05); EG: EC♂×ZG♀; GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC:厄瓜多尔野生群体F1; ZG:近交群体. Fig.6 Glutathione peroxidase (GPx) activity of Litopenaeus vannamei inbred and hybrid populations under MC-LR treatment Different letters indicate the survival rates of different populations are significant different (P < 0.05); the same letter indicates no significant difference (P < 0.05). EG: EC♂×ZG♀; GG: ZG♂× ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC: ecuador wild population F1; ZG: inbreeding population. |
在MC-LR暴露下, 4个群体的GR活性总体呈波浪形上升的趋势(图 7)。在0~24 h, 除EE群体在24 h即被显著诱导外(P < 0.05), 其他群体的GR活性波动复杂, 但变化不显著(P > 0.05)。暴露36 h时, 除GE群体外, GR活性普遍显著升高(P < 0.05), 此后4个群体的GR活性峰值出现分化, 其中EG和GG群体在36 h达到峰值, 而GE和EE群体则在60 h达到峰值, 此后都开始下降。
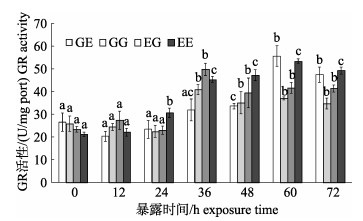
|
图 7 MC-LR暴露下凡纳滨对虾自交和杂交群体的GR活性变化 群体内不同暴露时间下字母不同代表差异显著(P < 0.05), 相同则差异不显著(P > 0.05); EG: EC♂×ZG♀; GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC:厄瓜多尔野生群体F1; ZG:近交群体. Fig.7 Glutathione reductase (GR) activity of Litopenaeus vannamei inbred and hybrid populations under MC-LR treatment Different letters indicate the survival rates of different populations are significant different (P < 0.05); the same letter indicates no significant difference (P < 0.05). EG: EC♂×ZG♀; GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC: ecuador wild population F1; ZG: inbreeding population. |
4个群体的生长曲线总体呈指数型生长趋势(图 8)。所有群体在放苗29 d内体重增加较小, 随后开始加速生长, 而GG群体在放苗60 d以后则生长速度有所放缓。生长对比发现:养殖40~ 70 d时, 群体生长速度开始出现显著性差异(P < 0.05)。至养殖70 d以后, EE和GE群体生长速度加快, 两者生长趋势相似, 而EG和GG群体的生长趋势较为接近。至实验结束时, EE群体的体重显著高于EG和GG群体(P < 0.05), GE群体的体重显著高于GG群体(P < 0.05)。
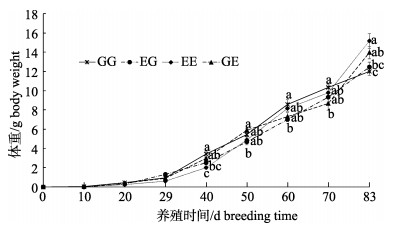
|
图 8 凡纳滨对虾自交和杂交群体的生长性状测试 群体间同一养殖时间字母不同代表差异显著(P < 0.05), 相同则差异不显著(P > 0.05); EG: EC♂×ZG♀; GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC:厄瓜多尔野生群体F1; ZG:近交群体. Fig.8 Growth trait test of Litopenaeus vannamei inbred and hybrid populations Different letters indicate the growth traits of different populations at the same time are significant different (P < 0.05); the same letter indicates no significant difference (P < 0.05). EG: EC♂×ZG♀; GG: ZG♂×ZG♀; EE: EC♂×EC♀; GE: ZG♂×EC♀; EC: ecuador wild population F1; ZG: inbreeding population. |
抗逆性是生物体应对恶劣环境的适应能力, 是受多基因控制的阈性状, 一般认为遗传力相对较低, 通过选育改进性状相对困难[10]。而虹鳟(Oncorhynchus mykiss)[11]、中国明对虾[12]和斑节对虾(Penaeus monodon)[13]等的抗逆性研究表明, 部分水生动物的抗逆性状具有较高的遗传力, 可以通过选育改进相关性状。本研究中, 4个群体急性低盐度和亚硝酸盐暴露下的存活率显示, EE和GE群体的抗逆性高于EG和GG群体, 并且母本的遗传性状占主导, 杂交组合GE群体的抗逆性明显优于EG群体。GE群体在低盐度和亚硝酸盐暴露下的杂种优势率分别为31.83%和77.01%, 并表现出一定的超亲杂种优势率; 而EG群体的杂种优势率分别为–19.21%和–8.01%, 抗逆性状弱于双亲中值。杨章武等[14]认为, 如果杂交亲本选配不当, 可能导致杂交后代某些重要经济性状的倒退, 本实验中杂交群体EG的抗逆性状表现较差, 可能是由于亲本ZG群体性状严重退化, 而其作为母本的遗传占主导优势导致杂交子代性状退化。
微囊藻毒素(MCs)是由微囊藻(Microcystis)、鱼腥藻(Anabaena)等多种蓝藻产生的肝毒性单环七肽[15-17], 在多种异构体中MC-LR的毒性最大[18-20], 具有时间、浓度双重效应[21]。MC-LR由胆汁酸转运蛋白(Bileacid transporter)携入肝细胞, 诱导产生活性氧(ROS), 对细胞脂质产生过氧化[22-23]。而抗氧化酶SOD、CAT催化O2–和H2O2生成H2O2和H2O, 谷胱甘肽(GSH)在GPx、GST催化下将ROOH、H2O2等二级产物转化为羟基化合物、水和氧化型谷胱甘肽(GSSH), GR催化GSSH还原为GSH[24-25]。在4个群体的MC-LR急性暴露实验中, SOD和CAT的活性都随暴露时间呈先强诱导后诱导减弱的趋势, 可能是MC-LR暴露下的时间效应, 在24~36 h时抗氧化系统的O2-清除反应达到峰值; GPx、GST和GR总体呈逐渐升高的趋势, 可能机体暴露的二次产物H2O2、ROOH等的清除反应正在进行, 同时实验仔虾肝胰腺中的GSH由于消耗而含量降低导致。MC-LR暴露下的抗氧化酶响应表明, 4个群体的MC-LR耐受性为EE > GE > EG > GG。
3.2 凡纳滨对虾4个群体的生长性能4个群体的生长性状测试发现, EE和GE群体在养殖前期(0~40 d)生长速度相对较慢, 但在养殖中后期(40~83 d)显现出较强的生长优势。而EG和GG群体的生长测试结果与实际生产经验相一致, 养殖户在养殖近交“土苗”时, 养殖前期通常生长表现尚可, 但养殖中后期, 往往会出现“长不大”的情况, 导致养殖饵料系数增加, 养殖效益低下。养殖测试结束时, 生长性状表现为EE > GE > EG > GG, 并且显示出母本遗传优势。杂交组合GE和EG群体的生长性状杂种优势率分别为2.77%和-8.14%, 这与急性低盐度和亚硝酸盐暴露存活率的杂种优势率趋势相一致。
3.3 凡纳滨对虾性状衰退群体杂交复壮效果评估新品种选育时如果没有外来“远源”群体的引入, 经过累代近交后, 群体的遗传多样性逐渐丧失, 有害隐形基因的纯合几率增加, 最终导致群体种质的退化, 表现为生长缓慢、抗逆性差等, 这些问题在引进品种中表现得尤为突出, 如大菱鲆(Scophthalmus maximus)[26]、美国红鱼(Sciaenops ocellatus)[27]、海湾扇贝(Argopecten irradians)[28]等。凡纳滨对虾作为外来引进种, 加上国外主要对虾选育公司的“育种者锁” (Breeder Lock)技术[29], 使得国内对虾选育研究的基础性群体收集工作相对困难, 群体渠道来源相对单一, 群体遗传多样性相对偏低, 经过多代选育后, 优良性状很容易丧失, 因此外来群体的引入就显得格外重要。胡志国等[5]认为, 杂交群体的性状取决于双亲性状间的差异和互补、双亲个体基因型的纯合度以及养殖环境条件等诸多因素的综合作用, 同时杂交群体父母亲本各有某些优良性状, 才能培育出一个优良品种[6]。因此凡纳滨对虾选育工作需要每年补充外源基础群体, 才能保持选育群体的优势性状。
| [1] |
Keys S J, Crocos P J, Burridgeb C Y, et al. Comparative growth and survival of inbred and outbred Penaeus (marsupenaeus) japonicus, reared under controlled environment conditions:indications of inbreeding depression[J]. Aquaculture, 2004, 241(1-4): 151-168. DOI:10.1016/j.aquaculture.2004.08.039 |
| [2] |
Zhang H Y, Luo K, Kong J, et al. Effects of inbreeding on growth, survival and stress resistance in Fenneropenaeus chinensis[J]. Journal of Fishery Sciences of China, 2009, 16(5): 744-750. [张洪玉, 罗坤, 孔杰, 等. 近交对中国明对虾生长、存活及抗逆性的影响[J]. 中国水产科学, 2009, 16(5): 744-750. DOI:10.3321/j.issn:1005-8737.2009.05.013] |
| [3] |
Moss D R, Arce S M, Otoshi C A, et al. Inbreeding effects on hatchery and growout performance of Pacific white shrimp, Penaeus (Litopenaeus) vannamei[J]. Journal of the World Aquaculture Society, 2008, 39(4): 467-476. DOI:10.1111/jwas.2008.39.issue-4 |
| [4] |
Yao X M, Huang B, Zhang J T, et al. Comparison of growth and survival rate of F1, F2 and hybrid generation from SPF Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2007, 14(2): 326-330. [姚雪梅, 黄勃, 张继涛, 等. SPF凡纳滨对虾F1、F2及杂交代生长和存活比较研究[J]. 中国水产科学, 2007, 14(2): 326-330. DOI:10.3321/j.issn:1005-8737.2007.02.023] |
| [5] |
Hu Z G, Liu J Y, Yuan R P, et al. Evaluation of growth performance in three imported Litopenaeus vannamei populations and their hybrid offspring[J]. Journal of Fishery Sciences of China, 2015, 22(5): 925-932. [胡志国, 刘建勇, 袁瑞鹏, 等. 凡纳滨对虾3个引进群体及其杂交子代的生长性能评估[J]. 中国水产科学, 2015, 22(5): 925-932.] |
| [6] |
Yao X M, Huang B, Lai Q M, et al. Comparison of growth and survival of the hybrid and inbred lines in Litopenaeus vannamei[J]. Journal of Fisheries of China, 2006, 30(6): 791-795. [姚雪梅, 黄勃, 赖秋明, 等. 凡纳滨对虾自交系与杂交系早期生长和存活的比较[J]. 水产学报, 2006, 30(6): 791-795.] |
| [7] |
Cao B X, Kong J, Luo K, et al. Comparison of growth and survival performance among selected population, imported population and inbreeding population in Litopenaeus vannamei[J]. Journal of Fisheries of China, 2015, 39(1): 42-51. [曹宝祥, 孔杰, 罗坤, 等. 凡纳滨对虾选育群体与近交群体、引进群体生长和存活性能比较[J]. 水产学报, 2015, 39(1): 42-51.] |
| [8] |
Zhang J C, Liu J Y, Yuan R P, et al. Effect of stocking density on growth and survival of inbred and hybrid offspring of Litopenaeus vannamei[J]. South China Fisheries Science, 2015, 11(4): 53-58. [张嘉晨, 刘建勇, 袁瑞鹏, 等. 养殖密度对凡纳滨对虾杂交和自交子一代生长与成活的影响[J]. 南方水产科学, 2015, 11(4): 53-58. DOI:10.3969/j.issn.2095-0780.2015.04.008] |
| [9] |
Yang Z W, Weng Z C, Yao Z X, et al. The immunology competence preliminary analysis of the offspring of artificial selection stocks for Litopenaeus vannamei[J]. Journal of Fujian Fisheries, 2012, 34(4): 278-283. [杨章武, 翁忠钗, 姚志贤, 等. 凡纳滨对虾选育群体子代免疫性能的初步分析[J]. 福建水产, 2012, 34(4): 278-283. DOI:10.3969/j.issn.1006-5601.2012.04.003] |
| [10] |
Bulmer M G. The Mathematical Theory of Quantitative Genetics[M]. Beijing: China Agriculture Press, 1991. [Bulmer M G. 数量遗传学的数学理论[M]. 北京: 农业出版社, 1991.]
|
| [11] |
Kudo H, Inoguchi N, Kijima A. Estimation of heritability of tolerance to low-oxygen water in rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture Science, 2002, 50(3): 369-374. |
| [12] |
Li J, Liu P, He Y Y, et al. Artificial selection in the new breed of Fenneropenaeus chinensis named "Yellow Sea 1" based on fast growth trait[J]. Journal of Fisheries of China, 2005, 29(1): 1-5. [李健, 刘萍, 何玉英, 等. 中国对虾快速生长新品种"黄海1号"的人工选育[J]. 水产学报, 2005, 29(1): 1-5.] |
| [13] |
Huang J H, Li Y, Yang Q B, et al. Comparison of tolerance to ammonia-N in Penaeus monodon families[J]. South China Fisheries Science, 2012, 8(6): 37-43. [黄建华, 李永, 杨其彬, 等. 斑节对虾家系氨氮耐受性的比较[J]. 南方水产科学, 2012, 8(6): 37-43. DOI:10.3969/j.issn.2095-0780.2012.06.006] |
| [14] |
Yang Z W, Zheng Y Y, Li Z L, et al. A comparative study on growth, low-salinity and low-temperature resistance among the inbred and hybrid offsprings at larval stages for Litopenaeus vannamei[J]. Journal of Fisheries of China, 2012, 36(2): 284-289. [杨章武, 郑雅友, 李正良, 等. 凡纳滨对虾群体自交与杂交子代幼体对低温、低盐抗逆性与生长比较[J]. 水产学报, 2012, 36(2): 284-289.] |
| [15] |
Falconer I R, Yeung D S. Cytoskeletal changes in hepatocytes induced by microcystis toxins and their relation to hyperphosphorylation of cell proteins[J]. Chemico-Biological Interactions, 1992, 81(1-2): 181-196. DOI:10.1016/0009-2797(92)90033-H |
| [16] |
Batista T, de Sousa G, Suput S J, et al. Microcystin-LR causes the collapse of actin filaments in primary human hepatocytes[J]. Aquatic Toxicology, 2003, 65(1): 85-91. DOI:10.1016/S0166-445X(03)00108-5 |
| [17] |
Xu L H, Chen G S, Chen J P, et al. Toxic effects of microcystin on fish liver[J]. Acta Hydrobiologica Sinica, 1998, 22(4): 378-379. [徐立红, 陈国胜, 陈加平, 等. 微囊藻毒素对鱼肝的毒性效应[J]. 水生生物学报, 1998, 22(4): 378-379. DOI:10.3321/j.issn:1000-3207.1998.04.015] |
| [18] |
Bieczynski F, Anna J S D, Schirmer V M P, et al. Cellular transport of microcystin-LR in rainbow trout (Oncorhynchus mykiss) across the intestinal wall:Possible involvement of multidrug resistance-associated proteins[J]. Aquatic Toxicology, 2014, 154: 97-106. DOI:10.1016/j.aquatox.2014.05.003 |
| [19] |
Campos A, Vasconcelos V. Molecular mechanisms of microcystin toxicity in animal cells[J]. International Journal of Molecular Sciences, 2010, 11(1): 268-278. DOI:10.3390/ijms11010268 |
| [20] |
Dietrich D, Hoeger S. Guidance values for microcystins in water and cyanobacterial supplement products (blue-green algal supplements):a reasonable or misguided approach?[J]. Toxicology & Applied Pharmacology, 2005, 203(3): 273-289. |
| [21] |
Zha G C, Zhou C Q, Niu X G. Harm of microcystis aeruginosa to Litopenaeus vannamei low salinity stokcing[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2007, 46(2): 64-67. [查广才, 周昌清, 牛晓光. 铜绿微囊藻对凡纳滨对虾低盐度养殖的危害研究[J]. 中山大学学报:自然科学版, 2007, 46(2): 64-67.] |
| [22] |
Ladenstein R, Epp O, Bartels K, et al. Structure analysis and molecular model of the selenoenzyme glutathione peroxidase at 2.8 resolution[J]. Journal of Molecular Biology, 1979, 134(2): 199-218. |
| [23] |
Winterbourn C C. Free radical toxicology and antioxidant defence[J]. Clinical and Experimental Pharmacology and Physiology, 1995, 22(11): 877-880. DOI:10.1111/cep.1995.22.issue-11 |
| [24] |
Liu X H. Antioxidative defence mechanism of glutathione on Litopenaeus vannamei[D]. Wuhan: Huazhong Agricultural University, 2010. [刘晓华.谷胱甘肽对凡纳滨对虾抗氧化防御的调控机理[D].武汉: 华中农业大学, 2010.]
|
| [25] |
Wang L. Effects of deitary bioactive peptides on growth performance, immunity and antioxidation of Litopenaeus vannamei[D]. Guangzhou: South China Agricultural University, 2016. [王玲.生物活性肽对凡纳滨对虾生长、免疫及抗氧化性能的影响[D].广州: 华南农业大学, 2016.]
|
| [26] |
Ma A J, Wang X A. Development of turbot Scophthalmus maximus seed industry and application of advanced technology[J]. Oceanologia et Limnologia Sinica, 2015, 46(6): 1461-1466. [马爱军, 王新安. 大菱鲆(Scophthalmus maximus)种业发展及相关前沿技术应用[J]. 海洋与湖沼, 2015, 46(6): 1461-1466.] |
| [27] |
Wang K L. Protection of brooder stock for proliferation of aquaculture organisms[J]. Marine Sciences, 1998, 22(4): 30-34. [王可玲. 增养殖生物种质资源的保护[J]. 海洋科学, 1998, 22(4): 30-34.] |
| [28] |
Zhang F S, He Y C, Qi L X, et al. Studies on the restoration of cultured bay scallop Argopecten irradians through reintroduction of broodstock[J]. Oceanologia et Limnologia Sinica, 1997, 28(2): 146-152. [张福绥, 何义朝, 亓铃欣, 等. 海湾扇贝引种复状研究[J]. 海洋与湖沼, 1997, 28(2): 146-152. DOI:10.3321/j.issn:0029-814X.1997.02.006] |
| [29] |
Doyle R W. Inbreeding and disease in tropical shrimp aquaculture:a reappraisal and caution[J]. Aquaculture Research, 2016, 47(1): 21-35. DOI:10.1111/are.12472 |
 2018, Vol. 25
2018, Vol. 25

