2. 青岛海洋科学与技术国家实验室, 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266072
2. Functional Laboratory of Marine Fisheries Science and Food Production Process, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266072, China
金乌贼(Sepia esculenta)隶属于头足纲(Cepha- lopoda), 乌贼目(Sepioidea), 乌贼科(Sepiidae), 乌贼属, 俗称墨鱼、乌鱼等[1], 广泛分布于中国沿海, 以及日本北海道以南、朝鲜西南海域和菲律宾群岛海域, 是世界乌贼科中的重要经济种, 也是中国北方海域中经济价值最大的乌贼[2-3]。近年来, 随着金乌贼增殖放流规模的日渐扩大, 提高其繁殖效率尤为重要。在人工繁育过程中, 精子质量对卵子受精率和幼体孵化率具有明显影响[4], 是决定繁殖效率的关键。但目前关于金乌贼精子的研究主要集中在精子的超微结构[5-6]。
精子的运动能力是其最基本的特性之一, 而其运动速度的大小往往与其受精能力有关[7]。已有研究表明, 速度更快的精子具有更强的受精能力[8]。精子运动需要消耗大量ATP并通过不断地分解能量物质产生ATP来维持自身运动[9]。蛋白质、糖类和脂类是精子代谢所利用的重要能量物质, 这些物质的利用通常与对应的代谢酶活性有关[10]。因此, 精子能量代谢情况和运动能力可从一定程度上反映出精子的质量[11]。目前关于精子活性和能量代谢的研究主要集中在鱼类, 如温度、溶解氧、渗透压、pH等变化会对其活性和代谢产生影响[12-16], 但头足类精子活性和能量代谢的研究较少。金乌贼在交配过程中, 雄性通过精荚将精子输送给雌性, 这些精荚被粘在雌性的口膜表面[17]。研究表明, 精荚从雄性体内排出后, 其内精子仍可存活多日[18]。外界环境因子的变化是否显著影响其能量代谢和活力, 具体影响机制等尚不明确。
因此, 本研究分析了不同温度、溶解氧条件下金乌贼精荚中蛋白质、糖原、甘油三酯含量和糖酵解、三羧酸循环、脂肪分解关键酶活性, 并观测了精子激活后的运动能力, 以期揭示金乌贼精子对外界水温和溶解氧的响应和存活机制, 为人工繁育条件下提高精子质量和受精率提供理论依据。
1 材料与方法 1.1 实验材料实验用金乌贼于2017年7月取自青岛金沙滩水产开发有限公司。选取健康状况良好、活性较强、规格一致的成熟雄性金乌贼带回实验室, 其平均胴长(17.372±0.435) cm, 平均体重(644.15± 33.259) g。将金乌贼麻醉后, 在冰上解剖取出精荚囊, 将其剪开, 取出精荚待用。精荚为长棒型, 外部包有被膜, 被膜内部包裹着三部分:头部弹射装置、接合部和精团(精子和精浆)。精荚中精子代谢的能量供应, 一是精子自身储存的能量物质, 另一个是精荚中精浆提供的能量物质。
1.2 实验方法 1.2.1 实验设计(1) 温度实验 金乌贼繁殖季节水温通常在16~24℃范围内波动, 因此本研究设计3个温度组(16℃、20℃、24℃), 并以20℃为对照组。每个温度组设置6个重复, 每个重复至少包含50个精荚, 分别放入18个150 mL烧杯中进行温度处理。处理期间溶解氧维持在(6±0.5) mg/L。利用可控温循环水槽进行水浴控温, 每隔1 h用温度计测定1次温度, 以保证烧杯中温度的恒定(控制温度在设定值±0.5℃的范围内)。实验分别在第0小时(刚采集的精荚)和第36小时(不同温度处理组)时取样, 每个重复随机取31个精荚用于后续分析, 其中1个用于精子活性的测定, 15个用于糖原含量的测定, 15个用于蛋白质、甘油三酯含量和酶活性的测定。
(2) 溶解氧实验 溶解氧实验在18个容积为150 mL的烧杯中进行, 温度为(20±0.5)℃, 设计3个不同溶解氧组, 分别为:缺氧组(1 mg/L)、低氧组(3 mg/L)、常氧组(6 mg/L), 每个溶解氧组设置6个重复, 每个重复中至少放入50个精荚。采用向海水中充氮气和空气的方式调节烧杯中水体的溶解氧浓度, 调节好溶解氧后用保鲜膜封住烧杯口, 每隔1 h用溶氧仪测定一次烧杯中溶解氧的含量, 以保证烧杯中溶解氧含量的恒定(控制溶解氧在设定值±0.5 mg/L的范围内)。取样时间、样品数量与温度实验相同。
1.2.2 精子活性的测定利用精子、微生物动(静)态图像检测系统(CASA-QH-Ⅲ, 北京华方神火科技有限公司), 在相同实验条件(水温为20℃, 溶解氧为6 mg/L)下检测温度和溶解氧处理36 h后精子激活10 s、300 s、600 s时的活性, 每个样品至少取40个精子进行测定。精子的运动状态参照Lahnsteiner等[19]的方法根据平均路径速度(VAP, 简称为运动速度)进行分级, VAP < 5 μm/s为不运动精子, 5 μm/s≤VAP≤20 μm/s为慢速运动精子, VAP > 20 μm/s为快速运动精子。
1.2.3 生化分析准确称量精荚样品的重量, 按重量(g):体积(mL)=1:9的比例加入预冷的生理盐水, 冰浴条件下机械匀浆, 获得的粗提取液在4℃条件下3000 r/min离心10 min, 取上清液用于生化分析。
蛋白质、甘油三酯、糖原的含量和己糖激酶(HK)、乳酸脱氢酶(LDH)、琥珀酸脱氢酶(SDH)、脂肪酶(LIP)活性均采用南京建成生物工程研究所生产的试剂盒测定; 丙酮酸脱氢酶(PDH)采用北京索莱宝科技有限公司生产的试剂盒测定。
1.3 数据处理所有数据均用SPSS19.0统计分析软件进行统计分析。数据用平均值±标准差(x±SD)表示。温度和溶氧处理组与未处理组之间的差异显著性采用t检验分析。不同温度和溶氧处理组之间的差异显著性用单因素方差分析(one-way ANOVA)和Duncan多重比较进行分析。精荚中能量物质的含量与酶活性之间的关系用曲线估计进行分析, 并用ANOVA对回归的显著性进行检验。
2 结果与分析 2.1 温度对精子的影响 2.1.1 能量物质和代谢酶活性未处理组和各温度处理组精荚蛋白质、糖原和甘油三酯含量见表 1。不同温度处理36 h后, 精荚蛋白质含量并未发生显著变化。当温度从20℃降至16℃时, 糖原和甘油三酯含量均显著上升(P < 0.05);但温度从20℃上升至24℃时, 糖原含量显著下降(P < 0.05), 而甘油三酯含量却无显著变化(P > 0.05)。
|
|
表 1 温度对金乌贼精荚中蛋白质、糖原和甘油三酯含量的影响 Tab.1 Effect of temperature on the content of protein, glycogen and triglyceride in spermatophore of Sepia esculenta |
不同温度条件下精荚糖脂代谢酶活见表 2。不同温度处理36 h后, 当温度从20℃降至16℃, 精荚己糖激酶、乳酸脱氢酶、丙酮酸脱氢酶、琥珀酸脱氢酶和脂肪酶活性均显著下降(P < 0.05);但温度从20℃上升至24℃时, 除脂肪酶活性无显著变化外其他酶活性均显著上升(P < 0.05)。
|
|
表 2 温度对金乌贼精荚中酶活性的影响 Tab.2 Effect of temperature on enzyme activities in spermatophore of Sepia esculenta |
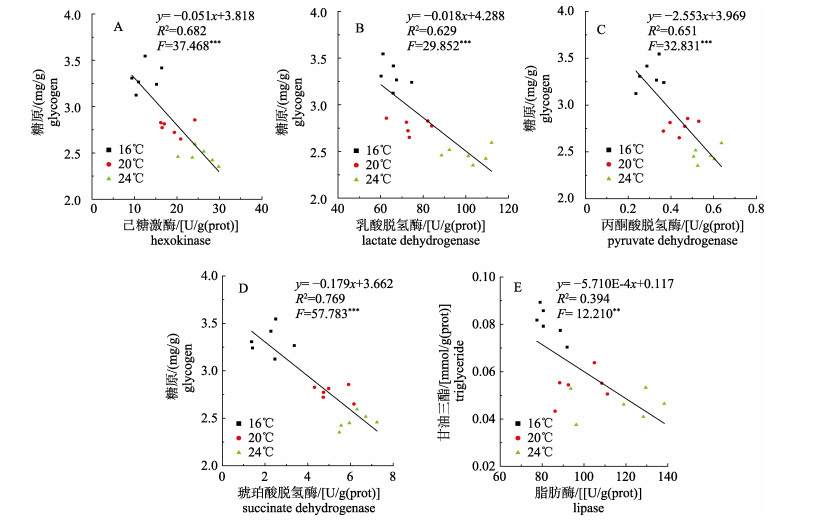
进一步分析温度处理36 h后精荚能量物质与糖脂代谢酶活关系发现, 糖原含量与所有糖代谢酶活性均呈显著线性负相关关系(图 1A, 图 1B, 图 1C, 图 1D, P < 0.05);与糖代谢类似, 甘油三酯含量同样与脂肪酶活性呈显著线性负相关关系(图 1E, P < 0.05)。
|
图 1 不同温度条件下金乌贼精荚中能量物质和相关酶活性的关系 **表示线性相关(P < 0.01). ***表示显著线性相关(P < 0.001). Fig.1 Relationship between energy substances and enzyme activities in spermatophore of Sepia esculenta under different temperatures **indicates linear correlation (P < 0.01). *** indicates significant linear correlation (P < 0.001). |
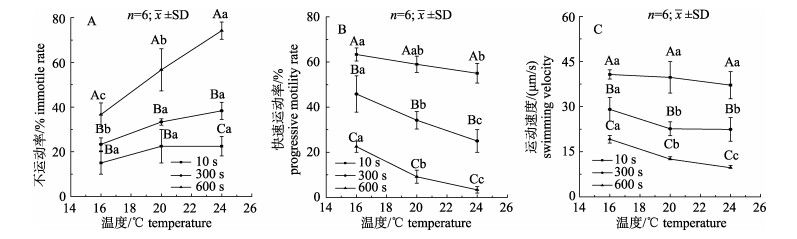
不同温度和激活时间下精子活性相关指标见图 2。精子激活10 s时, 不运动率和运动速度并未随温度变化而呈现显著改变; 16℃和24℃条件下的快速运动率与20℃相比均无显著变化, 但16℃条件下的快速运动率显著高于24℃(P < 0.05)。激活时间增加至300 s时, 温度从20℃降至16℃, 不运动率显著下降(P < 0.05), 快速运动率和运动速度均显著上升(P < 0.05);当温度从20℃上升至24℃时, 不运动率和运动速度无显著变化, 但快速运动率却显著下降(P < 0.05)。激活时间增加至600 s时, 不运动率随温度上升而显著上升(P < 0.05), 快速运动率和运动速度随温度上升显著下降(P < 0.05)。
|
图 2 温度对金乌贼精子活性的影响 不同小写字母表示相同激活时间不同温度下差异显著(P < 0.05);不同大写字母表示相同温度不同激活时间差异显著(P < 0.05). Fig.2 Effect of temperature on sperm motility of Sepia esculenta Different lowercase letters represent significant differences at the same time after activation among different temperatures (P < 0.05). Different capital letters represent significant differences at the same temperature among different times after activation (P < 0.05). |
在16℃条件下, 激活10 s与300 s时精子不运动率并无显著差异(P > 0.05), 但激活600 s时不运动率显著升高(P < 0.05), 而快速运动率和运动速度在激活300 s时均已显著下降(P < 0.05), 并且于激活600 s时进一步降低(P < 0.05)。在20℃条件下, 不运动率、快速运动率和运动速度随激活时间的变化趋势与16℃相同。在24℃条件下, 不运动率随激活时间增加而显著增加(P < 0.05), 快速运动率和运动速度均随激活时间增加而显著下降(P < 0.05)。
2.2 溶解氧对精子的影响 2.2.1 能量物质和代谢酶活性未处理组和各溶解氧处理组精荚蛋白质、糖原和甘油三酯含量见表 3。不同溶解氧处理36 h后, 精荚蛋白质含量并未随溶解氧变化而发生显著变化。当溶解氧从1 mg/L上升至6 mg/L时, 糖原含量显著下降(P < 0.05)。甘油三酯含量在溶解氧从1 mg/L上升至3 mg/L时无显著变化; 但溶解氧从3 mg/L上升至6 mg/L时, 甘油三酯含量显著下降(P < 0.05)。
|
|
表 3 溶解氧对金乌贼精荚中蛋白质、糖原和甘油三酯含量的影响 Tab.3 Effect of dissolved oxygen on the content of protein, glycogen and triglyceride in spermatophore of Sepia esculenta |
不同溶解氧条件下精荚糖脂代谢酶活见表 4。不同溶解氧处理36 h后, 当溶解氧从1 mg/L上升至6 mg/L时, 精荚己糖激酶、丙酮酸脱氢酶和琥珀酸脱氢酶活性均显著升高(P < 0.05), 但乳酸脱氢酶活性则是先升后降(P < 0.05)。当溶解氧从1 mg/L上升至3 mg/L时, 脂肪酶活性无显著变化; 但溶解氧从3 mg/L上升至6 mg/L时, 脂肪酶活性显著上升(P < 0.05)。
|
|
表 4 溶解氧对金乌贼精荚中酶活性的影响 Tab.4 Effect of dissolved oxygen on enzyme activities in spermatophore of Sepia esculenta |
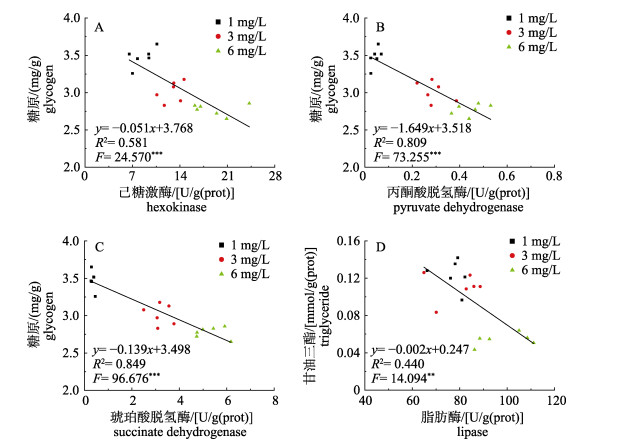
进一步分析溶解氧处理36 h后精荚能量物质与糖脂代谢酶活关系发现, 除乳酸脱氢酶外, 糖原含量与其他糖代谢酶活性均呈显著线性负相关关系(图 3A, 3B, 3C); 与糖代谢类似, 甘油三酯含量同样与脂肪酶活性呈显著线性负相关关系(图 3D)。
|
图 3 不同溶解氧条件下金乌贼精荚中能量物质和相关酶活性的关系 **表示线性相关(P < 0.01). ***表示显著线性相关(P < 0.001). Fig.3 Relationship between energy substances and enzyme activities in spermatophore of Sepia esculenta under different dissolved oxygen **indicates linear correlation (P < 0.01). *** indicates significant linear correlation (P < 0.001). |
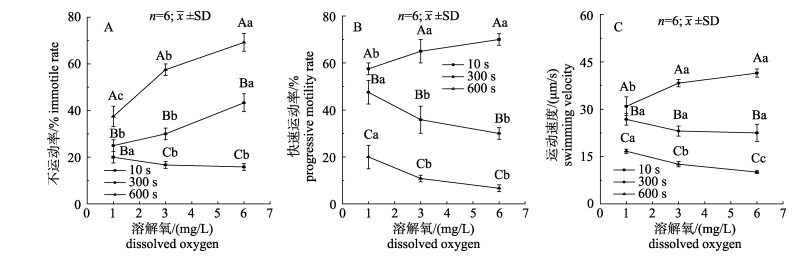
不同溶解氧和激活时间下精子活性相关指标见图 4。精子激活10 s时, 当溶解氧从1 mg/L上升至3 mg/L, 精子的快速运动率和运动速度显著上升(P < 0.05), 而不运动率则显著下降(P < 0.05);溶解氧从3 mg/L上升至6 mg/L时, 不运动率、快速运动率和运动速度均无显著变化。激活时间增加到300 s时, 当溶解氧从1 mg/L上升至3 mg/L, 不运动率和运动速度均没有显著变化, 但快速运动率显著下降(P < 0.05);当溶解氧从3 mg/L上升至6 mg/L, 不运动率显著上升(P < 0.05), 而快速运动率和运动速度均无显著变化。激活时间增加至600 s时, 不运动率随溶解氧含量的上升而显著上升(P < 0.05), 运动速度显著下降(P < 0.05), 快速运动率则先降后稳(1 mg/L至3 mg/L: P < 0.05; 3 mg/L至6 mg/L: P > 0.05)。
|
图 4 溶解氧对金乌贼精子活性的影响
不同小写字母表示相同激活时间不同溶解氧差异显著(P < 0.05);不同大写字母表示相同溶解氧不同激活时间差异显著(P < 0.05).
Fig.4 Effect of dissolved oxygen on sperm motility of Sepia esculenta
Different lowercase letters represent significant differences at the same time after activation among different dissolved oxygen (P < 0.05). Different capital letters represent significant differences at the same dissolved oxygen among different times after activation (P < 0.05). |
在1 mg/L溶解氧条件下, 激活10 s与300 s时精子不运动率并无显著差异(P > 0.05), 但激活600 s时不运动率显著升高(P < 0.05), 而快速运动率和运动速度在激活300 s时均已显著下降(P < 0.05), 并在激活600 s时进一步降低(P < 0.05)。在3 mg/L溶解氧条件下, 不运动率随激活时间增加而显著增加(P < 0.05), 快速运动率和运动速度均随激活时间增加而显著下降(P < 0.05)。在6 mg/L溶解氧条件下, 不运动率、快速运动率和运动速度随激活时间的变化趋势与3 mg/L相同。
3 讨论 3.1 精子能量代谢特征精子长期储存过程中, 能量供应对于维持其正常功能十分重要。脂类(甘油三酯)、糖类(糖原、葡萄糖等)和蛋白质是精子代谢过程中的重要能量物质, 但精子对这类能量物质的利用存在种间差异[20]。在十足目中, 大部分种类的精子利用糖类进行供能, 少部分种类利用蛋白质和脂类供能[21]。锯缘青蟹(Scylla serrata)精子只利用糖类进行能量供应[22]。而平分大额蟹(Metopograpsus messor)的精子在能量供应过程中主要消耗蛋白质和脂类[23]。对于大部分鱼类而言, 其精子在代谢过程中利用的能量物质是糖类和脂类。虹鳟(Oncorhynchus mykiss)以脂类作为精子的能量来源[11]。金头鲷(Sparus aurata)精子则利用糖类和脂类进行能量供应[24]。长枪乌贼(Heterololigo bleekeri)精子利用糖原来维持其所需能量[25]。在本研究中, 各温度或溶氧处理36 h后的精荚糖原和甘油三酯含量均显著低于未处理组, 但各处理组蛋白质含量均与未处理组无显著差异。结果表明, 金乌贼精子所利用的能量物质是糖原和甘油三酯而不是蛋白质。
水温是影响生物体代谢的重要因素之一, 水温变化通常会导致水生动物精子代谢酶活性发生变化。如水温从4℃升高至20℃时冷水性鱼类利文鳟(Salmo trutta)和江鳕(Lota lota)精子的糖酵解和三羧酸循环关键酶活力逐渐下降[14]。本研究发现, 精荚中精子糖代谢酶活性均随水温升高而升高, 脂代谢酶则先升后稳, 这可能与金乌贼繁殖季节水环境和酶自身特性有关。北方金乌贼繁殖期通常处于夏季, 水温较高导致其具有相对较高的最适温度, 因此精子糖代谢酶活性随水温升高而显著升高。而脂肪酶最适温度相对较低, 因此在升温过程中脂肪酶活性先达到峰值, 类似现象在仿刺参(Apostichopus japonicus)[26]中也有报道。由此认为, 一定范围内的升温能够提高精荚中精子糖脂代谢能力。较高的酶活性意味着较强的代谢能力, 从而消耗更多能量物质, 因此温度处理36 h后, 高温组精荚中剩余的糖原和甘油三酯含量低于低温组。
溶解氧也是十分重要的环境因子, 其含量变化会引起生物体呼吸、能量代谢等生理活动的变化[27]。本研究中, 当溶解氧含量由6 mg/L下降至3 mg/L时, 精荚丙酮酸脱氢酶、琥珀酸脱氢酶、脂肪酶活性显著下降, 但乳酸脱氢酶活性却显著上升, 其原因可能与精子摄取的氧气下降有关。低氧条件下, 精子从水体中摄取的氧气下降导致其有氧代谢能力下降, 因此通过增加厌氧代谢能力来满足代谢所需能量, 类似现象在曼氏无针乌贼(Sepiella japonica)也有报道[28]。但当溶氧低至1 mg/L时, 精子有氧代谢相关酶活进一步下降的同时, 乳酸脱氢酶活性也显著下降, 这可能是由于厌氧代谢增加导致精荚中产生大量乳酸, 而高浓度的乳酸会抑制乳酸脱氢酶活性来减少乳酸的产生, 从而导致厌氧代谢下降。由于低氧条件抑制了精子代谢能力, 从而降低了能量物质的消耗, 因此溶氧处理36 h后, 低氧组精荚中剩余的糖原和甘油三酯含量高于常氧组。
3.2 精子活性比较分析运动是精子最重要的功能, 决定其到达和进入卵细胞的能力。温度变化会对精子的运动率、运动时间和运动速度产生不同程度的影响[29]。Lahnsteiner[14]认为, 激活后一定时间再次测定精子活性指标可以从一定程度上反映精子运动时间的长短, 在激活后期更高的运动率和运动速度意味着具有更长的运动时间。本研究发现, 在激活初期(激活10 s), 精子的运动速度并不受温度变化的影响, 但快速运动率随着温度升高缓慢降低; 而在激活后期(激活600 s), 运动速度和快速运动率随温度的升高迅速降低。这与Lahnsteiner[30]和Williot等[31]对欧洲河鲈(Perca fluviatilis)和西伯利亚鲟(Acipenser baeri)的研究结果一致, 表明温度的升高会缩短精子的运动时间。但是温度对精子活性的影响存在种间差异。温度会影响澳大利亚海胆(Heliocidaris erythrogramma)精子的运动速度而不是运动率[32]。条纹鲮脂鲤(Prochilodus lineatus)精子的运动速度在17℃时最高, 当温度升高或者降低时其运动速度均会降低[33]。已有研究表明, 鱼类的精子会在运动速度、运动率和运动时间之间进行权衡[34]。本研究发现, 温度处理36 h后精子可利用的能量物质随着温度的升高而显著下降。但是在激活初期, 不同温度组精子的运动速度并未出现显著变化, 而快速运动率和运动时间随着温度的升高呈现降低的趋势, 表明金乌贼的精子更趋向于降低快速运动率和运动时间来维持较高的运动速度。这种最佳的运动速度和运动时间的组合可能取决于精子进入卵细胞机会的大小。在具有强烈精子竞争和卵能很快受精的种类中, 运动速度更快的精子会更具有优势; 而在精子来源有限和精子需要较长时间才能与卵细胞结合的种类中, 运动时间更长的精子会更具有优势[35-36]。由此, 维持较高的运动速度是金乌贼精子在有很强精子竞争的前提下[17], 对不同温度的一种适应。本研究表明, 相对低温对精荚中精子活力的影响较小, 更有利于精子的长期存活。
溶解氧含量的变化同样会对精子的活性产生很大影响。Krzyzosiak等[37]研究发现, 精子稀释液中溶解氧含量较高时, 牛(Bovine)精子具有很高的活性, 随着溶解氧含量的下降, 精子的活性迅速降低。长枪乌贼精子在低氧条件下具有更长的运动时间[25]。本研究中, 与3 mg/L组相比, 1 mg/L组精子在激活初期的快速运动率和运动速度显著降低, 而不运动率显著升高。推测极度缺氧导致精荚中的精子处于氧化应激的状态, 不利于精子的能量供应甚至对其造成一定的损伤, 从而导致激活初期快速运动率和运动速度的降低。3 mg/L组与6 mg/L组精子激活初期的运动速度和快速运动率无显著差异, 但3 mg/L组运动时间显著长于6 mg/L组。分析认为, 低氧(3 mg/L)降低了精子激活前能量物质的消耗, 导致其激活后仍具有较多的能量物质。由于低氧组的精子具有更长的运动时间, 推测中度低氧(3 mg/L)可能并未对精荚中的精子造成损伤。由此认为, 3 mg/L低氧环境更有利于精荚中精子的长期存活。
3.3 精荚中精子长期存活机制精荚对头足类精子的输送和精子的长时间存活具有重要作用。Naud等[38]研究发现, 澳洲巨型乌贼(Sepia apama)精荚中的精子在4℃条件下离体储存2个月后仍具有一定的活性。本研究发现, 无论是不同温度还是不同溶解氧处理36 h后, 精荚中的精子在激活后仍具有较强的活性。分析认为, 这与精荚中含有大量能够被精子利用的能量物质——糖原和甘油三脂密切相关。此外, 能量物质的消耗速度同样会对精子的存活时间产生显著影响。已有研究表明, 皮氏枪乌贼(Loligo pealii)精荚中的精浆能够抑制其精子的运动和代谢, 降低能量物质的消耗, 从而延长精荚中精子的存活时间[39]。推测金乌贼精荚中精子的存活机制应与之类似。
综上所述, 金乌贼精荚中的糖原和甘油三酯等能量物质为精子长期存活提供了物质基础, 而精子较低的能量物质消耗亦为其长期存活提供了保障。水温和溶解氧的变化会对精荚中精子的长期存活产生影响。高温(24℃)和常氧(6 mg/L)环境中精子糖脂代谢酶的活性增加, 促进了精子可利用能量物质的分解, 从而降低了精子激活后的活性, 不利于精荚中精子的长期存活。而相对低温(16℃)和中度低氧(3 mg/L)环境更有利于精荚中精子的长期存活。黏附于雌性口膜周围的精荚是否处于一个低氧环境, 使得其中的精子能够长期存活, 从而保证雌性在交配后能够连续多天产出受精卵, 这一推测将有待进一步研究证实。
| [1] |
Zhang X, Qi Z Y, Li J M, et al. Economic Fauna Sinica of China-Marine Mollusca[M]. Beijing: Science Press, 1962: 213-217. [张玺, 齐钟彦, 李洁民, 等. 中国经济动物志--海产软体动物[M]. 北京: 科学出版社, 1962: 213-217.]
|
| [2] |
Qi Z Y. Economic Mollusca of China[M]. Beijing: China Agriculture Press, 1998: 293-294. [齐钟彦. 中国经济软体动物[M]. 北京: 中国农业出版社, 1998: 293-294.]
|
| [3] |
Zheng Y J, Chen X Z, Cheng J H. Biological Resources and Environment of the Continental Shelf in the East China Sea[M]. Shanghai: Shanghai Scientific & Technical Publishers, 2003: 722-727. [郑元甲, 陈雪忠, 程家骅. 东海大陆架生物资源与环境[M]. 上海: 上海科学技术出版社, 2003: 722-727.]
|
| [4] |
Wang Q, Zhao Y L, Chen L Q. Biochemical composition and sperm metabolism in the reproductive system of the male, Eriocheir sinensis[J]. Journal of Fisheries of China, 2002, 26(5): 411-416. [王群, 赵云龙, 陈立侨. 中华绒螯蟹雄性生殖系统生化组成及精子代谢[J]. 水产学报, 2002, 26(5): 411-416.] |
| [5] |
Han S, Zheng X D, Li Q, et al. Ultrastructure of Sepia esculenta (Cephalopoda: Sepiida) spermatozoa and its damage by low temperature[J]. Oceanologia et Limnologia Sinica, 2010, 41(4): 483-488. [韩松, 郑小东, 李琪, 等. 金乌贼(Sepia esculenta)精子超微结构和低温损伤电镜观察[J]. 海洋与湖沼, 2010, 41(4): 483-488.] |
| [6] |
Liu C L, Zou J, Liu J G, et al. Ultrastructure of the spermatozoon of Sepia esculenta Hoyle[J]. Progress in Fishery Sciences, 2011, 32(3): 1-6. [刘长琳, 邹健, 刘君刚, 等. 金乌贼精子的超微结构[J]. 渔业科学进展, 2011, 32(3): 1-6. DOI:10.3969/j.issn.1000-7075.2011.03.001] |
| [7] |
Lahnsteiner F, Berger B, Weismann T, et al. Physiological and biochemical determination of rainbow trout, Oncorhynchus mykiss, semen quality for cryopreservation[J]. Journal of Applied Aquaculture, 1996, 6(4): 47-73. DOI:10.1300/J028v06n04_05 |
| [8] |
Gomendio M, Roldan E R S. Implications of diversity in sperm size and function for sperm competition and fertility[J]. The International Journal of Developmental Biology, 2008, 52(5): 439-447. |
| [9] |
Cosson J, Groison A L, Suquet M, et al. Marine fish spermatozoa: racing ephemeral swimmers[J]. Reproduction, 2008, 136(3): 277-294. DOI:10.1530/REP-07-0522 |
| [10] |
Lahnsteiner F, Patzner R A, Weismann T. Energy resources of spermatozoa of the rainbow trout Oncorhynchus mykiss (Pisces, Teleostei)[J]. Reproduction Nutrition Development, 1993, 33(4): 349-360. DOI:10.1051/rnd:19930404 |
| [11] |
Lahnsteiner F, Berger B, Weismann T, et al. Determination of semen quality of the rainbow trout (Oncorhynchus mykiss) by sperm motility, seminal plasma parameters, and spermatozoal metabolism[J]. Aquaculture, 1998, 163(1-2): 163-181. DOI:10.1016/S0044-8486(98)00243-9 |
| [12] |
Alavi S M H, Cosson J. Sperm motility in fishes. Ⅰ. Effects of temperature and pH: a review[J]. Cell Biology International, 2005, 29(2): 101-110. DOI:10.1016/j.cellbi.2004.11.021 |
| [13] |
Dziewulska K, Domagała J. Effect of pH and cation concentrations on spermatozoan motility of sea trout (Salmo trutta m. trutta L.)[J]. Theriogenology, 2013, 79(1): 48-58. DOI:10.1016/j.theriogenology.2012.09.008 |
| [14] |
Lahnsteiner F, Mansour N. The effect of temperature on sperm motility and enzymatic activity in brown trout Salmo trutta, burbot Lota lota and grayling Thymallus thymallus[J]. Journal of Fish Biology, 2012, 81(1): 197-209. DOI:10.1111/jfb.2012.81.issue-1 |
| [15] |
Morisawa M, Suzuki K, Morisawa S. Effects of potassium and osmolality on spermatozoan motility of salmonid fishes[J]. Journal of Experimental Biology, 1983, 107(11): 105-113. |
| [16] |
Cosson J, Groison A L, Fauvel C, et al. Description of hake (Merlucius merlucius) spermatozoa: flagellar wave characteristics and motility parameters in various situations[J]. Journal of Applied Ichthyology, 2010, 26(5): 644-652. DOI:10.1111/jai.2010.26.issue-5 |
| [17] |
Wada T, Takegaki T, Mori T, et al. Sperm displacement behavior of the cuttlefish Sepia esculenta (Cephalopoda: Sepiidae)[J]. Journal of Ethology, 2005, 23(2): 85-92. DOI:10.1007/s10164-005-0146-6 |
| [18] |
Wang L. Reproductive behavior and reproductive strategy of Sepia esculenta[D]. Qingdao: Ocean University of China, 2016: 38-41. [王亮.金乌贼繁殖行为和繁殖策略研究[D].青岛: 中国海洋大学, 2016: 38-41.]
|
| [19] |
Lahnsteiner F, Berger B, Weismann T, et al. Motility of spermatozoa of Alburnus alburnus (Cyprinidae) and its relationship to seminal plasma composition and sperm metabolism[J]. Fish Physiology and Biochemistry, 1996, 15(2): 167-179. DOI:10.1007/BF01875596 |
| [20] |
Wang Q, Zhao Y L, Chen L Q. Review of male nutrition reproduction and sperm metabolism, in the decapod crustacea[J]. Chinese Journal of Zoology, 2002, 37(5): 78-82. [王群, 赵云龙, 陈立侨. 虾蟹精子发育的营养及代谢研究概况[J]. 动物学杂志, 2002, 37(5): 78-82. DOI:10.3969/j.issn.0250-3263.2002.05.021] |
| [21] |
Adiyodi K G, Adiyodi R G. Reproductive Biology of Invertebrates. Vol.Ⅱ: Spermatogenesis and Sperm Function[M]. New York: Wiley, 1983: 692-718.
|
| [22] |
Jeyalectumie C, Subramoniam T. Biochemistry of seminal secretions of the crab Scylla serrata with reference to sperm metabolism and storage in the female[J]. Molecular Reproduction and Development, 1991, 30(1): 44-55. DOI:10.1002/(ISSN)1098-2795 |
| [23] |
Anilkumar G, Sudha K, Anitha E, et al. Aspects of sperm metabolism in the spermatheca of the brachyuran crab Metopograpsus messor (Forskal)[J]. Journal of Crustacean Biology, 1996, 16(2): 310-314. DOI:10.1163/193724096X00117 |
| [24] |
Lahnsteiner F, Caberlotto S. Motility of gilthead seabream Sparus aurata spermatozoa and its relation to temperature, energy metabolism and oxidative stress[J]. Aquaculture, 2012, 370. |
| [25] |
Hirohashi N, Tamura-Nakano M, Nakaya F, et al. Sneaker male squid produce long-lived spermatozoa by modulating their energy metabolism[J]. Journal of Biological Chemistry, 2016, 291(37): 19324-19334. DOI:10.1074/jbc.M116.737494 |
| [26] |
Ru X S, Gao T X, Liu S L, et al. Effects of temperature on digestive and metabolic enzymes activities of sea cucumber (Apostichopus japonicus) broodstock[J]. Marine Sciences, 2015, 39(3): 1-6. [茹小尚, 高天翔, 刘石林, 等. 温度对刺参繁殖期消化酶和代谢酶活力的影响[J]. 海洋科学, 2015, 39(3): 1-6.] |
| [27] |
Zheng D B, Pan L Q, Jin C X. The effect of dissolved oxygen on hemocyanin, osmolality and ion-transport enzyme activities of shrimp Litopenaeus vannamei[J]. Periodical of Ocean University of China, 2010, 40(11): 35-38. [郑德斌, 潘鲁青, 金彩霞. 溶解氧对凡纳滨对虾血淋巴血蓝蛋白、渗透压和鳃丝离子转运酶活力的影响[J]. 中国海洋大学学报(自然科学版), 2010, 40(11): 35-38.] |
| [28] |
Wang C L, Wu D H, Dong T Y, et al. Oxygen consumption rate and effects of hypoxia stress on enzyme activities of Sepiella japonica[J]. Chinese Journal of Applied Ecology, 2008, 19(11): 2420-2427. [王春琳, 吴丹华, 董天野, 等. 曼氏无针乌贼耗氧率及溶氧胁迫对其体内酶活力的影响[J]. 应用生态学报, 2008, 19(11): 2420-2427.] |
| [29] |
Islam M S, Akhter T. Tale of fish sperm and factors affecting sperm motility: a review[J]. Advances in Life Sciences, 2011, 1(1): 11-19. |
| [30] |
Lahnsteiner F. Spermatozoa of the teleost fish Perca fluviatilis (perch) have the ability to swim for more than two hours in saline solutions[J]. Aquaculture, 2011, 314(1-4): 221-224. DOI:10.1016/j.aquaculture.2011.02.024 |
| [31] |
Williot P, Kopeika E F, Goncharov B F. Influence of testis state, temperature and delay in semen collection on spermatozoa motility in the cultured siberian sturgeon (Acipenser baeri Brandt)[J]. Aquaculture, 2000, 189(1-2): 53-61. DOI:10.1016/S0044-8486(00)00358-6 |
| [32] |
Caldwell G S, Fitzer S, Gillespie C S, et al. Ocean acidification takes sperm back in time[J]. Invertebrate Reproduction & Development, 2011, 55(4): 217-221. |
| [33] |
Romagosa E, Souza B E, Sanches E A, et al. Sperm motility of Prochilodus lineatus in relation to dilution rate and temperature of the activating medium[J]. Journal of Applied Ichthyology, 2010, 26(5): 678-681. DOI:10.1111/jai.2010.26.issue-5 |
| [34] |
Mehlis M, Bakker T C M. The influence of ambient water temperature on sperm performance and fertilization success in three-spined sticklebacks (Gasterosteus aculeatus)[J]. Evolutionary Ecology, 2014, 28(4): 655-667. DOI:10.1007/s10682-014-9707-x |
| [35] |
Levitan D R. The importance of sperm limitation to the evolution of egg size in marine invertebrates[J]. The American Naturalist, 1993, 141(4): 517-536. DOI:10.1086/285489 |
| [36] |
Levitan D R. Sperm Limitation, Gamete Competition, and Sexual Selection in External Fertilizers[M]. San Diego: Academic Press, 1998: 173-215.
|
| [37] |
Krzyzosiak J, Molanb P, Vishwanatha R. Measurements of Bovine sperm velocities under true anaerobic and aerobic conditions[J]. Animal Reproduction Science, 1999, 55(3-4): 163-173. DOI:10.1016/S0378-4320(99)00016-0 |
| [38] |
Naud M, Havenhand J N. Sperm motility and longevity in the giant cuttlefish, Sepia apama (Mollusca: Cephalopoda)[J]. Marine Biology, 2006, 148(3): 559-566. DOI:10.1007/s00227-005-0109-z |
| [39] |
Austin C R, Lutwak-Mann C, Mann T. Spermatophores and spermatozoa of the squid Loligo pealii[J]. Proceedings of the Royal Society, 1964, 161(983): 143-152. |
 2019, Vol. 26
2019, Vol. 26

