2. 中山大学海洋学院, 广东 珠海 519082
2. School of Marine Sciences, Sun Yat-sen University, Zhuhai 519082, China
罗非鱼是全球范围内重要的水产养殖品种, 2016年全球罗非鱼养殖产量达626万t, 其中中国的产量为186万t, 是世界上罗非鱼养殖产量最高的国家, 约占世界总产量的29%[1]。随着全球罗非鱼养殖业的发展, 其病害问题日渐突出, 包括寄生虫、细菌[2]和病毒病原感染引起的疾病, 危害严重。已报道的引起罗非鱼病毒病的病原包括β-诺达病毒[3]、疱疹样病毒[4]、传染性脾肾坏死病毒(ISKNV)[5]、双RNA病毒(Birnaviruses)[6]、虹彩(样)病毒[7-8]、罗非鱼湖病毒等, 其中危害最为严重的是由罗非鱼湖病毒(tilapia lake virus, TiLV)感染引起的疾病, 可导致患病罗非鱼大量死亡。2009年以来, 以色列[9]、厄瓜多尔[10]、哥伦比亚[11]、埃及[12]、泰国[13-14]、马来西亚[15]等国家先后对罗非鱼湖病毒病进行了报道。此外, 在2015年, 本实验室在国内通过电镜观察到患病罗非鱼多个组织中存在大量30~40 nm的球形、无囊膜的病毒, 患病罗非鱼死亡率高达80%, 并通过人工感染和细胞培养实验证明了此病毒的感染性[16]。
鱼类细胞系是研究鱼类病毒学、生理学、毒理学、免疫学和分子遗传学的重要材料, 是一种重要的体外研究系统。截至2010年, 国内外已报道的鱼类细胞系约有275种[17]。然而, 迄今为止关于罗非鱼的细胞系没有报道, 罗非鱼病毒病的研究中使用的细胞系主要依赖于来源于石斑鱼的E-11细胞系、罗非鱼脑原代细胞等[9], 缺乏来源于罗非鱼的传代细胞系。罗非鱼病毒病的频频暴发及罗非鱼细胞系缺乏的现状表明建立来源于罗非鱼的细胞系迫在眉睫。因此, 本研究建立了来源于罗非鱼肾脏的细胞系, 旨在为罗非鱼病毒病原感染机理的研究及相关疫苗的开发和检测方法的建立等提供重要的实验材料, 从而推进罗非鱼病毒病防控技术的研究。
1 材料与方法 1.1 材料 1.1.1 实验鱼与病毒毒株健康罗非鱼(吉富罗非鱼, GIFT), 体重约200 g, 来自于珠海某罗非鱼养殖场。罗非鱼病毒由本实验室分离自湖北省荆门市某罗非鱼养殖场的患病罗非鱼[16]。
1.1.2 试剂与耗材L-15、RPMI 1640、M199、DMEM培养基、磷酸缓冲液(DPBS)、胰蛋白酶- EDTA (Trypsin-EDTA)、二甲基亚砜(DMSO)、秋水仙素、MS-222均购自Sigma公司; 胎牛血清(FBS)、非必需氨基酸(NEAA)、丙酮酸钠溶液、谷氨酰胺溶液、青霉素/链霉素、Opti-MEM减血清培养基购自Gibco公司; Lipofectamine 2000为Invitrogen公司产品; 生长因子bFGF购自Peprotech公司; 25 cm2和75 cm2细胞培养瓶、15 mL和50 mL离心管、移液管、细胞冻存管、24孔细胞培养板均为Corning公司产品; 程序降温盒购自Nalgene公司。
1.1.3 主要仪器设备Ⅱ级生物安全柜(ESCO); 倒置显微镜(Nikon); 正置显微镜(OLYMPUS), 成像CCD (OLYMPUS); 低速冷冻离心机(Sigma); 恒温培养箱(Sanyo); 液氮罐(MVE)。
1.2 方法 1.2.1 原代培养将健康罗非鱼使用30 mg/L的MS-222麻醉5 min后, 用70%酒精擦拭鱼体体表, 无菌条件下取其肾脏组织, 使用含有高浓度双抗的DPBS缓冲液(500 U/mL青霉素、500 μg/mL链霉素)清洗3次, 于含有高浓度双抗的DPBS缓冲液中, 将肾脏剪成1 mm3大小的组织块, 用0.5%胰酶和0.2% EDTA消化10 min后, 用含10% FBS的DMEM终止消化, 使用DPBS清洗2次、DMEM培养基清洗一次后将组织块移植到25 cm2的细胞培养瓶中(Corning, 美国), 均匀铺于培养瓶底面, 倒置平放, 贴壁过夜。次日添加3 mL含20%胎牛血清的DMEM培养基(含100 U/mL青霉素、100 μg/mL链霉素、10 ng/mL bFGF、1×丙酮酸钠、1×非必需氨基酸、1×谷氨酰胺)置于28℃培养箱进行原代培养, 随后逐日观察组织块细胞迁出状况, 每3天更换一半培养液。
1.2.2 传代培养当细胞从组织块中迁出单层达培养瓶底面积的80%时, 参照曾令兵等[18]的方法对细胞进行传代培养。当细胞传代至第5代后培养基中FBS的浓度降低到15%;当细胞传代至第10代后, 培养基中FBS的浓度降低到10%(不再添加生长因子等)。
1.2.3 细胞冻存与复苏细胞冻存:当传代培养的罗非鱼肾脏组织细胞生长至对数生长期时, 参照曾令兵等[18]的方法将细胞冻存。冻存的细胞置于盛有异丙醇的程序降温盒于‒80℃冰箱过夜后移入液氮罐中长期保存。
细胞复苏:从液氮罐中取出冻存6个月的细胞, 迅速置于37℃水浴中解冻, 将细胞悬液移入细胞培养瓶中, 添加5 mL含10% FBS的DMEM培养基, 于28℃培养过夜, 次日更换新鲜培养基。在细胞解冻后取少量细胞悬液于离心管中, 用台盼蓝染色, 显微镜下观察并计算细胞存活率。
1.2.4 最佳培养基选择4种培养基DMEM、L- 15、RPMI-1640、M199, 分别配制成含有15%FBS的完全培养基。将对数生长期的细胞传代并用DMEM培养基重悬, 调整细胞密度至5×104/mL接种到24孔板, 每孔1 mL, 置于28℃培养箱培养4 h至细胞贴壁后, 分别更换为含有15% FBS的DMEM、L-15、RPMI-1640、M199培养基。每天取3孔平行样品计数, 连续取样7天, 绘制其在不同培养基中的生长曲线。
1.2.5 最适培养温度将细胞按照1.2.4中的方法和密度接种至24孔板, 将细胞分别置于15℃、22℃、28℃、34℃的培养箱中, 每天取3孔平行样计数, 连续取样7 d, 绘制其在不同温度下的生长曲线。
1.2.6 最适血清浓度将细胞按照1.2.4中的方法和密度接种至24孔板, 置于28℃培养箱培养4 h至细胞贴壁后, 将培养基更换成分别含有5%、10%、15%、20% FBS的DMEM培养基, 每天取3孔平行样计数, 连续取样7 d, 绘制其在不同血清浓度下的生长曲线。
1.2.7 细胞群体倍增时间将细胞按照1.2.4中的方法和密度接种至24孔板, 置于28℃培养箱培养。每12 h取3孔平行样计数, 连续取样7 d, 绘制其生长曲线, 并根据公式T=t×lg2/lg(Nt/N0)计算细胞的群体倍增时间。
1.2.8 细胞染色体分析取32代的细胞, 传代培养24 h后, 更换新鲜的培养基, 并加入终浓度为1 μg/mL的秋水仙素, 28℃培养过夜, 胰酶消化后离心收集细胞, DPBS清洗细胞后, 参照Wang等[19]的方法经过低渗、固定、制片、晾干、吉姆萨染色, 制备染色体片, 在100倍油镜下观察染色体, 并随机选取100个中期细胞分裂相的视野, 统计其染色体数目。
1.2.9 病毒敏感性取患病罗非鱼的心脏、脾脏、肾脏, 加入10倍体积的DPBS, 于冰上研磨, 研磨彻底后将含有病毒的组织匀浆液于‒80℃至室温冻融2次, 5000 r/min、4℃离心30 min, 将上清用0.22 μm的滤器过滤除菌制备病毒组织滤液。
罗非鱼肾脏细胞形成单层后, 弃培养液, 加入1 mL病毒组织滤液, 28℃吸附2 h, 期间每间隔20 min轻微晃动培养瓶使病毒均匀吸附。吸附结束后, 弃去病毒液, 并使用无血清的DMEM培养基清洗1次, 随后添加5 mL含2% FBS的DMEM培养基, 28℃培养。同时设置PBS处理组为阴性空白对照细胞。显微镜下逐日观察并记录细胞病变情况, 待细胞病变效应(CPE)达到70%左右时, 收集细胞毒。将含有细胞毒的细胞瓶于‒80℃至室温反复冻融两次, 以使细胞破裂、病毒释放。5000 r/min、4℃离心30 min, 收集上清, 此为第一代细胞毒。按照上述方法将细胞毒继续感染细胞得到在罗非鱼肾脏细胞上传代的罗非鱼细胞毒。并将收集的病毒提取病毒DNA, 根据病毒的序列设计引物(数据未发表, 本文未列出)进行PCR扩增, 预期扩增产物大小为528 bp。PCR扩增条件为:
病毒基因组DNA: 2 μL, 10×PCR buffer: 2.5 μL, dNTPs: 1 μL, 上下游引物(10 μmol/L)各0.5 μL, rTaq: 0.25 μL, 补水至终体积25 μL。将PCR反应体系混匀后进行PCR扩增, 扩增条件为:首先95℃预变性5 min; 然后95℃ 1 min、57℃ 1 min、72℃ 1 min, 35次循环; 再72℃终延伸10 min; 最后4℃保存。反应结束后, 取10 μL PCR产物用1%琼脂糖凝胶(含0.5 μg/mL EB)进行电泳检测。
1.2.10 实验数据分析实验数据通过Excel处理, 用平均值±标准差(x±SD)表示, 利用SPSS 20进行生物学统计分析, 采用“一般线性模型—重复度量”方法对各项指标进行差异显著性检验, 且P < 0.05为差异显著。
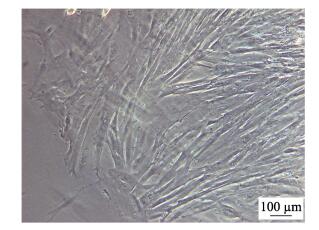
2 结果与分析 2.1 原代培养罗非鱼肾脏组织块接种到25 cm2细胞瓶后2 d肾脏组织周围开始迁出细胞, 细胞呈纤维状(图 1), 7 d左右细胞可形成单层, 约占瓶底面积的80 %。细胞初次传代后, 约5 d能长满单层。传代至第7代以后细胞生长速度加快, 2~3 d即可进行传代。
|
图 1 原代培养第4天的TiK细胞 Fig.1 Primary culture of TiK cells on the 4th day |
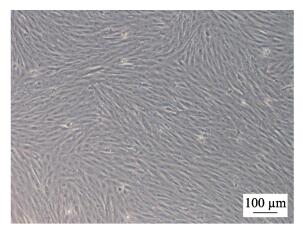
罗非鱼肾脏组织细胞传代后贴壁良好, 3 d左右可形成单层。待传代至第10代后, 更换为含10% FBS的DMEM培养基, 细胞依然生长良好。目前罗非鱼肾脏细胞已传至50多代, 细胞形态和生长稳定, 定名为TiK细胞系(图 2)。
|
图 2 传代培养的第55代罗非鱼肾脏细胞 Fig.2 Subculture of TiK cells of the 55th passage |
TiK细胞在液氮中冻存6个月后复苏, 台盼蓝染色后计数, 经统计细胞存活率约为(89.84± 3.48)%。复苏的细胞贴壁生长后, 细胞形态无明显变化, 生长状态良好, 可见TiK细胞可在液氮中长期保存。
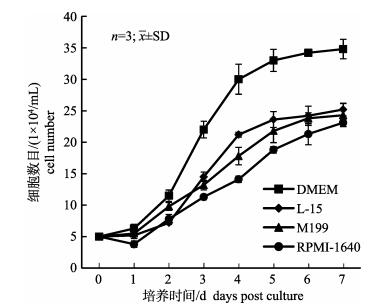
2.4 最佳培养基TiK细胞在DMEM、L-15、RPMI-1640、M199四种培养基中均有生长, 在DMEM培养基中增殖速度最快, 最适合于TiK细胞的生长。如图 3所示, TiK细胞在四种培养基中生长趋势相近, 均在第5天达到较高的细胞浓度, 第6天虽然仍有所增长, 但是生长速度明显变缓, 细胞在M199、RPMI-1640和L-15培养基中达到的细胞峰值较低, 其峰值约为2.5×105/mL, 而在DMEM培养基中的细胞峰值最高, 可达3.5×105/mL。细胞在DMEM培养基中生长速度最快, 达到的细胞峰值最高。因此, DMEM为TiK细胞生长的最佳培养基。
|
图 3 TiK细胞在不同培养基中的生长情况比较 Fig.3 Growth curve of TiK cells cultured at different media |
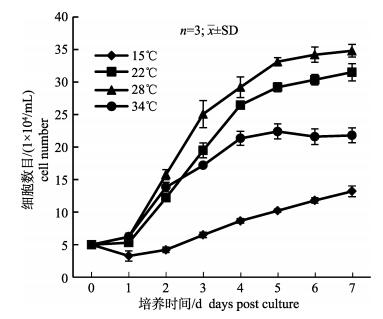
使用含有15% FBS的DMEM培养基, 在15℃、22℃、28℃、34℃四个不同温度下培养, 细胞的生长情况如图 4所示。在15℃培养温度下, 细胞增殖缓慢; 在34℃培养温度下, 细胞在前2 d生长较为迅速, 随后生长速度变慢, 进而进入稳定期, 最终细胞浓度约为2.2×105/mL; 在22℃培养温度下, 培养第1天细胞数目无明显变化, 第2天进入对数生长期, 5 d后呈缓慢增殖, 最终达到的细胞浓度约为3.1×105/mL; 在28℃培养温度下, 培养第1天细胞数量就有所增长, 在培养第5天达到峰值, 细胞浓度约为3.5×105/mL, 高于其他培养温度下达到的峰值。因此, 28℃为TiK细胞的最适培养温度。
|
图 4 TiK细胞在不同温度下的生长比较 Fig.4 Growth curve of TiK cells at different temperatures |
将TiK细胞中分别添加5%、10%、15%、20% FBS的DMEM培养液, 置于28℃恒温培养, 细胞的生长状况如图 5所示。细胞在5%血清浓度下生长缓慢, 在10%、15%、20%血清浓度下细胞生长趋势相近, 均在培养第5天达到最大值, 其中15%、20%血清浓度的细胞峰值较为接近, 约为3.5×105/mL, 10%血清浓度的细胞峰值略低, 约为3.0×105/mL。细胞在15%、20%血清浓度下, 生长状况较为接近, 且数据没有显著性差异, 因此, 从节约培养成本而言, 选择15%血清浓度更为合适。
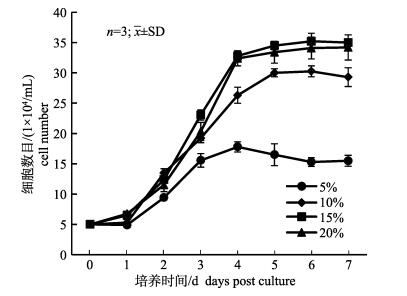
|
图 5 TiK细胞在不同血清浓度中的生长比较 Fig.5 Growth curve of TiK cells at different concentrations of fetal bovine |
第41代的TiK细胞群体倍增时间如图 6所示。TiK细胞经过1 d的生长迟缓期后进入对数期, 对数期持续时间为2~5 d, 5 d后细胞增殖速度明显变缓, 进入稳定期。选取细胞在对数生长期的一段时间, 通过公式T=t×lg2/lg(Nt /N0)计算细胞的群体倍增时间, 其中Nt为t时间的细胞数, N0为接种细胞数。计算结果显示, 第41代TiK细胞的群体倍增时间为45.8 h。
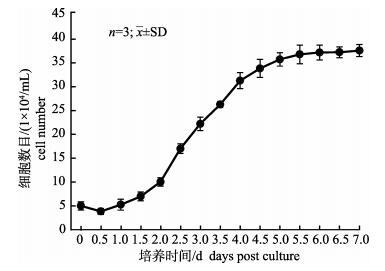
|
图 6 TiK细胞的群体倍增时间 Fig.6 Growth curve of TiK cells at the 41th passage |
TiK细胞染色体分析结果显示, 第32代TiK细胞染色体数目分布在20~66之间, 染色体众数为48, 出现频率为39%, 与已报道[20]的罗非鱼染色体数目2n=44有差异, 表明第32代的TiK细胞的染色体数目已经发生变化。
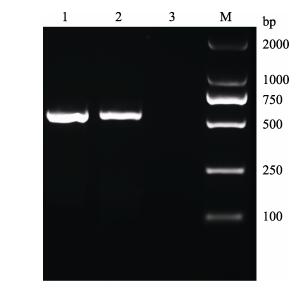
2.9 病毒敏感性用罗非鱼病毒组织滤液感染TiK细胞, 感染后第3天细胞开始收缩、变圆。感染后第6天, 出现细胞脱落、单层细胞呈“破渔网状”的典型细胞病变效应(CPE)(图 9A), 而对照细胞生长良好(图 9B)。表明TiK细胞对罗非鱼病毒敏感, 此病毒可在TiK细胞上增殖。收获细胞毒后继续在TiK细胞上传代, 第2代细胞毒感染TiK细胞后依然能引起明显的细胞病变。细胞培养的病毒通过PCR扩增出528 bp大小的条带(图 10), 与预期结果相一致, 将PCR产物测序, 测序结果与病毒序列相符。

|
图 7 第32代TiK细胞染色体 Fig.7 Chromosomes of TiK cells at the 32th passage |
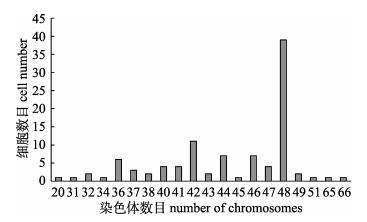
|
图 8 第32代TiK细胞染色体数目分布 Fig.8 Chromosome number distribution of TiK cells at the 32th passage |
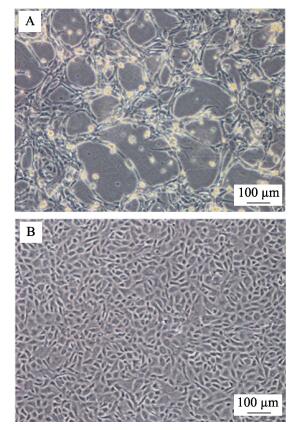
|
图 9 罗非鱼病毒感染TiK细胞出现典型细胞病变效应 A:病毒感染的TiK细胞; B:对照细胞. Fig.9 Cytopathic effect of TiK cells infected with tilapia virus A: virus infected TiK cells; B: control cells. |
|
图 10 罗非鱼病毒PCR检测结果. M: DL2000分子量标准; 1:罗非鱼病毒扩增产物; 2:阳性对照; 3:阴性对照. Fig.10 The PCR amplified result of TiK cell line cultured tilapia virus M: DL2000 DNA marker; 1: PCR products of tilapia virus; 2: positive control; 3: negative control. |
罗非鱼作为全球范围内重要的水产养殖品种, 近年来病毒病频发, 然而, 至今为止罗非鱼来源的稳定细胞系尚未报道。本研究采用组织块移植并结合胰酶消化结合的方法建立了罗非鱼肾脏细胞。其中, 通过胰酶消化去除细胞间质有利于细胞从组织块中迅速迁出, 已报道的研究中采用此方法成功建立了青石斑鱼(Epinephelus awoara)的眼、鳍、心、鳔[21]以及斜带石斑鱼(Epinephelus coioides)脾[22]组织来源的细胞系。
目前商品化的培养基中已添加了维持细胞生长所必需的成分, 但进行细胞原代培养时仍需要加入一些对细胞生长、增殖有促进作用的添加物。有研究表明, bFGF可以有效促进斑马鱼胚胎细胞的有丝分裂[23], 并且已经广泛用于原代细胞培养。谷氨酰胺作为细胞核酸和蛋白质合成必需的氨基酸, 已在多种哺乳动物细胞[24-26]中被证实会促进细胞的增殖; 同时, 谷氨酰胺可有效地修复鲤肠上皮细胞受到的氧化损伤[27]。丙酮酸钠是细胞生长过程中除d-葡萄糖以外的碳源, 有研究中发现培养基中补充丙酮酸钠有利于细胞增殖及细胞良好状态的维持[28]。王娓娓等[29]的研究表明在培养基中补充非必需氨基酸能够促进小鼠神经干细胞的增殖。本研究中通过向原代培养基中补充bFGF、谷氨酰胺、丙酮酸钠、非必需氨基酸成功建立了罗非鱼肾脏细胞系, 并且细胞迁出后生长迅速, 在组织块移植后一周内即形成单层。目前, TiK细胞已传至50多代, 细胞呈成纤维样, 与研究中其他肾脏来源的细胞形态相似[30-31]。TiK细胞在不同温度下的生长曲线表明, 细胞在15~34℃均能生长, 但在28℃生长最为迅速, 这也与已报道的其他鱼类细胞系具有较为广泛的生长温度相似[32-33]。
染色体分析显示第32代TiK染色体数目分布在20~66之间, 染色体众数为48, 出现频率为39%, 与已报道[20]的罗非鱼染色体数目2n=44有差异, 表明TiK细胞的染色体已经出现断裂或畸变; 且染色体数目小于(或等于)48的占绝大多数(95%), 其分布并不均匀。目前已报道的细胞系如赤点石斑鱼肾脏细胞[34]和斑点叉尾鮰肾脏细胞[18]其30多代的染色体数目也发生变异, 而同样为30多代的圆斑星鲽肾脏细胞系[30]和黑鲈肾脏细胞[35]其染色体数目与相应的其相应的二倍体染色体数目一致, 关于细胞染色体数目发生变异的具体机制还有待于进一步研究。
罗非鱼湖病毒现已经在全球多地相继暴发, Kembou Tsofack等[11]建立了罗非鱼湖病毒巢式RT-PCR检测方法。本实验室对湖北荆门患病罗非鱼采用Kembou Tsofack等[11]建立的巢式PCR方法进行检测, 未检测到罗非鱼湖病毒, 但利用电子显微镜技术在患病鱼多种组织中观察到大量病毒颗粒[16], 将含有病毒颗粒的罗非鱼组织样品匀浆后接种TiK细胞能够引起细胞病变效应(CPE), PCR检测结果与预期一致, 表明此病毒可以在TiK细胞上增殖。对于罗非鱼湖病毒是否可在TiK细胞系上增殖, 有待于获取病毒样品后的进一步研究。
本研究成功建立了罗非鱼肾脏细胞系, 并且发现由本实验室分离鉴定的罗非鱼病毒可在此细胞系上引起典型的细胞病变效应(CPE), 不仅丰富了鱼类细胞资源, 而且为进一步研究罗非鱼病毒感染机理以及疾病防控技术提供了重要实验材料。
| [1] |
Fishery Bureau of Ministry of Agriculture. China Fishery Statistics Yearbook[M]. Beijing: China Agriculture Press, 2017: 25. [农业部渔业局编制. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2017: 25.]
|
| [2] |
Lusiastuti A M, Textor M, Seeger H, et al. The occurrence of Streptococcus agalactiae sequence type 261 from fish disease outbreaks of tilapia Oreochromis niloticus in Indonesia[J]. Aquaculture Research, 2014, 45(7): 1260-1263. DOI:10.1111/are.2014.45.issue-7 |
| [3] |
Bigarré L, Cabon J, Baud M, et al. Outbreak of betanodavirus infection in tilapia, Oreochromis niloticus (L), in fresh water[J]. Journal of Fish Disease, 2009, 32(8): 667-673. DOI:10.1111/jfd.2009.32.issue-8 |
| [4] |
Shlapobersky M, Sinyakov M S, Katzenellenbogen M, et al. Viral encephalitis of tilapia larvae: Primary characterization of a novel herpes-like virus[J]. Virology, 2010, 399(2): 239-247. |
| [5] |
Suebsing R, Pradeep P J, Jitrakorn S, et al. Detection of natural infection of infectious spleen and kidney necrosis virus (ISKNV) in farmed tilapia by hydroxynapthol blue-loop- mediated isothermal amplification (blue-LAMP) assay[J]. Journal of Applied Microbiology, 2016, 121(1): 55-67. |
| [6] |
Hedrick R P, Fryer J L, Chen S N, et al. Characteristics of four birnaviruses isolated from fish in Taiwan[J]. Fish Pathology, 1983, 18(2): 91-97. DOI:10.3147/jsfp.18.91 |
| [7] |
Ariel E, Owens L. Epizootic mortalities in tilapia Oreochromis mossambicus[J]. Diseases of Aquatic Organisms, 1997, 29(1): 1-6. |
| [8] |
McGrogan D G, Ostland V E, Byrne P J, et al. Systemic disease involving an iridovirus-like agent in cultured tilapia, Oreochromis niloticus L. -a case report[J]. Journal of Fish Diseases, 2010, 21(2): 149-152. |
| [9] |
Eyngor M, Zamostiano R, Kembou Tsofack J E, et al. Identification of a novel RNA virus, lethal to tilapia[J]. Journal of Clinical Microbiology, 2014, 52(12): 4137-4146. DOI:10.1128/JCM.00827-14 |
| [10] |
Ferguson H W, Kabuusu R, Beltran S, et al. Syncytial hepatitis of farmed tilapia, Oreochromis niloticus (L.): a case report[J]. Journal of Fish Diseases, 2014, 37(6): 583-589. DOI:10.1111/jfd.2014.37.issue-6 |
| [11] |
Kembou Tsofack J E, Zamostiano R, Watted S, et al. Detection of tilapia lake virus in clinical samples by culturing and nested reverse transcription-PCR[J]. Journal of Clinical Microbiology, 2017, 55(3): 759-767. |
| [12] |
Fathi M, Dickson C, Dickson M, et al. Identification of Tilapia Lake Virus in Egypt in Nile tilapia affected by 'summer mortality' syndrome[J]. Aquaculture, 2017, 473: 430-432. DOI:10.1016/j.aquaculture.2017.03.014 |
| [13] |
Surachetpong W, Janetanakit T, Nonthabenjawan N, et al. Outbreaks of Tilapia Lake Virus infection, Thailand, 2015- 2016[J]. Emerging Infectious Diseases, 2017, 23(6): 1031-1033. DOI:10.3201/eid2306.161278 |
| [14] |
Dong H T, Ataguba G A, Khunrae P, et al. Evidence of TiLV infection in tilapia hatcheries in Thailand from 2012 to 2017 reveals probable global spread of the disease[J]. Aquaculture, 2017, 479: 579-583. DOI:10.1016/j.aquaculture.2017.06.035 |
| [15] |
Amal M N A, Koh C B, Nurliyana M, et al. A case of natural co-infection of Tilapia Lake Virus and Aeromonas veronii in a Malaysian red hybrid tilapia (Oreochromis niloticus × O. mossambicus) farm experiencing high mortality[J]. Aquaculture, 2018, 485: 12-16. DOI:10.1016/j.aquaculture.2017.11.019 |
| [16] |
Ma J, Jiang N, Liu W Z, et al. Preliminary observation of a viral agent by electron microscopy associated with an epizootic mortality in farmed tilapia[J]. Freshwater Fisheries, 2015, 45(6): 94-96. [马杰, 江南, 刘文枝, 等. 罗非鱼暴发性流行病病毒病原的电镜观察初报[J]. 淡水渔业, 2015, 45(6): 94-96. DOI:10.3969/j.issn.1000-6907.2015.06.017] |
| [17] |
Zhang B, Chen S L. Decades of researching progresses of fish cell culture and its application prospects[J]. Marine Sciences, 2011, 35(7): 113-121. [张博, 陈松林. 近10年鱼类细胞培养研究进展及应用展望[J]. 海洋科学, 2011, 35(7): 113-121.] |
| [18] |
Zeng L B, Li X L, Zhang L, et al. Establishment and characterization of a cell line derived from kidney of channel catfish, Ictaluris punctatus[J]. Journal of Fishery Sciences of China, 2009, 16(1): 75-81. [曾令兵, 李晓莉, 张林, 等. 斑点叉尾鮰肾脏组织细胞系的建立及其生物学特性[J]. 中国水产科学, 2009, 16(1): 75-81. DOI:10.3321/j.issn:1005-8737.2009.01.011] |
| [19] |
Wang G T, Lapatra S, Zeng L B, et al. Establishment, growth, cryopreservation and species of origin identification of three cell lines from white sturgeon, Acipenser transmontanus[J]. Methods in Cell Science, 2004, 25(3-4): 211-220. DOI:10.1007/s11022-004-9120-x |
| [20] |
Chen M R, Chen H X. A comparative study of karyotypes in three tilapia fishers[J]. Acta Genetica Sinica, 1983, 10(1): 56-63. [陈敏容, 陈宏溪. 三种罗非鱼染色体组型的比较研究[J]. 遗传学报, 1983, 10(1): 56-63.] |
| [21] |
Lai Y S, John J A, Lin C H, et al. Establishment of cell lines from a tropical grouper, Epinephelus awoara (Temminck & Schlegel), and their susceptibility to grouper irido- and nodaviruses[J]. Journal of Fish Diseases, 2003, 26(1): 31-42. DOI:10.1046/j.1365-2761.2003.00434.x |
| [22] |
Qin Q W, Wu T H, Jia T L, et al. Development and characterization of a new tropical marine fish cell line from grouper, Epinephelus coioides susceptible to iridovirus and nodavirus[J]. Journal of Virological Methods, 2006, 131(1): 58-64. DOI:10.1016/j.jviromet.2005.07.009 |
| [23] |
Bradford C S, Sun L, Barnes D W. Basic fibroblast growth factor stimulates proliferation and suppresses melanogenesis in cell cultures derived from early zebrafish embryos[J]. Molecular Marine Biology & Biotechnology, 1994, 3(2): 78-86. |
| [24] |
Follmar K E, Decroos F C, Prichard H L, et al. Effects of glutamine, glucose, and oxygen concentration on the metabolism and proliferation of rabbit adipose-derived stem cells[J]. Tissue Engineering, 2006, 12(12): 3525-3533. DOI:10.1089/ten.2006.12.3525 |
| [25] |
Kim D S, Jue S S, Lee S Y, et al. Effects of glutamine on proliferation, migration, and differentiation of human dental pulp cells[J]. Journal of Endodontics, 2014, 40(8): 1087-1094. DOI:10.1016/j.joen.2013.11.023 |
| [26] |
Kim B, Li J, Jang C, et al. Glutamine fuels proliferation but not migration of endothelial cells[J]. The EMBO Journal, 2017, 36(16): 2321-2333. DOI:10.15252/embj.201796436 |
| [27] |
Kai H, Feng L, Jiang W D, et al. Oxidative damage repair by glutamine in fish enterocytes[J]. Fish Physiology and Biochemistry, 2014, 40(5): 1437-1445. DOI:10.1007/s10695-014-9938-3 |
| [28] |
Wang S T, Wang S H, Dong X, et al. Improve the success rate of cell culture in vitro[J]. Journal of Dalian University, 2000, 21(6): 93-94. [王淑婷, 王松华, 董翔, 等. 提高体外细胞培养的成功率[J]. 大连大学学报, 2000, 21(6): 93-94.] |
| [29] |
Wang W W, Bao T H, Zhang H M, et al. Effects of non-essential amino acids and β-mercaptoethanol on proliferation of neural stem cells[J]. Shandong Medical Journal, 2016, 56(1): 21-23. [王娓娓, 鲍天昊, 张红苗, 等. 非必需氨基酸和β-巯基乙醇对神经干细胞增殖的影响[J]. 山东医药, 2016, 56(1): 21-23. DOI:10.3969/j.issn.1002-266X.2016.01.007] |
| [30] |
Wang X L, Chen S L, Sha Z X, et al. Establishment and characterization of a new cell line from the kidney of spotted halibut Verasper variegates[J]. Journal of Ocean University of China, 2010, 9(2): 162-168. DOI:10.1007/s11802-010-0162-1 |
| [31] |
Wang N, Wang X L, Sha Z X, et al. Establishment, characterization and virus susceptibility of a kidney-derived cell line from southern flounder, Paralichthys lethostigma Jordan & Gilbert[J]. Journal of Fish Diseases, 2011, 34(1): 81-85. DOI:10.1111/jfd.2010.34.issue-1 |
| [32] |
Zuo W G, Qian H X, Xu Y F, et al. A cell line derived from the kidney of grass carp (Ctenopharyngodon Idellus)[J]. Journal of Fisheries of China, 1986, 10(1): 11-17. [左文功, 钱华鑫, 许映芳, 等. 草鱼肾组织细胞系CIK的建立及其生物学特性[J]. 水产学报, 1986, 10(1): 11-17.] |
| [33] |
Lai Y S, Murali S, Ju H Y, et al. Two iridovirus-susceptible cell lines established from kidney and liver of grouper, Epinephelus awoara (Temminck & Schlegel), and partial characterization of grouper iridovirus[J]. Journal of Fish Diseases, 2000, 23(6): 379-388. DOI:10.1046/j.1365-2761.2000.00247.x |
| [34] |
Gong J, Huang Y, Huang X, et al. Establishment and characterization of a new cell line derived from kidney of grouper, Epinephelus akaara, (Temminck & Schlegel), susceptible to Singapore grouper iridovirus (SGIV)[J]. Journal of Fish Diseases, 2011, 34(9): 677-686. DOI:10.1111/jfd.2011.34.issue-9 |
| [35] |
Hameed A S S, Parameswaran V, Shukla R, et al. Establishment and characterization of India's first marine fish cell line (SISK) from the kidney of sea bass (Lates calcarifer)[J]. Aquaculture, 2006, 257(1-4): 92-103. DOI:10.1016/j.aquaculture.2006.01.011 |
 2019, Vol. 26
2019, Vol. 26

