2. 广东雅琪生物科技股份有限公司, 广东 广州 510000;
3. 厦门阳嘉环保科技有限公司, 福建 厦门 361021
2. Guangdong Atech Biotechnology Limited Corporation, Guangzhou 510000, China;
3. Xiamen Yangjia Environmental Science and Technology Limited Company, Xiamen 361021, China
溶藻弧菌(Vibrio alginolyticus)是一种条件致病菌, 其数量居海洋弧菌之首, 是弧菌中危害最大的病原菌之一[1-3]。它主要通过食物和水传播, 是一种人和水生动物共患病原菌[4]。它不仅对水产养殖业造成巨大的经济损失, 对公共安全也构成了严重的威胁[5-6]。近年来由溶藻弧菌引起的人类腹泻和食物中毒屡见报道, 因此, 世界各国食品卫生法规中均将溶藻弧菌列入法定检测项目[7-8]。然而, 由于弧菌种类多、变异快、基因相似度也很高, 不同弧菌引发的早期临床症状非常相似, 因此, 传统的一些检测方法对溶藻弧菌的检测鉴定效果并不理想[9-10]。
适配体是利用SELEX (systematic evolution of ligands by exponential enrichment)技术, 即指数富集配体的系统进化技术, 筛选出的对靶目标具有较高亲和特异性的寡核苷酸分子[11-13]。其识别能力达到、甚至超过了抗体的识别水平, 而制备技术则比抗体简单、快速[14-15]。因此, 有关适配体的应用检测研究目前已有不少报道。但不少检测方法都是先对寡核苷酸适配体进行标记后, 再对相关标记进行检测[16-17]。由于标记基团的引入会导致核酸适配体空间结构的改变, 因此其检测效果受相关标记的影响较大, 同时, 对核酸适配体进行标记也大大增加了检测成本, 使其应用受到限制。
本文研究建立了一种基于核酸适配体的无需标记的检测技术, 该技术将适配体的高亲和特异性与PCR的高灵敏性相结合, 通过适配体的特异结合锁定靶目标, 再利用PCR技术对适配体进行扩增, 放大适配体的识别信号, 最后通过电泳来检测这些放大的信号, 从而实现对靶目标——溶藻弧菌的快速检测。
1 材料与方法 1.1 菌种及其灭活处理溶藻弧菌(Vibrio alginolyticus)、哈维氏弧菌(Vibrio harveryi)、嗜水气单胞菌(Aeromonas hydrophila)、迟钝爱德华氏菌(Edwardsiella tarda)由集美大学病原生物实验室提供。
灭活菌的制备:取活菌菌液于离心管中, 6000 r/min离心5 min, 弃上清, 再加入含6%甲醛的生理盐水于62.5℃水浴1 h, 离心后生理盐水洗涤3次, 再用2×结合缓冲液(pH 7.4, 含0.1 mol/L NaCl, 5 mmol/L KCl, 50 mmol/L Tris-HCl, 1 mmol/L MgCl2)悬浮菌沉淀, 然后将灭活菌稀释至相应浓度备用。
1.2 适配体及其筛选产物和引物适配体筛选产物是前期以灭活溶藻弧菌为靶目标, 经过15轮SELEX筛选获得的PCR产物, 它是多种核酸适配体的混合物, 其中的适配体长度为66~107个单链寡核苷酸序列[18]。本研究采用的核酸适配体是对上述适配体筛选产物进行克隆测序和验证后获得的一条寡核苷酸序列(82nt)[18], 其序列为: 5'-TCAGTCGCTTCGCCGTCTCCTTCTGCAGGGCCAGAACAGGGGGAAGGCACAAGAGGGAGCACAAGAGGGAGACCCCAGAGGG-3', 两端带下划线的是与引物结合的固定序列。
引物P1: 5'-TCAGTCGCTTCGCCGTCTCCT TC-3'
引物P2: 5'-CCCTCTGGGGTCTCCCTCTTG TGC-3'
适配体和引物序列均由上海生工生物公司合成。PCR中的DreamTaq DNA聚合酶购自Fermentas公司, dNTP购自Generay Biotech公司, DNA marker购自天根生化科技有限公司, 琼脂糖购自厦门太阳马生物工程有限公司。
1.3 适配体或适配体筛选产物对水体中溶藻弧菌的识别检测结合:取浓度为10 μmol/L适配体5 μL或取适配体筛选产物5 μL, 用2×结合缓冲液稀释至100 μL, 95℃变性5 min, 冰浴10 min后, 分别加入待测样品100 μL或不同浓度的菌悬液100 μL中, 于转速100 r/min摇床中结合30 min。同时做一空白, 即用5 μL ddH2O代替适配体, 重复上述过程。
洗涤:结合完毕以后, 6000 r/min离心5 min, 弃上清, 沉淀部分为菌沉淀及其结合的适配体, 然后洗涤菌沉淀6次。每次洗涤, 菌沉淀加入1×结合缓冲液500 μL, 充分混匀后, 将菌悬液转移到新的离心管中, 以除去与管壁有亲和力的适配体, 然后离心、弃上清、取菌沉淀。
分离:沉淀中加入1×结合缓冲液100 μL, 95℃加热5 min, 使那些与菌结合的适配体变性, 空间结构改变, 从而与弧菌分离, 然后15000 r/min离心10 min, 取上清液, 则可分离到能与菌结合的适配体, 然后每管20 μL分装至200 μL的PCR管中, 保存在‒20℃备用。
PCR扩增:以分离出的上清液(内含与菌结合的适配体)为模版, 进行PCR扩增, PCR反应体系为:总体积25 μL, 其中模板2 μL, DreamTaq DNA聚合酶(5 U/μL) 0.2 μL, 引物P1 (10 μmol/L)1 μL, 引物P2 (10 μmol/L)1 μL, dNTP (10 mmol/L) 0.4 μL, 10×PCR缓冲液2 μL, ddH2O补充体积至25 μL。PCR扩增条件为: 94℃预变性4 min, 然后进行35个循环(94℃变性30 s, 58℃退火30 s, 72℃延伸20 s), 最后72℃延伸7 min。
电泳检测:取PCR产物5 μL, 用2.5%琼脂糖电泳进行检测拍照。
1.4 适配体对鱼血清中溶藻弧菌的识别检测感染实验:将溶藻弧菌接种于TSB液体培养基中, 于30℃下100 r/min摇床培养6~8 h后, 用无菌生理盐水洗涤2次后重悬, 测定菌浓度, 再用无菌生理盐水将菌浓度稀释为5.0×106 cfu/mL。设计2个平行实验组和1个阴性对照组, 选择250 g左右的罗非鱼为实验用鱼(购于集美菜市场), 每组2尾鱼, 进行人工感染。对实验组每尾鱼静脉注射0.1 mL的溶藻弧菌的菌悬液, 给对照组每尾鱼注射0.1 mL无菌生理盐水, 连续饲养2 d。
取血:分别选取被溶藻弧菌感染的鱼和未感染的鱼进行取血。先用1%肝素钠浸润注射器和离心管, 然后用无菌注射器抽取鱼血2 mL, 离心后, 吸取血清备用。
结合:取浓度为10 μmol/L适配体5 μL, 用2×结合缓冲液稀释至100 μL, 95℃变性5 min, 冰浴10 min后, 分别加入浓度103 cfu/mL的灭活菌悬液(阳性对照)、未感染的血清(阴性对照或空白)和被感染的待测血清各100 μL, 于转速100 r/min摇床结合30 min。
后续按照与1.3相同的方法进行洗涤、分离、PCR扩增和电泳检测。
2 结果与分析 2.1 适配体筛选产物对水体中溶藻弧菌的识别检测利用适配体筛选产物分别对活菌与灭活菌, 混合菌与单一菌的样品进行了检测, 结果发现, 对于嗜水气单胞菌、哈唯氏弧菌和迟钝爱德华菌, 不管是活菌还是灭活菌, 检测电泳图中均未显现出较明亮的条带(如图 1的泳道1~6), 说明适配体筛选产物对这三种菌的亲和力都较低。对于灭活的溶藻弧菌, 适配体筛选产物可检测出102 cfu/mL、103 cfu/mL的浓度(如图 1的泳道8、9), 但浓度为103 cfu/mL的检测效果较好; 而对于正常培养的活的溶藻弧菌, 适配体筛选产物可检测出103 cfu/mL的浓度(如图 1的泳道12), 说明适配体筛选产物不仅对灭活的溶藻弧菌有较好的亲和特异性, 对活的溶藻弧菌也有一定的识别作用。对于混合菌样品, 适配体筛选产物的识别效果与前面的也类似, 对灭活溶藻弧菌可检测出102 cfu/mL、103 cfu/mL的浓度(如图 1的泳道15、16), 但对菌浓度在103 cfu/mL以上的识别效果较好, 这表明即使有其他杂菌的干扰, 适配体筛选产物对灭活溶藻弧菌依然有较好的识别效果。
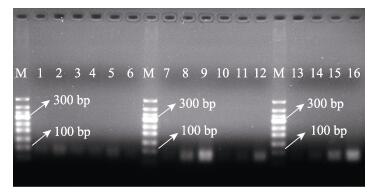
|
图 1 适配体筛选产物对溶藻弧菌的检测 M: marker; 1、2、3:适配体筛选产物对三种灭活菌(嗜水气单胞菌、哈唯氏弧菌和迟钝爱德华菌)的检测结果; 4、5、6:适配体筛选产物对三种活菌(嗜水气单胞菌、哈唯氏弧菌和迟钝爱德华菌)的检测结果, 三种菌的浓度依次为1.7×104 cfu/mL、6.6×103 cfu/mL、1.3×104 cfu/mL; 7、8、9:适配体筛选产物对三个浓度梯度(10 cfu/mL、102 cfu/mL、103 cfu/mL)的灭活溶藻弧菌的检测结果; 10、11、12:适配体筛选产物对三个浓度梯度(10 cfu/mL、102 cfu/mL、103 cfu/mL)的活的溶藻弧菌的检测结果; 13~16:适配体筛选产物对灭活混合菌(溶藻弧菌、嗜水气单胞菌、哈唯氏弧菌菌和迟钝爱德华菌的混合菌液)中的溶藻弧菌的检测结果, 混合菌中灭活溶藻弧菌的浓度依次为0 cfu/mL、10 cfu/mL、102 cfu/mL和103 cfu/mL, 其他3种菌浓度均为104 cfu/mL. Fig.1 Detection of Vibrio alginolyticus by the SELEX product M: marker; 1, 2, 3: the detections of 1.7×104 cfu/mL inactivated A. hydrophila, 6.6×103 cfu/mL inactivated V. harveryi, and 1.3×104 cfu/mL inactivated E. tarda respectively; 4, 5, 6: the detections of 1.7×104 cfu/mL live A. hydrophila, 6.6×103 cfu/mL live V. harveryi, and 1.3×104 cfu/mL live E. tarda respectively; 7, 8, 9: the detections of inactivated V. alginolyticus at the concentration of 10 cfu/mL, 102 cfu/mL, 103 cfu/mL respectively; 10, 11, 12: the detections of live V. alginolyticus at the concentration of 10 cfu/mL, 102 cfu/mL, 103 cfu/mL respectively; 13-16: the detections of the inactivated V. alginolyticus at the concentration of 0 cfu/mL, 10 cfu/mL, 102 cfu/mL, 103 cfu/mL in the mixed bacterial suspension and other three bacterial concentration was 104 cfu/mL each. |
对于水体中的溶藻弧菌, 不论是灭活菌还是活菌, 适配体最低都能检测到10 cfu/mL、102 cfu/mL (如图 2中的泳道5、6、8、9), 但在浓度102 cfu/mL以上的电泳条带明显较为明亮(如图 2的泳道6、7、9、10), 检测效果更好; 而该适配体对其他三种灭活菌(嗜水气单胞菌、迟钝爱德华菌、哈维氏弧菌)的电泳条带的亮度都较弱(如图 2的泳道2、3、4), 其中灭活哈维氏弧菌的电泳条带有一定的亮度(图 2的泳道4), 亮度其次的为灭活的迟钝爱德华氏菌(图 2的泳道3), 而嗜水气单胞菌的电泳条带几乎没有亮度(图 2的泳道2), 说明该适配体对灭活的哈维氏弧菌和迟钝爱德华氏菌有一定的交叉反应, 但比较而言, 这些电泳条带的亮度都明显弱于溶藻弧菌, 表明该适配体对溶藻弧菌有较好的亲和特异性和识别效果。与前面筛选产物相比, 单一适配体的检测灵敏度提高了一个数量级。
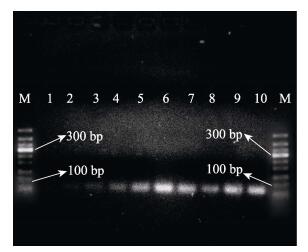
|
图 2 适配体对溶藻弧菌的检测 M: marker; 1:空白, 即适配体对ddH2O的检测结果; 2、3、4:适配体对三种灭活菌(嗜水气单胞菌、迟钝爱德华菌和哈唯氏弧菌)的检测, 三种菌的浓度依次为1.7×104 cfu/mL、1.3×104 cfu/mL、6.6×103 cfu/mL; 5、6、7:适配体对菌浓度为10 cfu/mL、102 cfu/mL、103 cfu/mL的灭活溶藻弧菌的检测; 8、9、10:适配体对浓度为10 cfu/mL、102 cfu/mL、103 cfu/mL的活的溶藻弧菌的检测. Fig.2 Detection of Vibrio alginolyticus by aptamer M: marker; 1: blank, the detection of ddH2O; 2, 3, 4: the detections of 1.7×104 cfu/mL inactivated A. hydrophila, 1.3×104 cfu/mL inactivated E. tarda and 6.6×103 cfu/mL inactivated V. harveryi respectively; 5, 6, 7: the detections of inactivated V. alginolyticus at the concentration of 10 cfu/mL, 102 cfu/mL, 103 cfu/mL respectively; 8, 9, 10: the detections of live V. alginolyticus at the concentration of 10 cfu/mL, 102 cfu/mL, 103 cfu/mL respectively. |
以未感染的鱼血清为阴性对照, 以灭活溶藻弧菌作为阳性对照, 检测鱼血清中的溶藻弧菌, 结果显示, 阴性对照的电泳条带亮度较弱(图 3的泳道B), 含有103 cfu/mL的灭活溶藻弧菌的阳性对照有较明亮的电泳条带(图 3的泳道93), 感染溶藻弧菌的血清也有较明亮的电泳条带, 其亮度与阳性对照的灭活溶藻弧菌的亮度相近(图 3的泳道9), 且明显比阴性对照的电泳条带亮, 说明该适配体对血清中的溶藻弧菌也能较好地识别检测, 而对血清中其他物质的亲和力较弱, 即血清本底对检测结果的影响不大。
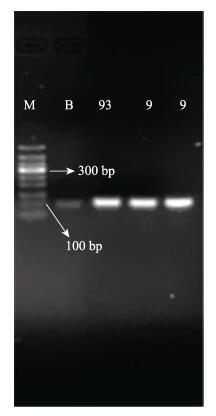
|
图 3 适配体对血清中溶藻弧菌的检测 M: marker; B:阴性对照; 93:适配体对浓度为103 cfu/mL的阳性对照菌——灭活溶藻弧菌的检测; 9:适配体对血清中溶藻弧菌的2个平行检测结果. Fig.3 Detection of Vibrio alginolyticus in serum by aptamer M: marker; B: negative control; 93: the detection of 103 cfu/mL inactivated V. alginolyticus (positive control); 9: the detections of V. alginolyticus in serum. |
有关核酸适配体在弧菌检测中的应用研究已有一些报道。Duan等[19-20]利用双适配体构建的传感器, 最低能检测出14 cfu/mL的副溶血弧菌; 而将适配体与纳米颗粒相结合, 则可同时检测副溶血弧菌和鼠伤寒沙门氏菌, 并且最低能检测出25 cfu/mL的副溶血弧菌。Zhao等[21]的研究则表明, 将适配体与纳米磁珠、膜电极相结合, 最低可以检测到10 cfu/mL的溶藻弧菌。本研究则表明, 将适配体与PCR相结合, 最低也可检出10 cfu/mL的溶藻弧菌。
溶藻弧菌是一种人和水生动物共患病原菌, 对其进行灭活处理后再进行检测, 能有效降低人感染的风险。不过目前的检测, 主要还是针对活菌, 其中最常用的就是传统的微生物培养法。该方法通过检测微生物在生长过程中产生的代谢物来实现对溶藻弧菌的检测。目前绝大部分的市售试剂盒就是采用这种方法。不过对于溶藻弧菌而言, 微生物培养法的灵敏度较低, 无法检出浓度低于103 cfu/mL的溶藻弧菌, 对不同种类弧菌的区分度也较差, 而且该方法只对活菌有效, 对灭活菌无效。另有一些方法是利用溶藻弧菌的特殊基因, 通过PCR扩增技术, 可以检测出最低为102 cfu/mL数量级的溶藻弧菌[22-23]。本研究结果则显示, 将核酸适配体与PCR技术相结合, 最低可检出10 cfu/mL的溶藻弧菌, 对102 cfu/mL以上的溶藻弧菌则有较好的检测效果。而且该方法对溶藻弧菌的活菌和灭活菌都同样有效, 并能有效区分溶藻弧菌和哈维氏弧菌等水产常见病原菌, 展现出了较好的亲和特异性及应用前景。
非特异性结合是分析检测中经常碰到的问题。在本研究中也发现, 核酸适配体与灭活哈维氏弧菌、灭活迟钝爱德华氏菌以及鱼血清等非靶目标之间都有一定的交叉反应, 存在少量较弱的非特异性结合, 不过这种非特异性结合的亲和力较弱, 可以通过增加洗涤次数和洗涤液用量等方法来降低其影响。本研究结果表明, 洗涤6次后, 这些非特异性结合明显减少, 相应电泳条带的亮度要显著弱于溶藻弧菌的目标实验组, 说明本研究采用的这种基于适配体的PCR法能够较好地实现对溶藻弧菌的检测。
适配体筛选产物, 是经过多轮SELEX筛选获得的PCR产物, 它是多种适配体的混合物, 含有多种对靶目标有较好亲和特异性的适配体。采用适配体筛选产物来检测目标菌, 不仅可以省去筛选后期的一些步骤, 如克隆测序、亲和特异性验证等步骤, 还可以降低采用单一适配体进行检测的成本。从本研究的检测效果看, 采用适配体筛选产物进行检测, 虽然比单一适配体的检测灵敏度有所降低, 但仍然比传统微生物培养法的灵敏度要高。因此, 对于灵敏度要求不太高的一些检测项目, 用适配体筛选产物来进行检测也不失为一种较为经济的备选方案。
| [1] |
Badreddine M, Abir M, Amel M, et al. Molecular characterization and phylogenetic analysis of highly pathogenic Vibrio alginolyticus strains isolated during mortality outbreaks in cultured Ruditapes decussatus juvenile[J]. Microbial Pathogenesis, 2017, 111(3): 487-496. |
| [2] |
Ye J, Ma Y, Liu Q, et al. Regulation of Vibrio alginolyticus virulence by the LuxS quorum-sensing system[J]. Journal of Fish Diseases, 2008, 31(3): 161-169. DOI:10.1111/jfd.2008.31.issue-3 |
| [3] |
Zhao J J, Chen C, Luo P, et al. SYBR Green I-based real-time PCR targeting the rpoX gene for sensitive and rapid detection of Vibrio alginolyticus[J]. Molecular and Cellular Probes, 2011, 25(2-3): 137-141. DOI:10.1016/j.mcp.2011.02.002 |
| [4] |
Hormansdorfer S, Wentges H, Neugebaur-Buchler K, et al. Isolation of Vibrio alginolyticus from seawater aquaria[J]. International Journal of Hygiene and Environmental Health, 2000, 203(2): 169-175. DOI:10.1078/S1438-4639(04)70024-3 |
| [5] |
Austin B. Vibrios as causal agents of zoonoses[J]. Veterinary Microbiology, 2010, 140(3-4): 310-317. DOI:10.1016/j.vetmic.2009.03.015 |
| [6] |
Sch rer K, Savioz S, Cernela N, et al. Occurrence of Vibrio spp. in fish and shellfish collected from the Swiss market[J]. Journal of Food Protection, 2011, 74(8): 1345-1347. DOI:10.4315/0362-028X.JFP-11-001 |
| [7] |
Schets F M, van den Berg H H J L, Marchese A, et al. Potentially human pathogenic vibrios in marine and fresh bathing waters related to environmental conditions and disease outcome[J]. International Journal of Hygiene and Environmental Health, 2011, 214(5): 399-406. DOI:10.1016/j.ijheh.2011.05.003 |
| [8] |
Liu Y, Kong F D, Xu S F, et al. Development and preliminary application of dual PCR assay for Vibrio parahaemolyticus and Vibrio alginolyticus[J]. Chinese Journal of Preventive Veterinary Medicine, 2012, 34(8): 647-650. [刘阳, 孔繁德, 徐淑菲, 等. 副溶血弧菌和溶藻弧菌双重PCR检测方法的建立与初步应用[J]. 中国预防兽医学报, 2012, 34(8): 647-650. DOI:10.3969/j.issn.1008-0589.2012.08.13] |
| [9] |
Sawabe T, Kita-Tsukamoto K, Thompson F L. Inferring the evolutionary history of vibrios by means of multilocus sequence analysis[J]. Journal of Bacteriology, 2007, 189(21): 7932-7936. DOI:10.1128/JB.00693-07 |
| [10] |
Wei S, Zhao H, Xian Y Y, et al. Multiplex PCR assays for the detection of Vibrio alginolyticus, Vibrio parahaemolyticus, Vibrio vulnificus, and Vibrio cholerae with an internal amplification control[J]. Diagnostic Microbiology and Infectious Disease, 2014, 79(2): 115-118. DOI:10.1016/j.diagmicrobio.2014.03.012 |
| [11] |
Li Y N, Zhao J, Zhang A Z, et al. Recent progress in in vitro screening of aptamers[J]. Biotechnology Bulletin, 2017, 33(4): 78-82. [李亚楠, 赵洁, 张傲哲, 等. 核酸适配体的体外筛选方法的最新研究进展[J]. 生物技术通报, 2017, 33(4): 78-82.] |
| [12] |
Kang K N, Lee Y S. RNA aptamers: a review of recent trends and applications[M]// Future Trends in Biotechnology. Advances in Biochemical Engineering/Biotechnology, 2012, 131: 153-169.
|
| [13] |
Ding F, Gao Y G, He X R. Recent progresses in biomedical applications of aptamer-functionalized systems[J]. Bioorganic & Medicinal Chemistry Letters, 2017, 27(18): 4256-4269. |
| [14] |
Kim Y S, Hyun C J, Kim I A, et al. Isolation and characterization of enantioselective DNA aptamers for ibuprofen[J]. Bioorganic & Medicinal Chemistry, 2010, 18(10): 3467-3473. |
| [15] |
Wang L, Ye H, Sang H Q, et al. Determination of isocarbophos and profenofos B by fluorescent spectrophotometry based on aptamer[J]. Chinese Journal of Analytic Chemistry, 2016, 44(5): 799-803. [王丽, 叶华, 桑宏庆, 等. 基于核酸适配体的荧光法检测水胺硫磷和丙溴磷[J]. 分析化学, 2016, 44(5): 799-803.] |
| [16] |
Wang L, Wang M K, Shi F P, et al. Aptamer based fluorescence biosensor for protein kinase activity detection and inhibitor screening[J]. Sensors and Actuators B: Chemical, 2017, 252: 209-214. DOI:10.1016/j.snb.2017.06.009 |
| [17] |
Bayraç C, Eyidoğan F, Avni Öktem H. DNA aptamer-based colorimetric detection platform for Salmonella enteritidis[J]. Biosensors and Bioelectronics, 2017, 98: 22-28. DOI:10.1016/j.bios.2017.06.029 |
| [18] |
Tang X M, Zheng J, Yan Q P, et al. Selection of aptamers against inactive Vibrio alginolyticus and application in a qualitative detection assay[J]. Biotechnology Letters, 2013, 35(6): 909-914. DOI:10.1007/s10529-013-1154-1 |
| [19] |
Duan N, Shen M F, Wu S J, et al. Graphene oxide wrapped Fe3O4@Au nanostructures as substrates for aptamer-based detection of Vibrio parahaemolyticus by surface-enhanced Raman spectroscopy[J]. Microchimica Acta, 2017, 184(8): 2653-2660. DOI:10.1007/s00604-017-2298-9 |
| [20] |
Duan N, Wu S J, Dai S L, et al. Simultaneous detection of pathogenic bacteria using an aptamer based biosensor and dual fluorescence resonance energy transfer from quantum dots to carbon nanoparticles[J]. Microchimica Acta, 2015, 182(5-6): 917-923. DOI:10.1007/s00604-014-1406-3 |
| [21] |
Zhao G T, Ding J W, Yu H, et al. Potentiometric aptasensing of Vibrio alginolyticus based on DNA nanostructure- modified magnetic beads[J]. Sensors, 2016, 16(12): 2052. DOI:10.3390/s16122052 |
| [22] |
Xu Y G, Sun L M, Wang Y S, et al. Simultaneous detection of Vibrio cholerae, Vibrio alginolyticus, Vibrio parahaemolyticus and Vibrio vulnificus in seafood using dual priming oligonucleotide (DPO) system-based multiplex PCR assay[J]. Food Control, 2017, 71: 64-70. DOI:10.1016/j.foodcont.2016.06.024 |
| [23] |
Xie Z Y, Pang X H, Zhou Y C, et al. Establishment of a method for detection of Vibrio alginolyticus virulent strains based on a new gene[J]. Fisheries Science, 2011, 30(6): 342-346. [谢珍玉, 庞兴红, 周永灿, 等. 基于一种新基因的溶藻弧菌毒力菌株检测方法的建立[J]. 水产科学, 2011, 30(6): 342-346. DOI:10.3969/j.issn.1003-1111.2011.06.007] |
 2019, Vol. 26
2019, Vol. 26

