2. 内蒙古自治区水产技术推广站, 内蒙古 呼和浩特 010010;
3. 内蒙古达里湖渔场, 内蒙古 赤峰 024000
2. Inner Mongolia Fishery Technical Extension Station, Hohhot 010010, China;
3. Dali Nor Lake Fishing Ground of Inner Mongolia, Chifeng 024000, China
鱼类的洄游是高耗能运动[1-2], 如对鲑鳟鱼类的研究显示其在洄游过程中停食或减少摄食, 期间由身体贮存供能[3-4], 面临能量匮乏的风险。因此, 鱼类需尽可能调节其身体结构、生理和行为模式以适应洄游的需要, 动用体内储存的能量为高强度的洄游活动、性腺的发育和渗透压的调节提供能量[2]。碳水化合物、脂肪和蛋白质是动物体内三大主要供能物质。国内外学者已对一些鱼类在洄游过程中的能量分配及代谢模式开展了研究[2-3, 5-7], 结果显示这些鱼类洄游过程中所需能量90%由身体组织提供, 且主要利用脂肪供能[3, 8], 蛋白质也可作为鱼类洄游过程中重要供能物质[9-10], 而碳水化合物含量在鱼类洄游过程中变化较小[3]。血浆或血清营养物质和代谢物水平可以作为评估鱼类营养状态的有用指示参数[5], 大量研究通过监测鱼类血液生化参数评估洄游性鱼类在洄游过程中营养物质的代谢及能量供应模式[2-3, 9]。鱼类对营养物质的消化、吸收需要消化酶的参与, 酶活力的高低在一定程度上可反映鱼类消化、吸收能力的大小。鱼类洄游过程中所需能量除来源于体内存储糖原、脂肪和蛋白的分解外, 也可通过对外界摄食营养物质进行消化、吸收获得。因此, 在鱼类洄游过程中其消化酶活性可能会发生适应性调节。已有研究通过室内实验生态学方法模拟水环境盐度改变, 发现洄游性鱼类消化酶活性随着盐度的改变发生适应性调节[11-12], 但目前关于鱼类洄游过程中消化酶活性变化的研究较为少见[9]。
瓦氏雅罗鱼(Leuciscus waleckii Cyprinidae)隶属鲤形目, 鲤科, 雅罗鱼亚科, 主要生活在中性淡水环境中, 但可以耐受较高盐度和碱度。达里湖瓦氏雅罗鱼种群进化出特殊的机制来完成盐碱环境下生理功能的调节[13-15], 可在碱度53.57 mmol/L, pH高达9.69的恶劣水域环境中生存[16], 但其性腺的最终发育成熟、排卵及早期胚胎和幼体的发育仍需洄游到贡格尔河等淡水河流中进行。近年来, 已对达里湖瓦氏雅罗鱼耐盐碱生理和分子机制开展了一些研究[13-15], 而关于其生殖洄游过程中的营养物质代谢生理尚未见报道。本研究拟通过比较未洄游和已洄游的达里湖瓦氏雅罗鱼血清生化指标、糖原含量、肝脏转氨酶和己糖激酶以及肝脏和肠道消化酶活性差异, 分析急性河水适应后其血清生化参数的变化, 初步研究其生殖洄游过程中的能量代谢和消化酶活性变化。为实现达里湖瓦氏雅罗鱼全人工繁殖技术, 保护其种群资源奠定科学的理论基础。
1 材料与方法 1.1 实验用鱼试验用瓦氏雅罗鱼于2017年5月7日捕于达里湖(43°22'22.63''N, 116°39'57.50''E)和贡格尔河(43°22'33.56''N, 116°42'54.83''E), 由内蒙古达里湖渔场协助获得。采集瓦氏雅罗鱼全部为性腺发育成熟的个体, 共采集河鱼45尾, 湖鱼45尾。在捕捞后选择雌性湖鱼和河鱼分别放于装有湖水和河水的塑料箱中1 h内运回渔场实验室。雌雄鉴定标准为:雌鱼体表光滑无珠星, 腹部圆润柔软, 生殖孔红色稍凸起, 雄鱼体表粗糙具珠星, 腹部平窄, 生殖孔白色, 内凹。首先随机挑选雌性湖鱼和河鱼各25尾, 用鱼安定(MS-222, 化学名为间氨基苯甲酸乙酯甲磺酸盐)麻醉后测量其形态学参数(表 1), 之后从麻醉的河鱼和湖鱼中各随机选取12尾鱼进行采样, 用于生理生化参数分析。
|
|
表 1 捕于达里湖和贡格尔河瓦氏雅罗鱼样品形态学参数 Tab.1 Morphological parameters of Leuciscus waleckii form Dali Nor Lake and Gongger River |
形态参数测量后从湖鱼和河鱼中各随机选取12尾鱼, 尾静脉采血, 置于1.5 mL离心管中, 在4℃冰箱中放置4 h, 待血清析出后, 3000 r/min, 离心20 min。取上层血清干冰运回实验室, ‒80℃冰箱保存, 用于测定血清生化指标。
采血后在冰盘上快速解剖, 取出肝脏、肠道和肌肉组织, 置于2 mL细胞冻存管中, 液氮速冻, 转入‒80℃冰箱保存。组织样品于4℃冰箱中解冻, 用预冷的0.86%的生理盐水清洗2次, 滤纸吸干表面水分, 称重, 加入9倍体积0.86%生理盐水, 于2 mL手持式玻璃组织匀浆器中, 冰浴匀浆至无明显组织颗粒。离心(4℃, 5000 r/min) 10 min, 取上清液用于测定糖原含量和转氨酶、己糖激酶以及消化酶活性。
1.2.2 急性河水适应实验设计湖鱼转运到实验室, 在湖水中适应2 h后, 另随机选取雌鱼12尾, 转入到河水中养殖, 河水取自贡格尔河捕捞点。暴露24 h后, MS-222麻醉, 尾静脉采血, 分析血清生化指标。实验在120 L的水族箱中进行, 实验过程中不投饵, 持续充氧, 水温保持在(12±1)℃。
1.2.3 血清生化指标测定血清在4℃冰箱中解冻, 测定葡萄糖、总蛋白、甘油三酯和总胆固醇含量。其中葡萄糖采用葡萄糖氧化酶-过氧化物酶法进行测定; 血清蛋白含量采用BCA法进行测定; 甘油三酯采用GPO-PAP酶法进行测定; 总胆固醇含量采用COD-PAP法进行测定, 血清生化参数的单位均为mmol/L, 血清生化参数测定试剂盒购于南京建成生物工程研究所。
1.2.4 糖原含量测定肝脏和肌肉组织匀浆液按照适宜比例稀释后, 采用蔥酮法测定肝脏和肌肉组织中糖原含量。糖原含量单位为mg/g。糖原检测试剂盒购于南京建成生物工程研究所。
1.2.5 酶活性测定肝脏和肠道组织匀浆液按照适宜比例稀释后测定转氨酶、己糖激酶和消化酶活性。肝脏谷草转氨酶(GOT)活性采用2, 4-二硝基苯肼法进行测定, 谷丙转氨酶(GPT)活性采用赖氏比色法进行测定, 根据标准曲线得出相当于酶活力的卡门氏单位。己糖激酶(HK)采用紫外比色法进行测定, 应用葡萄糖-6-磷酸脱氢酶的偶联反应, 在提供足够的底物条件下, 在340 nm波长处, 通过测定吸光度的增加值来反映己糖激酶的活性。谷草转氨酶、谷丙转氨酶和己糖激酶活性检测试剂盒均购于南京建成生物工程研究所。
消化酶活性参照杨志彪等[17]的方法进行测定。胃蛋白酶和胰蛋白酶活性测定采用福林-酚试剂法进行, 胰蛋白酶活性测定所用缓冲液为0.05 mol/L硼砂-氢氧化钠缓冲液(pH 9.8), 其他与胃蛋白酶活力的测定方法相同, 蛋白酶活力单位定义为:在37℃下每分钟水解干酪素所产生1 μg酪氨酸作为一个蛋白酶活力单位U (μg/min); 淀粉酶和纤维素酶活性均采用3, 5-二硝基水杨酸比色法进行测定, 淀粉酶活性单位定义为:在25℃条件下, 每分钟催化淀粉生成1 μg麦芽糖作为一个淀粉酶活力单位U (μg/min); 纤维素酶活力单位定义为:在40℃下, 每分钟催化纤维素生成1 μg葡萄糖作为一个酶活力单位U (μg/min)。所测以上各种酶的活力单位(U)除以相应的可溶性蛋白含量(mg)即为酶的比活力, 以U/mg protein表示。不同组织中蛋白含量采用BCA试剂盒进行测定, 以牛血清蛋白作为标准。
1.3 数据处理试验所有数据均用平均值±标准误(x±SE)表示, 采用SPSS 16.0软件进行统计分析, 用独立样本t检验法对达里湖和贡格尔河中瓦氏雅罗鱼生理、生化参数进行差异显著性分析。对达里湖、贡格尔河和河水适应24 h后瓦氏雅罗鱼血液生化参数采用单因素方差分析, 若差异显著时, 再进行多重比较(LSD’s test), P < 0.05时认为差异显著, P < 0.01时认为差异极显著。
2 结果与分析 2.1 不同环境中瓦氏雅罗鱼血清生化参数比较不同环境中达里湖瓦氏雅罗鱼血清生化参数见图 1。由图可见, 与达里湖中的瓦氏雅罗鱼相比, 洄游到贡格尔河后其血清葡萄糖含量显著降低(P < 0.05), 而血清总胆固醇含量显著升高(P < 0.05), 血清总蛋白和甘油三酯含量无显著变化。
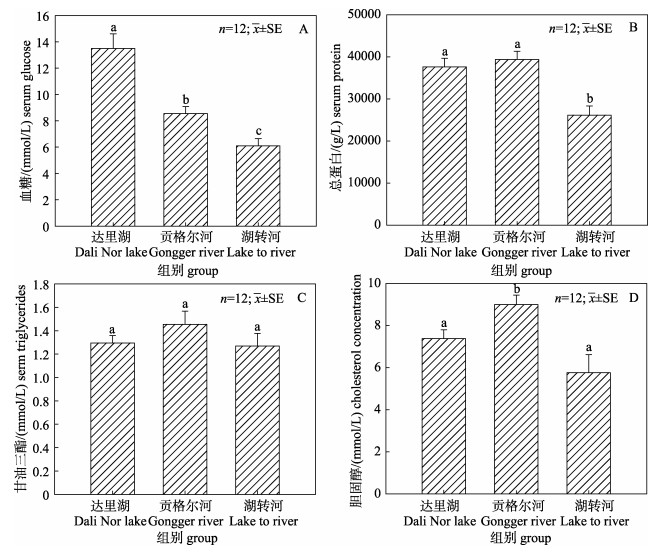
|
图 1 不同环境中洄游瓦氏雅罗鱼血清葡萄糖(A)、总蛋白(B)、甘油三酯(C)和胆固醇(D)含量变化 柱子上方不同的小写字母代表各组间存在显著差异(P < 0.05). Fig.1 Serum glucose (A), total protein (B), triglycerides (C) and cholesterol (D) concentration of Leuciscus waleckii collected form Dali Nor Lake, Gongger River and during 24-h transfer form Dali Nor Lake to Gongger River water Different superscript letters indicate significant differences (P < 0.05). |
与达里湖中瓦氏雅罗鱼相比, 适应河水24 h后其血清葡萄糖和总蛋白含量显著降低(P < 0.05), 且显著低于洄游到贡格尔河的雅罗鱼血清葡萄糖和总蛋白含量(P < 0.05);血清甘油三酯含量无显著变化; 血清胆固醇含量无显著改变, 但显著低于洄游到贡格尔河的瓦氏雅罗鱼血清胆固醇含量(P < 0.05)。
2.2 达里湖瓦氏雅罗鱼洄游前后肝脏和肌肉组织糖原含量比较达里湖和贡格尔河瓦氏雅罗鱼肝脏和肌肉组织中糖原含量见图 2。由图可见, 与达里湖瓦氏雅罗鱼相比, 洄游到贡格尔河后其肝脏组织糖原含量极显著升高(P < 0.01), 河鱼肝糖原含量约为湖鱼的53倍; 而湖鱼和河鱼肌糖原含量均较低, 且无显著差异。
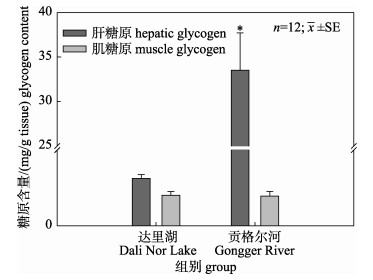
|
图 2 达里湖和贡格尔河瓦氏雅罗鱼肝脏和肌肉组织糖原含量变化 柱子上方星号代表组间存在显著差异(P < 0.05). Fig.2 Hepatic glycogen and muscle glycogen content of Leuciscus waleckii form Dali Nor Lake and Gongger River Asterisk above the column indicate significant differences (P < 0.05). |
达里湖和贡格尔河瓦氏雅罗鱼肝脏组织中转氨酶和己糖激酶活性见表 2。由表可见, 与达里湖瓦氏雅罗鱼相比, 洄游到贡格尔河后其肝脏组织谷草转氨酶活性显著降低(P < 0.05), 而肝脏组织谷丙转氨酶和己糖激酶活性无显著变化。
|
|
表 2 达里湖和贡格尔河瓦氏雅罗鱼肝脏三种代谢酶活性比较 Tab.2 Hepatic glycogen and muscle glycogen content of Leuciscus waleckii from Dali Nor Lake and Gongger River |
达里湖和贡格尔河瓦氏雅罗鱼肝脏和肠道消化酶活性见图 3。由图可见, 与达里湖瓦氏雅罗鱼相比, 洄游到贡格尔河后雅罗鱼肝脏和肠道纤维素酶、胃蛋白酶、胰蛋白酶和淀粉酶活性均显著升高(P < 0.05)。河鱼肝脏和肠道纤维素酶活性分别达到湖鱼的3.42倍和1.31倍; 河鱼淀粉酶活性分别是湖鱼的5.08倍和1.27倍; 胃蛋白酶活性分别是湖鱼的1.55倍和3.48倍; 胰蛋白酶活性分别是湖鱼的1.92倍和13.46倍。比较不同组织中消化酶活性差异, 可见在湖水中瓦氏雅罗鱼肠道四种消化酶活性均高于肝脏, 而洄游到河水中后肠道两种蛋白酶活性高于肝脏, 而纤维素酶活性显著低于肝脏, 淀粉酶活性在肝脏和肠道组织中相近。
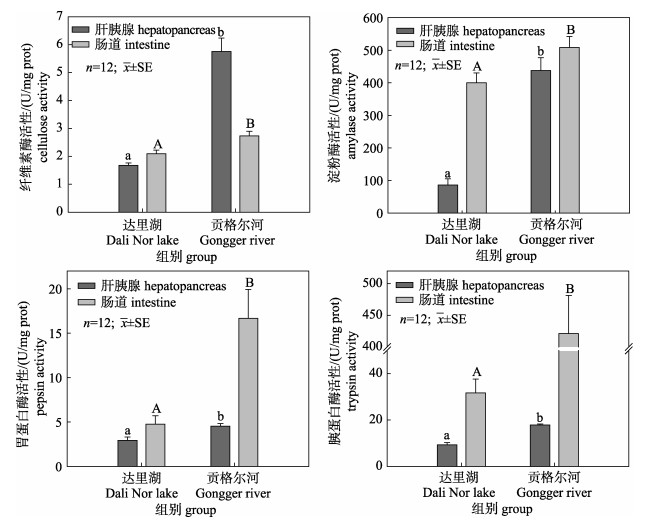
|
图 3 达里湖和贡格尔河瓦氏雅罗鱼肝脏和肠道纤维素酶(A)、淀粉酶(B)、胃蛋白酶(C)和胰蛋白酶(D)活性变化 不同的小写字母代表各组间肝胰腺消化酶存在显著差异(P < 0.05), 不同大写字母代表肠道消化酶活性存在显著差异. Fig.3 Cellulose (A), amylase (B), pepsin (C) and trypsin (D) activities in hepatopancreas and intestine of Leuciscus waleckii form Dali Nor Lake and Gongger River Different superscript letters indicate a significant difference (P < 0.05) of digestive enzyme activities in hepatopancreas of different groups. Different capital letters indicate significant differences (P < 0.05) of digestive enzyme activities in intestine among different groups. |
血浆蛋白水平可以作为一种营养水平指示因子, 其下降通常与营养缺乏有直接的关系。Storebakken等[18]对虹鳟(Oncorhynchus mykiss)的研究显示, 血浆蛋白浓度与摄食水平呈现显著的正相关关系, 在禁食期间虹鳟血浆蛋白水平显著降低[19]。本研究中发现, 洄游到贡格尔河后瓦氏雅罗鱼血清总蛋白含量与未洄游的达里湖中瓦氏雅罗鱼相比无显著差异, 表明洄游过程中瓦氏雅罗鱼可维持稳定的血清蛋白水平。本研究在解剖过程中发现, 洄游到贡格尔河中的雅罗鱼其肠道中仍有少量食糜, 表明雅罗鱼在洄游过程中仍存在摄食行为, 摄食在一定程度上可以补充其对能量的需求, 有利于维持稳定的血清蛋白水平。
与已适应河水环境的雅罗鱼不同, 将达里湖瓦氏雅罗鱼直接转入河水中24 h后, 其血清总蛋白浓度与未转运前相比显著降低。本研究结果与Fletcher等[20]的研究结果相似, 该研究发现红大马哈鱼从海水洄游到淡水中后血浆总蛋白含量显著降低, 作者认为血清蛋白水平下降可能与河水中水分进入鱼体内导致血液被稀释有关。另外, 与达里湖水相比, 贡格尔河水中离子浓度降低。因此, 洄游到河水中后瓦氏雅罗鱼体内离子被动流失增加, 鱼体需要主动吸收离子, 而离子的吸收需要消耗能量。加之本研究在实验期间未提供饵料, 这些均可能引起蛋白分解代谢增强, 导致血清总蛋白水平降低。
血糖含量在机体内总是处于一种动态平衡状态, 受到胰岛素和肾上腺素的控制, 同时受到机体自身生命活动的各种调节。血糖水平除了与摄食水平相关外, 还受到运动活性, 水环境因子变动等环境的影响。在某种程度上, 血糖水平的改变与应急因子的关系比营养因子更为紧密[5]。本研究发现, 从达里湖洄游到贡格尔河后以及急性河水转运后, 瓦氏雅罗鱼血清葡萄糖水平均显著降低。瓦氏雅罗鱼在湖水中血浆葡萄糖水平高于河水这一结果与在虹鳟[21-22]上的研究相似, 对虹鳟的研究发现其从淡水逐渐适应海水的过程中血糖水平增加; 对青海湖裸鲤的研究也发现, 将淡水中的裸鲤暴露在青海湖水中后其血浆葡萄糖水平显著升高[23]。在淡水中鱼体需主动从水环境中吸收离子, 以调高体内渗透浓度, 对能量的需求较高, 代谢用葡萄糖增加。本试验结果可以解释为, 在达里湖水中瓦氏雅罗鱼代谢水平相对较低, 代谢用葡萄糖较低, 因此血糖水平可能维持在较高水平。而瓦氏雅罗鱼洄游到贡格尔河后消耗大量的能量, 同时生殖活动对能量的需求也增加, 因此, 代谢用葡萄糖增加, 引起血糖水平降低。这在Wood等[24]对青海湖裸鲤的研究中似乎也得到证实, 该研究发现, 将青海湖裸鲤从河水转入到湖水中后, 其耗氧率和排氨率分别降低到河水中的60%和30%。从能量节约的角度而言, 在湖水中离子和渗透调节消耗较少能量, 因此对青海湖裸鲤或瓦氏雅罗鱼而言, 似乎是有益的。
糖原是机体在葡萄糖供应充足的情况下, 被动员存储在肝脏和肌肉中的一种暂时的存储形式, 是保证血糖稳定应急供能的重要物质。本研究发现, 洄游到河水中后瓦氏雅罗鱼血糖含量降低, 同时肝糖原含量升高到其在湖水时的近53倍。这种洄游性鱼类在溯河洄游过程中糖原存储增加的现象在红大麻哈鱼的研究中也曾被报道[25], 该研究发现从海洋到河流的洄游过程中, 大麻哈鱼在洄游晚期到达产卵场时肝脏糖原含量是河口大麻哈鱼的2倍。这似乎表明洄游性鱼类在溯河生殖洄游时对产生葡萄糖的需求较低。本研究中瓦氏雅罗鱼洄游到河水中后, 在维持较高代谢水平的同时仍可以肝糖原的形式存储能量, 这可能是雅罗鱼为其高耗能繁殖活动储备能量的一种适应性调节机制。
在鱼类洄游过程中血液生化参数的改变与其营养条件和能量的利用、组织损伤、应激[2]以及洄游过程中性腺的发育成熟有关[26]。与血糖相似, 甘油三酯也是鱼类代谢的主要供能物质, 血清甘油三酯与摄食状态和营养水平直接相关, 通常在摄食后2~4 h即升高, 停止摄食后降低, 之后恢复稳定[27]。研究证实, 即使对于洄游期间禁食的鱼而言, 也可通过从存储的体脂中释放脂肪酸, 转运到肝脏, 并在肝脏中被转换成甘油三酯, 分泌回到血液中[5]。因此, 血浆甘油三酯并不是一个可信任的营养状态指标。本研究中瓦氏雅罗鱼从湖洄游到河水中后血清甘油三酯水平并无显著变化, 表明雅罗鱼在洄游过程中仍可维持稳定的血脂水平。胆固醇是细胞膜的一种结构成分, 同时也合成类固醇激素如性激素的前体物质。血浆胆固醇水平的高低受到胆固醇合成和清除速度的影响。本试验中洄游到河水后雅罗鱼血清胆固醇含量显著升高, 这可能是由于从达里湖洄游到贡格尔河后, 淡水的刺激使得雅罗鱼性腺发育加速, 性激素的合成增加, 因此胆固醇的合成速度可能快于其清除速度, 推测这可能是雅罗鱼血清胆固醇水平升高的原因之一, 但仍需要进一步测定其性激素水平并评价其性腺发育程度予以证实。
3.2 瓦氏雅罗鱼生殖洄游过程中代谢酶活性调节肝是鱼类的重要器官, 在物质能量代谢过程中具有特殊功能。谷丙转氨酶和谷草转氨酶是广泛存在于鱼类细胞质和线粒体中的重要氨基酸转移酶, 参与氨基酸的分解和合成, 在鱼体蛋白质代谢过程中起重要作用[28]。已有研究显示, 体内游离氨酸在鱼类和甲壳类适应盐碱环境时发挥渗透调节作用[29-30]。本研究显示, 洄游到贡格尔河后瓦氏雅罗鱼肝谷草转氨酶活性显著降低, 这可能表明在盐碱水环境中, 雅罗鱼体内蛋白质被分解为游离氨基酸以供能或维持渗透压平衡, 而洄游到淡水河流中时氨基酸的分解和合成水平降低, 谷草转氨酶活性适应性的下调。这一假设在常玉梅等[30]的研究中已被证实, 该研究发现瓦氏雅罗鱼血浆游离氨基酸总量随着暴露碱度的升高而显著增加, 且作者认为, 瓦氏雅罗鱼提高血浆中非必需氨基酸的含量作为能量来源, 可能是其适应高碱环境的机制之一。
己糖激酶的功能主要是催化葡萄糖磷酸化生成6-磷酸葡萄糖, 参与糖酵解的第一步反应, 它的活力通常可以用来反映鱼体细胞利用外源性葡萄糖的能力[31]。肝己糖激酶活性升高通常表明肝加速了葡萄糖的磷酸化作用, 加速糖酵解反应, 为组织提供能量[32]。本研究中, 与达里湖雅罗鱼相比, 贡格尔河雅罗鱼肝己糖激酶活性略升高, 但未表现出显著差异, 这与贡格尔河鱼血糖水平显著降低、肝糖原含量显著升高的结果不相一致, 这可能表明洄游到采样点位置时瓦氏雅罗鱼肝糖原存储已达到较高水平, 己糖激酶活性已恢复到稳定水平。
3.3 达里湖瓦氏雅罗鱼生殖洄游过程中的消化酶活性调节盐度是水环境中重要的生态因子, 其变化对鱼类的生长、代谢等各种生理活动均会产生影响。盐度也可通过影响鱼类消化器官中消化酶活力大小而影响其对食物的消化吸收, 最终影响鱼类的生长发育[33]。通过室内实验生态学方法研究发现, 洄游性鱼类消化器官中消化酶活性随着盐度变化而改变[11-12]。在较早的野外试验研究中也发现, 大麻哈鱼在从海到河洄游过程中肝脏蛋白酶活性增加2倍, 同时蛋白水平在鱼已产卵后降低50%[9]。与该研究相似, 本研究发现瓦氏雅罗鱼洄游到贡格尔河后肝脏和肠道四种消化酶活性均极显著升高。消化酶活性的升高可提高鱼体对营养物质的消化吸收能力, 从而有利于其从有限的摄入饵料中获得更多的能量以维持正常的生理活动。
许多研究表明, 消化酶的蛋白质本性决定了pH是酶促反应的重要影响因素[34]。在达里湖中水体离子浓度较高, 雅罗鱼体内离子易流失, 因此, 与海水鱼相似, 达里湖瓦氏雅罗鱼可能需要摄入湖水以吸收水分, 而这将改变消化器官内环境的pH。已有研究证实, 消化酶适宜pH为中性偏酸性, 达里湖水体较高的pH (9.6)可能会导致雅罗鱼肠道和肝脏消化酶活性较低。而当其洄游到河水中时, 水体pH的降低在一定程度上可提高消化酶的活性, 但这一假设仍需要后续研究证实。也有研究认为, 海水中部分无机离子对酶具有激活或抑制作用, 无机离子直接作用于消化酶是盐度影响鱼体内消化酶活力的主要原因[11], 如较低浓度的氯离子对虱目鱼(Chanos chanos)肠道、胰腺、幽门盲囊和肝脏的α-淀粉酶有激活作用, 而较高浓度的氯离子抑制α-淀粉酶活性[35]。因此, 本实验中瓦氏雅罗鱼消化酶活性在湖水中较低也可能与达里湖水中离子浓度较高有关。
4 结论达里湖瓦氏雅罗鱼洄游过程中可维持稳定的能量代谢水平, 并以肝糖原的形式为其生殖活动储备能量; 肝脏和肠道组织中消化酶活性的升高可提高鱼体对营养物质的消化吸收能力, 这可能是其生殖洄游过程中的一种适应性调节。
| [1] |
Doucett R R, Booth R K, Power G, et al. Effects of the spawning migration on the nutritional status of anadromous Atlantic salmon (Salmo salar): insights from stable-isotope analysis[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1999, 56(11): 2172-2180. DOI:10.1139/f99-147 |
| [2] |
Kiessling A, Lindahl-Kiessling K, Kiessling K H. Energy utilization and metabolism in spawning migrating Early Stuart sockeye salmon (Oncorhynchus nerka): the migratory paradox[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2004, 61(3): 452-465. DOI:10.1139/f04-006 |
| [3] |
Jonsson N, Jonsson B, Hansen L P. Changes in proximate composition and estimates of energetic costs during upstream migration and spawning in Atlantic salmon (Salmo salar)[J]. Journal of Animal Ecology, 1997, 66(3): 425-436. DOI:10.2307/5987 |
| [4] |
Jonsson N, Jonsson B, Hansen L P. Energetic cost of spawning in male and female Atlantic salmon (Salmo salar L.)[J]. Journal of Fish Biology, 1991, 39(5): 739-744. DOI:10.1111/jfb.1991.39.issue-5 |
| [5] |
Wagner T, Congleton J L. Blood chemistry correlates of nutritional condition, tissue damage, and stress in migrating juvenile chinook salmon (Oncorhynchus tshawytscha)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2004, 61(7): 1066-1074. DOI:10.1139/f04-050 |
| [6] |
Glebe B D, Leggett W C. Temporal, intra-population differences in energy allocation and use by American shad (Alosa sapidissima) during the spawning migration[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1981, 38(7): 795-805. DOI:10.1139/f81-108 |
| [7] |
LeBlanc P J, Gillis T E, Gerrits M F, et al. Metabolic organization of liver and somatic muscle of landlocked sea lamprey, Petromyzon marinus, during the spawning migration[J]. Canadian Journal of Zoology, 1995, 73(5): 916-923. DOI:10.1139/z95-107 |
| [8] |
Xu Z L, Chen J J. Analysis of migratory route of Larimichthys crocea in the East China Sea and Yellow Sea[J]. Journal of Fisheries of China, 2011, 35(3): 429-437. [徐兆礼, 陈佳杰. 东黄海大黄鱼洄游路线的研究[J]. 水产学报, 2011, 35(3): 429-437.] |
| [9] |
Mommsen T P, French C J, Hochachka P W. Sites and patterns of protein and amino acid utilization during the spawning migration of salmon[J]. Canadian Journal of Zoology, 1980, 58(10): 1785-1799. DOI:10.1139/z80-246 |
| [10] |
Ando S, Yamazaki F, Hatano M, et al. Deterioration of chum salmon (Oncorhynchus keta) muscle during spawning migration—Ⅲ. Changes in protein composition and protease activity of juvenile chum salmon muscle upon treatment with sex steroids[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1986, 83(2): 325-330. |
| [11] |
Tian X L, Ren X W, Dong S L, et al. Studies on the specific activities of digestive enzymes of Cynoglossus semilaevis Gǜnther at different salinities and temperatures[J]. Periodical of Ocean University of China, 2008, 38(6): 895-901. [田相利, 任晓伟, 董双林, 等. 温度和盐度对半滑舌鳎幼鱼消化酶活性的影响[J]. 中国海洋大学学报, 2008, 38(6): 895-901.] |
| [12] |
Luo M Z, Guan R Z, Jin H. Effects of the salinity on the growth performance and digestive enzyme activities of Anguilla marmorata elver and A. bicolor pacifica elver[J]. Acta Hydrobiologica Sinica, 2015, 39(4): 653-660. [罗鸣钟, 关瑞章, 靳恒. 盐度对花鳗鲡和太平洋双色鳗鲡幼鳗生长性能及消化酶活力的影响[J]. 水生生物学报, 2015, 39(4): 653-660.] |
| [13] |
Xu J, Li Q, Xu L M, et al. Gene expression changes leading extreme alkaline tolerance in Amur ide (Leuciscus waleckii) inhabiting soda lake[J]. BMC Genomics, 2013, 14: 682. DOI:10.1186/1471-2164-14-682 |
| [14] |
Chang Y M, Tang R, Dou X J, et al. Transcriptome and expression profiling analysis of Leuciscus waleckii: An exploration of the alkali-adapted mechanisms of a freshwater teleost[J]. Molecular Biosystems, 2014, 10(3): 491-504. DOI:10.1039/C3MB70318E |
| [15] |
He Q, Chang Y M, Su B F, et al. Effects of high carbonate alkalinity water and high ammonia water on oxygen consumption and ammonia excretion in Leuciscus waleckii Dybowski[J]. Journal of Biology, 2016, 33(6): 48-51. [何强, 常玉梅, 苏宝锋, 等. 高碱度和高氨对达里湖瓦氏雅罗鱼耗氧率和排氨率的影响[J]. 生物学杂志, 2016, 33(6): 48-51.] |
| [16] |
Qi J W, An X P, Meng H P, et al. Utilization status of Leucisus waleckii (Dybowski) in Dali Lake and its rational exploitation[J]. Journal of Hydroecology, 2011, 32(1): 71-77. [齐景伟, 安晓萍, 孟和平, 等. 达里湖瓦氏雅罗鱼资源现状及合理利用探讨[J]. 水生态学杂志, 2011, 32(1): 71-77.] |
| [17] |
Yang Z B, Zhao Y L, Zhou Z L, et al. Effects of copper in water on distribution of copper and digestive enzymes activities in Eriocheir sinensis[J]. Journal of Fisheries of China, 2005, 29(4): 496-501. [杨志彪, 赵云龙, 周忠良, 等. 水体铜对中华绒螯蟹体内铜分布和消化酶活性的影响[J]. 水产学报, 2005, 29(4): 496-501.] |
| [18] |
Storebakken T, Hung S S O, Calvert C C, et al. Nutrient partitioning in rainbow trout at different feeding rates[J]. Aquaculture, 1990, 96(2): 191-203. |
| [19] |
Sauer D M, Haider G. Enzyme activities in the plasma of rainbow trout, Salmo gairdneri Richardson; the effects of nutritional status and salinity[J]. Journal of Fish Biology, 1979, 14(4): 407-412. DOI:10.1111/jfb.1979.14.issue-4 |
| [20] |
Fletcher G L, Watts E G, King M J. Copper, zinc, and total protein levels in the plasma of sockeye salmon (Oncorhynchus nerka) during their spawning migration[J]. Journal of the Fisheries Research Board of Canada, 1975, 32(1): 78-82. DOI:10.1139/f75-012 |
| [21] |
Soengas J L, Aldegunde M, Andres M D. Gradual transfer to seawater of rainbow trout: effects on liver carbohydrate metabolism[J]. Journal of Fish Biology, 1995, 47(3): 466-478. DOI:10.1111/jfb.1995.47.issue-3 |
| [22] |
Sangiao-Alvarellos S, Miguez J M, Soengas J L. Actions of growth hormone on carbohydrate metabolism and osmoregulation of rainbow trout (Oncorhynchus mykiss)[J]. General and Comparative Endocrinology, 2005, 141(3): 214-225. DOI:10.1016/j.ygcen.2005.01.007 |
| [23] |
Cao Y B, Chen X Q, Wang S, et al. Growth hormone and insulin-like growth factor of naked carp (Gymnocypris przewalskii) in Lake Qinghai: Expression in different water environments[J]. General and Comparative Endocrinology, 2009, 161(3): 400-406. DOI:10.1016/j.ygcen.2009.02.005 |
| [24] |
Wood C M, Du J, Rogers J, et al. Przewalski's naked carp (Gymnocypris przewalskii): an endangered species taking a metabolic holiday in Lake Qinghai, China[J]. Physiological and Biochemical Zoology, 2007, 80(1): 59-77. DOI:10.1086/509212 |
| [25] |
Chang V M, Idler D R. Biochemical studies on sockeye salmon during spawning migration: xii. liver glycogen[J]. Canadian Journal of Biochemistry and Physiology, 1960, 38(6): 553-556. DOI:10.1139/o60-067 |
| [26] |
Abassi Z, Shaikh S A, Abbassi J. Serum cholesterol level during vitellogenesis of teleost fish Cyprinus carpio[J]. Pakistan Journal of Zoology, 2011, 43(4): 739-745. |
| [27] |
Sheridan M A. Lipid dynamics in fish: aspects of absorption, transportation, deposition and mobilization[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1988, 90(4): 679-690. DOI:10.1016/0305-0491(88)90322-7 |
| [28] |
Vijayavel K, Balasubramanian M P. Fluctuations of biochemical constituents and marker enzymes as a consequence of naphthalene toxicity in the edible estuarine crab Scylla serrata[J]. Ecotoxicology and Environmental Safety, 2006, 63(1): 141-147. DOI:10.1016/j.ecoenv.2005.02.004 |
| [29] |
Li E C. Physiological effects of ambient salinity on Litopenaeus vannamei and nutrient modulation[D]. Shanghai: East China Normal University, 2008. [李二超.盐度对凡纳滨对虾的生理影响及其营养调节[D].上海: 华东师范大学, 2008.] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1373116
|
| [30] |
Chang Y M, He Q, Sun Y C, et al. Changes in plasma free amino acid levels in Leuciscus waleckii exposed to different environmental alkalinity levels[J]. Journal of Fishery Sciences of China, 2016, 23(1): 117-124. [常玉梅, 何强, 孙言春, 等. 碳酸盐碱度胁迫下瓦式雅罗鱼血浆游离氨基酸水平的变化[J]. 中国水产科学, 2016, 23(1): 117-124.] |
| [31] |
Laiz-Carrión R, Sangiao-Alvarellos S, Guzmán J M, et al. Energy metabolism in fish tissues related to osmoregulation and cortisol action[J]. Fish Physiology and Biochemistry, 2002, 27(3-4): 179-188. |
| [32] |
Fang Z H, Tian X L, Dong S L. The growth performance, osmotic physiology and carbohydrate metabolism activity of juvenile Cynoglossus semilaecis acclimated to low salinity water[J]. Periodical of Ocean University of China, 2016, 46(8): 19-27. [房子恒, 田相利, 董双林. 低盐驯化对半滑舌鳎幼鱼生长、渗透生理及糖代谢酶活力影响的研究[J]. 中国海洋大学学报, 2016, 46(8): 19-27.] |
| [33] |
Yan M J, Li Z J, Xiong B X. Food intake, growth and feed utilization of puffer fish (Takifugu fasciatus) after different salinity pretreatments[J]. Acta Hydrobiologica Sinica, 2005, 29(2): 142-145. [严美姣, 李钟杰, 熊邦喜. 不同盐度预处理后Ⅰ龄暗纹东方鲀的摄食、生长和饲料利用[J]. 水生生物学报, 2005, 29(2): 142-145. DOI:10.3321/j.issn:1000-3207.2005.02.006] |
| [34] |
Tian H J, Zhuang P, Zhang L Z, et al. Effects of water temperature on activities of digestive enzymes of juvenile Acipenser schrenckii[J]. Journal of Fishery Sciences of China, 2007, 14(1): 126-131. [田宏杰, 庄平, 章龙珍, 等. 水温对施氏鲟幼鱼消化酶活力的影响[J]. 中国水产科学, 2007, 14(1): 126-131. DOI:10.3321/j.issn:1005-8737.2007.01.018] |
| [35] |
Chiu Y N, Benitez L V. Studies on the carbohydrates in the digestive tract of the milkfish Chanos chanos[J]. Marine Biology, 1981, 61(2-3): 247-254. DOI:10.1007/BF00386667 |
 2019, Vol. 26
2019, Vol. 26

