2. 西藏高原饲料加工工程研究中心, 西藏 林芝 860000;
3. 藏猪协作研究中心, 西藏 林芝 860000
2. Tibetan Plateau Feed Processing Research Center, Nyingchi 860000, China;
3. Tibetan Pig Collaborative Research Center, Nyingchi 860000, China
异齿裂腹鱼(Schizothorax o’connori)又称异齿弓鱼, 地方名棒棒鱼, 隶属于鲤形目(Cypriniformes), 鲤科(Cyprinidae), 裂腹鱼属, 主要分布于雅鲁藏布江的干支流和其附属水体中, 是西藏高原特有的经济鱼种和土著鱼种之一, 对高原河流生态平衡具有重要的保护作用。异齿裂腹鱼性成熟晚、生长缓慢, 多生活于水质清新、砾石底质的河道, 以着生藻类为食[1]。近年来, 随着进藏开发的人员越来越多, 捕捞强度逐渐增加; 加之当地藏民的放生习俗, 使雅鲁藏布江中的入侵种自然成群, 与土著鱼竞争食物, 这些都导致异齿裂腹鱼的数量逐渐减少, 因此开发异齿裂腹鱼人工养殖技术对其种群数量保护具有重要意义。
缩胆囊素(cholecystokinin, CCK)是一种由115个氨基酸组成的[2], 以CCK-4等多种大分子形式存在于小肠黏膜、脑和周围神经组织中[3-4], 可以使胆囊收缩的脑肠肽-胃肠肽物质[5]。缩胆囊素具有广泛的生物活性, 主要包括调节摄食[6](CCK可以降低摄食量, 减短摄食时间、增加饱感)、促进胰腺分泌[7](CCK可以刺激胰腺分泌胰酶, 增强胰酶的活性)、促进胆囊收缩[8]、调节胃肠道运动[9] (CCK可以使休息状态下的胃肠道收缩)等多种功能。
所有鱼类都需要通过摄食来为个体的生长发育等活动提供物质基础[10]。但目前, 对西藏土著鱼类摄食调控的研究大部分集中于环境因素[11]、营养成分[12]和消化吸收[13]等因素对摄食的影响, 从分子水平对西藏土著鱼类摄食调控的研究还较少。因此, 本研究以异齿裂腹鱼为对象, 通过RT-PCR和RACE技术克隆了异齿裂腹鱼CCK基因全长, 并通过Real-time PCR技术分析了CCK基因在心脏、肝、肌肉、脑、眼、肾、肠道、鳃、皮肤、鳔和脾中的表达水平, 以及投喂、禁食和复喂对CCK基因表达量的影响, 为进一步从分子水平研究西藏土著鱼由缩胆囊素介导的摄食调控奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 实验用鱼体重(1.25±0.14) kg的健康异齿裂腹鱼共60尾, 采集于西藏雅鲁藏布江二级支流-巴河, 装入鱼用氧气袋运回实验室, 放入经过清洗消毒处理的养鱼缸中暂养。
1.1.2 实验试剂组织总RNA提取试剂盒为天根生化科技(北京)有限公司产品, RNA PCRTM Kit Ver.3.0反转录试剂盒、SYBR® Premix Ex TaqTM荧光定量试剂盒和LA Taq (TaKaRa DRR02AG)均为大连宝生物工程公司产品, M-MuLV First Strand cDNA Synthesis Kit M-MuLV第一链cDNA合成试剂盒(B532435)、Marker (BBI B600032)、6×DNA Loading Dye、柱式DNA胶回收试剂盒均为生工生物工程(上海)股份有限公司产品。
1.2 方法 1.2.1 实验设计实验用鱼进行3周的暂养, 水温控制在(12.0±1.0)℃, 其中用于基因克隆、组织分布和餐前餐后研究的鱼每天投喂1次(13:00, 0 h), 用于禁食复喂研究的鱼, 每天投喂2次(10:00和18:00)。饲养实验结束后, 取3尾健康异齿裂腹鱼, 采集心脏、肝脏、肌肉、脑、眼、肾、肠道、鳃、皮肤、鳔和脾共计11个组织, 用于CCK基因全长克隆和组织分布研究; 餐前餐后实验中, 共设置5个处理, 分别为餐前3 h、餐前1 h、0 h、餐后1 h和餐后3 h, 每组3尾鱼作为3个重复; 禁食复喂实验中, 共设置6个处理, 分别为禁食1 d、禁食3 d、禁食5 d、复喂1 d、复喂3 d和复喂5 d, 每组3尾鱼作为3个重复。
1.2.2 总RNA提取和cDNA合成利用总RNA提取试剂盒提取异齿裂腹鱼脑、心脏、肝脏等11个组织的总RNA, 使用RNA PCRTM Kit Ver. 3.0反转录试剂盒, 以获取的各组织样品的总RNA为模板, 合成cDNA。
1.2.3 引物的设计和合成根据GenBank中的齐口裂腹鱼(KJ194185)和斑马鱼(BC162428)的CCK基因序列, 应用Primer Premier 5.0软件设计引物CCK-1F和CCK-1R, CCK-2F和CCK-2R用于扩增CCK基因的核心片段, 根据所得CCK基因的核心片段设计RACE引物CCK-3' raceF1、CCK-3' raceF2、CCK-5' raceF1、CCK-5' raceF2、5.3' outer和5.3' inner, 用于扩增CCK基因5'和3'末端序列, 根据拼接所得的CCK基因序列设计荧光定量引物CCK-realF和CCK-realR, 用于Real-time PCR法检测CCK基因的组织分布和摄食功能, 内参基因为GAPDH, 所有引物具体碱基序列(表 1)。引物合成由生工生物工程(上海)股份有限公司完成。
|
|
表 1 异齿裂腹鱼CCK基因克隆及功能分析引物 Tab.1 Primers for cholecystokinin gene cloning and function analysis in Schizothorax o'connori |
核心片段PCR扩增使用LA Taq聚合酶, 以脑组织的cDNA为扩增模板, 反应体系共25 µL, 包括2×GC Buffer I 12.5 µL、上下游引物各0.5 µL、dNTP 4 µL、ddH2O 6.3 µL、模板1 µL、Taq酶0.2 µL。反应程序为预变性95℃ 3 min, 变性94℃ 30 s, 退火55℃ 30 s, 延伸72℃ 30 s, 修复延伸72℃ 7 min, 33个循环。CCK基因3'末端扩增利用以3' adaptor (GCTGTC AACGATACGCTACGTAACGGCATGACAGTGTTTTTTTTTTTTTTTTTT)为反转引物的cDNA为模板, 进行巢氏PCR反应, 第一轮以CCK-3' raceF1和5.3' outer为上下游引物进行扩增, 第二轮以CCK-3' raceF2和5.3' inner为上下游引物进行扩增。CCK基因5'末端扩增利用以特异性引物CCK-RT1(GCAATGATTTATTCGTAGACA)和CCK-RT2(TAAAGTGAGGACACAAATCATA)反转得到的cDNA为模板, 进行巢氏PCR反应, 第一轮以5' adaptor (GCTGTCAACGATACGCTACGTAACGGCATGACAGTGCCCCCCCCCCCCCCC)和CCK-5' raceF1为上下游引物进行扩增, 第二轮以5.3' outer和CCK-5' raceF2为上下游引物进行扩增。扩增产物经过回收、纯化后送至上海生工生物工程有限公司进行测序, 最后将所得序列进行拼接, 获得CCK基因的序列。
1.2.5 Real-time PCR检测各CCK基因的织分布特征和对摄食功能的影响利用大连宝生物工程公司生产的SYBR® Premix Ex TaqTM试剂盒进行Real-time PCR分析, 检测CCK基因在各组织中的相对表达量以及餐前餐后、禁食复喂实验组中CCK基因在脑组织中的相对表达量。反应体系20 μL, 包括: 2×SYBR® Premix Ex TaqTM 10 μL、上下游引物(10 μmol/L)各0.6 μL、DNA模板0.8 μL、ddH2O 8 μL。反应程序为95℃ 1 min; 95℃ 10 s, 60℃ 20 s, 72℃ 20 s, 40个循环; 95℃ 10 s、65℃ 60 s、97℃ 1 s。
1.2.6 生物信息学和数据分析利用Primer Premier 5.0软件设计本实验中所用到的所有引物。利用DNAMAN软件和ExPASy程序(http://www.expasy.ch/tools/)分别对CCK基因进行碱基序列编译和蛋白功能位点分析; 利用DNAMAN Alignmet进行氨基酸序列同源性比较; 利用MEGA 5.0软件构建CCK基因序列系统发育树; 利用ProtParam软件(http://web.expasy.org/protparam/)检索蛋白质序列理化参数; 利用PredictPritein (http://web.predictprotein.org)进行蛋白质二级结构预测; 荧光定量PCR所得数据采用2-ΔΔCt法进行分析, 基因相对表达量的实验结果通过IBM SPSS Statistics软件进行处理析, 采用单因素方差分析(ANOVA)进行差异性检验, 结果以P < 0.05作为显著性判断标准。
2 结果与分析 2.1 异齿裂腹鱼CCK基因全长克隆和氨基酸序列分析利用上游引物CCK-1F和下游引物CCK-1R、上游引物CCK-2F和下游引物CCK-2R进行PCR扩增, 分别获得1条200 bp和1条300 bp左右的条带, 测序后实际大小分别为158 bp和316 bp。分别以CCK-3' raceF1和CCK-3' raceF2作为3'RACE特异性引物, 进行3'RACE巢氏PCR反应, 获得1条200 bp左右的条带, 测序后实际大小为175 bp。分别以CCK-5' raceF1和CCK-5' raceF2作为5' RACE特异性引物, 进行5'RACE巢氏PCR反应, 获得1条100 bp左右的条带, 测序后实际大小为113 bp。测定序列经过拼接获得缩胆囊素(CCK)全长cDNA序列。
异齿裂腹鱼CCK全长cDNA为773 bp(图 1), 其中开放阅读框(ORF)为372 bp, 可以编码123个氨基酸。5'端非编码序列(5'-UTR)的长度为77 bp, 3'端非编码序列(3'-UTR)的长度为324 bp, 包含典型的polyA尾序列。起始密码子是ATG, 终止密码子是TAA。序列分析表明, 全序列中有5个酪蛋白激酶Ⅱ磷酸化位点(CK-2)、2个蛋白激酶C磷酸化位点(PCK)和2个色氨酸磷酸化位点(try phosphorlation site)。预测异齿裂腹鱼中缩胆囊素(CCK)的分子式为C566H910N174O195S6, 分子质量为13464.86, 原子总数为10832, 理论等电点为6.06, 不稳定系数为70.14, 因此推断异齿裂腹鱼缩胆囊素属于不稳定蛋白。正电荷氨基酸残基总数(Arg+Lys)为14, 负电荷氨基酸残基总数(Asp+Glu)为16, 疏水值为66.67, 总平均亲水性为–0.658, 因此异齿裂腹鱼缩胆囊素归类为亲水性蛋白。

|
图 1 异齿裂腹鱼CCK基因全长cDNA序列及其推导的氨基酸序列 粗体字表示完整的开放阅读框; 灰色阴影表示酪蛋白激酶Ⅱ磷酸化作用位点(CK-2);黑色虚线框表示色氨酸磷酸化位点; 黑色框表示蛋白激酶C磷酸化作用位点(PKC); 红色阴影表示保守结构域, CCK-8肽. Fig.1 The full-length cDNA sequences of cholecystokinin gene and the deduced amino acid sequence of Schizothorax o'connori Boldface characters represent open reading frame (ORF); casein kinase Ⅱ phosphorylation sites (CK-2) are shadowed in gray; Try phosphorlation sites are in black dotted boxes; protein kinase C phosphorylation sites (PKC) are in black boxes; conserved domain, the octapeptides of CCK-8 are shadowed in red. |
利用DNAMAN软件中的Alignment程序, 进行不同物种CCK序列同源性的比对。结果表明, 异齿裂腹鱼CCK基因序列与齐口裂腹鱼(Schizothorax prenanti)、重口裂腹鱼(Schizothorax davidi)、金鱼(Carassius auratus)、草鱼(Ctenopharyngodon idellus)、武昌鱼(Megalobrama amblycephala)、斑马鱼(Danio rerio)、斑点叉尾鮰(Ietalurus Punetaus)、虹鳟(Oncorhynchus mykiss)、日本鳗鲡(Anguilla japonica)、比目鱼(Paralichthys olivaceus)、日本青鳉(Oryziaslatipes)、白鲷(Diplodus sargus)、原鸡(Gallus gallus)、红耳龟(Trachemys scripta)、人(Homo sapiens)、非洲爪蛙(Xenopus laevis)、牛(Bos taurus)、小鼠(Mus musculus)、猪(Sus scrofa)的同源性依次为98.37%、94.31%、94.31%、90.24%、89.43%、81.30%、65.87%、61.65%、61.54%、52.21%、52.52%、50.00%、46.15%、43.85%、42.06%、39.53%、39.68%、38.10%、36.59%(表 2)。结果表明, 异齿裂腹鱼缩胆囊素与同属于裂腹鱼属的齐口裂腹鱼和重口裂腹鱼的同源性最高。与同属于鲤形目的草鱼、金鱼、武昌鱼、斑马鱼的同源性次之。
|
|
表 2 异齿裂腹鱼与其他动物缩胆囊素氨基酸序列比较 Tab.2 Amino acid sequence homologies of cholecystokinin between Schizothorax o'connori and other animals |
利用Mega 5软件中的Phylogenetic Analysis程序, 构建了多物种的CCK氨基酸序列系统发育树。由图 2可知, 所有动物的CCK基因在系统发育树上聚成2支, 分别为硬骨鱼1支, 哺乳动物、两栖动物、爬行动物和鸟纲1支。硬骨鱼的CCK有CCK-1和CCK-2两个分支, 而异齿裂腹鱼CCK属于CCK-1这一分支, 因此初步判断本研究克隆得到异齿裂腹鱼的CCK基因可能属于CCK-1亚型。
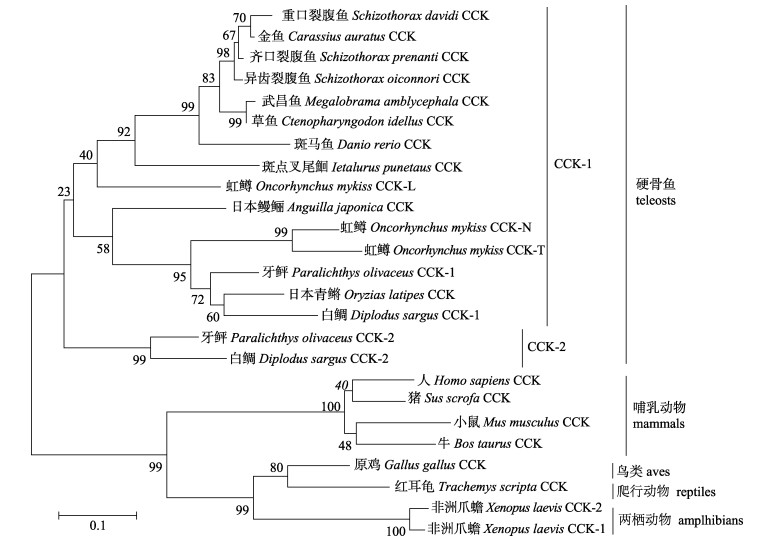
|
图 2 基于CCK氨基酸序列构建的异齿裂腹鱼及其他动物系统发育树 节点上数据表示1000次重复的支持率; 比例尺表示每千碱基的替换数目. Fig.2 Phylogenetic tree of Schizothorax o'connori and other animals based on cholecystokinin amino acid sequences Numbers at the nodes denote the bootstrap values of 1000 replicates. Scale represents the numbers of substitutions per 1000 bases. |
对CCK蛋白结构进行分析得到, 异齿裂腹鱼CCK序列包含1个由21个氨基酸残基(1~21位氨基酸)组成的信号肽和1个典型的CCK-8肽保守结构域(104~111位氨基酸); 利用TMHMM服务器分析得到异齿裂腹鱼CCK的蛋白结构中没有跨膜结构(图 3), 因此推测异齿裂腹鱼CCK不属于跨膜蛋白。利用ProtScale程序对CCK的蛋白质亲疏水性进行分析, 如图 4所示, 该蛋白质的4个低分值(score < 0)峰分别分布在22~35、38~50、58~68和77~123区域, 这些区域属于高亲水性。运用PredictProtein对CCK蛋白的二级结构进行预测, 分析结果显示在异齿裂腹鱼CCK蛋白中H螺旋(helix)占预测序列的21.14%, E折叠(sheet)占预测序列的3.25%, L环(loop)占预测序列的75.61%。暴露表面 > 16%的残基占预测序列的79.67%, 其他残基为20.33%。
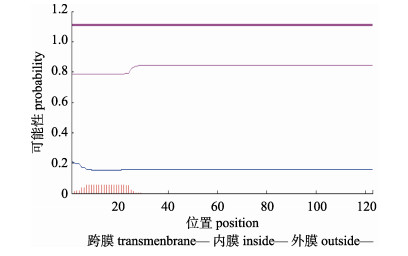
|
图 3 异齿裂腹鱼缩胆囊素蛋白跨膜结构 Fig.3 Transmenbrane area predicted in cholecystokinin protein from Schizothorax o'connori |
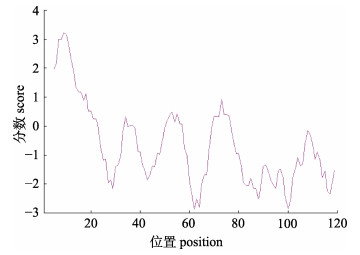
|
图 4 异齿裂腹鱼缩胆囊素蛋白疏水结构 Fig.4 Hydrophobic structure predicted in cholecystokinin protein from Schizothorax o'connori |
通过实时荧光定量PCR(Real-time PCR)技术检测CCK基因在异齿裂腹鱼脑、肠道、心脏、肝、脾、肾、皮肤、鳃、眼、鳔和肌肉组织中的相对表达量。由图 5可知, CCK基因在异齿裂腹鱼11个组织中均有表达, 其中在脑组织中表达量最高, 显著高于其他组织(P < 0.05), 而在肌肉中的表达量最低, 显著低于其他组织(P < 0.05), 这与草鱼和齐口裂腹鱼中关于CCK基因的组织分布的研究结果相一致。以肌肉组织中的表达量作为参照, CCK基因在脑、肠道、心脏、肝、脾、肾、皮肤、鳃、眼和鳔中的表达量分别为肌肉中表达量的4.91、3.04、2.89、2.69、2.07、1.93、1.88、1.75、1.66和1.57倍。
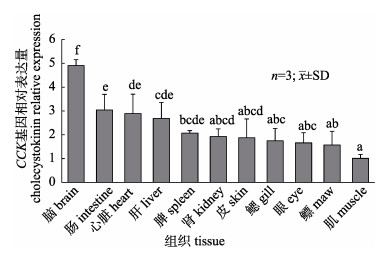
|
图 5 异齿裂腹鱼CCK基因的组织分布 柱形图上方字母不同表示差异显著(P < 0.05). Fig.5 Tissue distribution of cholecystokinin gene in Schizothorax o'connori Different letters on the column indicate significant difference (P < 0.05) |
通过实时荧光定量PCR(real-time PCR)技术检测摄食对异齿裂腹鱼CCK基因在脑组织中相对表达量的影响。由图 6可知, 摄食对CCK基因的相对表达量有明显的影响, 在未饲喂组中, 随着饲喂时间的变化, CCK基因的相对表达量逐渐降低, 但差异不显著(P > 0.05), 以餐前3 h组作为参照, 餐前1 h、0 h、餐后1 h和餐后3 h组中CCK基因的表达量分别为餐前3 h组中表达量的56%、52%、45%和49%。而对饲喂组的研究表明, 摄食使异齿裂腹鱼CCK基因的表达量显著升高(P < 0.05), 其中在餐后1 h时, 饲喂组中CCK基因的表达量为未饲喂组中表达量的4.20倍; 餐后3 h时, 饲喂组中CCK基因的表达量为未饲喂组中表达量的4.09倍。
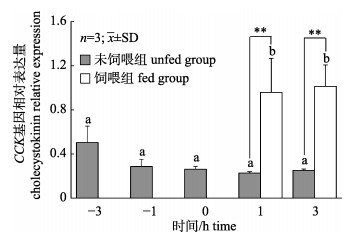
|
图 6 餐前餐后异齿裂腹鱼脑中CCK基因表达变化 *表示同一时间点的未饲喂组和饲喂组之间差异显著(P < 0.05), **表示差异极显著(P < 0.01). Fig.6 Preprandial and postprandial changes of cholecystokinin gene expression in the brain of Schizothorax o'connori * represents significant difference between the fed and unfed groups at the same time point (P < 0.05), and ** represents extremely significant difference (P < 0.01). |
通过实时荧光定量PCR (real-time PCR)技术检测禁食复喂对异齿裂腹鱼CCK基因在脑组织中相对表达量的影响。由图 7可知, 禁食复喂对CCK基因的相对表达量有明显的影响。在禁食实验中, 禁食使异齿裂腹鱼CCK基因的表达量极显著降低(P < 0.01)。与对照组相比, 禁食1 d时, 禁食组中CCK基因的表达量是对照组中表达量的56%;禁食3 d时, 禁食组中CCK基因的表达量是对照组中表达量的69%;禁食5 d时, 禁食组中CCK基因的表达量是对照组中表达量的73%。在复喂实验中, 复喂使异齿裂腹鱼CCK基因的表达量极显著升高(P < 0.01), 与对照组相比, 复喂1 d时, 复喂组中CCK基因的表达量是对照组中表达量的2.23倍, 复喂3 d时, 复喂组中CCK基因的表达量是对照组中表达量的2.83倍, 复喂5 d时, 复喂组中CCK基因的表达量是对照组中表达量的1.36倍。
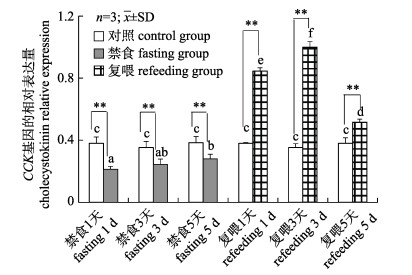
|
图 7 禁食和复喂对异齿裂腹鱼肝脏CCK基因表达的影响 *表示同一时间点的对照组和实验组差异显著(P < 0.05), **表示差异极显著(P < 0.01). Fig.7 Effects of fasting and refeeding on cholecystokinin gene expression in the liver of Schizothorax o'connori * and ** represent significant differences (P < 0.05) and extremely significant differences (P < 0.01) between the control and test groups at the same time point. |
大量的研究已经证实CCK具有调节动物摄食的功能, 但物种不同其调控方式存在差异[14-15]。本研究克隆得到异齿裂腹鱼CCK基因cDNA全长773 bp, 可以编码123个氨基酸。其氨基酸序列包含一个由21个氨基酸组成的信号肽(1~21位氨基酸)和一个典型的CCK家族的特征序列: DYLGWMDF(104~111位氨基酸), 这与齐口裂腹鱼[16]、武昌鱼[17]和草鱼[18]等其他鱼类的研究结果相似。氨基酸同源性分析表明, 异齿裂腹鱼CCK基因与同属于硬骨鱼纲鲤形目鱼类的CCK基因序列同源性最高, 为98.37%~81.30%;与其他鱼类的CCK基因序列同源性较低, 为65.87%~50.00%;而与哺乳动物和两栖动物的同源性最低, 均低于50.00%。异齿裂腹鱼CCK基因系统进化树分析的结果也是异齿裂腹鱼与齐口裂腹鱼、重口裂腹鱼、金鱼、草鱼、武昌鱼、斑马鱼聚在一个分支上, 亲缘关系最近, 而与哺乳动物和两栖动物亲缘关系较远。以上同源性分析和系统进化分析表明CCK基因的结构较为保守。研究还发现CCK在一些硬骨鱼中存在着2种或3种基因亚型, 如虹鳟[19]、绿河鲀[20]和白鲷[21], 但本研究通过氨基酸序列同源性分析得到, 异齿裂腹鱼的CCK基因与比目鱼和白鲷CCK-1聚在一支。因此初步判定本研究所获CCK基因可能属于CCK-1亚型。其是否还存在其他基因型, 有待进一步研究。
3.2 异齿裂腹鱼CCK的组织表达和摄食功能CCK基因在不同的动物中具有不同的组织表达特征。研究发现, CCK作为一种脑-肠肽在部分鱼类的脑和肠道组织中均有较高表达[22]。在本研究中, 异齿裂腹鱼CCK基因在脑中表达量最高, 这与草鱼[18]、虹鳟[19]、鲑[23]等鱼类中的研究结果相一致, 此外, CCK在肠道中也有较高表达, 这说明在异齿裂腹鱼中, CCK作为一种脑-肠肽在脑和肠道组织中广泛分布, 暗示CCK在异齿裂腹鱼的神经系统和消化系统中可能存在着重要的生理功能。本研究还发现, CCK基因在心脏、肝、脾、肾、皮肤、鳃、眼睛、鳔和肌肉等组织中也有一定表达, 但其在这些组织中的具体功能还需要做深入研究。
缩胆囊素已被证实是一种餐后饱感信号因子[24], 有研究表明, 在金鱼中, 脑部CCK基因的表达量在餐后2 h有明显的升高, 并有持续升高的趋势[25]; 斑点叉尾鮰大脑CCK-a和CCK-b的表达量分别在餐后1 h和4 h时有明显的增加[26]; 而鲑摄食3 h后, 大脑CCK-L的表达量显著升高, 但CCK-N的表达量没有显著变化[27]。这些研究表明, 摄食可以使CCK基因在脑组织中的表达量有显著性的升高, 但物种不同CCK基因对摄食的响应不同。因此, 本研究通过实时荧光定量技术检测餐前餐后、禁食复喂对异齿裂腹鱼CCK基因在脑组织中表达量的影响。研究结果显示, 异齿裂腹鱼摄食1 h后, 脑组织中CCK基因的表达量显著升高, 且随着餐后时间的增加, CCK基因的表达量也增加。这初步说明摄食使异齿裂腹鱼脑部CCK基因的表达量增加, 其是异齿裂腹鱼的餐后饱感信号因子。在禁食复喂研究中, 禁食使异齿裂腹鱼脑组织中CCK基因的表达量显著下降, 复喂使异齿裂腹鱼脑组织中CCK基因的表达量显著上升, 这与草鱼[18]、鲈[28]和鲑[23]等鱼类中关于禁食复喂对CCK基因表达量影响的研究结果相似。通常认为动物的摄食行为由摄食中枢和饱中枢控制, 下丘脑是调节食欲的基本中枢, 而外周调节信号传入食欲中枢, 经过整合信息后将复杂的信息转变为是否需要摄食的指令。其中能够参与调节指令的物质主要是中枢神经递质和脑肽。脑肽种类繁多, CCK是其中一种具有抑制摄食功能的肽类[29]。本研究结果表明, 异齿裂腹鱼脑中CCK基因在空腹状态时其表达量显著低于摄食后, 这说明异齿裂腹鱼可以通过CCK来调控其摄食行为。因此, 本研究推测异齿裂腹鱼脑组织中CCK基因可以对饱足和饥饿做出反应, 其既是异齿裂腹鱼的餐后饱感信号因子, 也是长期调控摄食因子[29]。综上所述, 本研究初步揭示了异齿裂腹鱼CCK基因的生物信息学特征、组织分布以及摄食功能, 为异齿裂腹鱼的人工饲养和品种保护等提供了理论依据。
| [1] |
Zhang L S. Study on the large scale artificial propagation of Schizothorax o'connori[J]. Freshwater Fisheries, 2011, 41(5): 88-91, 95. [张良松. 异齿裂腹鱼人工规模化繁殖技术研究[J]. 淡水渔业, 2011, 41(5): 88-91, 95. DOI:10.3969/j.issn.1000-6907.2011.05.016] |
| [2] |
Moran T H, Kinzig K P. Gastrointestinal satiety signals Ⅱ. Cholecystokinin[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2004, 286(2): G183-G188. DOI:10.1152/ajpgi.00434.2003 |
| [3] |
Williams J A. Cholecystokinin (CCK) regulation of pancreatic acinar cells: physiological actions and signal transduction mechanisms[J]. Comprehensive Physiology, 2019, 9(2): 535-564. |
| [4] |
Chaudhri O, Small C, Bloom S. Gastrointestinal hormones regulating appetite[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2006, 361(1471): 1187-1209. DOI:10.1098/rstb.2006.1856 |
| [5] |
Simpson K, Parker J, Plumer J, et al. CCK, PYY and PP: the control of energy balance[M]//Handbook of Experimental Pharmacology. Heidelberg: Springer, 2012: 209-230.
|
| [6] |
Coll A P, Farooqi I S, O'Rahilly S. The hormonal control of food intake[J]. Cell, 2007, 129(2): 251-262. DOI:10.1016/j.cell.2007.04.001 |
| [7] |
Plaza A, Merino B, del Olmo N, et al. The cholecystokinin receptor agonist, CCK-8, induces adiponectin production in rat white adipose tissue[J]. British Journal of Pharmacology, 2019, 176(15): 2678-2690. DOI:10.1111/bph.14690 |
| [8] |
Irwin N, Frizelle P, Montgomery I A, et al. Beneficial effects of the novel cholecystokinin agonist (pGlu-Gln)-CCK-8 in mouse models of obesity/diabetes[J]. Diabetologia, 2012, 55(10): 2747-2758. DOI:10.1007/s00125-012-2654-6 |
| [9] |
Plaza A, Merino B, Cano V, et al. Cholecystokinin is involved in triglyceride fatty acid uptake by rat adipose tissue[J]. Journal of Endocrinology, 2018, 236(3): 137-150. DOI:10.1530/JOE-17-0580 |
| [10] |
Valassi E, Scacchi M, Cavagnini F. Neuroendocrine control of food intake[J]. Nutrition Metabolism and Cardiovascular Diseases, 2008, 18(2): 158-168. DOI:10.1016/j.numecd.2007.06.004 |
| [11] |
Blanco S, Romo S, Villena M J. Experimental study on the diet of mosquitofish (Gambusia holbrooki) under different ecological conditions in a shallow lake[J]. International Review of Hydrobiology, 2004, 89: 250-262. DOI:10.1002/iroh.200310684 |
| [12] |
Quillet E, Le Guillou S, Aubin J, et al. Response of a lean muscle and a fat muscle rainbow trout (Oncorhynchus mykiss) line on growth, nutrient utilization, body composition and carcass traits when fed two different diets[J]. Aquaculture, 2007, 269(1-4): 220-231. DOI:10.1016/j.aquaculture.2007.02.047 |
| [13] |
Yang M. Effects of dietary acidolysis products of oxidized konjac glucomannan on intestinal digestive enzyme, intestinal microflora and intestinal mucosal immunity of Schizothorax prenanti[D]. Chengdu: Sichuan Agricultural University, 2016. [杨敏.氧化魔芋葡苷露聚糖酸解物对齐口裂腹鱼肠道消化酶、肠道微生物及肠黏膜免疫的影响[D].成都: 四川农业大学, 2016.] http://cdmd.cnki.com.cn/Article/CDMD-10626-1017013850.htm
|
| [14] |
Fan W, Ellacott K L J, Halatchev I G, et al. Cholecystokinin-mediated suppression of feeding involves the brainstem melanocortin system[J]. Nature Neuroscience, 2004, 7(4): 335-336. DOI:10.1038/nn1214 |
| [15] |
Irwin N, Montgomery I A, O'Harte F P M, et al. Comparison of the independent and combined metabolic effects of subchronic modulation of CCK and GIP receptor action in obesity-related diabetes[J]. International Journal of Obesity, 2013, 37(8): 1058-1063. DOI:10.1038/ijo.2012.179 |
| [16] |
Yuan D Y, Wang T, Zhou C W, et al. Leptin and cholecystokinin in Schizothorax prenanti: molecular cloning, tissue expression, and mRNA expression responses to periprandial changes and fasting[J]. General and Comparative Endocrinology, 2014, 204: 13-24. DOI:10.1016/j.ygcen.2014.05.013 |
| [17] |
Ji W, Ping H C, Wei K J, et al. Ghrelin, neuropeptide Y (NPY) and cholecystokinin (CCK) in blunt snout bream (Megalobrama amblycephala): cDNA cloning, tissue distribution and mRNA expression changes responding to fasting and refeeding[J]. General and Comparative Endocrinology, 2015, 223: 108-119. DOI:10.1016/j.ygcen.2015.08.009 |
| [18] |
Feng K, Zhang G R, Wei K J, et al. Molecular characterization of cholecystokinin in grass carp (Ctenopharyngodon idellus): cloning, localization, developmental profile, and effect of fasting and refeeding on expression in the brain and intestine[J]. Fish Physiology and Biochemistry, 2012, 38(6): 1825-1834. DOI:10.1007/s10695-012-9679-0 |
| [19] |
Jensen H, Rourke I J, Mϕller M, et al. Identification and distribution of CCK-related peptides and mRNAs in the rainbow trout, Oncorhynchus mykiss[J]. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 2001, 1517(2): 190-201. DOI:10.1016/S0167-4781(00)00263-3 |
| [20] |
Kurokawa T, Suzuki T, Hashimoto H. Identification of gastrin and multiple cholecystokinin genes in teleost[J]. Peptides, 2003, 24(2): 227-235. DOI:10.1016/S0196-9781(03)00034-2 |
| [21] |
Micale V, Campo S, D'Ascola A, et al. Cholecystokinin in white sea bream: molecular cloning, regional expression, and immunohistochemical localization in the gut after feeding and fasting[J]. PLoS ONE, 2012, 7(12): e52428. DOI:10.1371/journal.pone.0052428 |
| [22] |
Johnsen A H. The phylogeny of the cholecystokinin/gastrin family[J]. Frontiers in Neuroendocrinology, 1998, 19(2): 73-99. DOI:10.1006/frne.1997.0163 |
| [23] |
Murashita K, Kurokawa T, Nilsen T O, et al. Ghrelin, cholecystokinin, and peptide YY in Atlantic salmon (Salmo salar): molecular cloning and tissue expression[J]. General and Comparative Endocrinology, 2009, 160(3): 223-235. DOI:10.1016/j.ygcen.2008.11.024 |
| [24] |
Chaudhri O, Small C, Bloom S. Gastrointestinal hormones regulating appetite[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2006, 361(1471): 1187-1209. DOI:10.1098/rstb.2006.1856 |
| [25] |
Peyon P, Saied H, Lin X W, et al. Postprandial, seasonal and sexual variations in cholecystokinin gene expression in goldfish brain[J]. Molecular Brain Research, 1999, 74(1-2): 190-196. DOI:10.1016/S0169-328X(99)00282-X |
| [26] |
Peterson B C, Waldbieser G C, Riley L G Jr, et al. Pre-and postprandial changes in orexigenic and anorexigenic factors in channel catfish (Ictalurus punctatus)[J]. General and Comparative Endocrinology, 2012, 176(2): 231-239. DOI:10.1016/j.ygcen.2012.01.022 |
| [27] |
Valen R, Jordal A E O, Murashita K, et al. Postprandial effects on appetite-related neuropeptide expression in the brain of Atlantic salmon, Salmo salar[J]. General and Comparative Endocrinology, 2011, 171(3): 359-366. DOI:10.1016/j.ygcen.2011.02.027 |
| [28] |
MacDonald E, Volkoff H. Neuropeptide Y (NPY), cocaine- and amphetamine-regulated transcript (CART) and cholecystokinin (CCK) in winter skate (Raja ocellata): cDNA cloning, tissue distribution and mRNA expression responses to fasting[J]. General and Comparative Endocrinology, 2009, 161(2): 252-261. DOI:10.1016/j.ygcen.2009.01.021 |
| [29] |
Chen J. Physiology of Domestic Animals[M]. Beijing: China Agriculture Press, 2015: 144-145. [陈杰. 家畜生理学[M]. 北京: 中国农业出版社, 2015: 144-145.]
|
 2019, Vol. 26
2019, Vol. 26

