2. 南京农业大学无锡渔业学院, 江苏 无锡 214128;
3. 中国水产科学研究院淡水渔业研究中心, 中美淡水贝类种质资源保护及利用国际联合实验室, 江苏 无锡 214128;
4. 阜阳市水产管理局, 安徽 阜阳 236001
2. Wuxi Fisheries College, Nanjing Agricultural University, Wuxi 214128, China;
3. Sino-US Cooperative Laboratory for Germplasm Conservation and Utilization of Freshwater Mollusks, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214128, China;
4. Fuyang Fishery Administration, Fuyang 236001, China
大多数蚌类具有独特的寄生变态发育生活史, 这加剧了其受威胁程度和灭绝的速度, 因此成为全球水生生态系统中最为脆弱的一个类群[1-2]。世界自然保护联盟(IUCN)红色名录显示, 在全球600多种蚌类中, 目前有46.1%的蚌类物种处于灭绝、濒危或受威胁的状态[3-4]。鉴于它们在维持生态系统多样性中的作用、重要生态功能及濒危状况, 该类物种日益受到全球生物学家的关注[5]。长江中下游流域是亚洲蚌类生物多样性最为丰富的地区, 但近40年来, 由于栖息环境的破坏、水域污染及人为酷捕等因素, 长江中下游54.6%淡水贝类处于近危或受威胁状态, 而蚌类资源的衰退尤为显著[6]。
橄榄蛏蚌[Solenaia oleivora (Heude)]是中国特有的淡水经济贝类, 也是中国蛏蚌属仅有的3个现生种之一[7-8]。橄榄蛏蚌曾经在中国五大淡水湖、长江的支流、淮河及相通的河流均有自然分布。由于受到水质污染、栖息地破坏、人为酷捕及寄主鱼不明等影响, 橄榄蛏蚌自然资源急剧衰退, 已处于受威胁或接近濒危状态[6, 9]。鉴于其自然资源衰退状况及重要经济价值, 湖北天门和安徽阜阳相继建立了橄榄蛏蚌自然保护区和国家水产种质资源保护区。为了实现橄榄蛏蚌的人工繁育保护及开发, 自20世纪90年代, 国内研究者相继开展了形态与生长[10]、生理生化[11-13]、遗传信息[9-10, 14]等基础研究。由于特殊的穴居习性, 亲本采集和人工驯养极其困难, 其繁殖基础生物学研究尤为薄弱。王亚尼[15]对天门河橄榄蛏蚌繁殖生物学做了比较系统的研究, 为进一步开展人工繁育提供了基础资料。然而, 在橄榄蛏蚌繁殖周期、繁殖类型及繁殖力等关键问题上, 仍存在较大分歧[8, 15-18], 制约了这一珍稀水产种质资源的人工繁育保护及开发利用。
准确掌握橄榄蛏蚌的繁殖生物学特征和性腺发育规律, 是实现其人工繁养的基础条件。本研究以淮河橄榄蛏蚌资源为基础, 以雌蚌怀幼作为繁殖第一判定标准研究橄榄蛏蚌繁殖类型; 并结合组织切片法和扫描电镜观察, 全面系统地分析淮河橄榄蛏蚌性腺发育和生殖细胞形态特征, 旨为橄榄蛏蚌人工繁育奠定基础, 也可以为其他濒危蚌类保护和利用提供相关借鉴。
1 材料与方法 1.1 橄榄蛏蚌的采集2017年5月至2019年10月, 在淮河阜南县王家坝(115°37′E, 32°24′N)、洪河(115°11′E, 32°38′N)及霍邱(116°10′E, 31°55′N) 3个采样点定期采集橄榄蛏蚌样本, 累计采样18批(表 1)。样本采集后, 用保温箱加冰低温运回实验室, 用于繁殖生物学测定和分析。
|
|
表 1 淮河橄榄蛏蚌在不同月份的怀幼率统计 Tab.1 Percentage of the gravid mussel Solenaia oleivora from Huaihe River in different months |
清洗橄榄蛏蚌体表和内部底泥和黏附物, 每批样品随机取30只, 常规方法测定湿重(0.01 g)、壳长、壳高及壳宽(0.01 cm)等指标; 采用外部生长线法和内部切片法相结合进行年龄鉴定, 其中内部切片法参照华丹等[19]的方法。另选取部分月份样本, 采用性腺涂片法鉴别雌雄, 统计群体性比。每月取20只个体, 分离软体部和贝壳, 分别置于恒温干燥箱中65 ℃烘干48 h以上至恒重, 称量软体部干重和壳干重。参考杨小林等[16]的方法计算肥满度, 计算公式如下:
| $ 肥满度=软体部干重/壳干重×100\% $ |
检查每一批橄榄蛏蚌个体, 确认其内外鳃丝是否怀有钩介幼虫, 计算每批样本的怀幼率。计算公式如下:怀幼率=怀幼雌蚌数量/采集亲本总数×100%。从2018年3月28日采集的怀幼雌蚌中随机取6只统计怀幼量, 参考Hua[20]的方法采集育儿囊中的所有钩介幼虫并计数。从2019年3月24日采集的样本中选取怀幼雌蚌24只, 在贝壳表面标记; 另选25只雄性亲本一起暂养于循环流水养殖系统中, 每天2次定时投喂浓缩普通小球藻(Chlorella vulgaris), 投喂藻类浓度为5×105~6× 105个/mL; 每5 d检查所有雌蚌怀幼情况, 持续检查3个月, 直至2019年6月24日结束, 并根据胚胎发育阶段适当调整检查间隔, 统计每一只雌蚌怀幼次数。
1.4 性腺组织切片制备从每月采集样品中随机取雌雄蚌各3只, 切取性腺组织约1.5 cm×3 cm, 4%多聚甲醛溶液固定24 h后, 采用常规方法进行组织切片制备, 切片厚度6~7 μm, HE染色。切片在Leica DM3000显微镜下观察, LAS V4.8软件拍照与测量。参考林志华等[21]、Herrmann等[22]及徐亮等[23]对双壳类性腺发育时期的划分依据, 并根据滤泡的形状和大小、营养颗粒数量、各级生殖细胞的大小和数量等进行发育分期。
1.5 性腺组织及受精卵电镜观察选取性成熟的雌蚌和雄蚌, 用解剖刀取卵巢、精巢组织及成熟精子; 从怀幼雌蚌的育儿囊取受精卵, 分别用2.5%的戊二醛(0.l mol/L PBS缓冲液pH 7.2配制)浸泡24 h固定。电镜样品脱水、冷冻干燥及喷金等制备方法参考Wen等[24], 在HITACHI S-3000N扫描电镜上观察拍照。
1.6 数据处理与分析采用SPSS 20统计软件分析实验数据。采用最小显著差数法(LSD法)进行单因素方差分析和多重比较。在Word 2007和Excel 2007绘制图表。
2 结果与分析 2.1 不同月份橄榄蛏蚌的肥满度变化不同月份的橄榄蛏蚌肥满度如图 1所示。在测定的8个月份中, 平均肥满度在23.47%~ 29.17%之间; 其中6月的肥满度最低, 显著低于2月、3月、8月、11月和12月(P < 0.05), 而与1月和9月差异不显著(P > 0.05); 12月肥满度最高, 与1—3月、8月和11月差异不显著(P > 0.05), 而显著高于6月和9月(P < 0.05)。
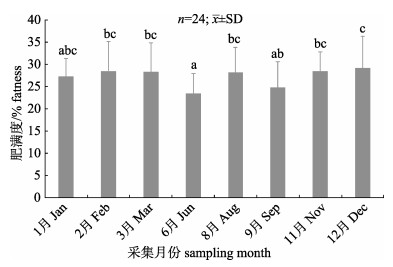
|
图 1 橄榄蛏蚌的肥满度月变化 标注不同字母表示各月份间差异显著(P < 0.05). Fig.1 Variation of fatness index of Solenaia oleivora in different months Different letters indicates significant difference between different months (P < 0.05). |
在为期2.5年的实验中, 从淮河阜阳段3个采样点采集橄榄蛏蚌样本18批, 共计1482只。如表 1所示, 在所采集的样本中, 3―6月均发现怀幼个体, 其中以3月的怀幼率最高, 平均为42.3%; 4月和5月次之, 分别为18.8%、20%; 6月最低, 为1.2%, 且仅在6月初能发现少量怀幼个体。由怀幼率数据表明, 淮河橄榄蛏蚌繁殖周期为每年3月至6月初, 其中3―5月为繁殖高峰期。
2.3 雌蚌育儿囊类型、怀幼量及怀幼次数对207只怀幼雌蚌可量性状和年龄测定结果表明, 怀幼雌蚌年龄段在2+~6+龄之间, 发现的最小怀幼雌蚌为2+龄, 体重31.25 g, 壳长10.54 cm; 发现怀幼的最大年龄为6+龄, 体重152.63 g, 壳长18.45 cm。观察发现, 85%怀幼雌蚌在内外2对鳃丝均有钩介幼虫, 其他15%雌蚌仅在外鳃丝上有钩介幼虫; 在同一怀幼雌蚌育儿囊中的钩介幼虫胚胎发育基本同步。这表明橄榄蛏蚌育儿囊属于外鳃类(Exobranchidae)中的四生型(Tetragenae)。统计结果表明, 橄榄蛏蚌一次怀幼量在134.9万~ 402.1万, 且雌蚌怀幼量与个体的体重、壳长及年龄均存在明显的正相关关系, 即怀幼量随着个体大小和年龄增长而增加(表 2)。
|
|
表 2 淮河橄榄蛏蚌雌蚌一次怀幼量 Tab.2 Total number of glochidia in marsupia of female Solenaia oleivora from Huaihe River |
对选取的24只雌蚌怀幼次数统计结果表明, 从3月下旬至6月中旬一个繁殖周期内, 淮河橄榄蛏蚌雌蚌的怀幼次数为1~4次, 其中怀幼1次雌蚌数量比例为16.7%, 2次为45.8%, 3次为25.0%, 最高为4次, 占12.5%。其中雌蚌出现2~3次怀幼约占70%。
2.4 性比与雌雄生长差异对6个不同月份橄榄蛏蚌性别鉴定结果表明, 总体雌雄性比为1.14:1, 经卡方(连续性矫正)检验符合1:1自然性比。T检验分析表明, 除2月样本的壳长指标外, 雌雄个体湿重和壳长均不存在显著差异(P > 0.05, 表 3)。
|
|
表 3 淮河橄榄蛏蚌雌雄生长差异和性比 Tab.3 The growth difference of male and female and sex ratio in Solenaia oleivora from Huaihe River |
橄榄蛏蚌生殖腺位于斧足上方, 包裹着整个内脏团, 弥散分布在消化道四周, 为滤泡型。成熟卵巢为淡黄色, 精巢为奶白色。根据性腺发育特征将卵巢和精巢分为增殖期、生长期、成熟期、排放期和休止期5个时期。在所有切片中未见雌雄同体现象。
2.5.1 卵巢发育及分期(1) 增殖期:从7月至9月中旬, 性腺组织塌陷, 无游离的卵母细胞, 无法用性腺组织涂片法鉴别雌雄。此时期滤泡体积小, 形态不规则, 相邻滤泡之间排列较稀疏, 周边有较多结缔组织和脂肪分布; 滤泡腔呈狭长形或不明显, 滤泡内有内膜将营养颗粒分割成团(图 2A1); 滤泡内营养颗粒较多, 大小不一, 直径小于3 μm, 几乎充满整个滤泡; 原始生殖细胞开始大量增殖形成卵原细胞, 直径3~10 μm, 原始生殖细胞和卵原细胞染色均深于营养颗粒。此外, 可见部分早期初级卵母细胞, 直径10~20 μm, 染色比卵原细胞淡(图 2A2)。
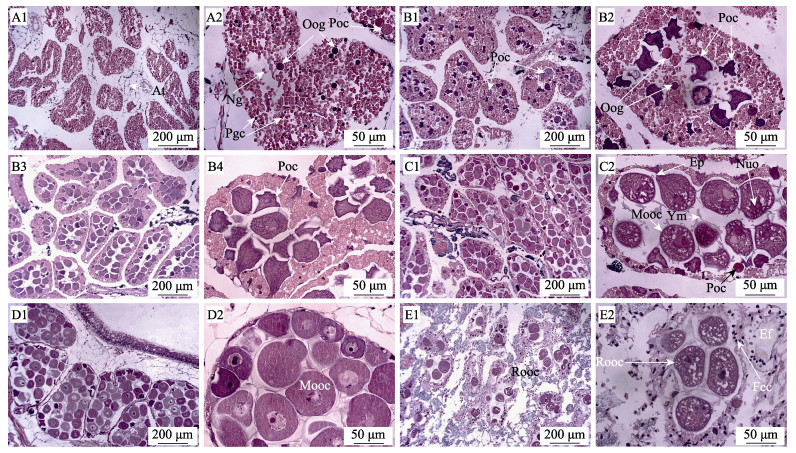
|
图 2 橄榄蛏蚌卵巢发育组织切片观察
A1-A2:增殖期; B1-B4:生长期; C1-C2:成熟期; D1-D2:排放期; E1-E2:休止期. Pgc:原始生殖细胞; At:脂肪组织; Ef:空滤泡; Ep:卵柄; Fec:滤泡表皮细胞; Mooc:成熟卵母细胞; Ng:营养颗粒; Poc:初级卵母细胞; Oog:卵原细胞; Nuo:卵母细胞核; Rooc:残留卵母细胞; Ym:卵黄膜. Fig.2 Histological section of the ovary development of Solenaia oleivora A1-A2: proliferating stage; B1-B4: growing stage; C1-C2: maturing stage; D1-D2: spawning stage; E1-E2: recovering stage. Pgc: primordial germ cell; At: adipose tissue; Ct: connective tissue; Ef: empty follicle; Ep: egg pedicle; Fec: follicular epidermal cell; Mooc: mature oocyte; Ng: nutrition granules; Poc: primary oocyte; Oog: oogonia; Nuo: nucleus of oocyte; Rooc: residual oocyte; Ym: york membrane. |
(2) 生长期:从9月下旬至12月上旬, 性腺逐步发育饱满。至10月中旬, 用组织涂片法仅有极少部分个体可鉴别雌雄。在前期阶段, 滤泡腔逐渐增大, 营养颗粒向滤泡壁集中, 成团分列于滤泡壁四周(图 2B1); 初级卵母细胞体积明显增大, 直径40~50 μm, 细胞收缩成不规则形态, 整个细胞呈深紫色, 表面可见较薄的卵膜, 核仁明显(图 2B2)。至后期阶段, 滤泡壁显著变薄, 可见2~5层营养颗粒; 滤泡腔内卵母细胞数量明显增加, 细胞体积继续增大而饱满, 直径50~70 μm; 连续切片显示, 滤泡边缘的卵母细胞通过卵柄与滤泡壁连接, 卵柄直径约5 μm (图 2B3, B4)。
(3) 成熟期:从12中旬至3月中旬, 性腺饱满有光泽, 肉眼可见明显的游离卵母细胞。此期滤泡之间相互挤压, 排列紧密, 形态较圆润; 滤泡腔内卵母细胞逐步发育成熟, 部分游离于滤泡腔内, 细胞多呈近圆形, 表面覆盖一层明显的卵膜, 内部卵黄颗粒致密而均匀; 卵母细胞核出现明显的空泡, 核仁出现偏位, 可见1~3个核仁, 直径3~5 μm, 其中1个被深染, 其他染色较淡; 仍可见位于滤泡边缘带有卵柄的未成熟卵母细胞(图 2C1, 图 2C2)。
(4) 排放期:从3月下旬至6月初, 性腺极度饱满, 肉眼可见明显的游离卵母细胞, 与成熟期后期相似。在前期阶段, 滤泡之间仍然排列紧密, 形态较圆润; 滤泡腔内包含较多的成熟卵母细胞, 仍有卵柄的未成熟卵母细胞。但总体而言, 后期滤泡中的卵母细胞总数逐渐减少, 在滤泡边缘的营养颗粒也逐步消耗(图 2D1, 图 2D2)。此外, 对3月和4月怀幼雌蚌卵巢组织切片观察发现, 在怀幼期间, 滤泡内仍有较多成熟的卵母细胞和接近成熟的卵母细胞, 表明橄榄蛏蚌在此期间分批多次排卵。
(5) 休止期:从6月初至7月初, 性腺逐步萎缩退化。此期性腺滤泡数量明显减少, 滤泡间结缔组织出现增生; 留存的滤泡内卵母细胞也大量减少, 其中一部分滤泡内基本排空, 有一部分滤泡内仍残留少量成熟和未成熟卵母细胞, 逐步退化被吸收; 滤泡边缘营养颗粒比排放期显著减少, 几乎全部耗尽; 在滤泡边缘的表皮细胞开始大量增殖, 表皮细胞被深染; 滤泡间结缔组织和脂肪逐步增多(图 2E1, 图 2E2)。
2.5.2 精巢发育及分期(1) 增殖期:从7―8月为精巢的增殖期。此期滤泡体积较小, 分布较分散, 间距较大, 滤泡之间存在较多的结缔组织和脂肪; 滤泡内充满粉红色的营养颗粒, 没有明显的滤泡腔; 在滤泡内, 随机分布深紫色的原始生殖细胞, 不断分裂形成精原细胞, 精原细胞进一步增殖分裂, 可见包裹数量不等的精原细胞囊, 直径8~12 μm (图 3A1, 图 3A2)。
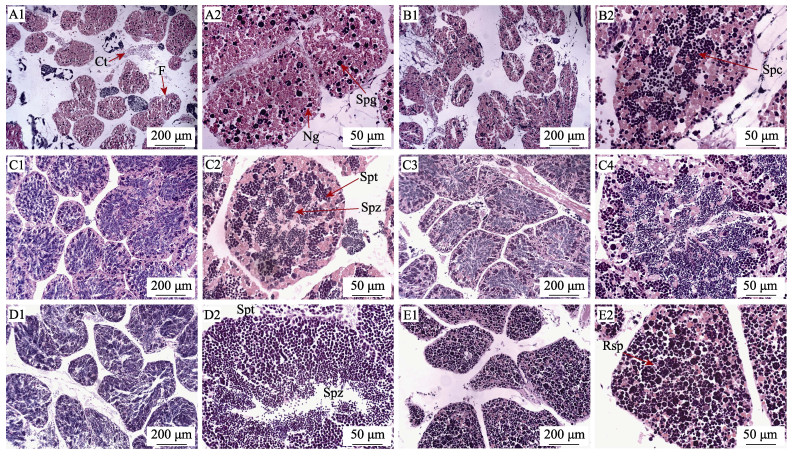
|
图 3 橄榄蛏蚌雄性精巢发育组织学观察 A1-A2:增殖期; B1-B2:生长期; C1-C4:成熟期; D1-D2:排放期; E1-E2:休止期. Ct:结缔组织; F:滤泡; Ng:营养颗粒; Rsp:残留的精子; Spc:精母细胞; Spg:精原细胞; Spt:精子细胞; Spz:精子. Fig.3 Histological section of the testis development of Solenaia oleivora A1-A2: proliferating stage; B1-B2: growing stage; C1-C4: maturing stage; D1-D2: spawning stage; E1-E2: recovering stage Ct: connective tissue; F: follicle; Ng: nutrition granules; Rsp: residual spermatozoa; Spc: spermatocytes; Spg: spermatogonia; Spt: spermatids; Spz: spermatozoa. |
(2) 生长期:从9月至10月中旬, 此期仍不能直接用性腺组织涂片法辨别雌雄。滤泡体积增大, 滤泡之间更加紧密; 在滤泡中央区出现狭长的滤泡腔, 营养颗粒明显减少; 各期精母细胞呈深紫色, 多集中分布在滤泡中央区, 约占滤泡总面积的50%(图 3B1, 图 3B2)。
(3) 成熟期:从10月下旬到第二年3月中旬, 用性腺组织涂片法很容易鉴别雌雄。在滤泡中央区, 已出现成熟的精子, 鞭毛清晰可见, 而滤泡边缘区仍以精母细胞和精子细胞为主(图 3C1, 图 3C2)。在10月下旬仅有少量的成熟精子, 占总面积的10%~30%, 而后期滤泡营养颗粒相应减少, 成熟精子比例逐步增加, 并向中央区形成辐射状排列, 整个滤泡被深染(图 3C3, C4)。
(4) 排放期:从3月下旬至6月初。此期滤泡全部被深染, 营养颗粒几乎全部被吸收、消失, 滤泡中央区有大量成熟精子, 四周仍有大量次级精母细胞和精子细胞(图 3D1, D2);至后期, 随着精子的排出, 滤泡空腔逐渐明显。
(5) 休止期: 6月初至7月。此期滤泡体积收缩, 间距增加, 一部分滤泡内出现空腔; 但滤泡内仍有未排出的精子、精母细胞及精子细胞存在; 而与成熟期分布规律不同, 3类细胞呈均匀分布在滤泡内, 它们逐步被重吸收, 滤泡壁开始增厚, 营养颗粒有所增加, 且滤泡数量逐步减少(图 3E1, E2)。
2.6 性腺组织及细胞形态学观察扫描电镜显示, 橄榄蛏蚌精子为鞭毛型, 全长约44 μm; 成熟精子的头颈部呈子弹头状, 头颈部长约4 μm, 最宽约2 μm, 头部宽度小于颈部; 鞭毛长约40 μm, 极细(图 4A, B, C)。对卵巢组织观察显示, 早期卵母细胞镶嵌在大量的营养颗粒之中, 直径一般小于17 μm, 细胞表面无明显的细胞膜, 表面出现少量不规则的凹陷(图 4D); 随着卵巢不断发育, 后期卵母细胞直径逐渐增大, 当直径近40 μm阶段, 细胞表面出现明显的细胞膜(图 4E), 这与卵巢组织切片(图 2C2)观察结果一致。此外, 在受精卵表面观察到一个明显的圆形卵膜孔, 即受精孔。在卵膜孔四周形成明显的同心圆凹陷区, 直径约7 μm, 卵膜孔边缘有一圈白色突起, 外径为3.2 μm, 内径即卵膜孔直径, 约1 μm(图 4F)。

|
图 4 橄榄蛏蚌精子与卵母细胞形态学观察 A,B,C:排放期; D:生长期; E:成熟期; F:胚胎发育期. Eo:早期初级卵母细胞; Fe:受精卵; Lo:后期初级卵母细胞; Mp:卵膜孔; Sh:精子头部; Spz:精子; Sf:精子鞭毛. Fig.4 Morphological observation of sperm and oocyte in Solenaia oleivora A, B, C: spawning stage; D: growing stage; E: mature stage; F: embryo developmental stage. Eo: early primary oocyte; Fe: fertilized egg; Lo: later primary oocyte; Mp: micropyle; Sh: spermatozoa head; Spz: spermatozoa; Sf: spermatozoa flagellum. |
按繁殖季节、钩介幼虫在育儿囊内存留时间的长短等特征, 蚌类的繁殖类型可分为短期孵育型和长期孵育型[20]。本研究结果表明, 橄榄蛏蚌属于短期孵育型, 以雌蚌怀幼为繁育期第一判定标准, 确定繁殖期为3月至6月初, 且在一个繁殖周期内, 雌蚌可出现1~4次排卵并怀幼, 并以2~3次怀幼为主。同时, 对雌蚌卵巢发育组织学观察发现, 在3月下旬至6月初的排放期, 怀幼雌蚌卵巢中仍存在大量成熟和待成熟卵母细胞, 卵母细胞能持续发育并较快成熟, 这与本研究在繁殖周期内发现的多次怀幼事实相符合, 进一步验证了橄榄蛏蚌为分批成熟多次排卵的繁殖类型。杨小林等[16]依据橄榄蛏蚌肥满度一年中仅出现一个高峰, 推测其为一年产卵一次繁殖类型; 王亚尼[15]对天门河橄榄蛏蚌卵母细胞直径频率分布研究表明, 除5月、6月卵径分布呈现双峰分布特征, 其他月份均为单峰特征, 故推测橄榄蛏蚌为一次排卵类型; 此后夏前征等[17]通过每月肥满度测定分析得到相似的结论, 这些与本研究得出的橄榄蛏蚌多次排卵怀幼的结论不同。鉴于本研究观察到橄榄蛏蚌雌蚌怀幼间隔时间及排放规律, 笔者推测在排放期卵母细胞从到成熟前到成熟的周期较短, 且由于卵径变化不大, 导致天门河橄榄蛏蚌在繁殖期(3月和4月)卵母细胞直径并不表现出明显的双峰特征。
由本研究确定淮河橄榄蛏蚌繁殖周期为3―6月, 与湖北天门河群体(繁殖周期为2―5月)[18]较为接近, 略有差异, 这可能是由于两个群体的积温差异产生, 但与其他研究者依据不完整的生物学信息推测的繁殖周期差异较大[8, 16-17]。本研究组织切片显示, 在繁殖期, 滤泡中卵黄颗粒逐步被消耗而减少, 至繁殖末期甚至完全消失。理论上, 随着双壳贝类的排卵和排精等繁殖活动持续, 亲贝将消耗大量的营养物质用于性腺发育, 肥满度总体呈下降趋势。本研究关于肥满度变化趋势的结果与夏前征等[17]的结果基本相符, 而与杨小林等[16]结果不同。本研究虽然仅测定了8个月份的肥满度, 且显示6月最低, 这与理论推测是一致的, 但其变化幅度仅为6%左右, 显著小于夏前征等[17] 19%~66%的变化幅度。由于采用估算方法相同, 出现较大差异的原因有待探讨。
综合本研究结果得出, 橄榄蛏蚌与刻裂丽蚌(Lamprotula scripta)[25]、三角帆蚌(Hyriopsis cumingii)[10]、真柱矛蚌(Lanceolaria eucylindrica)和剑状矛蚌(L. gladiola)[23]具有相似的繁殖类型, 均为一年中有一个繁殖高峰, 繁殖力较高, 在排放期卵母细胞快速成熟多次排卵并怀幼。蚌类通过这种繁殖类型可提高钩介幼虫遇上特定寄主鱼的几率, 从而利于物种的生存繁衍。
3.2 关于橄榄蛏蚌繁殖力估算问题蚌类繁殖力主要通过卵巢中怀卵量和育儿囊中钩介幼虫数量来估算。其中怀卵量估算可采用重量法、稀释法及酶联免疫吸附等方法[17, 26-27]。但这些方法首先需要选用特定时相(Ⅳ期)的卵巢作为研究材料, 解剖取出整个卵巢, 再进行怀卵量估算。由于蚌类性腺没有完全形成独立的组织, 卵巢与消化道、消化腺等交错弥散分布, 完全准确分离卵巢组织难度较大; 其次, 蚌类性腺发育分期难以界定, 且有些种类存在分批发育多次排卵的现象, 卵母细胞个体差异大, 显著增加了繁殖力估算的难度和不确定性。因此, 笔者认为蚌类繁殖力以雌蚌育儿囊中钩介幼虫的数量, 即怀幼量表示更加科学、简便和准确, 能直接反映出蚌类繁殖力大小。对于多次排卵的蚌类, Bruenderman等[28]认为繁殖力估算需要乘以排卵的频率。橄榄蛏蚌一次怀幼数量可能主要受到亲本营养供给、年龄及水温等条件影响, 但每次怀幼的数量是否存在较大差异还有待进一步研究。
理论上用怀卵量估算的繁殖力应高于用钩介幼虫数量估算的数据。夏前征等[17]用重量法测定橄榄蛏蚌个体绝对繁殖力为40.8万~57.7万粒; 而王亚尼用稀释法估算橄榄蛏蚌绝对繁殖力在29.7万~407.9万粒之间[15], 两者的研究结果存在较大差异。本研究采用第二种方法估算橄榄蛏蚌一次怀幼量在134.9万~402.1万只, 而根据一个繁殖周期内怀幼2~3次推算其繁殖力。
3.3 关于橄榄蛏蚌的卵母细胞结构及受精方式本研究对淮河橄榄蛏蚌性腺发育分期与王亚尼[15]对湖北天门河橄榄蛏蚌种群观察结果基本一致, 但进一步对怀幼雌蚌卵巢发育和卵母细胞发育特征进行比较观察, 为橄榄蛏蚌排卵类型的确认提供了组织学佐证。本研究利用组织切片清晰地观察到橄榄蛏蚌未成熟的卵母细胞通过“瓜蒂状”的卵柄与滤泡壁相连, 这与文蛤的卵母细胞发育特征相似[21], 卵柄横截面直径约5 μm; 当卵母细胞成熟时, 卵柄断裂, 卵母细胞游离于滤泡中。因此在卵细胞表面形成一个明显的卵膜孔, 是卵母细胞附着于滤泡壁的痕迹, 这与先前的经典结论相符[29]。本研究同时表明, 从卵巢生长期(9月中旬)可以明显观察到卵细胞的卵柄结构, 且直至排放末期(翌年6月初)仍明显可见, 推测卵柄可能是蚌类卵母细胞生长发育和营养积累的重要组织结构和通道, 但卵柄是从卵母细胞增殖期就存在还是生长期才出现还有待进一步研究确认。
经典观点认为, 蚌类精子通常在植物极进入卵子, 即通过卵膜孔进入卵母细胞而受精[29]。本研究通过扫描电镜显示, 橄榄蛏蚌成熟精子为鞭毛型, 头部为子弹头形, 头颈部最宽约2 μm; 而在受精卵表面的卵膜孔直径仅1 μm。因此推测橄榄蛏蚌精子不能直接通过卵膜孔完全进入卵母细胞, 可能仅头部或雄性遗传物质进入卵母细胞而启动卵母细胞的第一次减速分裂。在橄榄蛏蚌受精卵的卵膜孔四周边缘存在的白色突起, 其直径与精子的头颈部宽度相似, 这是卵柄断裂时留下的痕迹, 还是精子进入卵母细胞的残留物还有待进一步的研究。
| [1] |
Bogan A E. Freshwater bivalve extinctions (Mollusca:Unionoida) search for causes[J]. Integrative and Comparative Biology, 1993, 33(6): 599-609. |
| [2] |
Bogan A E. Global diversity of freshwater mussels (Mollusca, Bivalvia) in freshwater[J]. Hydrobiologia, 2008, 595(1): 139-147. DOI:10.1007/s10750-007-9011-7 |
| [3] |
Ouyan J X. Studies on molecular phylogeny and genetic diversity of Chinese unionidae animals[D]. Nanchang: Nanchang University, 2011. [欧阳解秀.中国蚌科动物的分子系统进化及遗传多样性研究[D].南昌: 南昌大学, 2011.]
|
| [4] |
International Union for Conservation of Nature (IUCN). The IUCN red list of threatened species[EB/OL]. Version 2019-3. https://www.iucnredlist.org.
|
| [5] |
Zieritz A, Bogan A E, Froufe E, et al. Diversity, biogeography and conservation of freshwater mussels (Bivalvia:Unionida) in East and Southeast Asia[J]. Hydrobiologia, 2018, 810(1): 29-44. DOI:10.1007/s10750-017-3104-8 |
| [6] |
Shu F Y, Wang H J, Pan B Z, et al. Assessment of species status of Mollusca in the mid-lower Yangtze Lakes[J]. Acta Hydrobiologica Sinica, 2009, 33(6): 1051-1058. [舒凤月, 王海军, 潘保柱, 等. 长江中下游湖泊贝类物种濒危状况评估[J]. 水生生物学报, 2009, 33(6): 1051-1058.] |
| [7] |
Liu Y Y, Zhang W Z, Wang Y X, et al. Economic Fauna of China:Freshwater Mollusks[M]. Beijing: Science Press, 1979: 116-117. [刘月英, 张文珍, 王跃先, 等. 中国经济动物志:淡水软体动物[M]. 北京: 科学出版社, 1979: 116-117.]
|
| [8] |
Li C S. Preliminary study on population status and digestive system of Solenaia oleivora in Poyang Lake[D]. Nanchang: Nanchang University, 2012. [李程思.鄱阳湖橄榄蛏蚌(Solenaia oleivora)的种群现状及其消化系统的初步研究[D].南昌: 南昌大学, 2012.]
|
| [9] |
Xu Y. Isolation of microsatellite markers and population genetic diversity analysis in Solenaia oleivora[D]. Wuhan: Huazhong Agricultural University, 2014. [徐艳.橄榄蛏蚌微卫星标记开发及群体遗传多样性分析[D].武汉: 华中农业大学, 2014.]
|
| [10] |
Wen H B. Study of germplasm of major economic freshwater mollusks of China[D]. Nanjing: Nanjing Agricultural University, 2009. [闻海波.我国主要淡水经济贝类的种质资源研究[D].南京: 南京农业大学, 2009.]
|
| [11] |
Xu Q Q, Liu J, He L R. Analysis of meat content and muscular nutrients in Solenaia oleivora[J]. Freshwater Fisheries, 2003, 33(4): 28-29. [许巧情, 刘俊, 贺利容. 橄榄蛏蚌含肉率及肌肉营养成分分析[J]. 淡水渔业, 2003, 33(4): 28-29.] |
| [12] |
Xu Q Q, Liu J, Huang H W. Effects of temperature on oxygen consumption rate and ammonia excretion rate of Solenaia oleivora[J]. Journal of Zhanjiang Ocean University, 2005, 25(1): 51-55. [许巧情, 刘俊, 黄华伟. 温度对橄榄蛏蚌耗氧率和排氨率的影响[J]. 湛江海洋大学学报, 2005, 25(1): 51-55.] |
| [13] |
Xu Q Q, Liu J, Feng K K. Influence of temperature on clearance rate of Solenaia oleivora[J]. Journal of Fishery Sciences of China, 2005, 12(2): 207-210. [许巧情, 刘俊, 冯抗抗. 温度对橄榄蛏蚌滤水率的影响[J]. 中国水产科学, 2005, 12(2): 207-210. DOI:10.3321/j.issn:1005-8737.2005.02.017] |
| [14] |
Huang X C. Complete paternal and maternal mitochondrial genomes of the freshwater mussel genus Solenaia (Unionidae: Gonideinae) in China and mitochondrial phylogenomics of Unionoida[D]. Nanchang: Nanchang University, 2014. [黄晓晨.中国蛏蚌属的父系与母系线粒体基因组全序列及淡水蚌类系统发育基因组学研究[D].南昌: 南昌大学, 2014.]
|
| [15] |
Wang Y N. Reproductive traits of the freshwater mussel Solenaia oleivora (Bivalvia: Unionidae) in the Tianmen River[D]. Wuhan: Huazhong Agricultural University, 2013. [王亚尼.天门河橄榄蛏蚌的繁殖生物学研究[D].武汉: 华中农业大学, 2013.]
|
| [16] |
Yang X L, Li H C, Song L. Gonadal development and growth of freshwater mussel Solenaia oleivora[J]. Fisheries Science, 2011, 30(9): 580-582. [杨小林, 李昊成, 宋浪. 橄榄蛏蚌性腺发育与生长[J]. 水产科学, 2011, 30(9): 580-582.] |
| [17] |
Xia Q Z, Han X Z, Zhu W, et al. Preliminary study on the reproductive biology of Solenaia oleivora[J]. Jiangxi Fishery Science and Technology, 2014, 21(2): 17-19. [夏前征, 韩学忠, 祝玮, 等. 橄榄蛏蚌繁殖生物学的初步研究[J]. 江西水产科技, 2014, 21(2): 17-19.] |
| [18] |
Wang Y N, Zhang G R, Wei K J, et al. Reproductive traits of the threatened freshwater mussel Solenaia oleivora (Bivalvia:Unionidae) from the middle Yangtze River[J]. Journal of Molluscan Studies, 2015, 81(4): 522-526. DOI:10.1093/mollus/eyv016 |
| [19] |
Hua D, Neves R J, Jones J. Age determination of freshwater mussels using the method of thin section[J]. Journal of Fisheries of China, 2001, 25(5): 413-418. [华丹, Neves R J, Jones J. 内部切片法测定淡水贝类的年龄[J]. 水产学报, 2001, 25(5): 413-418.] |
| [20] |
Hua D. Biology, captive propagation, and feasibility of pearl culture in the pink heelsplitter (Potamilus alatus) (Say, 1817) (Bivalvia: Unionidae)[D]. Blacksburg: Virginia Polytechnic Institute and State University, 2005.
|
| [21] |
Lin Z H, Shan L Z, Chai X L, et al. Study of the gonad development and reproductive cycle of Meretrix meretrix Linnaeus[J]. Journal of Fisheries of China, 2004, 28(5): 510-514. [林志华, 单乐州, 柴雪良, 等. 文蛤的性腺发育和生殖周期[J]. 水产学报, 2004, 28(5): 510-514.] |
| [22] |
Herrmann M, Alfaya J E F, Lepore M L, et al. Reproductive cycle and gonad development of the Northern Argentinean Mesodesma mactroides (Bivalvia:Mesodesmatidae)[J]. Helgoland Marine Research, 2009, 63(3): 207-218. DOI:10.1007/s10152-009-0150-2 |
| [23] |
Xu L, Wu X P, Ling G, et al. Reproductive traits and glochidium morphology of Lamprotula leai (Gray)[J]. Journal of Nanchang University (Natural Science), 2013, 37(3): 262-266. [徐亮, 吴小平, 凌高, 等. 背瘤丽蚌繁殖特征及钩介幼虫形态[J]. 南昌大学学报(理科版), 2013, 37(3): 262-266.] |
| [24] |
Wen H B, Hua D, Ma X Y, et al. Byssogenesis in the juvenile pink heelsplitter mussel, Potamilus alatus (Bivalvia:Unionidae)[J]. Journal of Morphology, 2015, 276(11): 1273-1282. DOI:10.1002/jmor.20406 |
| [25] |
Wang Y F, Wei Q S, Stansbery D H. On reproductive biology of Lamprotula scripta Heude[J]. Journal of Huazhong Agricultural University, 1994, 13(2): 170-174. [王玉凤, 魏青山, Stansbery D H. 刻裂丽蚌的繁殖生物学[J]. 华中农业大学学报, 1994, 13(2): 170-174.] |
| [26] |
Yu Y, Hong Y J, Qiu Q J, et al. Embryonic development and breeding season gonad in Hyriopsis schlegeli[J]. Chinese Journal of Zoology, 2008, 43(3): 102-107. [余颖, 洪一江, 邱齐骏, 等. 池蝶蚌胚胎发育与繁殖季节性腺的观察[J]. 动物学杂志, 2008, 43(3): 102-107.] |
| [27] |
Ngo T T T, Kang S G, Kang D H, et al. Effect of culture depth on the proximate composition and reproduction of the Pacific oyster, Crassostrea gigas from Gosung Bay, Korea[J]. Aquaculture, 2006, 253(1-4): 712-720. DOI:10.1016/j.aquaculture.2005.09.009 |
| [28] |
Bruenderman S A, Neves R J. Life history of the endangered fine rayed pigtoe Fusconaia cuneolus (Bivalvia:Unionidae) in the Clinch River, Virginia[J]. American Malacological Bulletin, 1993, 10: 83-91. |
| [29] |
Shanghai Fisheries College. Histoembryology[M]. Beijing: Agriculture Press, 1981. [上海水产学院. 组织胚胎学[M]. 北京: 农业出版社, 1981.]
|
 2020, Vol. 27
2020, Vol. 27

