三角鲂(Megalobrama terminalis)隶属鲤科(Cyprinidae), 鲌亚科(Culterinae), 鲂属, 广泛分布于中国的各主要水系, 为重要的淡水中大型经济鱼类[1]。近年来, 受环境污染、过度捕捞等因素的影响, 三角鲂的栖息范围逐年缩小, 其自然种群的数量急剧减少。现仅在黑龙江、钱塘江和湖北金沙河水库有少量分布[2]。自20世纪八、九十年代开始, 中国学者就完成了钱塘江和金沙河水库三角鲂的人工繁殖, 并在此基础上开展了很多保种繁育、养殖推广、营养需求、种质评价等方面的研究[3-4]。历史上, 产自黑龙江流域的三角鲂也被称作法罗鱼, 是名贵的“三花五罗”之一, 深受消费者喜爱。法罗鱼曾广泛分布于黑龙江、松花江、嫩江、镜泊湖和兴凯湖[5-7], 但目前仅在黑龙江有少量分布, 其种质资源已接近枯竭。作为黄河以北唯一自然分布的鲂属鱼类, 法罗鱼的黑龙江种群(M. terminalis in the Heilong River, MTH)具有重要的经济、生态和科研价值。由于资源稀少, 样本采集困难, 有关该鱼的研究十分有限, 仅王志远等[8]于20世纪90年代初基于少量野生个体进行过形态学的初步研究。最近, Hu等[9]揭示了MTH的线粒体基因组特征, 鉴定出1个MTH区别于鲂属4个种6个群体的特异性标记。在线粒体水平厘清了MTH和其他鲂属种类的系统发生关系。2018年和2019年, 黑龙江水产研究所分别在产地(抚远)和宽甸基地开展MTH的人工繁殖, 均获得了成功[10]。由于MTH卵膜较厚, 在胚胎发育至原肠胚及后期的形态不易观察, 本研究对MTH的胚胎进行去膜培养, 并形成完整的胚胎及早期仔鱼发育观察记录, 以期为MTH的资源保护和苗种培育提供科学依据。
1 材料与方法 1.1 实验鱼及受精卵获取实验鱼于2018年取自黑龙江抚远江段, 为基本达到性成熟的野生亲鱼, 在黑龙江水产研究所宽甸水产试验站池塘进行驯养。于2019年5月在试验站产孵车间对亲鱼(2.3~3.0 kg)进行人工催产, 观察到亲鱼开始产卵后, 挤出卵和精液, 完成干法授精, 取受精卵约10000粒, 用于胚胎发育观察。
1.2 胚胎及早期仔鱼发育观察每次取约60粒卵, 置入2个培养皿中, 用控温仪使水温保持在(23.5±1.0) ℃, 在解剖镜(OLYMPUS, SZX2-TR30, 日本)下观察胚胎及早期仔鱼发育的全过程, 利用cellSens Entry软件拍照, 测量卵径、仔鱼全长和卵黄囊长径。胚胎发育各时期的确定以观察的样本中50%以上达到该时期为准。在多细胞发育期后, 为增加辨认准确度, 采用去膜的受精卵进行观察。受精卵去膜参照朱作言[11]的方法略有改动:卵子在受精约5 min后, 将其置入使用Holtfreter氏液配制的0.25%胰蛋白酶溶液中处理约10 min。轻轻摇晃, 当观察到卵附着能力减弱, 卵膜变薄、变皱后, 用解剖针将膜小心剥落。接着用吸管将无膜的卵吸入一个盛有Holtfreter氏液的新培养皿中, 处理结束后, 再对所有无膜卵用Holtfreter氏液进行清洗, 用于后序观察。当胚胎发育至尾芽期时, 用曝气的冷开水对培养液进行逐级稀释, 并与孵化桶中的对照组(未去膜卵)相比较。
仔鱼在人工控制的(25.5±1.0) ℃水族箱内培育。为观察仔鱼摄食情况, 利用锥形专用瓶孵化丰年虫, 每升水放入20 g盐和2 g虫卵, 将孵化水温控制在28 ℃, 保持LED光源及充气状态。
1.3 数据处理本研究用于卵径及各发育阶段的仔鱼全长和卵黄囊长径测量的样本数均为20个。利用Excel 2013进行数据处理, 结果以平均数±标准差(x± SD)来表示。
2 结果与分析 2.1 去膜卵培育本实验获得了一定数量处于相同发育阶段的去膜卵(图 1), 在Holtfreter氏液中可正常发育。
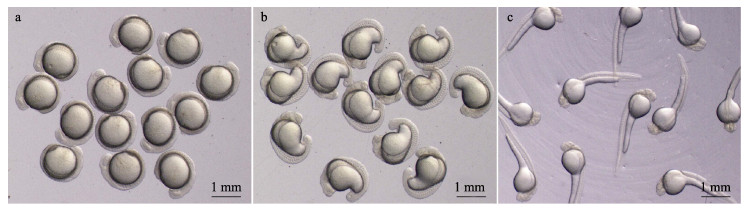
|
图 1 黑龙江三角鲂去膜卵的培育 A.尾芽期; b.尾泡期; c.耳石形成期. Fig.1 Culture of chorion-free eggs of Megalobrama terminalis from the Heilong River a. Tail bud period; b. Tail vesicle period; c. Otoliths formation period. |
MTH胚胎在水温(23.5±1.0) ℃的条件下, 历时30 h 10 min完成整个发育过程。
2.2.1 卵裂前受精卵: MTH卵为球形, 浅黄色, 具黏沉性; 卵膜较厚, 半透明。卵遇水后即开始膨胀, 20~30 min时卵径达到最大。吸水后平均卵径为(1.38±0.06) mm, 卵黄周隙较小(图 2a)。
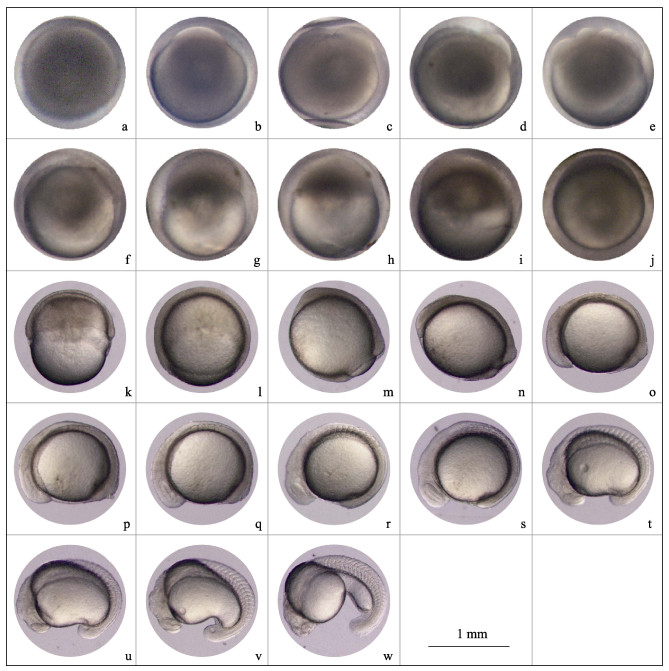
|
图 2 黑龙江三角鲂部分胚胎发育时期的形态特征 a.受精卵; b.胚盘形成期; c. 2细胞期; d. 4细胞期; e. 8细胞期; f.多细胞期; g.囊胚早期; h.囊胚中期; i.囊胚晚期; j.原肠早期; k.原肠中期; l.原肠晚期; m.神经胚期; n.胚孔封闭期; o-p.肌节和眼基形成期; q-r.视囊形成期; s.尾芽期; t.听囊期; u-v.尾泡期; w.肌肉效应期. Fig.2 Morphological characteristics of partial periods of embryonic development of Megalobrama terminalis from the Heilong River a. Fertilized egg; b. Blastodisc formation period; c. 2-cell period; d. 4-cell period; e. 8-cell period; f. Multicellular period; g. Early-blastula period; h. Mid-blastula period; i. Late-blastula period; j. Early-gastrula period; k. Mid-gastrula period; l. Late-gastrula period; m. Neurula period; n. Blastopore closing period; o-p. Myomere and eye rudiment formation period; q-r. Eye vesicle formation period; s. Tail bud period; t. Otocyst period; u-v. Tail vesicle period; w. Muscle contraction period. |
胚盘形成期:受精后55 min, 卵子原生质由均匀分布向动物极集中, 在卵黄体上部隆起一个帽状的胚盘(图 2b)。
2.2.2 卵裂2细胞期:受精后1 h 5 min, 开始第一次卵裂, 胚盘中央凹陷, 形成卵裂沟且向中间逐渐加深, 胚盘被切割为2细胞(图 2c);
4细胞期:受精后1 h 15 min, 第二次卵裂开始, 在与第一卵裂沟垂直方向出现第二卵裂沟, 胚盘被切割为4细胞(图 2d);
8细胞期:受精后1 h 30 min, 第三次卵裂发生, 在与第一卵裂沟平行方向形成第三和第四卵裂沟, 4细胞胚盘被切割为8细胞(图 2e);
多细胞期:受精后2 h 50 min, 卵经多次分裂进入多细胞期(图 2f)。
2.2.3 囊胚囊胚早期:受精后4 h 20 min, 可见囊胚层在卵黄上高高隆起, 囊胚分裂球界限明显, 但与卵黄交界处模糊不清, 表层细胞界限依稀可见(图 2g);
囊胚中期:受精后4 h 40 min, 囊胚层开始变薄, 囊胚细胞向卵黄球扩散, 细胞界限不清(图 2h);
囊胚晚期:受精后5 h 10 min, 囊胚细胞沿卵黄球继续向下扩散, 胚层逐渐变得扁平并加宽, 逐渐包围卵黄球(图 2i)。
2.2.4 原肠胚原肠早期:受精后5 h 40 min, 可见部分囊胚细胞向内卷入, 受到卵黄的阻挡形成月芽状的胚环, 下包卵黄的1/3(图 2j);
原肠中期:受精后7 h, 囊胚下包卵黄的1/2, 胚环边缘变厚, 形成胚盾(图 2k);
原肠晚期:受精后8 h 20 min, 囊胚继续下包卵黄的3/4(图 2l)。
2.2.5 神经胚神经胚期:受精后9 h 10 min, 囊胚下包卵黄的4/5, 粗细不匀, 可见较粗的部分出现细线状不连续分布的原始神经; 卵黄呈梨形, 外露部分为卵黄栓(图 2m);
胚孔封闭期:受精后10 h 10 min, 囊胚继续下包, 卵黄栓逐步消失。在卵黄栓中心形成圆形的胚孔, 胚孔逐渐变小, 最终完全封闭(图 2n)。
2.2.6 器官形成肌节和眼基形成期:受精后11 h 30 min, 胚体环抱卵黄, 在胚体中央清晰可见2对肌节。头尾大小相似, 比胚孔封闭时有所靠近, 但仍保持一定距离。头部前端未观察到明显抬起, 出现椭圆形眼基(图 2 o)。肌节发育至4对时, 可见眼基轮廓更为明显(图 2p);
视囊形成期:受精后12 h, 头部比尾部略粗, 且头部前端抬起, 稍高于尾部, 头尾更接近。脑部分化为较原始的前、中、后三部分。视囊清晰, 为长椭圆形, 肌节发育至5对(图 2q~r)。
尾芽形成期:受精后13 h 25 min, 肌节发育至10对, 眼的腹下方形成一长圆形的嗅板。在靠近尾部末端的胚体和卵黄之间可见将二者分开的膜状结构, 形成尾芽(图 2s);
听囊形成期:受精后14 h 40 min, 肌节发育至15对时, 可见头部胚体略变细, 眼角与胚体的角度变大, 在脊索前部形成长圆形听囊。尾部将胚体和卵黄分开的膜状结构继续向上延伸(图 2t);
尾泡形成期:受精后15 h 20 min, 肌节发育至18对, 尾部变粗, 尾泡出现。与尾部末端相接触的卵黄向内凹陷, 卵黄形状向肾形转变(图 2u)。肌节发育至20对时, 卵黄结构发生明显变化, 在尾部位置发生较大程度的内凹, 尾部末端开始脱离卵黄, 尾鳍基形成(图 2v);
肌肉效应期:受精后16 h 15 min, 肌节发育至25对, 胚体出现间歇性颤动, 每分钟约20次。尾鳍出现鳍褶, 尾泡消失。卵黄前半部分近圆形, 后半部分为弯曲的棒状(图 2w);
心脏原基期:受精后18 h 20 min, 肌节发育至30对, 心脏原基出现。卵黄前半部分仍为近圆形, 后半部分仍为棒状, 但拉长变细, 尾鳍出现(图 3a);
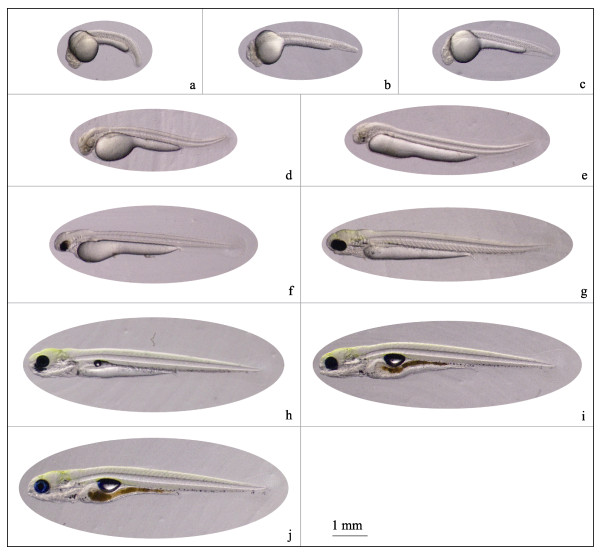
|
图 3 黑龙江三角鲂的部分胚胎发育时期及早期仔鱼发育的形态特征 a.心脏原基期; b.耳石形成期; c.心脏搏动期; d.出膜仔鱼; e.出膜12h仔鱼; f.出膜36 h仔鱼; g.出膜60 h仔鱼; h.出膜84 h仔鱼; i.出膜96 h仔鱼; j.出膜144 h仔鱼. Fig.3 Morphological characteristics of partial periods of embryonic development and early larval development of Megalobrama terminalis from the Heilong River a. Heart rudiment period; b. Otoliths formation period; c. Heart pulsation period; d. Hatching larva; e. 12 h after hatching (HAH); f. 36 HAH; g. 60 HAH; h. 84 HAH; i. 96 HAH; j. 144 HAH. |
耳石形成期:受精后21 h 50 min, 肌节发育至35对, 听囊中出现耳石(图 3b);
心脏搏动期:受精后23 h 10 min, 卵黄前上方心脏开始有节律地跳动, 每分钟跳动70~80次, 肌节为37对(图 3c)。
2.2.7 出膜出膜前期:受精后24 h 30 min, 进入出膜前期, 尾鳍分化明显且向背方翘起, 泄殖腔出现。背鳍出现, 且与尾鳍相连。未去卵膜的胚体在膜内不时扭动、旋转。
出膜期:受精后30 h 10 min, 胚体离开卵膜, 尾部依然向背方举起, 此时肌节达到43对。卵黄前端为椭圆形, 后端变细延长呈棒状。除眼球腹面内侧出现一对黑点外, 全身透明无色。仔鱼全长为(4.33±0.16) mm, 卵黄囊长径为(2.46± 0.10) mm (图 3d)。
2.3 早期仔鱼发育 2.3.1 眼色素增多期出膜12 h后, 仔鱼全长为(5.41±0.16) mm, 卵黄囊长径为(3.00±0.10) mm。与出膜时相比, 卵黄前端的圆球明显变细, 长径增长, 眼腹面内侧颗粒状黑点增大(图 3e), 背、臀和尾鳍鳍褶连成一片。出膜36 h后, 仔鱼全长为(5.86±0.16) mm, 卵黄囊长径为(3.00±0.11) mm, 继续被吸收变细。眼黑色素明显增多, 眼眶周围向头部方向形成少量黄色素。尾鳍扇形轮廓形成, 背、尾鳍在近尾处出现一个凹陷, 口咽腔出现(图 3f)。
2.3.2 体色素增多期出膜60 h后, 仔鱼全长为(6.68±0.25) mm, 卵黄囊长径为(2.94±0.12) mm, 眼因积累大量黑色素而完全变黑, 口裂形成。头部骨骼形成, 能看到4块鳃板, 头部及颈部后缘、胸腔前部及背部有不连续的黄、黑色素, 其中头部黄色素较集中。消化道形成, 且沉积较多黑色素, 卵黄囊进一步被吸收(图 3g)。
2.3.3 鳔出现期出膜84 h后, 仔鱼全长为(7.05±0.15) mm, 卵黄囊长径为(2.63±0.11) mm, 黑色的鳔出现。仔鱼头部黄色素沉积较多, 颜色加深。端口位形成, 消化道发育完整, 从口咽腔、消化道到尾部, 均沉积大量黑色素。胸鳍呈扇状, 分向身体两侧(图 3h)。
2.3.4 鳔充气期出膜96 h后, 仔鱼全长为(7.11±0.26) mm, 卵黄囊长径为(2.55±0.11) mm, 鳔充气膨大, 位于鳔后部的卵黄及消化道有较多黑色素沉积。卵黄囊仅余狭窄的条状, 消化道发育完整。此时, 仔鱼已平游, 并出现追食和摄食行为, 进入混合营养期(图 3i)。
2.3.5 卵黄囊完全吸收期出膜后144 h后, 仔鱼全长为(7.73±0.20) mm, 卵黄囊被完全吸收, 开始依赖外源营养存活(图 3j)。
3 讨论黑龙江三角鲂(MTH)产黏沉性卵, 这与以往在三角鲂的其他种群及鲂属其他种类中的报道一致[12-20], 但与已有报道的MTH产浮性卵的结论不同[5-8]。有些产黏沉性卵鱼类, 例如厚颌鲂(Megalobrama pellegrini), 其受精卵可顺水漂散, 并黏附于河底沙砾或石质河床上孵化[19]。在抚远江段, 采捕到接近成熟的三角鲂相对较多, 该江段水流湍急, 沿岸无草本植物, 因此容易误认为其产浮性卵。由于以前的调查在进行之时并未完成MTH人工繁殖, 因此导致该误判的根本原因是MTH数量太少, 难以确认其产卵场。本研究在进行MTH人工繁殖时发现, 该鱼在产卵池可将卵产于棕榈皮制作的人工鱼巢上, 可见其在自然条件下的产卵场很可能位于水草繁茂的浅水域。
MTH受精卵吸水后卵径仅为1.4 mm左右, 且卵膜较厚, 在正常情况下, 很难准确判断胚胎发育阶段。本研究参考朱作言[11]的方法, 完成了MTH卵的去膜。为保证胚胎发育各时期的准确判断, 需获得一定数量同步发育的去膜卵。快速且精确的操作技术是保证去膜卵在后续的培育过程中正常发育的关键。MTH去膜卵可在Holtfreter氏液中正常发育, 且与同期放在孵化桶中的卵发育同步, 这与以往在胡子鲇(Clarias fuscus)[11]及翘嘴鲌(Culter alburnus)[21]等淡水鱼中的报道一致。与以往在鲤(Cyprinus carpio L.)人工授精操作中得到的经验不同, MTH新挤出的卵密封保存于4 ℃冰箱内的时间不宜过长, 如存放超过2 h, 则会发现卵明显变干而不再滑润, 受精后黏性下降, 且部分卵的形状变得不规则, 此时大部分胚胎不能正常发育。因而, 须注意在挤卵后迅速开展胚胎发育观察及去膜操作实验。
中国学者在20世纪八、九十年代开展过三角鲂的胚胎发育研究[12-14], 实验材料均来自湖北红安县金沙河水库。由于水温关系, MTH胚胎不同发育时期的时间与万成炎等[12]的结果最为接近, 而与林永泰[13]和赵俊等[14]的研究有一定差异。从卵裂到神经胚阶段, 本研究在MTH中观察到的形态特征与以往在金沙河水库三角鲂中的研究基本一致。然而, 在器官形成阶段, 本研究的部分结果与已报道的结果有较大出入。如针对三角鲂胚胎发育器官形成阶段的肌节数目, 万成炎等[12]的描述为:在肌节形成期的肌节数为5对; 眼基形成期的肌节数是7对; 尾泡出现期的肌节数为20对; 心脏原基形成期的肌节数为33对。在以上各时期, 本研究对MTH的观察结果为:肌节出现和眼基形成两个时期重叠, 在肌节为2对时, 眼基轮廓已出现; 而当肌节为4对时, 眼基已较明显; 在肌节为18对时, 尾泡即已形成; 而当肌节为30对时, 心脏原基已形成。尽管万成炎等[12]和赵俊等[14]均对卵作了去膜处理, 但早期研究可能受拍摄条件限制, 均未对胚胎发育各阶段实时拍摄, 这对某些发育时期的判定可能有一定影响。本实验对去膜卵在原肠胚及后期不同发育阶段进行拍摄, 获得大量具有较高分辨率的图片, 并对其进行后期分析, 该操作在胚胎发育不同时期起始特征的判定上更有优势。
MTH仔鱼从鳔出现到充气膨大需经历约12 h (即出膜后96 h), 而后仔鱼方能完成摄食行为, 此时卵黄囊未被完全吸收; 进入混合营养期, 再经历48 h (即出膜后144 h), 卵黄囊才被完全吸收。该过程的观察比以往在金沙河水库三角鲂中的研究更全面, 且反映出二者不同的生物学特征。如林永泰等[13]观察到金沙河水库三角鲂仔鱼在鳔形成时已有部分充气, 且部分仔鱼开始摄食, 从这时到卵黄囊被完全吸收的时间仅为24 h。赵俊等[14]对金沙河水库三角鲂的观察结果为, 仔鱼出膜后40 h, 鳔尚未出现前即进入混合营养期, 而从鳔出现(出膜后74 h)到卵黄囊被完全吸收(出膜后120 h)历时46 h。在混合营养期的发育阶段问题上, 赵俊等[14]的观察结果不符合淡水鱼的一般发育规律, 且与本研究和林永泰等[13]的结果均不同, 其原因尚需进一步探讨。值得关注的是, MTH仔鱼从具备摄食能力到卵黄囊被完全吸收的时间明显长于金沙河水库三角鲂。据课题组2018年在产地(抚远)完成人工繁殖的时间推测, MTH在黑龙江的产卵时间应至少在6月中旬之后, 此期间黑龙江水温正处于一年中相对较高的阶段, 再结合本次和以往三角鲂胚胎发育研究的温度控制可知, MTH仔鱼混合营养期更长的原因可能并非完全源于水温, 而可能还与其栖息地的摄食环境和饵料丰度有关。考虑到黑龙江和金沙河水库三角鲂的生存条件差异, 本研究推测, MTH更长的混合营养期可能降低了仔鱼在短时间内摄食不到外源营养而死亡的风险, 从而提高了存活机会, 但其确切机制仍有待于深入研究。在养殖生产方面得出结论, MTH仔鱼在出膜后96~144 h期间适宜转入池塘进行夏花培育。
现有资料显示, 法罗鱼仅存黑龙江1个种群(MTH), 作为中国分布纬度最高的鲂属鱼类, MTH是人工繁殖完成时间最晚、基础研究最薄弱、最需保护的三角鲂地理种群。本研究完成了MTH受精卵去膜后的胚胎发育观察, 并探讨了其早期仔鱼的发育特点, 期望对三角鲂黑龙江种群的人工繁殖及其规模化制种提供科学的参考依据。
| [1] |
Chen Y Y. Fauna Sinica:Osteichthyes Cypriniformes Ⅱ[M]. Beijing: Science Press, 1998: 204. [陈宜瑜. 中国动物志:硬骨鱼纲鲤形目(中卷)[M]. 北京: 科学出版社, 1998: 204.]
|
| [2] |
Liu X Y, Xie N, Ma H J, et al. Overview of germplasm characteristics of 4 fish species in the genus Megalobrama[J]. Hangzhou Agriculture Science and Technology, 2016(6): 41-43. [刘新轶, 谢楠, 马恒甲, 等. 鲂属4种鱼类种质特性概述[J]. 杭州农业与科技, 2016(6): 41-43.] |
| [3] |
Feng X Y. Research progress and demonstration extention situation of black bream (Megalobrama terminalis) in Zhejiang Province[J]. Scientific Fish Farming, 2009(10): 40-41. [冯晓宇. 浙江省三角鲂研究进展及示范推广情况[J]. 科学养鱼, 2009(10): 40-41.] |
| [4] |
Guan W Z, Zheng G D, Wu C B, et al. Comparative analysis of growth and morphological variations among Megalobrama amblycephala, M. terminalis, Parabramis pekinensis and their hybrids[J]. Journal of Fishery Sciences of China, 2017, 24(1): 31-39. [关文志, 郑国栋, 吴成宾, 等. 团头鲂与三角鲂或长春鳊杂交后代的生长及形态对比分析[J]. 中国水产科学, 2017, 24(1): 31-39.] |
| [5] |
Zhang J M. Fishes of the Heilongjiang Province[M]. Harbin: Heilongjiang Science & Technology Press, 1985: 121. [张觉民. 黑龙江省鱼类志[M]. 哈尔滨: 黑龙江科学技术出版社, 1985: 121.]
|
| [6] |
Ren M L. Ichthyofauna of the Heilongjiang River[J]. Chinese Journal of Fisheries, 1994, 7(1): 1-14. [任慕莲. 黑龙江的鱼类区系[J]. 水产学杂志, 1994, 7(1): 1-14.] |
| [7] |
Ren M L. Fish Species in Heilongjiang River[M]. Harbin: Heilongjiang People's Publishing House, 1981: 101. [任慕莲. 黑龙江鱼类[M]. 哈尔滨: 黑龙江人民出版社, 1981: 101.]
|
| [8] |
Wang Z Y, Yang D Y, Zhang Z H, et al. The preliminary study on Megalobrama skolkovii Dybowsky from Heilongjiang River[J]. Fisheries of Heilongjiang, 1993, S1: 10-13. [王志远, 杨达予, 张志华, 等. 黑龙江鲂初步研究[J]. 黑龙江水产, 1993, S1: 10-13.] |
| [9] |
Hu X S, Luan P X, Cao C H, et al. Characterization of the mitochondrial genome of Megalobrama terminalis in the Heilong River and a clearer phylogeny of the genus Megalobrama[J]. Scientific Reports, 2019, 9: 8509. DOI:10.1038/s41598-019-44721-2 |
| [10] |
Hu X S, Xu C X. Success of artificial breeding in black bream (Megalobrama terminalis) in the Heilong River[J]. Fisheries Science & Technology Information, 2019, 46(4): 236-237. [胡雪松, 徐承旭. 法罗鱼人工繁殖获得成功[J]. 水产科技情报, 2019, 46(4): 236-237.] |
| [11] |
Zhu Z Y. Embryonic development of Clarias fuscus (Teleostei siluriformes)[J]. Acta Hydrobiologica Sinica, 1982, 7(4): 445-451. [朱作言. 胡子鲶的胚胎发育[J]. 水生生物学集刊, 1982, 7(4): 445-451.] |
| [12] |
Wan C Y, Lin Y T, Huang D M. Embryonic development of Megalobrama skolkovii[J]. Journal of Lake Sciences, 1999, 11(1): 70-74. [万成炎, 林永泰, 黄道明. 鲂胚胎的发育[J]. 湖泊科学, 1999, 11(1): 70-74.] |
| [13] |
Lin Y T, Wan C Y, Huang D M, et al. Artificial breeding and embryonic development of black bream (Megalobrama terminalis)[J]. Reservoir Fisheries, 1989(2): 28-31. [林永泰, 万成炎, 黄道明, 等. 三角鲂人工繁殖和胚胎发育[J]. 水利渔业, 1989(2): 28-31.] |
| [14] |
Zhao J, Wang C, Chen X L, et al. Observation on the embryonic and larval development of Megalobrama skolkovii Dybowsky[J]. Journal of South China Normal University (Natural Science Edition), 1994, 26(2): 51-59. [赵俊, 王春, 陈湘麟, 等. 鲂鱼(Megalobrama skolkovii)早期发育的研究[J]. 华南师范大学学报:自然科学版, 1994, 26(2): 51-59.] |
| [15] |
Cao W X. A biological study of Magalobrama amblycephala and M. terminalis of Liangzi Lake[J]. Acta Hydrobiologica Sinica, 1960(1): 58-78. [曹文宣. 梁子湖的团头鲂与三角鲂[J]. 水生生物学集刊, 1960(1): 58-78.] |
| [16] |
Yu M, Fang J, Xue T, et al. Embryonic development of Megalobrama amblycephala and optimization on the observation method[J]. Journal of Henan Normal University:Natural Science Edition, 2018, 46(1): 89-94. [于淼, 方健, 薛亭, 等. 团头鲂的胚胎发育与观察方法优化[J]. 河南师范大学学报:自然科学版, 2018, 46(1): 89-94.] |
| [17] |
Yu P C, Zhang F W. Observations on the embryonic development of Megalobrama amblycephala in the fishing areas of Poyang Lake[J]. Journal of Fishery Sciences of China, 1998, 5(1): 103-108. [虞鹏程, 张丰旺. 鄱阳湖渔区的团头鲂胚胎发育观察[J]. 中国水产科学, 1998, 5(1): 103-108.] |
| [18] |
Li J, Zhang H M. Observation on the embryonic and larval development of blunt snout bream (Megalobrama amblycephala)[J]. Fisheries Science & Technology Information, 1993, 20(4): 158-163. [李军, 张海明. 团头鲂胚胎及仔稚鱼发育观察[J]. 水产科技情报, 1993, 20(4): 158-163.] |
| [19] |
Wang J W, Tan D Q, Li W J. Preliminary studies on artificial propagation and embryonic development of Megalobrama pellegrini[J]. Acta Hydrobiologica Sinica, 2005, 29(2): 130-136. [王剑伟, 谭德清, 李文静. 厚颌鲂人工繁殖初报及胚胎发育观察[J]. 水生生物学报, 2005, 29(2): 130-136.] |
| [20] |
Pang S X, Xie G, Xu S Y, et al. Studies on the whole artificial propagation of Megalobrama hoffmanni[J]. Journal of Shanghai Fisheries University, 1998, 7(1): 19-24. [庞世勋, 谢刚, 许淑英, 等. 广东鲂全人工繁殖的研究[J]. 上海水产大学学报, 1998, 7(1): 19-24.] |
| [21] |
Huang Y L, Peng M, He A Y, et al. Embryonic development of Culter alburnus[J]. Journal of Guangxi Academy of Sciences, 2005, 21(3): 24-28. [黄玉玲, 彭敏, 何安尤, 等. 翘嘴红鲌胚胎发育研究[J]. 广西科学院学报, 2005, 21(3): 24-28.] |
 2020, Vol. 27
2020, Vol. 27

