2. 水利部水工程生态效应与生态修复重点实验室, 水利部中国科学院水工程生态研究所, 湖北 武汉 430079;
3. 修文县农业局 贵州 贵阳 550200
2. Key Laboratory of Ecological Impacts of Hydraulic-projects and Restoration of Aquatic Ecosystem of Ministry of Water Resources; Institute of Hydroecology, Ministry of Water Resources and Chinese Academy of Sciences, Wuhan 430079, China;
3. Xiuwen Agricultural Bureau, Guiyang 550200, China
鱼类形态特征作为辨识鱼类不同种群的依据, 不仅是研究短期内环境变异对鱼体表型可塑性影响的重要工具, 也是进行鱼类资源管理的有利工具[1-3]。研究表明, 不同采样区域鱼类在形态上的稳定变异能够揭示不同区域种群在生长、死亡以及繁殖特征上的差异, 进而形成与当地环境相适应的地理种群[3-6]。因此, 对不同地理种群形态变异的研究, 可以为种质资源鉴别及评价、良种选育和资源保护提供理论依据[3, 6]。在对不同地理种群的形态变异的识别研究中, 除遗传学方法外[7-8], 基于传统形态学和框架结构数据的多元分析法也已在国内外不同鱼类形态变异识别中被广泛运用[2-4, 6, 9-10]。
大眼鳜(Siniperca kneri)隶属于鲈形目(Perci formes), 鮨科(Serranidae), 鳜属, 是淡水鱼类中的名贵品种[10-12], 其分布于中国淮河水系以南的大小河流和湖泊中, 为中国南方特有种[10, 12]。目前, 有关大眼鳜的年龄生长、繁殖特征、遗传结构等方面已有较多研究[13-15], 但关于不同地理区域大眼鳜的形态学差异, 仅有杨慧荣等[10]对珠江流域3条主要河流群体的比较研究, 缺乏对长江流域相关河流群体的比较研究, 特别是长江流域群体与珠江流域群体的形态学比较研究。作为大眼鳜的主要分布区域之一, 贵州省内的乌江、锦江分别为长江、沅水的一级支流, 其均位于长江流域内, 而境内的北盘江则属于珠江流域西江上源红水河的大型支流, 其可以近似代表珠江流域的大眼鳜群体[8, 11], 因此对这3条河流大眼鳜群体的形态学比较, 可以分析比较不同流域之间大眼鳜的形态变异。本研究将传统形态学测定和框架测量相结合, 采用主成分分析和判别分析等多元分析法, 从不同方向定量比较长江和珠江流域大眼鳜群体的形态差异性, 并通过筛选群体形态差异显著的指标建立不同群体外形特征判别函数, 旨在为不同区域大眼鳜种群的鉴别及区分、良种的选育和资源的保护提供基础数据支撑。
1 材料与方法 1.1 样本采集野生大眼鳜采自3个国家级水产种质资源保护区, 共计233尾。其中, 乌江黄颡鱼国家级水产种质资源保护区沿河县城河段70尾, 体长10.60~ 26.30 cm, 体重26.80~438.30 g; 锦江河特有鱼类国家级水产种质资源保护区铜仁段32尾, 体长19.50~25.10 cm, 体重191.40~400.10 g; 北盘江九盘段特有鱼类国家级水产种质资源保护区关岭段131尾, 体长11.10~19.00 cm, 体重40.76~211.35 g。
1.2 参数测量测定了传统形态学和框架结构的25个参数[3, 10, 16], 共5825条数据, 分为10项常规可量性状以及15项框架结构性状。
常规可量性状:全长(TL)、体长(BL)、体高(BD)、体宽(BW)、头长(HL)、吻长(SL)、眼径(ED)、眼间距(ID)、尾柄长(CPL)、尾柄高(CPW), 共10项(图 1)。距离采用电子数显卡尺测量, 精确度为0.1 mm。重量采用电子天平称量, 精确到0.1 g。

|
图 1 大眼鳜形态测量 TL:全长; BL:体长; BD:体高; HL:头长; SL:吻长; ED:眼径; CPL:尾柄长; CPW:尾柄高. Fig.1 Measurements on Siniperca kneri TL: total length; BL: body length; BD: body depth; HL: head length; SL: snout length; ED: eye diameter; CPL: caudal peduncle length; CPW: caudal peduncle width. |
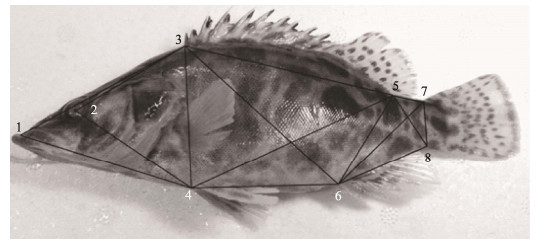
框架结构性状:设置8个解剖学坐标点1~8, 测量15个框架结构性状1-3~6-8 (图 2)。
|
图 2 大眼鳜框架结构示意图
8个解剖学同源坐标点, 1:吻前端; 2:眼径中点; 3:背鳍基部起点; 4:腹鳍基部起点; 5:背鳍基部后末端; 6:臀鳍基部起点; 7:尾鳍基部背部起点; 8:尾鳍基部腹部起点. Fig.2 Frame structure diagram of Siniperca kneri Eight landmarks of anatomy, 1: tip of snout; 2: middle of eye diameter; 3: origin of dorsal fin base; 4: origin of pelvic fin base; 5: posterior end of dorsal-fin base; 6: origin of anal fin base; 7: dorsal origin of caudal fin base; 8: ventral origin of caudal fin base. |
为了消除鱼体规格大小对实验结果的影响, 将除体长外的24个传统可量性状和框架数据除以体长并采用下式进行标准化:
| ${M_{{\text{ad}}}}_{\text{j}} = \lg \left( {\frac{M}{{BL}} + 1} \right)$ |
式中, M为原始测量数据; Madj为标准化后的数据; BL为体长(cm)。
基于标准化的数据, 采用单因素方差分析方法(one-way ANOVA)筛选在3个采样区域间具有显著差异的参数[17]。基于单因素方差分析的结果, 采用Pearson相关性法筛选反映信息独立性的参数, 并剔除反映冗余信息的参数, 以减少参数的多重共线性[17]。
1.3.2 主成分分析基于所选择的参数, 运用主成分分析法对233尾样品标准化后的数据进行分析。首先采用KMO和Bartlett’s球度检验确定所分析数据对于主成分分析的适合情况, 其中, KMO值越接近1以及Bartlett’s球度检验显示的P值小于0.05, 均表明所分析的数据适合进行主成分分析[3, 10, 17]。通过建立相关系数矩阵, 以主成分法提取公因子, 选择特征值大于1的因子为主要因子, 并采用方差最大正交旋转法(varimax)对因子负荷矩阵进行旋转, 从而获得各主成分的特征值和贡献率。基于各因子得分, 绘制主成分分析结果散点图[10]。
1.3.3 逐步判别函数分析采用逐步判别函数分析法筛选关键参数, 并建立3个不同类群的线性判别函数, 参考杨慧荣等[10]和Poulet[18]计算判别准确率、交互验证判别准确率和综合判别率。
1.3.4 差异系数参照Mayr等[19]对亚种进行识别和划分的75%规则, 对3个大眼鳜群体20项性状比的差异系数进行差异性分析。分析公式为:
CD=|M1-M2|/(SD1+SD2)
式中, M1、M2分别代表 2个群体某种性状参数的平均值, SD1 + SD2为对应的标准差。
数据的分析与处理采用Microsoft Excel 2010和SPSS 16.0软件进行, 本研究的显著性水平设置为0.05。
2 结果与分析 2.1 参数选择将标准化后的数据进行单因素方差分析, 除参数TL/BL、HL/BL、1~4/BL和4~2/BL外, 其他20个参数在3个大眼鳜群体之间均在统计学上差异显著, 因此这20个参数将被用来进一步进行Pearson相关性分析(表 1)。经Pearson相关性分析, 剔除与2个或2个以上参数相关系数大于或等于0.80的参数, 最终获得12个参数(BD/BL、BW/BL、SL/BL、ED/BL、ID/BL、CPL/BL、CPW/BL、3~2/BL、3~5/BL、5~7/ BL、5~8/ BL和7~8/BL)作为主成分分析和逐步判别函数分析的备选参数(表 2)。
|
|
表 1 3个大眼鳜群体比例性状标准化的平均值及比较 Tab.1 The mean values of standardized data of characters for the three Siniperca kneri populations and the comparisons among them |
|
|
表 2 3个大眼鳜种群不同测量性状之间的皮尔逊相关性 Tab.2 The Pearson correlations among different measured characters for the three Siniperca kneri populations |
KMO和Bartlett’s球度检验得出的KMO值和P值分别为0.940和0.000, 均表明本研究所用数据非常适合进行主成分分析。主成分分析结果显示, 前2项主成分的特征值大于1.0, 累计贡献率达到64.255%, 即这2个相互独立的主成分包含了原有12个变量的64.255%变异信息(表 3)。其中, 第1主成分贡献率为54.742%, 第2主成分贡献率为9.513% (表 3)。
|
|
表 3 3种大眼鳜主成分分析的特征值和累积贡献率(主成分1-6) Tab.3 Eigenvalue and cumulative contribution of variance calculated by principal component analysis from the correlation matrix of thirty-four morphological characters of three Siniperca kneri populations |
从3个大眼鳜群体的前2个主成分来看, 主成分1中起关键作用的是BW/BL、CPW/BL、CPL/BL、7~8/BL、5~7/BL、5~8/BL、ID/BL、3~2/BL和3~5/BL, 主要反映鱼体吻前端至尾鳍起点之间躯体纵向、横向和斜向大小差异; 主成分2中起关键作用的为SL/BL和ED/BL, 分别反映了头部的长短和眼睛的大小(表 4)。
|
|
表 4 3个大眼鳜群体的12个性状在前两个主成分的因子负荷值 Tab.4 The factor loadings for 12 characters of Siniperca kneri on the first two principal components |
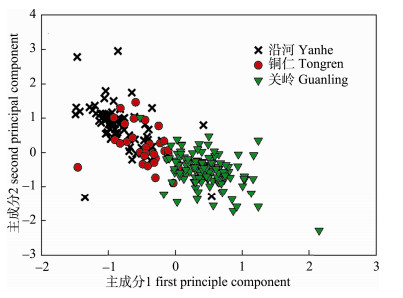
3个大眼鳜群体主成分1和主成分2绘制的二维散布图如图 2所示。图中显示, 沿河和铜仁群体均分布在主成分1=0的左侧, 而关岭群体则主要分布在主成分1=0的右侧; 沿河和铜仁群体之间存在部分重叠, 但这2个群体与关岭群体能够明显区分开来(图 3)。
|
图 3 3个大眼鳜群体前两个主成分散点图
Fig.3 Distribution of the first and second principal component coordinates of three Siniperca kneri populations
|
3个群体的逐步判别分析结果见表 5。表 5显示BW/BL、SL/BL、ED/BL、CPL/BL、3~5/BL和7~8/BL为判别3个种群的显著性状参数。采用这6个性状参数建立了3个大眼鳜群体的判别公式:
|
|
表 5 3个大眼鳜群体的Fisher线性判别函数系数 Tab.5 Linear discriminated functions of threeSiniperca kneri populations |
沿河大眼鳜群体:
Y=–219.451+122.890X1+1458X2+2809X3+
841.963X4+528.671X5+1404X6
铜仁大眼鳜群体:
Y=–224.240+1432X1+1494X2+2168X3+
901.268X4+572.005X5+1369X6
关岭大眼鳜群体:
Y=–247.235+1555X1+909.569X2+2755X3+
1124X4+579.359X5+1654X6
3个大眼鳜群体的判别归类结果见表 6。由表 6可知:非交互验证时, 沿河、铜仁和关岭群体分别有8尾、3尾和5尾判别错误, 判别准确率分别为87.5%、90.0%、96.2%, 综合判别准确率为93.13%。交互验证时沿河群体的判别准确率为87.14%, 铜仁群体为87.50%, 关岭群体为95.42%, 综合判别准确率为91.85%。交互验证结果与直接使用判别公式进行判别的结果的准确率均非常高而且接近, 说明判别公式是可信的。
|
|
表 6 3种大眼鳜的判别分类结果 Tab.6 Classification results of three Siniperca kneri populations |
对3个大眼鳜群体的12项显著性状进行差异性分析, 其结果见表 7。3个大眼鳜群体的所有显著性状的差异系数值均小于亚种分类的阈值1.28, 因此可以初步断定它们之间的差异属于不同地理种群内的差异, 还未达到亚种水平。
|
|
表 7 3个大眼鳜群体间12项性状的差异系数 Tab.7 Variation coefficient of 12 characters of three Siniperca kneri populations |
本研究基于多种多元统计分析法, 对贵州3条河流的大眼鳜群体的形态变异进行了分析。主成分分析结果表明:乌江沿河群体与锦江河铜仁群体的形态较为接近, 而与北盘江关岭群体的形态差异较为明显(图 2)。主成分分析中特征值大于1.0的前2个主成分能够解释不同群体间总变异方差的64.255%, 显示这2个相互独立的主要因子能够反映不同群体间的形态差异。2个主要成分中, 主成分1主要反映鱼体从头部至尾柄之间躯体在纵向、横向和斜向的差异, 其中, 体宽/体长、尾柄高/体长和尾柄长/体长这3个比例性状的因子负荷值排在前3位, 表明躯体宽度以及尾部形态是区分不同群体差异较为明显的性状, 主成分2中起关键作用的为吻长/体长和眼径/体长, 表明吻部的长度以及眼睛的大小也是区分3个地理种群的重要性状参数。就2个主成分而言, 头部和尾部上部分性状特征的差异是导致这3个地理种群形态差异最为关键的因素。已有研究也表明, 头部和尾部区域的部分性状是区分许多鱼类不同地理种群差异的关键因素[16, 20-22]。尽管如此, 由于不同鱼类在种间形态上的差异, 所以也有许多鱼类在地理种群上的区分主要依据鱼体其他区域的性状参数[23-24]。
尽管主成分分析法已在确定不同群体间的种群形态差异、亲缘关系等方面得到了广泛的运用[3, 9-10, 22, 25], 但是必须进行主成分分析数据的预处理以及数据适用性分析[6, 17, 23]。Tzeng等[26]和Kinsey等[27]的研究表明, 样品个体大小变化对数据的影响通常较为明显, 未对原始测量数据进行标准化, 有可能会导致数据不能满足如正态性、方差齐次性等某些统计方法运用的假设前提, 从而得出错误的分析结果。而且, 主成分分析法适用性前提为通过KMO和Bartlett’s球度检验, 因此, 必须进行数据的协方差矩阵或相关矩阵检验,能够收敛即为正定矩阵。为使矩阵收敛, 样本量的大小以及分析参数的相关性均需要进行分析[17]。样本量太少或分析参数高度相关, 均会产生非正定矩阵, 从而使得矩阵无法收敛而不能得到正确的分析结果。在本研究中, 尽管样本数量满足统计学要求, 但是未进行参数选择时, 该样本数据是无法通过KMO和Bartlett’s球度检验的。为此,采用以下方法和步骤进行了参数选择:首先采用单因素方差分析方法(one-way ANOVA)筛选出在3个采样区域间具有显著差异的性状参数; 然后采用Pearson相关性法对这些性状参数进行分析, 剔除部分高度相关的参数。经过参数选择, 选择后的样本数据通过了KMO和Bartlett’s球度检验。
研究表明, 鱼类的外部形态除受遗传因子影响以外, 外部环境因子的影响也不可忽视[10, 26-28]。不同地理种群之间形态的变异通常是局域生境差异引起的表型可塑性的结果, 而水温、浊度、食物的可获得性以及水体的流速和水深等通常为局域生境, 特别是淡水鱼类局域生境中导致表型差异的关键因子[10-11, 26]。Poulet[18]的研究表明, 一般情况下, 地理隔离距离的大小与不同地理种群形态差异的大小呈正相关关系。本研究中, 沿河群体和铜仁群体之间的外形差异较小, 其很可能与这2个群体所在的水域地理位置较近、海拔高度相差不大、生存环境类似有关, 而关岭群体采集于北盘江中游, 与其他2个大眼鳜群体的地理位置相距较远, 海拔高度以及栖息生境相差也较大, 从而与其他2个群体的外形差异较为显著。但差异系数的分析结果显示, 3个大眼鳜群体显著性差异性状的差异系数值均小于亚种分类的阈值1.28[19], 表明虽然3个大眼鳜群体间存在一定程度的性状差异, 但这些差异仍然属于种内不同地理群体上的差异, 还未达到亚种水平。这一结果与采用遗传分析方法对3个种群进行的分析结果相一致[8]。尽管遗传分析方法能够正确地鉴别不同地理种群, 但是本研究采用6个性状参数建立的种群判别函数对个体的种群识别, 不仅准确性较好, 而且相较遗传学分析方法更为方便、迅速且对鱼体伤害小, 有利于对不同地理种群进行快速、无损伤的鉴定。因此, 本研究结果可以为本研究区域内大眼鳜群体的无损、快速良种选育提供参考。
| [1] |
Cadrin S X, Friedland K D, Waldman J R. Stock identification methods: applications in fishery science[J]. E Streams Electronic Reviews of Science & Technology, 2012(1): 68-69. |
| [2] |
Bagherian A, Rahmani H. Morphological discrimination between two populations of shemaya, chalcalburnus chalcoides (actinopterygii, cyprinidae), using a truss network[J]. Animal Biodiversity & Conservation, 2009, 32(1): 1-8. |
| [3] |
Mohaddasi M, Shabanipour N, Abdolmaleki S. Morphometric variation among four populations of shemaya (Alburnus chalcoides) in the south of caspian sea using truss network[J]. The Journal of Basic & Applied Zoology, 2013, 66(2): 87-92. |
| [4] |
Swain D P, Foote C J. Stocks and chameleons: the use of phenotypic variation in stock identification[J]. Fisheries Research, 1999, 43(1): 1123-1128. |
| [5] |
Cadrin S X. Advances in morphometric identification of fishery stocks[J]. Reviews in Fish Biology and Fisheries, 2000, 10(1): 91-112. DOI:10.1023/A:1008939104413 |
| [6] |
Liu C Z, Yan L P, Li J S, et al. Morphological differences between breeding stocks of chub mackerel (Scomber japonicus) in the East China and Yellow seas[J]. Journal of Fishery Sciences of China, 2011, 18(4): 908-917. [刘楚珠, 严利平, 李建生, 等. 基于框架法的东黄海日本鲭产卵群体形态差异分析[J]. 中国水产科学, 2011, 18(4): 908-917.] |
| [7] |
Jayasankar P, Thomas P C, Paulton M P, et al. Morphometric and genetic analyzes of Indian mackerel (Rastrelliger kanagurta) from Peninsular India[J]. Asian Fisheries Science, 2004, 17: 201-215. |
| [8] |
Guo J K, An M, Wang J N, et al. Sequence analysis of rDNA ITS-1 from three populations of Siniperca kneri in Gui zhou[J]. Genomics and Applied Biology, 2016, 35(6): 1383-1387. [郭健康, 安苗, 王金娜, 等. 贵州大眼鳜3个群体rDNA ITS-1序列分析[J]. 基因组学与应用生物学, 2016, 35(6): 1383-1387.] |
| [9] |
Huang T, Zhao B, Babacar D, et al. Analysis of morphological differences between Paramisgurnus dabryanus and Misgurnus anguillicaudatus formosa cultured in Zhoushan archipelago[J]. Journal of Hydroecology, 2016, 37(2): 83-87. [黄涛, 赵波, Babacar Diakhate, 等. 舟山群岛大鳞副泥鳅与台湾泥鳅的形态差异性分析[J]. 水生态学杂志, 2016, 37(2): 83-87.] |
| [10] |
Yang H R, Ouyang P H, Li G F, et al. Morphological differentiation among three wild populations of Siniperca kneri in Pearl River[J]. Journal of Fishery Sciences of China, 2016, 23(2): 447-457. [杨慧荣, 欧阳徘徊, 李桂峰, 等. 珠江流域3个野生大眼鳜群体的形态差异[J]. 中国水产科学, 2016, 23(2): 447-457.] |
| [11] |
Wu L, Zhao Z F, Zheng J Z, et al. Fish Fauna of Guizhou[M]. Guiyang: Guizhou People's Press, 1989: 259-266. [伍律, 赵执桴, 郑建州, 等. 贵州鱼类志[M]. 贵阳: 贵州人民出版社, 1989: 259-266.]
|
| [12] |
Ding R H. Fish Fauna of Sichuan[M]. Chengdu: Sichuan Science and Technology Publishing House, 1994: 509-515. [丁瑞华. 四川鱼类志[M]. 成都: 四川科学技术出版社, 1994: 259-266.]
|
| [13] |
Wang G J, Xie J, Pang S X, et al. Reproductive biology of Siniperca kneri in Pearl River water system[J]. Journal of Fisheries of China, 2012, 30(1): 50-55. |
| [14] |
Liu L Z, Li G F, Chen S J, et al. Age and growth of bigeye mandarinfish (Siniperca kneri) in Guishi Reservoir, Guangxi Province[J]. Journal of Fishery Sciences of China, 2012, 19(2): 229-236. [刘凌志, 李桂峰, 陈石娟, 等. 广西龟石水库大眼鳜的年龄与生长特征[J]. 中国水产科学, 2012, 19(2): 229-236.] |
| [15] |
Chen D X, Chu W Y, Liu X L, et al. Phylogenetic studies of three sinipercid fishes (Perciformes: Sinipercidae) based on complete mitochondrial DNA sequences[J]. Mitochondrial DNA, 2012, 23(2): 70-76. DOI:10.3109/19401736.2011.653799 |
| [16] |
Liu J Y, Yang T B. Morphological variation of grey mullet Mugil cephalus in different geographical populations along china coast[J]. Oceanologia et Limnologia Sinica, 2009, 40(5): 572-576. [刘建勇, 杨廷宝. 我国沿海鲻鱼(Mugil cephalus)不同地理群体形态差异研究[J]. 海洋与湖沼, 2009, 40(5): 572-576. DOI:10.3321/j.issn:0029-814X.2009.05.008] |
| [17] |
Song Z G, Xie L L, He H X. Practical Tutorial of SPSS 16: SPSS 16.0 Guide to Data Analysis[J]. Beijing: The People's Posts and Telecommunications Press, 2008, 112-256. [宋志刚, 谢蕾蕾, 何旭洪. SPSS 16实用教程: SPSS 16.0 Guide to Data Analysis[J]. 北京:人民邮电出版社, 2008, 112-256.] |
| [18] |
Poulet N. Evidence of morphological discrete units in an endemic fish, the rostrum dace (Leuciscus burdigalensis Valenciennes 1844), within a small river basin[J]. Knowledge and Management of Aquatic Ecosystems, 2008(388): 3. |
| [19] |
Mayr E, Linsle E G, Usinger R L. Methods and Principles of Systematic Zoology[M]. New York: McGRAW Hill, 1953: 125-154.
|
| [20] |
Wang W, Chen L Q, Gu Z M, et al. Analysis of morphological variations among seven populations of Erythroculter ilishaeformis[J]. Freshwater Fisheries, 2007, 37(3): 40-44. [王伟, 陈立侨, 顾志敏, 等. 7个不同翘嘴红鲌群体的形态差异分析[J]. 淡水渔业, 2007, 37(3): 40-44. DOI:10.3969/j.issn.1000-6907.2007.03.010] |
| [21] |
Qiao D L, Li S F. Morphological differences of three Plagiognathops microlepis populations[J]. Chinese Journal of Ecology, 2010, 29(12): 2425-2430. [乔德亮, 李思发. 细鳞斜颌鲴三个群体形态差异[J]. 生态学杂志, 2010, 29(12): 2425-2430.] |
| [22] |
Sen S, Jahageerdar S, Jaiswar A K, et al. Stock structure analysis of Decapterus russelli (Ruppell, 1830) from east and west coast of India using truss network analysis[J]. Fisheries Research, 2011, 112(1): 38-43. |
| [23] |
Wang X A, Ma A J, Chen C, et al. Morphological variation in two wild populations of seven band grouper (Epinephelus Septemfasciatus)[J]. Oceanologia et Limnologia Sinica, 2008, 39(6): 655-660. [王新安, 马爱军, 陈超, 等. 七带石斑鱼(Epinephelus septemfasciaius)两个野生群体形态差异分析[J]. 海洋与湖沼, 2008, 39(6): 655-660. DOI:10.3321/j.issn:0029-814X.2008.06.017] |
| [24] |
Liu D J, Zhu S Y. Study of morphological difference of Coelomactra antiquate in Fujian and Jiangsu coasts[J]. South China Fisheries Science, 2010, 6(2): 29-34. [刘德经, 朱善央. 福建与江苏西施舌群体形态差异研究[J]. 南方水产科学, 2010, 6(2): 29-34. DOI:10.3969/j.issn.1673-2227.2010.02.005] |
| [25] |
Li X J, Li A J, Li S F. Morphometric difference between blackchin tilapia Sarotherodon melanotheron and the other five tilapias revealed by multivariate statistical analysis[J]. Oceanologia et Limnologia Sinica, 2008, 39(6): 683-688. [李学军, 李爱景, 李思发. 萨罗罗非鱼(Sarotherodon melanotheron)与其它5种罗非鱼形态差异的多元统计分析[J]. 海洋与湖沼, 2008, 39(6): 683-688. DOI:10.3321/j.issn:0029-814X.2008.06.022] |
| [26] |
Tzeng T D, Yeh S Y. Morphological variation in the common mackerel (Scomber japonicus) off Taiwan[J]. Journal of the Fisheries Society of Taiwan, 2007, 34(2): 197-205. |
| [27] |
Kinsey S T, Orsoy T, Bert T M, et al. Population structure of the Spanish sardine Sardinella aurita: natural morphological variation in a genetically homogeneous population[J]. Marine Biology, 1994, 118(2): 309-317. DOI:10.1007/BF00349798 |
| [28] |
Poulet N, Berrebi P, Crivelli A J, et al. Genetic and morphometric variations in the pikeperch (Sander lucioperca L.) of a fragmented delta[J]. Archiv für Hydrobiologie, 2004, 159(4): 531-554. DOI:10.1127/0003-9136/2004/0159-0531 |
 2018, Vol. 25
2018, Vol. 25

