鱼类在繁殖、季节温度剧烈变化或者食物稀缺期间经常要经历饥饿阶段, 为了在饥饿阶段生存, 鱼类会做出不同的代谢调整及动用自身贮藏的能量物质[1-2]。碳水化合物是三大能量物质中最廉价的营养素, 不同鱼类对碳水化合物的来源和需求量有很大的不同, 但其代谢途径及调节机制基本一致[3], 鱼类代谢系统的多样性决定了生物机体对碳水化合物利用能力的高低[4], 如海鲈(Lateolabrax japonicus)和虹鳟(Oncorhynchus mykiss)等肉食性鱼类虽能高效地利用蛋白质物质, 但相比于杂食性和草食性鱼类, 其对可消化糖的利用能力比较低, 只能高度依赖氨基酸通过糖异生途径合成内源性葡萄糖来维持机体对能量的需求[4-5]。相比哺乳动物, 鱼类在高糖负荷下不能迅速有效地维持血糖的内稳态[3], 在一定程度上反映了鱼类糖酵解和糖异生调节的失衡。在饥饿状态下, 鱼类在利用供代谢分解的能源贮藏物质的同时必须减少其过多的消耗, 这必然要求抑制糖酵解相关酶的活性, 减少能量分解代谢[6], 因而长期饥饿状态并不会对机体造成严重的生理功能损伤。同时许多学者研究表明, 鱼类在饥饿处理后再投喂会恢复到饥饿前正常的生理状态, 包括恢复其体重甚至有补偿性生长作用[7-10]。葡萄糖从胞外进入胞内需要借助细胞膜上葡萄糖转运载体的协助运输, 才能为细胞的代谢提供能量。葡萄糖转运蛋白1 (glucose transporter 1, GLUT1)在哺乳动物各组织广泛分布, 且在大多数细胞膜上低水平表达, 是非胰岛素依赖转运葡萄糖。鱼类对葡萄糖的高度不耐受可能与其葡萄糖转运蛋白的表达和转运效率有关[11], 然而迄今为止, 研究者对鱼类在饥饿和再投喂下的糖代谢机理及葡萄糖蛋白转运机制仍不甚清晰。
草鱼(Ctenopharyngodon idellus)作为一种典型的淡水草食性鱼类, 相比肉食性鱼类, 它能有效地利用高水平碳水化合物饲料[12], 许多研究报道主要集中在饥饿及再投喂处理对于草鱼的激素分泌[13]、糖原合成代谢[14]、脂肪代谢[15]和能量收支[16]的影响, 关于草鱼在饥饿及再投喂条件下的糖代谢及葡萄糖转运机制尚未有研究报道, 研究草鱼不同饥饿营养状态下及在急性高糖胁迫条件下的糖代谢及葡萄糖转运机制可为不同食性经济鱼类的葡萄糖利用机制研究提供科学依据, 因此本实验拟通过研究长期饥饿处理、饥饿再投喂和持续投喂3种不同处理下草鱼血清生化指标、糖原和糖代谢相关酶和葡萄糖转运蛋白1(GLUT1)的变化规律, 同时在此实验基础上研究草鱼在急性高糖负荷胁迫下的糖耐受能力, 旨在阐明草鱼在饥饿及再投喂处理条件下的糖代谢特征及机制。
1 材料与方法 1.1 实验饲料基础饲料以低温蒸汽鱼粉和酪蛋白为蛋白源(30.02%), 玉米淀粉为糖源(39.16%), 鱼油为脂肪源(12.30%), 粗灰分(16.18%)和水分(8.01%), 总能量(18.68 MJ/kg)。实验草鱼分为3个处理组:持续投喂组(8周, C)、饥饿再投喂组(饥饿4周+投喂4周, R)和持续饥饿组(8周, S) 3个投喂模式组。
|
|
表 1 实验饲料配方和营养成分组成 Tab.1 Formulation and proximate analysis of trial diets |
实验鱼购自湖南省岳阳市湘阴县, 大小均匀, 健康无病, 先暂养于湖南省娄底市新化县车田江水库聚乙烯网箱内6个月, 暂养网箱大小为4 m× 5 m×5 m。随机挑选均匀、体格健康的草鱼(125.35±0.54) g, 30尾/网箱进行养殖实验(2 m×2 m× 2 m)。草鱼放养前用3%的食盐水浸泡5~10 min, 随机分为持续投喂组(C)、饥饿再投喂组(R, 饥饿4周+投喂4周)和饥饿组(S) 3个投喂模式组, 每个处理组设置3个重复, 每个重复30尾鱼。实验期间养殖水体的溶解氧要保持在5.0 mg/L以上, pH变化范围在7.2~7.4, 总氨氮低于0.5 mg/L, 水温在20~29℃之间, 水温低于25℃时, 以草鱼体重的1%~2%投喂以上配合饲料, 日投喂两次(8:30- 10:00、15:30-17:00), 早晚比例为40%, 60%;水温高于25℃时以草鱼体重的1%~3%投喂, 日投喂3次(7:00-8:00、11:00-12:00、17:00-18:00), 早、中、晚比例为20%、35%、45%, 下雨天停食, 每日记录摄食量, 计数病死鱼。
1.3 养殖实验样本采集及保存养殖实验结束, 停饲24 h后逐箱称重。采样时, 从每个网箱中逐尾捞取实验鱼, 用丁香酚轻度麻醉后计数和称重, 再随机选取3尾鱼, 用2 mL注射器从尾部静脉抽血合并置于离心管中, 4℃静置12 h后4000 r/min离心10 min, 分离血清于-80℃冰箱保存, 用来测定血清生化指标, 并分离肝脏和肌肉置于防冻管, 迅速放入液氮中, 同时另取3尾鱼用于体成分分析。
1.4 葡萄糖耐量实验饲养实验结束后, 实验鱼均停饲24 h后进行葡萄糖耐量实验, 从各个处理组网箱中逐条捞取实验鱼, 然后用丁香油酚轻度麻醉, 迅速称重, 每个时间点每个网箱随机捞取3尾鱼并腹腔注射葡萄糖溶液进行葡萄糖耐量实验(溶解于0.65%的生理盐水, 浓度60 mg/mL; 预实验确定注射剂量: 30 mg/100 g鱼体重; 注射时, 将注射针小心沿着实验鱼腹部45°斜角斜插入鱼体腔内, 实验鱼在30 min内注射完毕)。注射葡萄糖溶液时, 分别从各处理组网箱中随机捞取3尾鱼依次注射相应体积0.65%的生理盐水作为0 h处理[17]。
葡萄糖耐量实验:于注射生理盐水(0 h)以及注射葡萄糖溶液后1 h、3 h、6 h和12 h分别取血液、肝脏和肌肉样品。每个时间点每个网箱随机捞取3尾鱼, 用2 mL注射器从尾部静脉抽血合并置于离心管中, 静置12 h, 以4000 r/min离心10 min, 收集血清待测。所有血样在3 min之内完成, 采完血后将实验鱼解剖, 分别迅速剥离肝脏和肌肉组织置于冻存管, 放入液氮速冻, ‒80℃超低温保存待测。
1.5 指标测定血糖、血浆甘油三酯、总胆固醇、低(高)密度脂蛋白胆固醇和总蛋白采用全自动生化分析仪(7020型, Hitachi, 日本)测定。肝/肌糖原、葡萄糖激酶(GK)、丙酮酸激酶(PK)、果糖-6-磷酸激酶(PFK)和磷酸烯醇式丙酮酸激酶(PEPCK)试剂盒均由南京建成生物工程研究所生产。饲料和肌肉样品进行常规养分分析, 水分测定采用105℃烘干恒重法, 粗蛋白质采用凯氏定氮法, 粗脂肪采用索式抽提法, 粗灰分采用550℃灼烧法测定, 所有操作步骤均严格按照AOAC及试剂盒说明书进行。
1.6 GLUT1基因表达量测定 1.6.1 RNA提取和cDNA合成采用宝生物工程(大连)有限公司(大连TaKaRa)Trizol法提取草鱼肌肉组织的RNA, 1%琼脂糖电泳检测RNA完整性, 核酸定量仪(NanoDrop 2000, USA)检测RNA浓度及纯度, 以各组织总RNA为模板, Oligo(dT)20为反转录引物, 使用Invitrogen公司M-MLV First-Strand Sy n thesis System试剂盒的使用说明, 以总RNA为模板, Oligo(dT)20为反转录引物, 合成cDNA第l链, 反应总体系和条件参考试剂盒使用手册。
1.6.2 引物设计及合成根据实验室成功克隆的草鱼 GLUT1 基因全长序列并使用软件Primer premier 5.0进行特异性引物设计: GLUT1 F: 5ʹ− TGCTCCTGGGCTTTACCT−3ʹ; GLUT1 R: 5ʹ−CT G A TTTGGCTTTGTTTTCC−3ʹ;内参管家基因β- actin (登录号: M25013.1)的引物设计: β-actin F: 5ʹ−CGTGACATCAAGGAGAAG−3ʹ; β-actin R: 5ʹ− GAGTTGAAGGTGGTCTCAT−3ʹ, 本实验所用引物均由Invitrogen公司广州部合成。
1.6.3 Real-time PCR以草鱼肌肉的cDNA为模板, 用SYBR® Premix Ex TaqTM试剂盒(大连TaKaRa)对目的基因进行荧光定量PCR检测, 预实验确定扩增效率, 参考试剂盒推荐体系和反应条件, 在实时荧光定量PCR仪ABI 7500上进行荧光定量检测。
1.7 计算公式及数据处理本研究中各参数的计算按以下公式进行:
特定生长率(special growth rate, SGR, %/d)= (ln末均重-ln初均重)/饲养天数x100%;
成活率(survival rate, SR, %)=实验结束时鱼尾数/实验开始时鱼尾数x100%;
实验数据用平均值±标准差(x±SD)表示, 不同饥饿状态下饲养8周后生长、体成分和血清生化指标的数据分析采用SPSS 17.0软件, 在同质方差检验(Levene test)后进行单因素方差分析(one-way ANOVA), 而糖耐受实验数据先采用双因素方差分析(two-way ANOVA), 若有显著性差异, 再采用单因素方差分析和Duncan多重比较检验, 显著性差异为P < 0.05。GLUT1 mRNA水平以β-actin为内参, 以草鱼持续投喂组(C组) 0 h GLUT1基因表达量为基准, 应用2-∆∆Ct确定不同样品的mRNA的相对含量。
2 结果和分析 2.1 饥饿及再投喂对草鱼生长、体成分和存活率的影响饥饿及再投喂对草鱼体成分和存活率的影响见表 2, 草鱼存活率均高于97%, 各组无显著差异(P > 0.05), S组的草鱼体重有所下降, 特定生长率为-0.24%/d, 而R组体重显著上升(P < 0.05)。不同饥饿营养条件对草鱼体成分有显著影响, 其中S组的草鱼体成分粗蛋白最高, 显著高于其余两组(P < 0.05), 而R组和C组则无显著差异(P > 0.05)。粗脂肪含量以C组最高, S组最低, 各组差异性显著(P < 0.05)。灰分和水分含量S组最高, C组最低, 各组差异性显著(P < 0.05)。
|
|
表 2 饥饿及再投喂对草鱼生长、体成分和存活率的影响 Tab.2 Effects of starvation and refeeding on growth, composition of whole body and survival rate of grass carp |
由表 3可知, S组草鱼血清的血糖、甘油三酯、总胆固醇、脂蛋白胆固醇和总蛋白含量均最低而C组含量均最高, 除高密度脂蛋白胆固醇外, 各组差异性显著(P < 0.05);肝糖原含量以C组最高, S组最低, 各组差异性显著(P < 0.05), 而肌糖原各处理组无显著性差异(P > 0.05)。
|
|
表 3 饥饿及再投喂对草鱼血清生化指标和肝/肌糖原的影响 Tab.3 Effects of starvation and refeeding on grass carp plasma biochemical index and liver/muscle glycogen |
由表 4可知, 相对于持续投喂组(C组), 饥饿处理(S组)诱使GK和PEPCK酶的活性上升, 显著高于C组(P < 0.05), 而饥饿再投喂(R组)后GK和PEPCK酶的活性均显著下降, 恢复到持续投喂(C组)处理水平(P < 0.05);而相比于持续投喂组(C组), 饥饿处理(S组)抑制PK酶和PFK酶的活性, 而饥饿再投喂(R组)促进PK酶和PFK酶的活性上升; PFK酶活性恢复到持续投喂(C组)处理水平, 而PK酶活性显著高于持续投喂(C组)水平(P < 0.05)。
|
|
表 4 饥饿及再投喂对草鱼肝脏糖代谢酶的影响 Tab.4 Effects of starvation and refeeding on grass carp glucose metabolism enzyme activities |
由图 1可见, 草鱼注射葡萄糖后血糖值均迅速升高, 其中C组、S组和R组分别在1 h、3 h和6 h达到峰值, 不同处理组注射葡萄糖后出现涨幅不同, 以S组的涨幅最低(5.32 mmol/L), 其余两组R组(9.54 mmol/L)、C组(7.56 mmol/L)较高, 各组血糖组随后逐渐下降, 至12 h时S和C组均显著高于注射前水平(P < 0.05), 而R组恢复至注射前水平。比较相同时间点上不同处理组的血糖值发现, S组在0~12 h时间段血糖含量显著低于R和C组(P < 0.05)。血浆中甘油三脂(TG)含量在0 h时, S组含量最低, C组TG含量最高, 各组差异显著(P < 0.05)。S组TG含量在0~12 h时间段内基本无明显变化(P > 0.05), 而R和C组在0~ 6 h也保持总体稳定, 而在12 h时急剧上升, 分别是6 h的2倍和1.7倍。
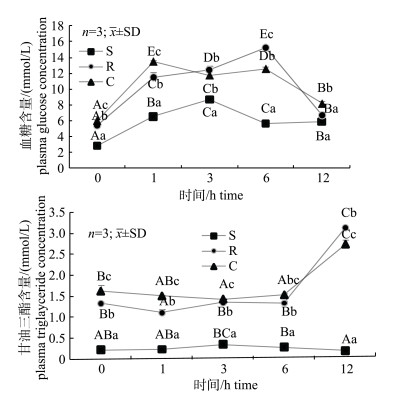
|
图 1 饥饿及再投喂条件下草鱼注射葡萄糖后血糖和甘油三酯含量的变化
同一处理组不同大写字母表示差异显著(P < 0.05), 同一时间点不同小写字母表示差异显著(P < 0.05); C:持续投喂组; S:饥饿处理组; R:再投喂组. Fig.1 The change of plasma glucose and cholesterol concentrations in grass carp after glucose injection under starvation and refeeding The different capital letters in the same treatment and small letters in the same time stand for significant difference at 0.05; C: continuous feeding group; S: starvation group; R: refeeding group. |
由图 2可见, 草鱼在注射葡萄糖后各处理组肝糖原含量均呈先上升后下降的趋势, C组、S组和R组分别在1 h、6 h、3 h达到最高值, 12 h时均恢复到最初水平, 总体来说, C组肝糖原含量在各个时间点上均高于其余两组(P < 0.05), 而S组在各个时间点(除6 h)总体最低(P < 0.05)。各处理组肌糖原含量随着时间的变化均呈现先上升后下降的趋势, R组和C组均在3 h达到最大值, 分别是0 h的9.5倍和6.1倍, 而S组在6 h达到最大值, 是0 h的7.4倍, 但在0 h和12 h时间点上, 各组肌糖原含量无显著差异(P > 0.05)。
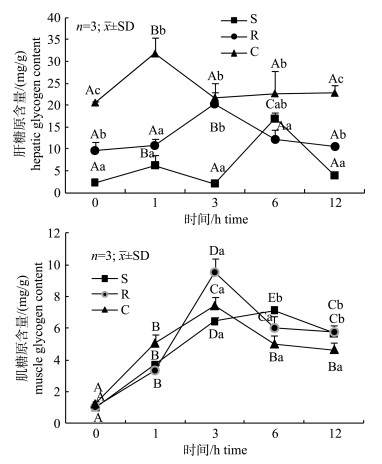
|
图 2 饥饿及再投喂条件下草鱼注射葡萄糖后肝/肌糖原含量的变化
同一处理组不同大写字母表示差异显著(P < 0.05), 同一时间点不同小写字母表示差异显著(P < 0.05); C:持续投喂组; S:饥饿处理组; R:再投喂组. Fig.2 The change of hepatic and muscle glycogen content in grass carp after glucose injection under starvation and refeeding The different capital letters in the same treatment and small letters in the same time stand for significant difference at 0.05. C: continuous feeding group; S: starvation group; R: refeeding group. |
由图 3可见, 注射葡萄糖后, 草鱼肝脏GK酶活性均呈现先上升后下降的趋势, S组和R组GK酶活性峰值均出现在1 h, 而C组出现在6 h; 其中以S组GK酶活性增幅最大, 最高值是0 h的2倍, 且S组GK酶活在各个时间点上均显著高于其余两组(P < 0.05)。C组PK酶活性则无显著变化(P > 0.05), 而S组PK酶活性呈现上升的趋势, 在各个时间点上S组PK酶活性均低于C组, R组呈现先下降后上升的趋势, 在1~6 h PK酶活性也均低于C组。C组PFK酶活性则呈现先显著上升后下降的趋势, 在3 h时达到最大值, 而S组和R组PFK酶的活性总体上呈现下降的趋势, S组PFK酶的活性显著低于其余两组(P < 0.05), 且R组在1~12 h时间段内均显著低于C组(P < 0.05)。然而在注射葡萄糖后, C组PEPCK酶活性在各个时间点上无显著变化(P > 0.05), 而S组和R组PEPCK酶活性均在1 h时显著降低(P < 0.05), 且在总体上也均呈现先下降后上升的趋势, 同时两组均在1~6 h时间段内显著低于C组PEPCK酶活性(P < 0.05)。
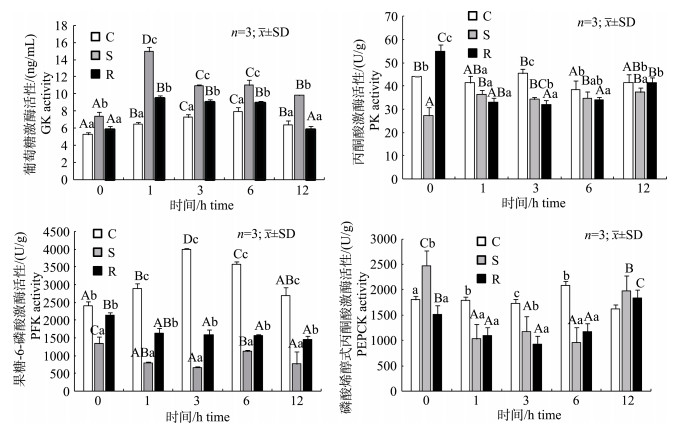
|
图 3 饥饿及再投喂条件下注射葡萄糖对草鱼肝脏糖代谢酶GK、PK、PFK和PEPCK酶活性的影响
同一处理组不同大写字母表示差异显著(P < 0.05), 同一时间点不同小写字母表示差异显著(P < 0.05). C:持续投喂组; S:饥饿处理组; R:再投喂组. Fig.3 Effects of glucose injection on the GK、PK、PFK and PEPCK enzyme activities of grass carp liver under starvation and refeeding Different capital letters in the same treatment and small letters in the same time stand for significant difference at 0.05. C: continuous feeding group; S: starvation group; R: refeeding group. |
由图 4可见, 相对于持续投喂组(C组), 饥饿处理(S组)和饥饿再投喂(R组)诱使草鱼肝脏GLUT1基因表达量的上升(P < 0.05)。在肌肉中, 饥饿处理(S组)促进GLUT1基因的表达(P < 0.05), 而饥饿再投喂(R组)则抑制GLUT1基因的表达(P < 0.05)。注射葡萄糖后, C组和S组草鱼肝脏GLUT1基因表达量均有上升的趋势, 分别在12 h和6 h达到最高值, 是0 h的2.1倍和1.9倍, 而R组肝脏GLUT1基因表达量无显著变化(P > 0.05);而不同营养状态下注射葡萄糖后, 草鱼肌肉GLUT1基因表达量均呈现先上升后下降的趋势, C组、S组和R组的峰值分别出现在1 h、3 h和1 h, 最高值分别是0 h的4.7倍、3.3倍和9.4倍, 且S组肌肉GLUT1基因表达量在各个时间点上均高于其余两组。
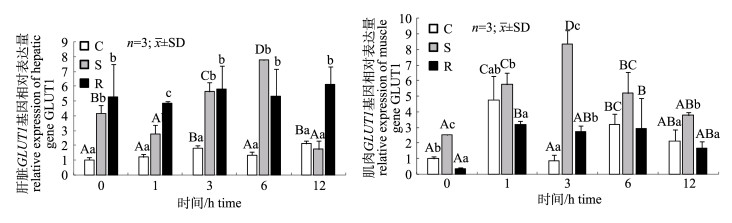
|
图 4 饥饿及再投喂条件下注射葡萄糖对草鱼肝脏和肌肉GLUT1基因表达量的影响
同一处理组不同大写字母表示差异显著(P < 0.05), 同一时间点不同小写字母表示差异显著(P < 0.05). C:持续投喂组; S:饥饿处理组; R:再投喂组. Fig.4 Effects of glucose injection on hepatic and muscle relative expression of gene GLUT1 in grass carp under starvation and refeeding Different capital letters in the same treatment and small letters in the same time stand for significant difference at 0.05. C: continuous feeding group; S: starvation group; R: refeeding group. |
鱼类在饥饿状态下一般通过消耗机体的储备能量物质(糖原, 脂肪和蛋白质)以满足其正常生命活动的能量需求, 因此必将导致体重的下降[1, 18-19]。本实验长期饥饿处理导致草鱼体重下降0.24%/d (表 2), 显著低于金头鲷(0.63%/d)[20], 表明草鱼具有较强的抗饥饿能力。很多研究结果表明, 短期饥饿后再投喂可使鱼类机体生理功能恢复到正常水平[21-24], 本实验草鱼饥饿再投喂后血糖水平和粗脂肪含量仍比持续投喂组低, 这说明补偿性生长会增加机体对能量的消耗, 因此较少的营养物质被沉积储存起来, 同时本研究结果显示一个月的再投喂并不能有效地使草鱼的血清生化指标完全恢复到正常的代谢水平。鱼类能运用多种策略应对饥饿挑战, 不同鱼类在饥饿状态下的血糖水平也不尽相同, 例如美洲鳗(Anguilla rostrata)[25]和胡鲇(Clarias lazera)[1]在数月饥饿后无显著变化, 但鲶(Rha mdia hilarii)[26]在1个月的禁食后血糖浓度下降一半, 本实验草鱼在长期饥饿状态下血糖水平显著下降, 这结果与很多鱼类研究相符[23, 27-28]。但在再投喂1个月后, 草鱼的血糖并未恢复到持续投喂组水平(略低于正常投喂组血糖水平), 推测可能与鱼的种类不同和恢复投喂时间的长短有关。
本研究结果显示草鱼的肝糖原含量在长期饥饿状态下大幅减少, 推测可能与机体在饥饿早期阶段分解糖原释放葡萄糖以维持血糖水平直接相关, 很多鱼类研究均有类似报道[22-23]。然而, 两个月的长期饥饿处理后肝糖原并未被完全消耗, 这意味着草鱼机体存在其他糖异生途径来确保一定的糖原储存量, 相似的结果在以往的研究中均有报道[22-23]。而草鱼在再投喂后, 肝糖原含量有显著上升, 相同的研究结果在其他鱼类也有报道[7, 21-22, 29]。虽然肌肉糖原的贮藏水平相对比较低, 但肌肉组织占总体重接近50%, 所以肌肉组织对于葡萄糖的吸收和贮藏发挥着重要作用。本实验发现长期饥饿处理并未使草鱼肌糖原含量显著减少, 同时, 再投喂后肌糖原含量也没有显著上升, 这可能是由于肌糖原不是直接维护血糖平衡的糖源, 肌肉组织只在急需能量供应的情况下才会消耗糖原。甘油三酯是人体内含量最多的脂类, 大部分组织均可以利用甘油三酯的分解产物供给能量, 在长期饥饿条件下, 甘油三酯在甘油激酶的催化下可分解生成甘油作为糖异生途径中的底物, 为机体正常的生理活动提供必须的能量供给[30], 本实验中草鱼在长期饥饿状态下, 血浆中甘油三酯和脂蛋白(总胆固醇、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇)显著低于持续投喂组, 这在其他鱼类中也有报道[23, 31], 表明鱼类在长期饥饿状态下脂质物质在机体代谢能量供给中起着重要的作用, 这与本研究中饥饿处理后粗脂肪含量显著最低的研究结果一致。
在饥饿状态下, 鱼类一般会通过抑制肝脏糖酵解和磷酸戊糖相关酶和激活糖异生相关酶活性来调节糖代谢从而维持血糖平衡[32-33]。本实验结果表明, 草鱼在长期饥饿状态下PK(丙酮酸激酶)和PFK(果糖-6-磷酸激酶)酶活性极显著下降, 但在再投喂1个月后, PFK酶恢复到正常水平, 而PK酶活性不仅显著上升且高于持续投喂组, 这说明长时间的饥饿处理可抑制糖酵解相关酶的活性, 而再投喂则可刺激促进糖酵解活动, 这与上文中血糖的变化趋势呈正相关。然而, GK(葡萄糖激酶)酶活性在长期饥饿状态下却呈现显著上升, 研究结果与在虹鳟[34]和金头鲷[35]的研究相反, 而在再投喂1个月后, GK酶活性又恢复到正常投喂组水平, 这可能是由于GK酶是糖酵解途径的第一步限速酶, 能磷酸化葡萄糖分子为6磷酸葡萄糖, 而6磷酸葡萄糖既能为后续糖酵解活动提供底物, 又能作为糖原合成的底物, 对维持一定的糖原含量及维护肝脏正常生理功能具有重要作用, 这与本实验长期饥饿状态下, 草鱼肝糖原并未被完全消耗的研究结果相符。糖酵解促进葡萄糖的分解利用, 而糖异生则使促进葡萄糖的合成, 提高机体的血糖浓度。PEPCK(磷酸烯醇式丙酮酸激酶)是糖异生途径的关键酶, 它可催化草酰乙酸转化为磷酸烯醇式丙酮酸, 其表达水平的高低, 决定了糖异生的速度[36]。长期饥饿处理能促进草鱼肝脏PEPCK酶活性, 而再投喂后其活性又恢复到正常水平, 说明再投喂后草鱼血浆葡萄糖浓度上升, 抑制了糖异生酶PEPCK活性, 相似的研究结果在小鼠中也有报道[37]。
3.2 注射葡萄糖对草鱼糖耐受、糖代谢关键酶和GLUT1表达的影响葡萄糖是细胞内重要的能源物质, 一般而言, 哺乳动物对葡萄糖的利用效率较高, 而鱼类却表现出很强的糖耐受不良特征[3, 5, 38]。本实验注射葡萄糖后结果显示, 草鱼在不同饥饿营养状态下的血糖浓度均呈现先上升后下降的趋势, 不同处理组涨幅不同, 饥饿处理组的涨幅最低(5.32 mmol/L), 说明饥饿处理组对葡萄糖的吸收利用能力比持续投喂组和饥饿再投喂组强, 推测这可能是由于机体长期缺乏碳水化合物等营养物质导致草鱼在高糖负荷后对葡萄糖的吸收利用或贮藏增强。然而, 也有学者研究报道褐鳟在长期饥饿状态下对葡萄糖的吸收率下降[39], 这可能与鱼的种类和规格大小不同有关。饥饿处理组甘油三酯含量在0~12 h内基本无明显变化, 而持续投喂组和饥饿再投喂组在0~6 h也保持稳定, 而在12 h时急剧上升, 暗示在高糖负荷条件下, 草鱼可通过脂肪合成代谢途径来降低高浓度血糖。肝/肌糖原在注射葡萄糖后各处理组均呈现先上升后下降的趋势, 说明糖原的合成也是缓解急性高糖胁迫的有效途径。
注射葡萄糖后, 不同处理组GK酶活性均出现先上升后下降的趋势, 其中以饥饿处理组的增幅最大, 最高值是0 h的2倍, 且饥饿处理组在各时间点上均显著高于持续投喂组和饥饿再投喂组, 这表明高糖负荷可诱导GK酶活性且饥饿处理效果最佳, 相似的研究结果在团头鲂(Megalobrama amblycephala)上也有报道[40]。也有研究报道GK酶具有很多独特的调节特征, 可有效促进肝脏对葡萄糖的吸收和糖原的合成, 且肝糖原的含量与葡萄糖激酶的活性呈正相关[41], 提示葡萄糖激酶可有效促进肝糖原的合成。在注射葡萄糖后, 饥饿处理组PK酶的活性呈现上升的趋势, 而持续投喂组则无显著变化, 饥饿再投喂组呈现先下降后上升的趋势。除此之外, 饥饿处理组PFK酶活性总体上呈现下降的趋势, 而再投喂组呈现下降的趋势, 这都说明草鱼在不同饥饿营养状态及高糖负荷下, PK和PFK酶能在糖代谢中进行灵活地调节, 这与机体整个代谢网络(糖、蛋白质和脂肪代谢)有密切联系, 但不同饥饿营养状态下具体的调节机制尚未完全清楚, 可能与降低糖酵解酶活性, 促进糖原合成有关, 相似的研究结果在小鼠上有报道[42], 结果与饥饿组和再投喂组注射葡萄糖后肝糖原显著上升相符。而在注射葡萄糖后, 持续投喂组PEPCK酶活性在各个时间点上无显著变化, 而饥饿处理组和饥饿再投喂组PEPCK酶活性均在1 h时显著降低, 这说明饥饿处理条件下进行急性高糖胁迫能有效地抑制PEPCK酶活性, 从而达到迅速降低高浓度血糖的目的。
葡萄糖从胞外进入胞内需要借助细胞膜上葡萄糖转运载体的协助运输, 才能为细胞的代谢提供能量。葡萄糖转运蛋白1(GLUT1)在哺乳动物动各组织广泛分布, 是非胰岛素依赖转运葡萄糖。在哺乳动物中, GLUT1基因的表达受很多因素的影响, 如胰岛素、甲状腺激素和生长激素的分泌、缺氧条件和癌症发生[43]。但血糖含量的变化却对各组织GLUT1基因的表达无显著影响[44]。本实验草鱼肝脏组织GLUT1基因在不同饥饿处理下的表达均出现上调, 而肌肉组织GLUT1 基因表达在两个月的饥饿处理后上调, 但在饥饿再投喂后GLUT1基因表达却呈现下调, 这与哺乳动物肌肉细胞在葡萄糖缺乏的条件下GLUT1基因表达上调的结果相似, 在一定程度上补偿由GLUT4下调导致葡萄糖摄取率的下降[44], 与在褐鳟[45]上的研究结果相反; 饥饿处理与正常投喂的肌肉组织GLUT1基因表达量无显著变化。研究结果还发现, 注射葡萄糖后草鱼肌肉组织GLUT1表达量均呈现显著上调, 肝脏组织除了再投喂组无显著影响外, 持续投喂组和饥饿组均有显著上调, 这表明注射葡萄糖能激活草鱼肌肉和肝脏组织GLUT1基因的表达, 这与尼罗罗非鱼(Oreochromis nilo ticus)在喂食或注射葡萄糖后肌肉组织GLUT1基因表达上调的结果相同[46]。此外饥饿处理组的肌肉GLUT1基因表达量在各个时间点上均高于其余两组, 在一定程度提高了细胞对葡萄糖摄取率, 与其急性血糖负荷下血糖增幅最小相符, 表明饥饿处理可有效诱导GLUT1的表达和转运, 从而促进葡萄糖的摄入和利用。
4 结论及展望综上所述, 在饥饿处理下, 草鱼通过消耗肝糖原、甘油三酯, 降低肝脏糖酵解相关酶(PK和PFK)活性以及促进糖异生PEPCK酶活性来应对饥饿胁迫, 而饥饿处理可诱使GK和PK酶活性上升、促进糖原合成、激活GLUT1基因的表达和转运来缓解草鱼急性高糖负荷, 从而提高其糖耐受能力。
随着中国水产养殖业的迅速发展, 蛋白质价格居高不下, 导致饲料成本逐年上升, 而蛋白质又是水产养殖中最大的水质污染源, 这都严重限制了水产养殖业的可持续发展。而碳水化合物作为廉价的能源物质, 在自然界中广泛分布, 适当地添加碳水化合物替代部分蛋白源和脂肪源, 既能降低饲料成本, 又可以减少氨氮排泄物污染。然而现有的研究对鱼类糖代谢机理及葡萄糖转运机制仍不甚清晰, 草鱼作为典型的淡水草食性经济鱼类, 对碳水化合物的利用能力较肉食性和杂食性鱼类高, 研究草鱼不同饥饿处理下及其在急性高糖胁迫条件下的糖代谢及葡萄糖转运机制, 可为不同食性经济鱼类的葡萄糖利用机制研究提供科学依据, 以期解释鱼类对碳水化合物利用效率低的原因, 为水产养殖业的健康可持续发展提供理论支撑。
| [1] |
Navarro I, Gutiérrez J. Fasting and starvation[J]. Biochemistry and Molecular Biology of Fishes, 1995, 4: 393-434. DOI:10.1016/S1873-0140(06)80020-2 |
| [2] |
Tian J, Tu W, Zeng L B, et al. The changes in growth, serum biochemical indices and GH/IGF-Ⅰ/IN mRNA expression abundance of Oreochromis niloticus during fasting and re-feeding[J]. Journal of Fisheries of China, 2012, 36(6): 900-907. [田娟, 涂玮, 曾令兵, 等. 饥饿和再投喂期间尼罗罗非鱼生长、血清生化指标和肝胰脏生长激素、类胰岛素生长因子-Ⅰ和胰岛素mRNA表达丰度的变化[J]. 水产学报, 2012, 36(6): 900-907.] |
| [3] |
Polakof S, Mommsen T P, Soengas J L. Glucosensing and glucose homeostasis:from fish to mammals[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2011, 160(4): 123-149. |
| [4] |
Enes P, Panserat S, Kaushik S, et al. Nutritional regulation of hepatic glucose metabolism in fish[J]. Fish Physiology and Biochemistry, 2009, 35(3): 519-539. DOI:10.1007/s10695-008-9259-5 |
| [5] |
Moon T W. Glucose intolerance in teleost fish:fact or fiction?[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2001, 129(2): 243-249. |
| [6] |
Novak C M, Jiang X, Wang C, et al. Caloric restriction and physical activity in zebrafish (Danio rerio)[J]. Neuroscience Letters, 2005, 383(1): 99-104. |
| [7] |
Pottinger T G, Rand-Weaver M, Sumpter J P. Overwinter fasting and re-feeding in rainbow trout:plasma growth hormone and cortisol levels in relation to energy mobilisation[J]. Comparative Biochemistry & Physiology Part B:Biochemistry & Molecular Biology, 2003, 136(3): 403-417. |
| [8] |
Eroldoğan O T, Kumlu M, Kiris G A, et al. Compensatory growth response of Sparus aurata, following different starvation and refeeding protocols[J]. Aquaculture Nutrition, 2006, 12(3): 203-210. DOI:10.1111/anu.2006.12.issue-3 |
| [9] |
Long Z Q, Peng S M, Chen L Q, et al. Effects of starvation and re-feeding on body weight, tissue biochemical composition and hepatic digestive enzyme activity in juvenile black seabream, Acanthopagrus schlegeli[J]. Journal of Fishery Sciences of China, 2008, 15(4): 606-614. [龙章强, 彭士明, 陈立侨, 等. 饥饿与再投喂对黑鲷幼鱼体重变化、生化组成及肝脏消化酶活性的影响[J]. 中国水产科学, 2008, 15(4): 606-614. DOI:10.3321/j.issn:1005-8737.2008.04.011] |
| [10] |
Fan Q X, Cheng P, Liu W K. Effects of starvation and refeeding on activities of digestive enzymes in Culter alburnus Basilewsky juveniles[J]. Journal of Fishery Sciences of China, 2008, 15(3): 439-445. [樊启学, 程鹏, 刘文奎. 饥饿和再投喂对翘嘴鲌幼鱼消化酶活性的影响[J]. 中国水产科学, 2008, 15(3): 439-445. DOI:10.3321/j.issn:1005-8737.2008.03.009] |
| [11] |
Díaz M, Vraskou Y, Gutiérrez J, et al. Expression of rainbow trout glucose transporters GLUT1 and GLUT4 during in vitro muscle cell differentiation and regulation by insulin and IGF-I[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2009, 296(3). |
| [12] |
Tian L X, Liu Y J, Yang H J, et al. Effects of different dietary wheat starch levels on growth, feed efficiency and digestibility in grass carp (Ctenopharyngodon idella)[J]. Aquaculture International, 2012, 20(2): 283-293. DOI:10.1007/s10499-011-9456-6 |
| [13] |
Zhang W M, Zhang L H, Shen W Y, et al. The secretion of growth hormone in starved grass carp, Ctenopharyngodon idellus[J]. Acta Hydrobiologica Sinica, 2001, 25(3): 236-240. [张为民, 张利红, 沈文英, 等. 饥饿状态下草鱼生长激素的分泌[J]. 水生生物学报, 2001, 25(3): 236-240. DOI:10.3321/j.issn:1000-3207.2001.03.006] |
| [14] |
Zhu Y R, Shen W Y. Effect of starvation and refeeding on glycogen metabolism in grass carp (Ctenopharyngodon idellus) fingerling[J]. Journal of Shaoxing University, 2002, 22(10): 23-25. [祝尧荣, 沈文英. 饥饿和再投喂对草鱼鱼种糖代谢的影响[J]. 绍兴文理学院学报, 2002, 22(10): 23-25. DOI:10.3969/j.issn.1008-293X.2002.10.006] |
| [15] |
Ji H, Su S S, Liu Q, et al. Study on the LPL gene expression and the influcence of fasting and refeeding on it in grass carp, Ctenopharyngodon idellus[J]. Journal of Fisheries of China, 2009, 33(6): 980-986. [吉红, 苏尚顺, 刘茜, 等. 草鱼LPL基因的表达及饥饿和再投喂对其影响[J]. 水产学报, 2009, 33(6): 980-986.] |
| [16] |
Cui Y B, Wang S M, Chen S L. Rates of metabolism and nitrogen excretion in starving grass carp in relation to body weight[J]. Acta Hydrobiologica Sinica, 1993, 17(4): 375-376. [崔奕波, 王少梅, 陈少莲. 饥饿状态下草鱼的代谢率和氮排泄率及其与体重的关系[J]. 水生生物学报, 1993, 17(4): 375-376.] |
| [17] |
Peres H, Gon alves P, Oliva-Teles A. Glucose tolerance in gilthead seabream (Sparus aurata) and European seabass (Dicentrarchus labrax)[J]. Aquaculture, 1999, 179(1): 415-423. |
| [18] |
Vigliano F A, Quiroga M I, Nieto J M. Adaptaciones metabólicas al ayuno y realimentación en peces[J]. Rev Ictiol, 2002, 10(1/2): 79-108. |
| [19] |
Lou B, Shi H L, Luo J A, et al. Effects of starvation and refeeding on growth and biochemical compositions of common sea-perch Lateolabrax japonicus[J]. Journal of Dalian Fisheries University, 2008, 23(3): 173-178. [楼宝, 史会来, 骆季安, 等. 饥饿和再投喂对鲈幼鱼生长和生化组成的影响[J]. 大连海洋大学学报, 2008, 23(3): 173-178. DOI:10.3969/j.issn.1000-9957.2008.03.003] |
| [20] |
Power D M, Melo J, Santos C R A. The effect of food deprivation and refeeding on the liver, thyroid hormones and transthyretin in sea bream[J]. Journal of Fish Biology, 2000, 56(2): 374-387. DOI:10.1111/jfb.2000.56.issue-2 |
| [21] |
Metón I, Fernández F, Baanante I V. Short-and long-term effects of refeeding on key enzyme activities in glycolysis-gluconeogenesis in the liver of gilthead seabream (Sparus aurata)[J]. Aquaculture, 2003, 225(1): 99-107. |
| [22] |
Rios F S, Moraes G, Oba E T, et al. Mobilization and recovery of energy stores in traíra, Hoplias malabaricus Bloch (Teleostei, Erythrinidae) during long-term starvation and after re-feeding[J]. Journal of Comparative Physiology B, 2006, 176(7): 721-728. DOI:10.1007/s00360-006-0098-3 |
| [23] |
Pérez-Jiménez A, Guedes M J, Morales A E, et al. Metabolic responses to short starvation and refeeding in Dicentrarchus labraxEffect of dietary composition[J]. Aquaculture, 2007, 265(1): 325-335. |
| [24] |
Yang C H, Cai X, Liu X, et al. Effects of starvation and refeeding on the physiological and biochemical indices of blood of Hucho tajmen juveniles[J]. Freshwater Fisheries, 2009, 39(1): 36-40. [杨成辉, 蔡勋, 刘霞, 等. 饥饿和再投喂对哲罗鱼幼鱼血液生理生化指标的影响[J]. 淡水渔业, 2009, 39(1): 36-40. DOI:10.3969/j.issn.1000-6907.2009.01.007] |
| [25] |
Suarez R K, Mommsen T P. Gluconeogenesis in teleost fishes[J]. Canadian Journal of Zoology, 1987, 65(8): 1869-1882. DOI:10.1139/z87-287 |
| [26] |
Machado C R, Garofalo M A, Roselino J E, et al. Effects of starvation, refeeding, and insulin on energy-linked metabolic processes in catfish (Rhamdia hilarii) adapted to a carbohydrate-rich diet[J]. General & Comparative Endocrinology, 1988, 71(3): 429-437. |
| [27] |
Viegas I, Mendes V M, Leston S, et al. Analysis of glucose metabolism in farmed European sea bass (Dicentrarchus labrax L[J]. Comparative Biochemistry & Physiology Part A:Molecular & Integrative Physiology, 2011, 160(3): 341-347. |
| [28] |
Pérez-Jiménez A, Cardenete G, Hidalgo M C, et al. Metabolic adjustments of Dentex dentex to prolonged starvation and refeeding[J]. Fish Physiology and Biochemistry, 2012, 38(4): 1145-1157. DOI:10.1007/s10695-011-9600-2 |
| [29] |
Du Q Y, Wang P, Wang Y L, et al. Effects of long term starvation and refeeding on glycogen, acid phosphatase and alkaline phosphatase in different tissues of Misgurnus anguillicadatus[J]. Journal of Jiangxi Normal University, 2008, 32(4): 488-493. [杜启艳, 王萍, 王友利, 等. 长期饥饿和再投喂对泥鳅不同组织糖原、酸性磷酸酶和碱性磷酸酶的影响[J]. 江西师范大学学报(自然版), 2008, 32(4): 488-493.] |
| [30] |
Grigorakis K, Alexis M N. Effects of fasting on the meat quality and fat deposition of commercial-size farmed gilthead sea bream (Sparus aurata, L[J]. Aquaculture Nutrition, 2005, 11(5): 341-344. DOI:10.1111/anu.2005.11.issue-5 |
| [31] |
Hung S S O, Wei L, Li H, et al. Effect of starvation on some morphological and biochemical parameters in white sturgeon, Acipenser transmontanus[J]. Aquaculture, 1997, 151(1-4): 357-363. DOI:10.1016/S0044-8486(96)01506-2 |
| [32] |
Nordlie R C, Foster J D, Lange A J. Regulation of glucose production by the liver[J]. Annual Review of Nutrition, 1999, 19: 379-406. DOI:10.1146/annurev.nutr.19.1.379 |
| [33] |
Pilkis S J, Granner D K. Molecular physiology of the regulation of hepatic gluconeogenesis and glycolysis[J]. Annual Review of Physiology, 1992, 54: 885-909. DOI:10.1146/annurev.ph.54.030192.004321 |
| [34] |
Kirchner S, Seixas P, Kaushik S, et al. Effects of low protein intake on extra-hepatic gluconeogenic enzyme expression and peripheral glucose phosphorylation in rainbow trout (Oncorhynchus mykiss)[J]. Comparative Biochemistry & Physiology Part B:Biochemistry & Molecular Biology, 2005, 140(2): 333-340. |
| [35] |
Metón I, Caseras A, Fernández F, et al. Molecular cloning of hepatic glucose-6-phosphatase catalytic subunit from gilthead sea bream (Sparus aurata):response of its mRNA levels and glucokinase expression to refeeding and diet composition[J]. Comparative Biochemistry & Physiology Part B:Biochemistry & Molecular Biology, 2004, 138(2): 145-153. |
| [36] |
Li S Y, Liu H Y, Tan B P, et al. Effects of dietary carbohydrate levels on the gene expression and the activity of PEPCK in marine fishes with different food habits[J]. Acta Hydrobiologica Sinica, 2015, 39(1): 80-89. [李淑云, 刘泓宇, 谭北平, 等. 饲料中糖水平对不同食性海水鱼类PEPCK基因表达和酶活性的影响[J]. 水生生物学报, 2015, 39(1): 80-89.] |
| [37] |
Wimmer M. Effects of starvation and refeeding a high carbohydrate diet on the intra-acinar distribution pattern of phosphoenolpyruvate carboxykinase activity in the liver of male and female rats[J]. Histochemistry, 1989, 92(4): 331-336. DOI:10.1007/BF00500549 |
| [38] |
Cai C F, Chen L Q, Song X H, et al. The change of plasma glucose, plasma triglyceride and liver glycogen after oral glucose administration in allogynogenetic silver crucian carp[J]. Journal of Fisheries of China, 2002, 26(3): 236-241. [蔡春芳, 陈立侨, 宋学宏, 等. 异育银鲫口服葡萄糖后血糖、血脂和肝糖原的变化[J]. 水产学报, 2002, 26(3): 237-241.] |
| [39] |
Blasco J, Fernàndez-Borràs J, Marimon I, et al. Plasma glucose kinetics and tissue uptake in brown trout in vivo:effect of an intravascular glucose load[J]. Journal of Comparative Physiology B, 1996, 165(7): 534-541. DOI:10.1007/BF00387514 |
| [40] |
Li X F, Xu C, Zhang D D, et al. Molecular characterization and expression analysis of glucokinase from herbivorous fish Megalobrama amblycephala subjected to a glucose load after the adaption to dietary carbohydrate levels[J]. Aquaculture, 2016, 459: 89-98. DOI:10.1016/j.aquaculture.2016.03.035 |
| [41] |
Iglesia N De la, Mukhtar M, Seoane J, et al. The role of the regulatory protein of glucokinase in the glucose sensory mechanism of the hepatocyte[J]. Journal of Biological Chemistry, 2000, 275(14): 10597-10603. DOI:10.1074/jbc.275.14.10597 |
| [42] |
Morifuji M, Sakai K, Sanbongi C, et al. Dietary whey protein increases liver and skeletal muscle glycogen levels in exercise-trained rats[J]. British Journal of Nutrition, 2005, 93(4): 439-445. DOI:10.1079/BJN20051373 |
| [43] |
Mueckler M. Facilitative glucose transporters[J]. European Journal of Biochemistry, 1994, 219(3): 713-725. DOI:10.1111/ejb.1994.219.issue-3 |
| [44] |
Klip A, Tsakiridis T, Marette A, et al. Regulation of expression of glucose transporters by glucose:a review of studies in vivo and in cell cultures[J]. Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology, 1994, 8(1): 43-53. DOI:10.1096/fasebj.8.1.8299889 |
| [45] |
Capilla E, Díaz M, Gutiérrez J, et al. Physiological regulation of the expression of a GLUT4 homolog in fish skeletal muscle[J]. American Journal of Physiology-Endocrinology and Metabolism, 2002, 283(1): E44-E49. DOI:10.1152/ajpendo.00065.2002 |
| [46] |
Hrytsenko O, Pohajdak B, Xu B Y, et al. Cloning and molecular characterization of the glucose transporter 1 in tilapia (Oreochromis niloticus)[J]. General and Comparative Endocrinology, 2010, 165(2): 293-303. DOI:10.1016/j.ygcen.2009.07.017 |
 2018, Vol. 25
2018, Vol. 25

