2. 中国水产科学研究院 黄海水产研究所, 农业部海洋渔业可持续发展重点实验室, 山东 青岛 266071;
3. 江苏中洋集团, 江苏 南通 226600
2. Key Laboratory for Sustainable Development of Marine Fisheries, Ministry of Agriculture; Yellow Sea Fisheries Research Institute Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Jiangsu Zhongyang Group, Nantong 226600, China
美洲西鲱(Alosa sapidissima), 又名美洲鲥, 与中国鲥(Tenualosa reevesii)不仅在分类上比较接近, 其生活习性和食用口感都比较接近, 具有较高的营养价值[1-2]。在过去的几十年里, 作为替代品种引入中国, 养殖技术日益成熟, 养殖规模逐渐扩大, 具有较高的市场和经济价值[3-5]。然而美洲西鲱早期发育阶段尤其是开口摄食外源性饵料之后的高死亡率严重制约了产业的发展, 因此苗种培育阶段的饵料选择具有重要意义。
饵料的选择是苗种培育的关键之一, 目前轮虫、卤虫和桡足类等生物饵料依然是仔鱼的主要营养来源。然而, 生物饵料的生产成本高, 受自然条件影响很大, 难以满足苗种培育的需要[6-7]; 另外生物饵料缺乏必须的脂肪酸, 其营养组成常常难以满足仔鱼后期的生长以及抗逆抗病需求, 不利于苗种的成活、生长[8-10]。因此, 用人工微颗粒饲料代替生物饵料已经成为一种趋势。目前对人工微颗粒饲料的研发已广泛开展, 旨在开发适合于仔鱼摄食和消化的微颗粒饲料, 以期部分或全部代替生物饵料, 以解决生物饵料短缺和营养不足的问题[6, 11]。然而使用微颗粒饲料进行育苗的效果与生物饵料相比还有一定差距, 主要表现在成活率偏低、生长速度较慢等[12-13]。因此, 许多学者积极探讨合理的投喂策略, 研究表明, 微颗粒饲料与生物饵料联合投喂不仅能够使仔鱼更容易接受人工饵料, 还能够提高仔鱼对营养的摄入水平[14-15]。
目前美洲西鲱苗种培育一般采用轮虫开口, 经卤虫无节幼体过渡然后转食配合饲料的方式, 或者经卤虫无节幼体和枝角类过渡的方式进行[16]。一般情况下, 外源摄食的仔鱼对脂肪酸的需求与卵黄囊仔鱼组成相接近[17]。本研究根据美洲西鲱早期发育过程中仔鱼脂肪酸的组成, 选择了一种脂肪酸组型上比卤虫更为接近的微颗粒饲料进行投喂, 以期部分或完全替代生物饵料。试验采用单独投喂卤虫、单独投喂微颗粒饲料以及混合投喂的方式, 对仔鱼的存活、生长、消化酶活性、非特异性免疫相关酶活性以及体脂肪酸进行分析, 旨在找到更为经济有效的饵料投喂策略, 为美洲西鲱苗种培育提供依据。
1 材料与方法 1.1 实验材料实验于2015年5月在江苏中洋集团良种场进行, 挑选体质健康、状态活跃的美洲西鲱亲鱼放入环形的产卵池中, 水温19~20℃, 自然光照, 经人工催产, 收集自然产出的受精卵放入锥形孵化器中充气培养, 育苗所用水为多次过滤后的井水, 孵化后的仔鱼在孵化器中继续培养1 d后转入多个体积为200 L的塑料桶内, 孵化3 d后开始投喂淡水轮虫[(优势种为萼花臂尾轮虫(Brachionus calyciflorus)), 仔鱼开口后1周内辅以投喂卤虫(Artemia)无节幼体或微颗粒饲料进行驯化, 卤虫无节幼虫由产自美国大盐湖的卤虫卵孵化而得, 微颗粒饲料为日本林兼产业株式会社所产鱼宝S1型开口饵料。
1.2 实验方法 1.2.1 实验分组及管理实验从第10日龄开始, 养殖周期30 d。根据投喂饵料的不同分3组(A:卤虫; B:微颗粒饲料+卤虫; C:微颗粒饲料), 每组3个平行, 每个平行500尾。实验仔鱼分别饲养在9个体积为200 L的塑料桶内, 水温19~20℃, 溶解氧(6.97±0.12) mg/L, 自然光照。每天自7:30开始至17:30结束, 每隔2 h投喂1次, 共投喂6次。A组只投喂卤虫无节幼体, 密度为2个/mL; B组卤虫与微颗粒饲料交替投喂, 每天各投喂3次, 卤虫密度为2个/mL, 微颗粒饲料投喂量为每次每桶100 mg; C组只投喂微颗粒饲料, 投喂量为每次每桶100 mg。每天换水1次, 换水量为总量的1/5。每天吸污2次, 及时清理残饵粪便和死鱼, 并做好记录。
1.2.2 样品采集与计算实验开始时随机取60尾仔鱼使用游标卡尺和分析天平测量平均体长、体重作为各实验组的初始体长和体重。为了解实验过程中各指标的基本变化趋势, 分别于实验开始后10 d、20 d、30 d(实验结束)进行样品采集, 每个平行组随机取20尾仔鱼, 仔鱼经MS222麻醉后, 使用游标卡尺测量全长, 然后将每个平行组取样仔鱼合为一个样本, 吸干体表水分后使用分析天平称量得到平均体质量。实验结束后每个平行组另取20尾, 在冰上迅速解剖, 取出内脏团, 液氮速冻后转移到-80℃冰箱, 用于消化酶以及免疫相关酶的测量; 再取100尾液氮速冻后转移到-80℃冰箱, 用于脂肪酸的检测。
特定生长率(specific growth rate, SGR)和存活率(survival rate, SR)按下列公式计算:
SGR = 100×[ln (Wf/Wi)/T]
SR = 100×(Qi−Qt)/Qi
式中, Wf表示终末湿重, Wi表示初始湿重, Qi表示实验开始时的仔鱼数量, Qt表示实验过程中的仔鱼死亡数, T表示实验天数。
1.2.3 酶活性测定准确称取组织重量, 按重量(g) :体积(mL)=1:9的比例, 加入9倍体积的生理盐水, 冰水浴条件下机械匀浆, 2500 r/min, 离心10 min, 取上清液, 分装后4℃冰箱保存待用, 8 h内完成酶活性测定。
样品胃蛋白酶、胰蛋白酶、糜蛋白酶、淀粉酶、脂肪酶、碱性磷酸酶(ALP)、溶菌酶(LZM)、过氧化氢酶(CAT)、超氧化物岐化酶(SOD)的活性测定均使用南京建成生物工程研究所生产的试剂盒进行, 蛋白浓度用考马斯亮蓝染色法测定。
酶活力单位的定义如下, 胃蛋白酶活性为每mg组织蛋白37℃每min分解蛋白生成1 μg氨基酸相当于1个酶活力单位; 胰蛋白酶活性为在pH 8.0, 温度37℃条件下, 每mg蛋白中含有的胰蛋白酶每min使吸光度变化0.003为1个酶活力单位; 糜蛋白酶活性为每mg组织蛋白37℃时每min分解蛋白生成1 μg氨基酸相当于1个酶活力单位; 淀粉酶活性为组织中每mg蛋白在37℃时与底物作用30 min水解10 mg淀粉定义为1个酶活力单位; 脂肪酶活性为在37℃条件下, 每g组织蛋白在本反应体系中与底物反应1 min每消耗1 μmol底物为1个酶活力单位; ALP活性为每g组织蛋白在37℃时与基质作用15 min产生1 mg酚为1个酶活力单位; 在37℃条件下, 一定浓度的混浊菌液因溶菌酶溶解细菌细胞壁使细菌裂解, 从而浓度降低, 透明度增加, 因此可以根据菌液透明度的变化计算溶菌酶含量, LZM的活力为1 μg = 80 U; 过氧化氢酶活性为每mg组织蛋白1 s分解1 µmol的H2O2的量为1个活力单位; SOD活性为每mg组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个酶活力单位。
1.2.4 脂肪酸测定样品经研磨后放入水解管中, 加入3 mL 1mol/L KOH-CH3OH溶液, 在75℃水浴中皂化10 min。冷却后, 加入3 mL 2 mol/L的HCl-CH3OH溶液, 再放入75℃水浴中加热10 min, 使其甲酯化。然后加入1 mL的正已烷振荡萃取, 将上清液转移至离心管中低速离心5 min, 使用美国惠普公司HP6890型气相色谱仪分析测定脂肪酸的含量。
1.3 数据统计应用Excel 2010软件进行常规数据统计, 用SPSS18.0统计软件进行ANOVA单因素方差分析, 用LSD和SNK多重比较检验组间差异, 显著性水平为0.05。数据均表用平均值±标准误x±SE表示。
2 结果与分析 2.1 饵料的脂肪酸分析饵料的脂肪酸组成分析见表 1, 卤虫中饱和脂肪酸(SFA)含量显著低于微颗粒饲料, 而单不饱和脂肪酸(MUFA)的含量显著高于微颗粒饲料; 多不饱和脂肪酸(PUFA)的含量两者之间差异不显著(P > 0.05);卤虫中n-3高不饱和脂肪酸(n-3HUFA)的含量显著低于微颗粒饲料(P < 0.05), 其中二十碳五烯酸(EPA)含量两者之间差异不显著(P > 0.05), 而卤虫中几乎不含有二十二碳六烯酸(DHA), 其含量显著低于微颗粒饲料(P < 0.05)。
|
|
表 1 卤虫与微颗粒饲料的脂肪酸组成比较(占总脂肪酸的百分比) Tab.1 The comparison of fatty acids composition between Artemia and micro diet (% of total fatty acids content) |
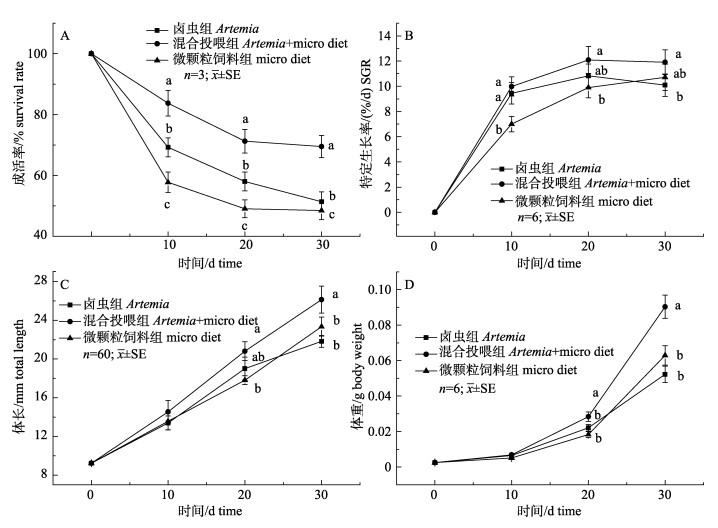
不同饵料对美洲西鲱仔鱼成活与生长的影响见图 1, 3组的成活率变化规律基本一致, 在20 d前降低幅度较大, 20 d后混合投喂组和微颗粒饲料组保持平稳, 而卤虫组继续下降; 试验结束后, 混合投喂组成活率最高, 从第10天后都显著高于其他两组(P < 0.05), 微颗粒饲料组成活率最低, 但与卤虫组相比无显著性差异(图 1A)。体长与体重的变化规律基本一致(图 1C, 1D), 试验结束后混合投喂组的体长与体重最高, 显著高于其他两组(P < 0.05), 微颗粒饲料组次之, 卤虫组最低, 两者之间不存在显著性差异; 另外混合投喂组SGR最高, 显著高于卤虫组(P < 0.05), 但与微颗粒饲料组相比无显著性差异(图 1B)。
|
图 1 不同饵料对美洲西鲱仔鱼成活与生长的影响 不同字母表示同一时间点不同组之间存在显著性差异(P<0.05). Fig.1 Effect of different diets on survival and growth of Alosa sapidissima larvae Different letters indicate significant differences between different groups at the same time (P<0.05). |
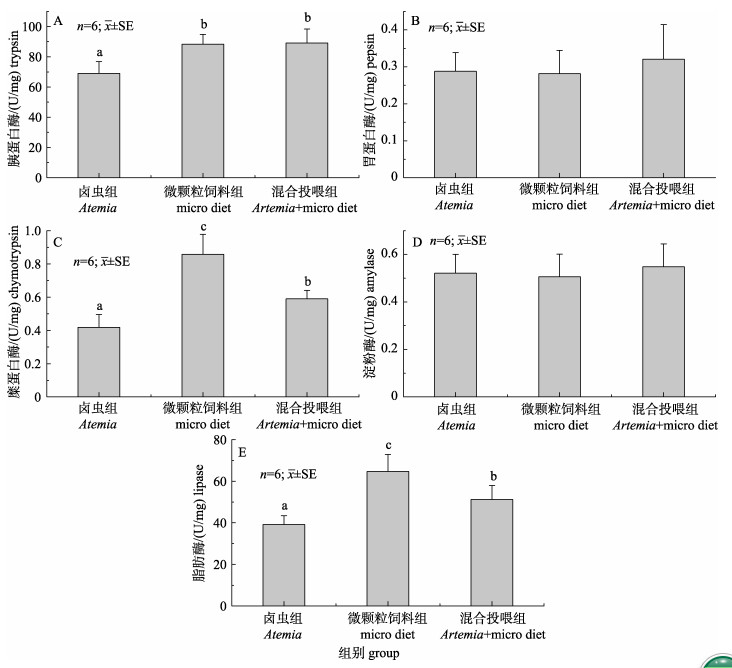
不同饵料对美洲西鲱仔鱼消化酶活力的影响见图 2, 其中胃蛋白酶和淀粉酶活力水平在各组中无显著性差异(图 2B, 2D); 胰蛋白酶活力水平在卤虫组中最低, 显著低于其他两组(P < 0.05), 混合投喂组与微颗粒饲料组无显著性差异(图 2A); 糜蛋白酶与脂肪酶在各组中的分布规律一致, 都是微颗粒饲料组中活力最高, 混合投喂组次之, 卤虫组最低, 各组之间差异显著(P < 0.05, 图 2C, 2E)。
|
图 2 不同饵料对美洲西鲱仔鱼消化酶活力的影响 不同字母表示各投喂组间存在显著性差异(P < 0.05). Fig.2 Effect of different diets on digestive enzyme activities in Alosa sapidissima larvae Different letters indicate significant differences between different groups (P<0.05). |
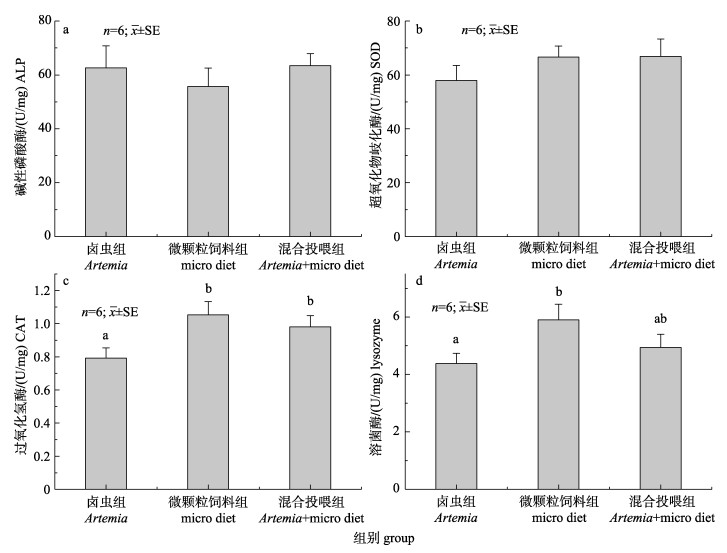
SOD的活力水平在卤虫组中最低, 各组之间无显著性差异(P > 0.05, 图 3a); ALP活力水平在微颗粒饲料中最低, 各组之间无显著性差异(P > 0.05, 图 3b); CAT与LZM活力水平在微颗粒饲料组中最高, 显著高于卤虫组(P < 0.05), 但与混合投喂组相比无显著性差异(P > 0.05, 图 3c, 3d)。
|
图 3 不同饵料对美洲西鲱仔鱼非特异性免疫的影响 不同字母表示各投喂组间存在显著性差异(P < 0.05). Fig.3 Effect of different diets on non-specific immune response in Alosa sapidissima larvae Different letters indicate significant differences between different groups (P < 0.05). |
实验后的美洲西鲱仔鱼脂肪酸的分析结果见表 2, SFA的含量在微颗粒饲料组中最高, 混合投喂组中次之, 卤虫组中最低, 微颗粒饲料组显著高于卤虫组(P < 0.05); MUFA的含量在卤虫组中最高, 微颗粒饲料组中最低, 各组间均存在显著性差异(P < 0.05); PUFA的含量在各组之间不存在显著性差异; n-3HUFA的含量在卤虫组中最低, 显著低于其他两组(P < 0.05), 其他两组间无显著性差异, 其中EPA含量在各组间不存在显著性差异, 而DHA含量在微颗粒组中最高, 卤虫组中最低, 并且各组间均存在显著性差异(P < 0.05)。
|
|
表 2 不同饵料对美洲西鲱仔鱼脂肪酸组成的影响(占总脂肪酸的百分比) Tab.2 Effect of different diets on body fatty acids composition in American shad larvae (% of total fatty acids content) |
饵料是苗种培育的关键之一, 饵料的选择对仔鱼的存活及生长状况具有重大的影响, 饵料所含必需脂肪酸的差异是影响仔鱼生长和存活的重要因素之一。一般外源摄食的仔鱼对脂肪酸的需求与卵黄囊仔鱼组成相接近[17]。对美洲西鲱早期发育过程中脂肪酸变化的研究发现, 卵黄囊仔鱼中n-3HUFA以及DHA都处在较高的水平, 对比卤虫与微颗粒饲料中的脂肪酸组成可以发现, 微颗粒饲料的脂肪酸组型与卵黄囊仔鱼更为接近。本实验中, 对比与实验鱼同批次的仔鱼在实际生产中的存活率(50%)和特定生长率(10.2%/d), 各组都表现出相近的或者更高的存活率和特定生长率, 由此表明试验条件满足仔鱼正常生长发育。另外, 只投喂卤虫的仔鱼存活率低, 生长表现较差, 可能与卤虫体内较低的n-3HUFA含量以及几乎不含有DHA有关。饵料中较高的n-3HUFA含量可以提高仔鱼的抗逆能力, 从而有利于改善仔鱼在发育阶段的存活表现[18-19]。DHA是细胞膜的结构成分, 在仔鱼早期发育突触的形成过程中发挥重要的作用[20-21], 对仔鱼的成活率和生长表现也有着极为重要的作用[22], 作为必需不饱和脂肪酸, 与EPA和AA相比更为重要[23-24], 饵料中缺乏DHA可能会导致神经和视觉发育不良[25]。单一投喂微颗粒饲料的仔鱼存活率低, 生长表现较差, 可能是由于在仔鱼发育前期消化器官发育不完全, 导致不能有效地利用微颗粒饲料[16, 26-27]。混合投喂组在成活率、体长、体重以及特定生长率方面都是最佳表现, 原因可能在于一方面保持的生物饵料的适口性以及易被消化, 另一方面摄入的微颗粒饲料又满足了必需脂肪酸的需要, 在生产上可以减少或代替强化剂的使用, 不仅减少了生产成本, 还能够使仔鱼更好地转食配合饲料。另外不同饵料对仔鱼体脂肪酸的组成也具有显著影响, 微颗粒饲料组和混合投喂组n-3HUFA以及DHA的含量显著高于卤虫组, 尤其是微颗粒饲料组, 与饵料中的脂肪酸含量呈正相关, 这与邱小琮等[18]、刘光兴等[28]、Robin[29]的研究结果一致。刘光兴等[28]研究发现, 鱼体的脂肪酸组成受饵料脂肪酸组成影响较大, 使用缺乏DHA的饵料投喂斜带石斑鱼(Epinephelus coioides)仔鱼后, 其体内DHA的含量也很低。邱小琮等[18]使用AA、EPA、DHA含量较高的火腿许水蚤投喂牙鲆(Paralichthys olivaceus)仔鱼后, 其含量显著高于投喂卤虫无节幼体的仔鱼。
研究表明, 鱼类早期发育过程中的消化系统具有一定的可塑性[30], 可以根据不同的饵料调整其消化能力, 以满足其生长的营养需求[31]。饵料的营养成分作为消化酶的底物可以影响消化酶的分泌与活力, 投喂不同饵料对仔鱼的消化酶活力具有显著影响[26]。消化酶活性不仅可以反映不同的摄食类型和摄食能力, 还可以反映出仔鱼对营养物质的选择性吸收倾向[27, 32]。本实验中不同投喂条件下的胃蛋白酶活力没有显著性差异, 表明投喂生物饵料对胃蛋白酶活力没有明显的提高, 这与强俊等[33]对奥尼罗非鱼(Oreochromis niloticus×O. aureus)的研究结果类似。胰蛋白酶和糜蛋白酶以酶原的形式在胰腺细胞中合成, 经蛋白水解激活后释放到肠道, 作为主要的肠道蛋白酶, 其活性的变化影响摄食蛋白质的消化和吸收[34]。另外, 研究发现在鱼类个体发育早期发育阶段, 胰蛋白酶和脂肪酶活性还可以作为指示剂监测仔鱼的营养状态[35-37]。本实验中两种蛋白酶的活性以及脂肪酶的活性在微颗粒饲料组和混合投喂组中都处在较高的水平, 并且显著高于卤虫组, 表明微颗粒饲料的添加提高了对摄食蛋白及脂质的消化与吸收能力。然而消化酶的活力大小与实验结束时的生长表现并不十分一致, 根据不投饵料投喂下仔鱼的存活与生长表现, 混合投喂要优于单一投喂卤虫或者单一投喂微颗粒饲料。微颗粒饲料组生长表现不佳的原因分析可能是由于投喂前中期(0~20 d)仔鱼消化系统发育不完全, 过早地摄入微颗粒饲料可能会影响仔鱼对食物的消化, 导致饵料利用率低, 对仔鱼生长会有消极的影响[38-39]。实验结束时虽然没有达到混合投喂组的生长表现, 但在投喂后期(20~30 d)生长速度加快, 而卤虫组在这段时间内生长速度缓慢, 与消化酶的活力一致。研究发现, 在鱼类苗种培育期间摄食卤虫的时间越长, 转食配合饲料的过程就越困难[40], 尽早进行配合饲料的驯化可以提高转食的成功率[41]。另外投喂不同饵料对淀粉酶活力没有显著影响, 也间接说明单一投喂微颗粒饲料并不会造成饥饿胁迫, 因为仔鱼长期处于饥饿状态时会大量利用淀粉, 淀粉酶活力也会增加[42]。
不同饵料的投喂除了对消化酶产生影响外, 对非特异性免疫相关酶也产生了一定的影响。一些研究发现, ALP与LZM作为吞噬活性和多种应激因子的指标, 与免疫应答密切相关[43-45]。CAT和SOD是生理抗氧化的主要成分, 能够应对自身代谢及环境因素引起的氧化应激, 在鱼类免疫系统中发挥重要的作用[46-48]。在本实验中, 不同的投喂方式下各组的ALP与SOD的活性差别不大, 而CAT与LZM的活性在卤虫组中最低, 微颗粒饲料组中最高。这与试验结束时的存活率并不一致, 但与20 d后的存活表现具有一定的相关性。在此期间卤虫组死亡数量持续增多, 而其他两组则比较稳定。这也表明, 在20 d后开始摄食微颗粒饲料的仔鱼具有更好的存活表现, 这可能与具有更高的非特异性免疫能力有关。
综合分析不同饵料对美洲西鲱仔鱼存活、生长、消化酶活性、非特异性免疫相关酶活性以及体脂肪酸组成的影响, 可以发现混合投喂组在投喂的前20 d在存活和生长方面都要显著优于其他两组, 在20 d后其存活率趋于平稳, 与微颗粒饲料组相似。另外在投喂30 d时微颗粒饲料组在消化酶活力和非特异性免疫应答方面表现出一定的优越性, 因此初步认为, 在试验20 d前使用卤虫与微颗粒饲料混合投喂, 20 d后完全转食微颗粒饲料, 可以在减少成本的同时, 提高生产效率。由于试验采样时间在10 d、20 d和30 d, 因此想获得最佳的完全转食时间, 仍需要进一步的研究。
| [1] |
Guo Y J, Xing K Z, Yang G, et al. Determination and analysis of nutritional components in muscle of Alosa sapidissima[J]. China Feed, 2010, 10(8): 39-41. [郭永军, 邢克智, 杨广, 等. 美洲鲥鱼肌肉营养成分测定及分析[J]. 中国饲料, 2010, 10(8): 39-41. DOI:10.3969/j.issn.1004-3314.2010.08.013] |
| [2] |
Gu R B, Zhang C X, Xu G C, et al. Analysis and evaluation of nutritional components in muscle of Alosa sapidissima[J]. Chinese Journal of Fisheries, 2007, 20(2): 40-46. [顾若波, 张呈祥, 徐钢春, 等. 美洲鲥肌肉营养成分分析与评价[J]. 水产学杂志, 2007, 20(2): 40-46. DOI:10.3969/j.issn.1005-3832.2007.02.008] |
| [3] |
Xu G C, Zhang C X, Zheng J L, et al. Study on artificial propagation and embryonic development of Alosa sapidissima[J]. Marine Science, 2012, 36(7): 89-96. [徐钢春, 张呈祥, 郑金良, 等. 美洲鲥的人工繁殖及胚胎发育的研究[J]. 海洋科学, 2012, 36(7): 89-96.] |
| [4] |
Yu G B, Li G. Study on the biological characteristics and breeding technology of Alosa sapidissima[J]. China Fisheries, 2016(6): 100-103. [于广宝, 李刚. 鲥鱼的生物学特性及增养殖技术研究[J]. 中国水产, 2016(6): 100-103.] |
| [5] |
Wu W H, Wang B, Shi W, et al. Study on culture technology of Alosa sapidissima on a large scale -Ⅰ juveniles culturing[J]. Chinese Journal of Fisheries, 2004, 17(2): 61-64. [吴文化, 王斌, 师伟, 等. 美洲鲥鱼苗种规模化养殖技术研究-Ⅰ稚鱼培育[J]. 水产学杂志, 2004, 17(2): 61-64. DOI:10.3969/j.issn.1005-3832.2004.02.012] |
| [6] |
Kanazawa A, Koshio S, Teshima S I. Growth and survival of larval red sea bream Pagrus major and Japanese flounder Paralichthys olivaceus fed microbound diets[J]. Journal of the World Aquaculture Society, 1989, 20(2): 31-37. DOI:10.1111/jwas.1989.20.issue-2 |
| [7] |
Zhao J Z, Ai Q H, Mai K S, et al. Effects of substitution of live prey by microdiet on growth, survival and activities of digestive enzymes of larval Pseudosciaena crocea[J]. Journal of Fisheries of China, 2008, 32(1): 91-97. [赵金柱, 艾庆辉, 麦康森, 等. 微粒饲料替代生物饵料对大黄鱼稚鱼生长、存活和消化酶活力的影响[J]. 水产学报, 2008, 32(1): 91-97.] |
| [8] |
Mourente G, Rodriguez A, Tocher D R, et al. Effects of dietary docosahexaenoic acid (DHA; 22:6n-3) on lipid and fatty acid compositions and growth in gilthead sea bream (Sparus aurata L[J]. Aquaculture, 1993, 112(1): 79-98. DOI:10.1016/0044-8486(93)90160-Z |
| [9] |
Levine D M, Sulkin S D. Nutritional significance of long-chain polyunsaturated fatty acids to the zoeal development of the brachyuran crab, Eurypanopeus depressus (Smith)[J]. Journal of Experimental Marine Biology & Ecology, 1984, 81(3): 211-223. |
| [10] |
Rodriguez C, Perez J A, Lorenzo A, et al. n-3 HUFA requirement of larval gilthead seabream Sparus aurata when using high levels of eicosapentaenoic acid[J]. Comparative Biochemistry and Physiology Part A Physiology, 1994, 107(4): 693-698. DOI:10.1016/0300-9629(94)90371-9 |
| [11] |
Lin J B. Application of pellet feed in aquaculture[J]. Water Conservancy Related Fisheries, 2005, 25(6): 82-83, 99. [林建斌. 微粒饲料在水产养殖中的应用[J]. 水利渔业, 2005, 25(6): 82-83, 99. DOI:10.3969/j.issn.1003-1278.2005.06.037] |
| [12] |
Cahu C, Infante J Z. Substitution of live food by formulated diets in marine fish larvae[J]. Aquaculture, 2001, 200(1-2): 161-180. DOI:10.1016/S0044-8486(01)00699-8 |
| [13] |
Sakunthala H S, Senarathna A K S. Sudden weaning of angel fish Pterophyllum scalare (Lichtenstein) (Pisces; Cichlidae) larvae from brine shrimp (Artemiasp) nauplii to formulated larval feed[J]. Springer Plus, 2013, 2(1): 102. DOI:10.1186/2193-1801-2-102 |
| [14] |
Jeannine P L R, Claude A J, Laurence T, et al. Marine fish larvae feeding:formulated diets or live prey?[J]. Journal of the World Aquaculture Society, 1993, 24(2): 211-224. DOI:10.1111/jwas.1993.24.issue-2 |
| [15] |
Rosenlund G, Stoss J, Talbot C. Co-feeding marine fish larvae with inert and live diets[J]. Aquaculture, 1997, 155(1): 183-191. |
| [16] |
Gao X Q, Hong L, Liu Z F, et al. An integrative study of larval organogenesis of American shad Alosa sapidissima in histological aspects[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(1): 136-152. DOI:10.1007/s00343-016-5008-2 |
| [17] |
Sargent J, Bell G, McEvoy L, et al. Recent developments in the essential fatty acid nutrition of fish[J]. Aquaculture, 1999, 177(1-4): 191-199. DOI:10.1016/S0044-8486(99)00083-6 |
| [18] |
Qiu X Z, Zhou H Q, Zeng Q H, et al. The effect of enriched Brachionus plicatilis and Artemia nauplii on the survival, growth and fatty acid composition in Paralichthys olivaceus[J]. Fisheries Science, 2004, 23(2): 4-8. [邱小琮, 周洪琪, 曾庆华, 等. 营养强化的轮虫、卤虫对牙鲆仔鱼的成活、生长及体脂肪酸组成的影响[J]. 水产科学, 2004, 23(2): 4-8. DOI:10.3969/j.issn.1003-1111.2004.02.002] |
| [19] |
Wang S, Liu Y J, Tian L X, et al. Nutritional analysis of different diets and effect of diets on growth and fatty acid composition in larval grouper Epinephelus coioides[J]. Journal of Zhongshan University:Natural Science Edition, 2003, 42(s2): 214-217. [王胜, 刘永坚, 田丽霞, 等. 斜带石斑仔鱼不同饵料的营养分析及其对生长和鱼体脂肪酸组成的影响[J]. 中山大学学报:自然科学版, 2003, 42(s2): 214-217.] |
| [20] |
Lauritzen L A, Hansen H S, J rgensen M H, et al. The essentiality of long chain n-3 fatty acids in relation to development and function of the brain and retina[J]. Progress in Lipid Research, 2001, 40(1): 1-94. |
| [21] |
Tocher D R. Metabolism and functions of lipids and fatty acids in teleost fish[J]. Reviews in Fisheries Science, 2003, 11(2): 107-184. DOI:10.1080/713610925 |
| [22] |
Sargent J, McEvoy L, Estevez A, et al. Lipid nutrition of marine fish during early development:current status and future directions[J]. Aquaculture, 1999, 179(1-4): 217-229. DOI:10.1016/S0044-8486(99)00191-X |
| [23] |
Watanabe T, Arakawa T, Takeuchi T, et al. Comparison between eicosapentaenoic and docosahexaenoic acids in terms of essential fatty acid efficiency in juvenile striped jack Pseudocaranx dentex[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1989, 55(11): 1989-1995. DOI:10.2331/suisan.55.1989 |
| [24] |
Takeuchi T, Arakawa T, Satoh S, et al. Supplemental effect of phospholipids and requirement of eicosapentaenoic acid and docosahexaenoic acid of juvenile striped Jack[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1992, 58(4): 707-713. DOI:10.2331/suisan.58.707 |
| [25] |
Tocher D R, Harvie D G. Fatty acid compositions of the major phosphoglycerides from fish neural tissues; (n-3) and (n-6) polyunsaturated fatty acids in rainbow trout (Salmo gairdneri) and cod (Gadus morhua) brains and retinas[J]. Fish Physiology and Biochemistry, 1988, 5(4): 229-239. DOI:10.1007/BF01874800 |
| [26] |
Su S P, Zhao X W. The influence of different diets on the digestive enzyme activities of amur sturgeon Acipenseride schrencki Brandt larvae[J]. Journal of Biology, 2005, 22(1): 27-29. [苏时萍, 赵兴文. 不同饵料对史氏鲟仔鱼消化酶活性的影响[J]. 生物学杂志, 2005, 22(1): 27-29. DOI:10.3969/j.issn.2095-1736.2005.01.010] |
| [27] |
Gao X Q, Liu Z F, Guan C T, et al. Developmental changes in digestive enzyme activity in American shad, Alosa sapidissima, during early ontogeny[J]. Fish Physiology and Biochemistry, 2017, 43(2): 397-409. DOI:10.1007/s10695-016-0295-2 |
| [28] |
Liu G X, Xu D H, Qiu X C, et al. Study on the growth, survival and fatty acids composition of larvae and juvenile of Paralichthys olivaceus raised with Schmackeria poplesia[J]. Periodical of Ocean University of China, 2007, 37(2): 259-265. [刘光兴, 徐东晖, 邱旭春, 等. 火腿许水蚤对牙鲆仔稚鱼成活、生长及脂肪酸组成的影响[J]. 中国海洋大学学报:自然科学版, 2007, 37(2): 259-265.] |
| [29] |
Robin J H. Use of borage oil in rotifer production and Artemia enrichment:effect on growth and survival of turbot (Scophthalmus maximus) larvae[J]. Aquaculture, 1998, 161(1-4): 323-331. DOI:10.1016/S0044-8486(97)00279-2 |
| [30] |
Buddington R K, Krogdahl A, Bakkemckellep A M. The intestines of carnivorous fish:structure and functions and the relations with diet[J]. Acta Physiologica Scandinavica Supplementum, 1997, 638: 67-80. |
| [31] |
Infante J L Z, Cahu C. Development and response to a diet change of some digestive enzymes in sea bass (Dicentrarchus labrax) larvae[J]. Fish Physiology and Biochemistry, 1994, 12(5): 399-408. DOI:10.1007/BF00004304 |
| [32] |
Debnath D, Pal A, Sahu N, et al. Digestive enzymes and metabolic profile of Labeo rohita fingerlings fed diets with different crude protein levels[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2007, 146(1): 107-114. DOI:10.1016/j.cbpb.2006.09.008 |
| [33] |
Qiang J, Wang H, Li R W, et al. Effects of different diets on growth, development and digestive enzymes activity in Tilapia Hybrid larvae[J]. Fisheries Science, 2009, 28(11): 618-623. [强俊, 王辉, 李瑞伟, 等. 不同饵料对奥尼罗非鱼仔稚鱼生长发育及消化酶活力的影响[J]. 水产科学, 2009, 28(11): 618-623. DOI:10.3969/j.issn.1003-1111.2009.11.002] |
| [34] |
Tsuzuki M Y, Sugai J K, Maciel J C, et al. Survival, growth and digestive enzyme activity of juveniles of the fat snook (Centropomus parallelus) reared at different salinities[J]. Aquaculture, 2007, 271(1): 319-325. |
| [35] |
Bolasina S, Pérez A, Yamashita Y. Digestive enzymes activity during ontogenetic development and effect of starvation in Japanese flounder, Paralichthys olivaceus[J]. Aquaculture, 2006, 252(2): 503-515. |
| [36] |
Uebersch r B. The use of tryptic enzyme activity measurement as a nutritional condition index:laboratory calibration data and field application[J]. ICES Marine Science Symposia, 1995, 201: 119-129. |
| [37] |
Oozeki Y, Bailey K M. Ontogenetic development of digestive enzyme activities in larval walleye pollock, Theragra chalcogramma[J]. Marine Biology, 1995, 122(2): 177-186. |
| [38] |
AndradeC A P, Nascimento F, Concei o L E C, et al. Red Porgy, Pagrus pagrus, larvae performance and nutritional condition in response to different weaning regimes[J]. Journal of the World Aquaculture Society, 2012, 43(3): 321-334. DOI:10.1111/jwas.2012.43.issue-3 |
| [39] |
Ring E, Johansen L, Raa J. Feeding of cod, Gadus morhua L., larvae on an artificial diet. Preliminary results[J]. Fisheries Research, 1991, 11(2): 191-193. DOI:10.1016/0165-7836(91)90108-R |
| [40] |
Ca avate J P, Fernández-Dı́Az C. Influence of co-feeding larvae with live and inert diets on weaning the sole Solea senegalensis onto commercial dry feeds[J]. Aquaculture, 1999, 174(3-4): 255-263. DOI:10.1016/S0044-8486(99)00021-6 |
| [41] |
Watanabe T, Kiron V. Prospects in larval fish dietetics[J]. Aquaculture, 1994, 124(1-4): 223-251. DOI:10.1016/0044-8486(94)90386-7 |
| [42] |
Tang B G, Chen G, Zhang J D, et al. Effect of diet series on growth, activity of digestive enzymes and body composition of larval cobia, Rachycentron Canadum[J]. Acta Hydrobiologica Sinica, 2007, 31(4): 479-484. [汤保贵, 陈刚, 张健东, 等. 饵料系列对军曹鱼仔鱼生长、消化酶活力和体成分的影响[J]. 水生生物学报, 2007, 31(4): 479-484. DOI:10.3321/j.issn:1000-3207.2007.04.005] |
| [43] |
Iger Y, Abraham M. Rodlet cells in the epidermis of fish exposed to stressors[J]. Tissue and Cell, 1997, 29(4): 431-438. DOI:10.1016/S0040-8166(97)80029-8 |
| [44] |
Fast M D, Sims D E, Burka J F, et al. Skin morphology and humoral non-specific defence parameters of mucus and plasma in rainbow trout, coho and Atlantic salmon[J]. Comparative Biochemistry and Physiology Part A:Molecular and Integrative Physiology, 2002, 132(3): 645-657. DOI:10.1016/S1095-6433(02)00109-5 |
| [45] |
Ross N W, Firth K J, Wang A, et al. Changes in hydrolytic enzyme activities of na ve Atlantic salmon Salmo salar skin mucus due to infection with the salmon louse Lepeophtheirus salmonis and cortisol implantation[J]. Diseases of Aquatic Organisms, 2000, 41(1): 43-51. |
| [46] |
Martínez- lvarez R M, Morales A E, Sanz A. Antioxidant defenses in fish:biotic and abiotic factors[J]. Reviews in Fish Biology and Fisheries, 2005, 15(1): 75-88. |
| [47] |
Tripathi B N, Mehta S K, Amar A, et al. Oxidative stress in Scenedesmus sp. during short-and long-term exposure to Cu2+ and Zn2+[J]. Chemosphere, 2006, 62(4): 538-544. DOI:10.1016/j.chemosphere.2005.06.031 |
| [48] |
Winston G W, Giulio R T D. Prooxidant and antioxidant mechanisms in aquatic organisms[J]. Aquatic Toxicology, 1991, 19(2): 137-161. DOI:10.1016/0166-445X(91)90033-6 |
 2018, Vol. 25
2018, Vol. 25

