2. 上海海洋大学 水产与生命学院, 上海 201306;
3. 余江县画桥中学, 江西 鹰潭 335000
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Yujiang County Huaqiao Middle School, Yingtan 335000, China
珠母贝(Pinctada margaritifera)又称黑蝶贝, 广泛分布于印度洋和太平洋的热带和亚热带区域, 从澳大利亚北部穿过赤道一直延伸到日本南部, 主要栖息于有珊瑚礁的浅海[1-3]。法属波利尼西亚珠母贝自然资源丰富, 当地传统的方法是捕捞野生成贝以及在贝类繁殖季节采集野生贝苗进行培育, 待贝壳壳高达到11 cm左右时, 对其进行插核移植手术, 随后在海区经过18~24个月的养殖, 待到珍珠层厚度达到0.8 mm时收获, 此种方法培育出的黑珍珠价格十分昂贵[3-5]。珠母贝已成为当地最主要的水产养殖品种, 黑珍珠产量由1980年的86 kg增至2012年的16 t, 占世界总产量的95%以上, 黑珍珠已成为该地出口经济价值最大的商品[2, 6]。珍珠养殖不仅成为当地继旅游业的第二大经济来源, 也带动了相关产业的发展并为当地提供许多就业资源[2, 7]。然而, 一直以来对野生珠母贝的过度捕捞, 导致自然资源锐减, 因此苗种人工繁育替代野生资源捕捞被认为是应对珍珠养殖产业可持续发展以及恢复自然资源的一项重要策略[8]。随着法属波利尼西亚和库克群岛一些珍珠养殖企业苗种培育首获成功, 其他太平洋国家如日本、印度、夏威夷和澳大利亚等纷纷效仿, 建立孵化场进行育苗以替代因过度捕捞而渐渐枯竭的野生资源[9-10]。然而, 珠母贝苗种培育技术目前并未十分成熟, 幼虫在变态附着前和刚沉淀附着后不久死亡率特别高, 这也一直是制约着珠母贝苗种大规模成功培育的关键。经验总结表明, 幼虫在达到变态附着期的成活率通常仅为初始幼虫的5%左右[9-10]。Alagarswami等[9]曾尝试优化单胞藻投喂种类及饵料浓度来提高幼虫培育成活率, 效果最佳的搭配组合幼虫在28 dph(days post hatching, 孵化后天数)开始出现变态附着, 幼虫成活率仅为初始幼虫的6.3%; Southgate等[10]试图通过改进幼虫培育设施, 用一种部分流水装置培育幼虫, 幼虫7 dph成活率为61.2%、14 dph为38.5%、23 dph为11.3%以及28 dph为7.2%。
珠母贝在中国南海部分海区亦有分布, 但自然资源极其有限, 目前主要依赖于采集野生成贝进行育珠, 因此由珠母贝培育的珍珠极少。海水珍珠95%以上产自合浦珠母贝(Pinctada fucata), 虽其珍珠总产量较大, 但所产珍珠粒径小、珠层薄, 不能与大珠母贝(P. maxima)、珠母贝及企鹅贝(Pteria penguin)等大型珍珠贝所培育的粒径大、珠层厚及特异性珍珠相媲美, 在国际市场上难有竞争力。一直以来珠母贝苗种培育和海区稚贝养殖出现的高死亡率问题尚未解决, 制约着中国珠母贝养殖产业的发展。笔者曾多次收集野生珠母贝亲贝, 对其进行催产使其自然排卵受精并获得大量幼虫, 采取与其他双壳贝类相同的方法进行培育, 观察的结果与以上描述大致相同, 幼虫在变态附着前死亡率特别高。多次的培育结果显示, 从D-形幼虫到60 dph苗种收获时(壳长3 mm左右)成活率不及0.1%。本研究旨在观察珠母贝幼虫形态变化、幼虫运动、自然沉降及摄食行为等生物学信息, 以期为幼虫培育设施及饵料投喂策略提供优化改进思路。
1 材料与方法 1.1 实验材料珠母贝亲贝壳长(97.74±8.33) mm (n=30), 捕捞自海南省三亚市天然海区(18°13 N, 109°33 E), 球等鞭金藻(Isochrysis galbana)与小球藻(Chlorella vulgaris)均为本课题组保种, 实验地点位于海南三亚。
1.2 饵料培养与幼虫培育球等鞭金藻与小球藻在顶部直径90 cm、底部直径80 cm、高74 cm的玻璃缸纤维桶内添加F/2营养液[11], 于自然光照(桶内光照强度0~5000 lx)条件下一次性培养, 单胞藻投喂时应处于快速生长期且细胞浓度大于106个/mL。
珠母贝亲贝清除表面附着物刷洗干净, 于阴凉处阴干3 h, 待亲贝张开壳后挑选性腺饱满的个体转移至水泥池中流水刺激进行自然排卵授精。受精卵经过24 h发育至D-形幼虫, 用400目筛绢网对幼虫进行过滤清洗, 然后转移至1 m× 1 m×1 m的水泥池以5个/mL的密度培养。幼虫培育期间每天8:00和18:00投喂球等鞭金藻(球等鞭金藻不能满足时以小球藻替代), 投喂量为1× 103~5×103个/mL, 每天换水30%~50%, 幼虫培育期间水温(28.73±1.05)℃、盐度28.45±1.20、pH 8.05±0.03。
1.3 观察幼虫运动、摄食与自然沉降及数据采集幼虫分别放入103个/mL和105个/mL的单胞藻液中摄食1 h, 用吸管把幼虫放入0.1 mL(2 cm× 2 cm×250 μm)浮游植物计数框中盖上盖玻片, 用phenix-ph 50显微镜物镜40倍镜下观察幼虫纤毛摆动与摄食状态。在幼虫培育的1 dph、5 dph、9 dph、13 dph、17 dph、21 dph和25 dph, 在内径为3.00 cm、高为2.00 cm的胚胎皿中放入幼虫密度大于10个/mL的幼虫浓缩液2 mL, 在低倍镜下连接800万像素摄像头以24帧/s的帧速率拍摄视频。用After Effects CS5图形视频处理软件对运动的幼虫追踪10 s形成运动轨迹并保存至图片, 用Toup View 3.7图像分析软件测量运动轨迹曲线长度, 从而计算幼虫运动速率, 在Toup View 3.7图像分析软件下用三点法作圆测量轨迹半径, 每一时期测量20个幼虫的运动速率与轨迹半径。
观察不同时期幼虫静置状态下的沉降, 把含幼虫密度为2个/mL的溶液500 mL倒入容积为550 mL(长30.00 cm、内径5.00 cm)的“U”形试管, 试管在黑暗条件下静置2 h, 用虹吸法从上至下吸出490 mL, 每次4个重复。上层液和底层液分别滴入2滴有效含量为5 %的NaClO2溶液使幼虫沉淀, 然后把幼虫集中至1 mL浮游生物计数框, 在显微镜下计数并测量幼虫(n=30)壳长大小, 上层幼虫个数n1、底层幼虫个数n2, 幼虫静置状态下的沉降率W计算方法如下:
| $ W{\rm{ = }}\frac{{{n_2} - \frac{{{n_1}}}{{490}} \times 10}}{{{n_1} + {n_2}}} \times 100\% $ |
用Photoshop CS5对图像进行处理; 用CAD 2016绘制幼虫运动状态示意图; 实验数据以“平均值±标准差”(x± SD)表示, 数据采用SPSS 21统计软件进行方差分析(One-Way ANOVA), LSD法多重比较各组间数值的差异显著性(P < 0.05);用Origin 9.1进行相关分析及作图。
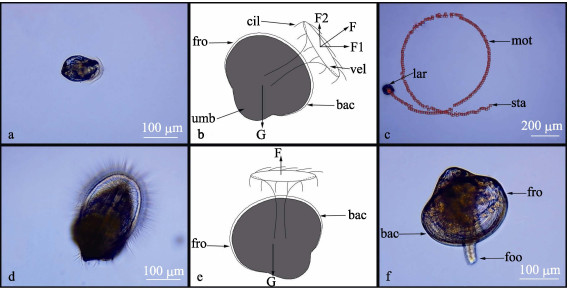
2 结果与分析 2.1 幼虫形态变化及运动状态不同日龄珠母贝幼虫形态变化如图 1所示, 壳长大小如表 1所示, 幼虫在1~8 dph为D-形幼虫期, 幼虫壳扁平、透明且呈“D”形; 9 dph进入壳顶幼虫期, 幼虫壳顶逐渐突起、壳宽增长明显; 29 dph进入变态期, 部分幼虫附着变态与成贝相似。幼虫附着变态前于水中呈浮游状态, 显微镜下观察到幼虫正常运动状态俯视图如图 2a, 侧面观示意图如图 2b。幼虫正常运动时双壳张开, 开壳朝上壳顶朝下, 面盘伸出壳外呈椭圆形且靠近壳的后端, 位于面盘外周的纤毛不断摆动从而使面盘产生牵引力F。牵引力F分解为水平方向力F1和垂直方向力F2, F1用于牵引幼虫于水平方向运动, F2用于克服自身重力使幼虫悬浮或在垂直方向上的运动。俯视观幼虫在水平方向运动轨迹如图 2c, 幼虫绕一定半径的圆顺时针方向圆周运动。垂直方向, 当F2大于幼虫自身重力G与浮力的合力时, 幼虫在水平方向运动的同时还在向上运动, 此时幼虫顺时针螺旋上升; 同理当F2小于自身重力G与浮力的合力时幼虫顺时针螺旋下降。部分幼虫运动上升至水体表面时, 俯视观如图 2d, 侧面观示意图如图 2e, 此时幼虫面盘正面朝上, 面盘产生的牵引力F只用于克服幼虫自身重力, 幼虫在纤毛摆动时绕自身顺时针旋转, 当幼虫双壳关闭时幼虫瞬间垂直下沉。幼虫培育的第27 dph[壳长(273.69±17.91) μm, n=10]如图 2f, 此时部分幼虫面盘逐渐退化并出现原始斧足, 幼虫不能悬浮于水中而是匍匐于水底, 幼虫运动靠斧足伸缩来完成, 正常运动时开壳朝下壳顶朝上, 斧足伸出壳外吸附底部, 靠斧足伸缩带动身体爬行。

|
图 1 不同日龄珠母贝幼虫 a. 1日龄; b. 5日龄; c. 9日龄; d. 13日龄; e. 17日龄; f. 21日龄; g. 25日龄; h. 29日龄. Fig.1 larvae of Pinctada margaritifera at different days post hatching a. 1 dph; b. 5 dph; c. 9 dph; d. 13 dph; e. 17 dph; f. 21 dph; g. 25 dph; h. 29 dph. |
|
|
表 1 不同日龄珠母贝幼虫壳长 Tab.1 The shell length of Pinctada margaritifera larvae at different days post hatching |
|
图 2 珠母贝幼虫运动状态 a.幼虫水中运动状态俯视图; b.幼虫水中运动侧面观示意图; c.幼虫运动轨迹; d.幼虫水面运动状态俯视图; e.幼虫水面运动侧面观示意图; f.幼虫出现斧足. fro:前端; bac:后端; cil:纤毛; vel:面盘; umb:壳顶; lar:幼虫; sta:开始; mot:运动轨迹; foo:斧足. Fig.2 The motion of Pinctada margaritifera larvae a. The top view of motion of larvae in the water; b. The side view of motion of larvae in the water; c. The motion trajectory of larvae in the water; d. The top view of motion of larvae on the surface of the water; e. The side view of motion of larvae on the surface of the water; f. Larvae foot emerged. fro: front; bac: back; cil: cilia; vel: velum; umb: umbo; lar: larvae; sta: start; mot: motion trajectory; foo: foot. |
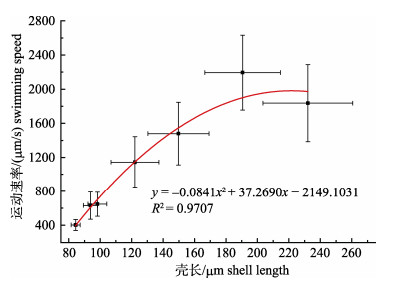
幼虫水平运动速率变化范围为246.88~3641.94 μm/s, 如图 3所示, 根据实验所得数据, 幼虫运动速率v(μm/s)与壳长l(μm)之间存在的关系如下: v = -0.0841 l2 + 37.2690 l -2149.1031, l (74.64, 287.48) μm, R2=0.9707。由此可见, 幼虫在一定壳长范围内, 随着幼虫的生长, 运动速率增加; 当超过一定壳长后, 运动速率随着幼虫的生长而降低。测量不同时期140个幼虫的运动轨迹, 环绕半径范围为381.21~3000.41 μm, 幼虫运动速率与环绕半径相关性显著(P < 0.05, 表 2)。
|
图 3 珠母贝幼虫运动速率与壳长关系 Fig.3 Relationship between the swimming speed and the shell length of Pinctada margaritifera larvae |
|
|
表 2 不同日龄珠母贝幼虫运动速率与环绕半径相关分析 Tab.2 Analysis of correlation between the swimming speed and the surround radius of Pinctada margaritifera larvae at different days post hatching |
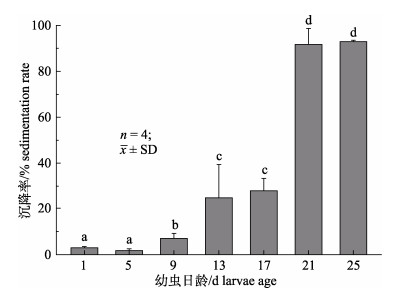
静置状态下观察到幼虫并非均匀分布于水体, 早期幼虫容易集群浮于水体表面, 幼虫双壳间歇性关闭使幼虫下沉, 当面盘伸出壳外纤毛摆动时幼虫又重新上升悬浮; 后期幼虫沉到水体底部时则难以上升, 从而贴近水底顺时针方向运动。不同日龄幼虫在“U”形管中静置2 h, 其沉降率如图 4, 可见随着幼虫的生长, 沉降率逐渐增加。对底部幼虫与悬浮幼虫的壳长进行比较, 结果见表 3, 在1 dph、5 dph和9 dph时, 浮游幼虫与沉降幼虫的壳长差异不显著(P > 0.05); 13 dph、17 dph、21 dph和25 dph时, 底部幼虫的壳长显著(P < 0.05)大于悬浮幼虫。
|
图 4 不同日龄珠母贝幼虫沉降率
不同字母表示不同日龄间差异显著(P < 0.05).
Fig.4 The sedimentation rates of different days post Pinctada margaritifera larvae hatching
Different letters denote significant difference between different larvae ages(P < 0.05). |
|
|
表 3 不同日龄珠母贝悬浮幼虫与底部幼虫壳长大小 Tab.3 The shell length of suspension and bottom Pinctada margaritifera larvae at different days post hatching |
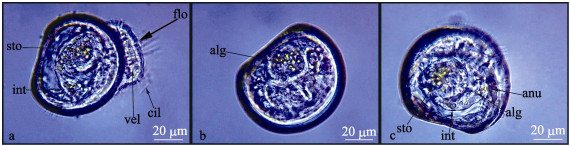
物镜40倍镜下观察幼虫对单胞藻的摄食过程如图 5a, 幼虫通过位于面盘外周纤毛不断摆动使自身运动并形成水流, 单胞藻随水流方向运动, 一部分被口沟纤毛捕获而进入口沟, 再通过口沟内纤毛的摆动把单胞藻带入胃。胃内微绒毛的摆动使单胞藻在胃内快速转动并伴随着细胞的裂解和消化, 消化裂解的单胞藻在微绒毛的摆动和胃自身收缩条件下排入到肠, 再从肛门排出体外, 从而完成对单胞藻的摄食、消化和排泄过程。图 5b和5c分别是幼虫在103个/mL和105个/mL的小球藻中摄食1 h的图像, 在103个/mL的小球藻中摄食后, 单胞藻只出现在幼虫胃; 在105个/mL的小球藻中摄食, 单胞藻不仅出现在幼虫的胃也出现在肠。在高浓度单胞藻中, 幼虫对单胞藻摄食过多, 胃内微绒毛的摆动和胃自身收缩把胃内未完全消化的单胞藻从胃中挤压到肠, 并快速从肛门排出体外, 从而对单胞藻未能完全消化利用。
|
图 5 珠母贝幼虫摄食过程 a.幼虫摄食状态; b.幼虫在103个/mL单胞藻中摄食1 h; c.幼虫在105个/mL单胞藻中摄食1 h. flo:水流方向; cil:纤毛; vel:面盘; sto:胃; int:肠; alg:单胞藻; anu:肛门. Fig.5 The process of ingesting of Pinctada margaritifera larvae a. The ingestion behavior of larvae; b. The larvae ingested microalgae at 103/mL for 1 h; c. The larvae ingested microalgae at 105/mL for 1 h. flo: flow indicator; cil: cilia; vel: velum; sto: stomach; int: intestines; alg: algal cell; anu: anus. |
幼虫自身形态结构特征决定其运动状态, 珠母贝幼虫与其他双壳贝类幼虫一样, 运动动力源于面盘外周纤毛摆动, 由面盘牵引幼虫运动[12-14]。幼虫壳顶较重, 致使幼虫运动时开壳朝上壳顶朝下, 面盘伸出壳外位于幼虫壳后端且斜向上, 因此面盘所产生的牵引力一部分用于克服自身重力使幼虫悬浮, 一部分牵引幼虫于水平方向运动。幼虫于水中水平方向绕一定半径的圆顺时针方向作圆周运动, 或浮于水体表面时绕自身顺时针方向转动。根据Blake等[12]对牡蛎(Crassostrea an gulata)幼虫纤毛摆动规律的观察发现, 面盘外周纤毛摆动与钟形虫(Vorticella)类似, 纤毛周期性按统一方向摆动, 因此在带动面盘运动的同时也产生一定方向旋转力, 从而能使幼虫沿顺时针方向转动。幼虫运动速率随着幼虫的生长, 首先逐渐上升, 然后逐渐下降, 这与Qiu等[14]观察的牡蛎幼虫运动速率变化规律相同。幼虫在生长发育过程中, 面盘以及外周纤毛不断发育完善, 促使面盘牵引力增大, 从而增加了幼虫运动速率; 幼虫生长发育至一定阶段后, 形态结构发生改变, 面盘以及纤毛逐渐退化, 运动器官变为斧足, 幼虫由浮游状态转变为匍匐于底部的爬行状态, 因此在面盘完全退化消失前幼虫运动速率逐渐降低。随着幼虫生长, 幼虫静置状态下的沉降率增加, 且13 dph后沉降幼虫壳长显著(P < 0.05)大于悬浮幼虫。在对不同阶段珠母贝[15]幼虫以及其他两种珍珠贝[16-17]幼虫的壳进行扫描电镜观察发现, D-形幼虫的壳由薄的棱柱层组成, 随着幼虫生长, 至壳顶期无定形碳酸钙成分增加, 由此增加了幼虫体重。幼虫双壳间歇性关闭使幼虫骤然垂直下降, 前期幼虫虽面盘以及纤毛发育不完善, 但体重较轻, 幼虫重新张开双壳运动后, 螺旋上升又能悬浮于水中甚至浮于水体表面。幼虫在生长发育过程中虽面盘与纤毛有所完善, 但体重的增加使幼虫下降后难以上升, 从而于水体底部进行圆周运动, 直至幼虫面盘完全退化斧足形成时, 幼虫沉降至底部利用斧足爬行。
幼虫浮游阶段, 纤毛摆动使幼虫维持运动并完成摄食, 幼虫在运动的同时也在进行着摄食。Le等[13]认为幼虫通过面盘外周纤毛不断摆动从而形成水流, 单胞藻随水流方向运动到幼虫口沟处, 在口沟纤毛摆动下部分被捕获, 被捕获的单胞藻再通过食道纤毛运输至胃。胃内微绒毛的摆动使食物颗粒运动并伴随着裂解和消化, 肠和肛门纤毛的摆动使消化后的食物颗粒排出。实验中珠母贝幼虫在105个/mL的单胞藻液中摄食1 h, 未完全消化的单胞藻在微绒毛摆动和胃自身收缩条件下被挤压到肠, 从而对单胞藻未能充分消化利用。邓正华等[18]研究发现合浦珠母贝因单胞藻投喂过多导致单胞藻消化程度降低, 冉福等[19]发现在单胞藻投喂过多时会导致文蛤(Meretrix mer etr ix)对单胞藻表观消化和同化率降低, 邓正华等[20]研究的黄边糙鸟蛤(Trachycardium flavum)幼虫在摄食过多时会导致单胞藻不能完全消化, Fern ández-Pardo等[21]研究的蛤仔(Venerupis corrugata)幼虫在单胞藻投喂过多时会导致幼虫生长速率和成活率降低,这些研究结果均与该研究结果类似。一般认为, 当水体饵料一次性投喂过多, 滤食性贝类则主要依靠以下两种途径来调节: (1)降低贝类自身滤水率[22-24], (2)加快排泄。排泄的加快使饵料在胃和肠中停留时间缩短, 从而导致饵料同化率和吸收率降低, 这也是蛤仔幼虫培育[21]时当饵料超过一定浓度, 随着饵料浓度的增加, 致使幼虫成活率和生长速率下降的主要原因。
综上所述, 随着幼虫的生长, 幼虫更容易下沉, 因此在幼虫培育后期应防止幼虫沉底; 幼虫在面盘退化斧足形成时应及时投放附着装置; 饵料一次性投喂过多导致饵料不完全消化甚至不消化, 因此应根据幼虫对饵料的摄食与消化情况进行合理投喂。
| [1] |
Cunha R L, Blanc F, Bonhomme F, et al. Evolutionary patterns in pearl oysters of the genus Pinctada (Bivalvia:Pteriidae)[J]. Marine Biotechnology, 2011, 13(2): 181-192. DOI:10.1007/s10126-010-9278-y |
| [2] |
Ky C L, Blay C, Sham-Koua M, et al. Indirect improvement of pearl grade and shape in farmed Pinctada margaritifera by donor "oyster" selection for green pearls[J]. Aquaculture, 2014, 432: 154-162. DOI:10.1016/j.aquaculture.2014.05.002 |
| [3] |
Ky C L, Lo C, Planes S. Mono-and polychromatic inner shell phenotype diversity in Pinctada margaritifera donor pearl oysters and its relation with cultured pearl colour[J]. Aquaculture, 2017, 468: 199-205. DOI:10.1016/j.aquaculture.2016.10.017 |
| [4] |
Gervis M H, Sims N A. The biology and culture of pearl oysters (Bivalvia:Pteriidae)[J]. Iclam Studies & Reviews, 1992, 21: 1-49. |
| [5] |
Thomas Y, Garen P, Pouvreau S. Application of a bioenergetic growth model to larvae of the pearl oyster Pinctada margaritifera L[J]. Journal of Sea Research, 2011, 66(4): 331-339. DOI:10.1016/j.seares.2011.04.005 |
| [6] |
Latchere O, Fievet J, Lo C, et al. Effect of electrolysis treatment on the biomineralization capacities of pearl oyster Pinctada margaritifera juveniles[J]. Estuarine, Coastal and Shelf Science, 2016, 182: 235-242. DOI:10.1016/j.ecss.2016.06.014 |
| [7] |
Ky C L, Molinari N, Moe E, et al. Impact of season and grafter skill on nucleus retention and pearl oyster mortality rate in Pinctada margaritifera aquaculture[J]. Aquaculture International, 2014, 22(5): 1689-1701. DOI:10.1007/s10499-014-9774-6 |
| [8] |
Ehteshami F, Christianus A, Rameshi H. Effects of location and time of Pinctada margaritifera spat transfer from hatchery, on its growth and mortality in the sea[J]. Aquaculture, 2010, 306(1-4): 85-91. DOI:10.1016/j.aquaculture.2010.06.018 |
| [9] |
Alagarswami K, Dharmaraj S, Chellam A, et al. Larval and juvenile rearing of black-lip pearl oyster, Pinctada margaritifera (Linnaeus)[J]. Aquaculture, 1989, 76(1-2): 43-56. DOI:10.1016/0044-8486(89)90250-0 |
| [10] |
Southgate P C, Ito M. Evaluation of a partial flow-through culture technique for pearl oyster (Pinctada margaritifera L[J]. Aquacultural Engineering, 1998, 18(1): 1-7. DOI:10.1016/S0144-8609(97)00020-4 |
| [11] |
Guillard R R L. Culture of Phytoplankton for feeding marine invertebrates[M]. 1975: 29-60.
|
| [12] |
Blake J R, Otto S R. Ciliary propulsion, chaotic filtration and a 'blinking' stokeslet[J]. Journal of Engineering Mathematics, 1996, 30(1-2): 151-168. DOI:10.1007/BF00118828 |
| [13] |
Le D V, Alfaro A C, Ragg N L C, et al. Functional morphology and performance of New Zealand geoduck clam (Panopea zelandica) larvae reared in a flow-through system[J]. Aquaculture, 2017, 468: 32-44. DOI:10.1016/j.aquaculture.2016.09.047 |
| [14] |
Qiu T, Liu Y, Zheng J, et al. A feeding model of oyster larvae (Crassostrea angulata)[J]. Physiology & Behavior, 2015, 147: 169-174. |
| [15] |
Doroudi M S, Southgate P C. Embryonic and larval development of Pinctada margaritifera (Linnaeus, 1758)[J]. Molluscan Research, 2003, 23(2): 101-107. DOI:10.1071/MR02015 |
| [16] |
Miyazaki Y, Nishida T, Aoki H, et al. Expression of genes responsible for biomineralization of Pinctada fucata during development[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2010, 155(3): 241-248. DOI:10.1016/j.cbpb.2009.11.009 |
| [17] |
Wassnig M, Southgate P C. Embryonic and larval development of Pteria penguin (Rӧding, 1798) (Bivalvia:Pteriidae)[J]. Journal of Molluscan Studies, 2012, 78(1): 134-141. DOI:10.1093/mollus/eyr051 |
| [18] |
Deng Z H, Jiang S, Zhang B, et al. Ingestion and digestion of pearl oyster (Pinctada fucata) on microalgae of different types and concentrations[J]. South China Fisheries Science, 2016, 12(3): 112-118. [邓正华, 姜松, 张博, 等. 合浦珠母贝对不同种类及浓度的单胞藻摄食与消化效果研究[J]. 南方水产科学, 2016, 12(3): 112-118. DOI:10.3969/j.issn.2095-0780.2016.03.015] |
| [19] |
Ran F, Shen H D, Lv B, et al. Apparent digestion and absorption efficiency of four kinds of microalgae by hard clam Meretrix meretrix (Rumphius)[J]. Journal of Shanghai Fisheries University, 2007, 16(6): 602-607. [冉福, 沈和定, 吕凛, 等. 文蛤对四种单胞藻的表观消化状况及同化率[J]. 上海水产大学学报, 2007, 16(6): 602-607.] |
| [20] |
Deng Z H, Ye L, Wu K C, et al. Ingestion and digestion of nine species of microalgae by Trachycardium flavum larvae[J]. South China Fisheries Science, 2016, 12(6): 91-98. [邓正华, 叶乐, 吴开畅, 等. 黄边糙鸟蛤幼虫对9种单胞藻的摄食与消化研究[J]. 南方水产科学, 2016, 12(6): 91-98. DOI:10.3969/j.issn.2095-0780.2016.06.012] |
| [21] |
Fernández-Pardo A, da Costa F, Rial D, et al. Use of response surface methodology to determine optimum diets for venerupis corrugata larvae:effects of ration and microalgal assemblages[J]. Aquaculture, 2016, 452: 283-290. DOI:10.1016/j.aquaculture.2015.11.005 |
| [22] |
Liu G F, Shen H D, Chen H, et al. Effects of different microalgae on ingestion and growth of juvenile razor clam Smonovacula constricta[J]. Journal of Shanghai Fisheries University, 2009, 18(6): 708-714. [刘广丰, 沈和定, 陈慧, 等. 不同微藻对缢蛏稚贝摄食和生长的影响[J]. 上海海洋大学学报, 2009, 18(6): 708-714.] |
| [23] |
Luo C L, Gao R C, Luo X. Effects of the quantity of microalgae on the ingestion rate of juveniles of Coelomactra antiquata[J]. Journal of Fujian Normal University:Natural Science Edition, 2005, 21(4): 89-91. [罗彩林, 高如承, 骆轩. 单胞藻投饵量对西施舌稚贝摄食率的影响[J]. 福建师范大学学报(自然科学版), 2005, 21(4): 89-91. DOI:10.3969/j.issn.1000-5277.2005.04.022] |
| [24] |
Song Q, Fang J G, Liu H, et al. Studies on the effects suspended sediment on the feeding physiology of three suspension-feeding bivalves[J]. Marine Fisheries Research, 2006, 27(4): 21-27. [宋强, 方建光, 刘慧, 等. 沉积再悬浮颗粒物对3种滤食性贝类摄食生理的影响[J]. 海洋水产研究, 2006, 27(4): 21-27.] |
 2018, Vol. 25
2018, Vol. 25

