浮游植物是水体中最主要的初级生产者, 它通过光合作用释放出氧气, 启动了水生态系统中物质循环和能量流动过程。在养殖池塘水体中, 浮游植物还具有促进有机质降解、祛除过剩营养元素、吸收有毒有害化合物和保持水体理化性质稳定等多重作用[1]。浮游植物群落结构组成和演替过程与水体环境密切相关, 可以迅速地对变化的水体环境作出响应, 被视为重要的水生态环境指示性生物[2-3]。早期的浮游植物生态学研究中, 主要是依据林奈物种同源性特点, 通过对浮游植物进行物种分类鉴定与计数, 分析其群落组成、密度动态、优势物种、多样性指数等表征其种群结构的重要指标, 借以直接或间接评价水环境质量状况[4]。然而, 经典的浮游植物分类方法, 虽然能够在一定程度上反映水体环境, 但是不能更精确地描述浮游植物集群机理和反映所在水体的生态功能。Reynolds等[5]借鉴陆地植物生态学的研究方法, 于2002年提出了浮游植物功能群的概念, 后经逐步拓展和完善, 在2009年形成了较为完整的浮游植物功能群理论[6]。浮游植物功能群不具有物种系统发生上的意义, 它以浮游植物生理生长特性及其对环境的适应机制为基础, 依据浮游植物形态、生理和生态特征相似性等进行归类分组, 形成多个具有相近的生态适应性的浮游植物功能类群。与传统浮游植物生态学研究方法相比较, 浮游植物功能群法更注重浮游植物生理生态特征与特定生境方面分析, 对研究者藻类鉴定技术水平要求不太严格, 简化了分类过程。该方法对于揭示生境变化对浮游植物群落演替的影响机制, 以及解释浮游植物对水体环境变异的响应过程具有重要意义。鉴于它的便捷与实用性, 浮游植物功能群法自提出后便迅速在河流、湖泊、水库生态学研究领域得到广泛应用[7-10]。经过多年发展, 目前, 浮游植物功能群法已成为国际上研究江河湖库等自然水体环境状况和生态功能的主要技术手段[11-13]。
珠江三角洲地区气候适宜, 河网交错, 池塘棋布, 是我国淡水池塘养殖最为发达的地区之一[14]。改革开放以后, 池塘养殖技术得到快速发展, 高密度、高饵料投喂量的集约化养殖模式取代了传统的粗放型养殖模式。随着养殖密度的提高和大量人工饲料的投入, 池塘环境出现了巨大变化, 呈现出养殖水质恶化、有害藻类水华增多和渔产量下降的状况[15-16]。目前对于该地区养殖池塘水体浮游植物群落结构动态的研究并不多, 而从浮游植物功能群角度开展池塘水体生态功能方面的研究在该区域、乃至全国均较为鲜见, 这对于准确评价各类群浮游植物在养殖水体中的生态功能具有一定的局限性。鉴于此, 本研究选取珠江三角洲地区的主养淡水品种草鱼(Ctenopharyngodon idellus)、大口黑鲈(Micropterus salmoides)、云斑尖塘鳢(Oxyeleotris marmoratus)和乌鳢(Channa argus)池塘, 对其水体环境因子和浮游植物群落进行一个养殖周期内的持续性跟踪监测, 了解池塘水体的浮游植物群落组成、浮游植物功能群变化格局及其主要影响因素, 旨在为该地区集约化养殖池塘浮游植物调控技术、水体环境的监测管理和修复技术, 以及养殖饵料的科学投放和鱼类疫病的防控技术研究奠定基础, 为该区域健康生态养殖模式的构建提供基础数据, 并初步探讨浮游植物功能群法在养殖池塘这类较小型人工水体生态环境评价与分析方面的适用性。
1 材料与方法 1.1 采样地点与池塘情况选取广东省佛山市顺德区4个主养淡水鱼类池塘开展研究(具体位置见表 1), 养殖品种分别为草鱼、大口黑鲈、云斑尖塘鳢和乌鳢。池塘均于当年4月清塘注水后放苗。每个池塘的水面面积在2500~6670 m2, 水深为1~2 m, 均属于精养池塘, 其中, 乌鳢池塘放养密度要高于其他品种, 其次是草鱼池塘。草鱼和乌鳢池塘中都套养有较大量的其他滤食性鱼类, 这两类池塘周围为居民区或厂区, 池塘基本封闭, 与外界水体自然交换少; 大口黑鲈和云斑尖塘鳢池塘靠近珠江三角洲河网水道, 附近多沟渠且无工业厂区, 仅分布有零散住户。池塘都装有曝气设备, 养殖过程中, 晴好天气从傍晚到次日清晨持续开机, 阴雨天则视天气情况延长开机时间。该研究分别于5月(养殖前期)、9月(养殖中期)和12月(养殖末期)对池塘进行水体环境和浮游植物群落结构特征方面的调查测定。
|
|
表 1 采样池塘的地理位置 Tab.1 Latitude and longitude of the sampling ponds |
使用萨氏盘现场测定水体透明度(transparency, SD, cm); 使用YSI便携式多参数水质分析仪(美国, YSI)测定pH、溶解氧(dissolved oxygen, DO, mg/L)、氧化还原电位(oxidation-reduction potential, ORP, mv)、电导率(conductivity, Cond, μS/m)和总可溶性固体(total dissolvable solid, TDS, mg/L)等理化因子; 取一定量水样, 经WHATMAN GF/C滤膜过滤后分光光度法测定水体Chl a含量(µg/L); 另取一定量水样按要求处理后经Skalar流动注射水质分析仪(荷兰, Skalar)测定NH4+-N、NO3--N、NO2--N、TN、TP等营养盐指标(单位: mg/L, 下同); 非离子氨(NH3)根据已测指标和公式计算得出; CODMn采用高锰酸盐滴定法测定[17], 以此显示水体中有机质含量。本研究中选取TP、TN、SD、Chl a浓度和CODMn等5项指标, 根据相应的公式计算水体综合营养状态指数TLI(∑) [18].
1.3 浮游植物样品采集与处理使用采水器采集池塘0.5 m深度处水样5 L, 从中取出600 mL, 加鲁哥氏液固定, 带回实验室静置沉淀48 h后并逐步浓缩至30 mL。在OLYMPUS CX21光学显微镜下, 参考《中国淡水藻类—系统、分类及生态》[19]和相关藻类图谱对浮游植物进行鉴定与定量计数。生物量按照藻类的近似形状及相应体积公式计算[20]。
1.4 浮游植物群落分析浮游植物Shannon-Weaver多样性指数(H)、Margalef多样性指数(M)和均匀度指数Evenness(E) [4]分析, 根据Reynolds等[5]和Padisák等[6]确定的浮游植物功能类群分类方法对浮游植物进行功能类群划分。将在同一时期两个以上池塘中出现过, 且至少在一个采样点的相对生物量比例≥5%的功能群视为优势功能群; 另外, 部分藻类个体微小(如微囊藻和平裂藻), 生物量会较低, 但由于其漂浮于水体表层, 当数量较多时, 会形成恶劣的水体表观, 鉴于此, 该研究将细胞密度占比达到10%以上的藻类所在的功能群也计入优势功能群。
1.5 数据处理与分析采用R统计软件进行数据分析, 包括对环境因子、浮游植物功能群进行相关性分析、主成分分析(principal components analysis, PCA)、冗余分析(redundancy analysis, RDA)和非度量多维尺度(nonmetric multidimensional scaling, NMDS)排序分析。分析前先将浮游植物功能群生物量、环境因子进行lg(x+1)转换。
2 结果与分析 2.1 池塘理化环境状况采样池塘水体各理化环境指标均值及变化范围见表 2。池塘水体透明度为10~35 cm, 云斑尖塘鳢和大口黑鲈池塘透明度大致相同, 草鱼与乌鳢池塘透明度相近。池塘间水温差异不明显, 变化范围为14.79~33.02℃, 云斑尖塘鳢池塘变化范围较小, 处于23.95~31.35℃之间。池塘溶解氧变化范围为3.35~8.77 mg/L, 各养殖品种池塘溶氧由高到低依次为大口黑鲈、草鱼、云斑尖塘鳢、乌鳢。池塘水体pH处于7.08~9.87之间, 大口黑鲈池塘pH明显较乌鳢池塘高, 而乌鳢池塘、云斑尖塘鳢池塘和草鱼池塘间pH值差异不大。池塘水体的营养盐(TN、TP、NO3--N、NH4+-N、NO2--N和NH3等)指标高于渔业水质标准值或文献中的推荐值[21-23], 突出表现为水体TN、NO3--N和NH4+-N等指标含量过高, 且超标状况严重。测定结果表明池塘水体受有机质污染较为严重, 表现为水体大部分时期CODMn出现超标, 且数值远远高于6 mg/L, 其中草鱼和乌鳢池塘要高于其他品种, 乌鳢池塘最大值达到48.50 mg/L。池塘水体Chl a含量变化范围为43.94~332.31 µg/L, Chl a含量高于40 µg/L, 且表观呈浓绿水色及表层水体具漂浮藻类, 水体呈现富营养化和受污染状态, 而草鱼和乌鳢池塘最为严重。在整个养殖过程中, 池塘N : P总体上呈逐渐升高的变化趋势。采样池塘均属于超富营养化水体(TLI(∑) > 70), 综合营养状态指数(均值)从高到底依序为乌鳢、草鱼、大口黑鲈、云斑尖塘鳢, 营养状态指数较高的样点分别为草鱼塘5月、9月和12月, 乌鳢塘5月、9月、12月和大口黑鲈塘9月。其他指标中, 各池塘间的氧化还原电位差异较小; 草鱼、云斑尖塘鳢和大口黑鲈池塘水体的电导率、总可溶性固体和盐度差异不大, 但低于乌鳢池塘。
|
|
表 2 各采样池塘水体理化因子均值及范围 Tab.2 Mean and range of physical-chemical parameters in the sampling ponds |
采样池塘浮游植物细胞密度和生物量结果分别见图 1和图 2。4个养殖品种池塘细胞密度均值为1.32×108 cell/L, 生物量均值为168.17 mg/L。细胞密度和生物量最大值均为乌鳢池塘(5月), 分别达到3.00×108 cell/L和345.41 mg/L。从图 1、图 2整体反映出的精养池塘中浮游植物细胞密度和生物量来看, 两者的关联性不太明显, 主要是由于优势藻类物种的不同。最为突出的是草鱼池塘和云斑尖塘鳢池塘, 12月, 草鱼池塘中由于体积较小的平裂藻和纤维藻密度很高, 导致总的浮游植物细胞密度升高, 但藻类生物量在3个时期最低; 5月, 云斑尖塘鳢池塘出现蓝藻水华, 优势种主要为小型个体的微囊藻、平裂藻和伪鱼腥藻, 导致前期的细胞密度远高于中期和后期, 但是生物量差别不大; 乌鳢池塘养殖前期即出现轻微蓝藻水华(主要优势种为微囊藻、平裂藻等), 同时绿藻门藻类细胞密度较高, 到养殖中期, 蓝藻水华程度加重, 其他藻类生长受到抑制, 导致细胞密度与前期差别不大, 但由于优势蓝藻的个体小, 到养殖中期藻类生物量出现大幅下降; 在大口黑鲈池塘, 藻类细胞密度和生物量呈现一定的正相关关系。
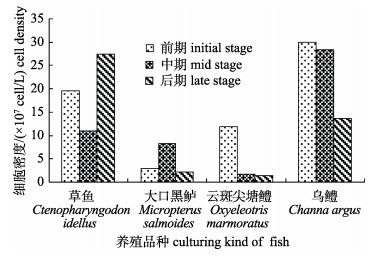
|
图 1 采样池塘浮游植物细胞密度 Fig.1 Phytoplankton cell density of the sampling ponds with different kinds of fish |
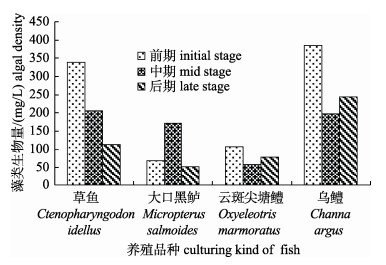
|
图 2 不同养殖品种池塘浮游植物生物量 Fig.2 Phytoplankton biomass of the sampling ponds with different kinds of fis |
对采集的池塘样品中的浮游植物鉴定结果显示, 整个采样期共鉴定到196种藻类(含变种变型), 分属于绿藻(91种)、裸藻(40种)、硅藻(27种)、蓝藻(23种)、甲藻(7种)、隐藻(4种)、黄藻(3种)、金藻(1种)等8大淡水门藻类。各采样池塘浮游藻类组成比例见图 3。草鱼池塘共鉴定到133种藻类(含变种变型), 其中, 绿藻65种(含变种变型), 占比48.87%;硅藻19种(含变种变型), 占比14.29%;蓝藻19种(属), 占比14.29%;裸藻18种(含变种), 占比13.53%;其余甲藻、隐藻、黄藻、金藻共占9.02%。大口黑鲈池塘共鉴定到109种藻类, 其中, 绿藻53种(含变种)占比48.62%;裸藻22种(含变种), 占比20.18%;硅藻14种(含变种变型), 占比12.84%;蓝藻10种(属), 占比9.17%;其余甲藻、隐藻、黄藻、金藻共占9.17%。云斑尖塘鳢池塘共鉴定到82种藻类, 其中, 绿藻34种(含变种), 占比41.46%;裸藻23种(含变种), 占比28.05%;硅藻15种(含变种变型), 占比18.29%;隐藻4种, 占比4.88%;其余蓝藻、甲藻、隐藻、黄藻、金藻共占12.20%。乌鳢池塘共鉴定到104种藻类, 其中, 蓝藻10种(属), 占比9.62%;绿藻57种(含变种), 占比54.81%;硅藻16种(含变种), 占比15.38%;裸藻13种, 占比12.50%;其余甲藻、隐藻、黄藻、金藻共占7.69%。浮游植物多样性指数分析结果显示, 采样池塘具有较高的浮游植物多样性指数, 具体见表 3。4个池塘中Shannon- Weaver多样性指数(H)变化范围为2.34~4.89, 均值3.93; Margalef多样性指数(M)变化范围为2.76~4.90, 均值3.55;均匀度指数Evenness(E)变化范围为0.40~0.84, 均值0.68.
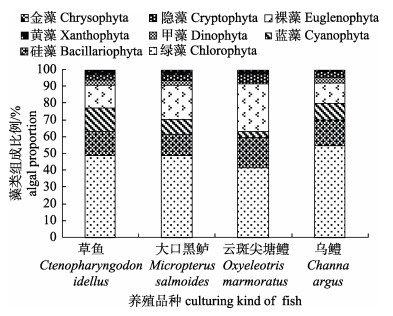
|
图 3 各养采样池塘藻类组成比例 Fig.3 Algal proportion of the sampling ponds with different kinds of fish |
|
|
表 3 采样池塘养殖前期、中期、后期浮游植物Shannon-Weaver多样性指数(H)、Margalef多样性指数(M)和Evenness多样性指数(E) Tab.3 Shannon-Weaver index(H), Margalef index(M) and Evenness index(E) of the sampling ponds during the initial, mid and late culturing periods |
根据文献[5-6]的功能群划分方法, 划分出A、B、C、D、F、G、G2、H1、J、K、L1、LM、L0、M、MP、N、P、S1、S2、T、TD、W1、W2、WS、X1、X2、XPh、Y共计28个功能群。对采样池塘浮游植物功能群频率分析发现(图 4), 养殖池塘中, 功能群C、F、J、K、M、MP、W1、X2的出现频率为100%, 适宜于各养殖期和养殖品种池塘环境, 为高频广布功能群; 功能群G、P、Y、D、L0、N、T、W2、XPh、B、G2、H1、WS出现频率在50%~100%之间, 这部分功能群偶尔会受到水环境条件的限制, 但是多数情况下会出现, 可视为常见功能群; 而功能群S1、S2、A出现频率在25%~50%之间, 这部分功能群受水环境条件的限制, 出现频率略低, 可定为次常见功能群; 功能群L1、TD出现频率在10%以下, 为罕见或偶见类群。对上述28个浮游植物功能群生物量计算后, 得到C、F、J、MP、N、P、W1、X2、Y、K、L0、M、W2为主要优势功能群, 表 4列出了主要优势功能群及其所适应的生境特征。
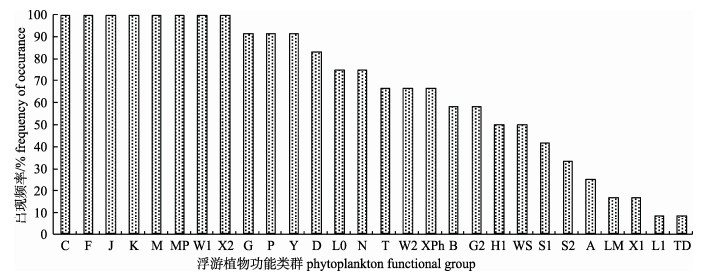
|
图 4 采样池塘浮游植物功能群频率分布 Fig.4 Frequency distribution of phytoplankton functional groups in the sampling ponds |
|
|
表 4 采样池塘浮游植物优势功能群及其生境特征 Tab.4 The dominant phytoplankton functional groups and their main representative habitats in the sampling ponds |
在草鱼池塘, 共鉴定到A、B、C、D、F、G、G2、H1、J、K、L1、LM、L0、M、MP、N、P、S1、S2、T、W1、W2、WS、X1、X2、XPh、Y共计27个功能群, 其中F、J、L0、M、N、P、W1、Y为主要优势功能群。养殖前期, 草鱼池塘浮游植物生物量为340.40 mg/L, 主要优势功能群有N(197.93 mg/L)、J(40.90 mg/L)、W1(38.52 mg/L)、M(微囊藻属细胞密度占比达20.65%)、L0(平裂藻属细胞密度占比达23.64%)。养殖中期, 浮游植物生物量为205.31 mg/L, 主要优势功能群有N(50.34 mg/L)、Y(33.43 mg/L)、J(32.69 mg/L)、W1(31.42 mg/L)、M(微囊藻属细胞密度占比达24.50%)。养殖后期, 浮游植物生物量为111.57 mg/L, 主要优势功能群有J(40.44 mg/L)、F(17.15 mg/L)、W1(13.47 mg/L)、P(9.18 mg/L)、L0(平裂藻属细胞密度占比达44.35%)。
在大口黑鲈池塘, 共鉴定到B、C、D、F、G、G2、H1、J、K、L0、M、MP、N、P、T、W1、W2、WS、X1、X2、XPh、Y共计22个功能群, 其中C、F、J、L0、M、P、W1、X2、Y为主要优势功能群。养殖前期, 大口黑鲈池塘浮游植物生物量为67.82 mg/L, 主要优势功能群有W1(21.22 mg/L)、J(17.85 mg/L)、F(7.89 mg/L)、P(4.29 mg/L)、M(微囊藻属细胞密度占比达12.95%)。养殖中期, 浮游植物生物量为171.98 mg/L, 主要优势功能群有W1(74.30 mg/L)、J(21.56 mg/L)、Y(20.38 mg/L)、C(9.12 mg/L)、M(微囊藻属细胞密度占比达19.29%)、F(葡萄球藻细胞密度占比达14.32%)、L0(平裂藻属细胞密度占比达11.46%)。养殖后期, 浮游植物生物量为51.21 mg/L, 主要优势功能群有W1(15.27 mg/L)、X2(9.79 mg/L)、Y(8.56 mg/L)、J(6.68 mg/L)、M(微囊藻属细胞密度占比达10.17%)。
在云斑尖塘鳢池塘, 共鉴定到A、B、C、D、F、G、G2、J、K、L0、M、MP、N、P、T、W1、W2、X1、X2、XPh、Y共计21个功能群, 其中J、P、M、W1、W2、X2、Y为主要优势功能群。养殖前期, 云斑尖塘鳢池塘浮游植物生物量为106.98 mg/L, 主要优势功能群有W1(63.89 mg/L)、J(13.09 mg/L)、Y(5.25 mg/L)、M(微囊藻属细胞密度占比达65.09%)。养殖中期, 浮游植物生物量为56.39 mg/L, 主要优势功能群有Y(22.04 mg/L)、W1(14.99 mg/L)、P(4.56 mg/L)、W2(3.33 mg/L)、X2(3.32 mg/L)、M(微囊藻属细胞密度占比达15.43%)、F(葡萄球藻细胞密度占比达14.32%)、L0(平裂藻属细胞密度占比达11.46%)。养殖后期, 浮游植物生物量为77.91 mg/L, 主要优势功能群有W1(40.94 mg/L)、Y(24.83 mg/L)、J(3.95 mg/L)、X2(3.85 mg/L)。
在乌鳢池塘, 共鉴定到A、B、C、D、F、G、H1、J、K、LM、L0、M、MP、N、P、S1、S2、T、TD、W1、W2、WS、X2、XPh、Y, 共计25个功能群, 其中F、J、K、M、MP、N、W1、Y为主要优势功能群。养殖前期, 乌鳢池塘浮游植物生物量为385.41 mg/L, 主要优势功能群有MP(209.27 mg/L)、W1(42.28 mg/L)、J(27.52 mg/L)、N(27.10 mg/L)、M(微囊藻属细胞密度占比达50.47%)。养殖中期, 浮游植物生物量为198.38 mg/L, 主要优势功能群有J(767.14 mg/L)、N(55.44 mg/L)、F(25.17 mg/L)、Y(11.67 mg/L)、M(微囊藻属细胞密度占比达47.06%)。养殖后期, 浮游植物生物量为244.69 mg/L, 主要优势功能群有N(87.94 mg/L)、J(66.25 mg/L)、Y(21.83 mg/L)、W1(13.70 mg/L)、K(微囊藻属细胞密度占比达19.37%)。
在养殖前期、养殖中期、养殖末期3个阶段, 各养殖品种池塘浮游植物主要优势功能群的变化趋势如下。草鱼: J、N、W1、Y、L0→J、N、W1、M、Y→F、J、P、W1、L0; 大口黑鲈: F、J、P、M、W1→C、J、F、M、W1、M、L0→J、M、W1、X2、Y; 云斑尖塘鳢: J、M、W1、Y→M、P、W1、W2、X2、Y→J、W1、X2、Y; 乌鳢: J、M、MP、N、W1→F、M、W1、J、N、Y→J、K、N、W1、Y.
2.4 浮游植物优势功能群的NMDS分析采样期各养殖品种池塘浮游植物功能群组成的NMDS分析表明, 营养盐水平较高、水体污染较为严重的样点分布在坐标系左上侧, 其对应的是浮游植物丰度较高的样点; 营养盐水平相对较低、水体污染程度略轻的样点分布在坐标系右下侧, 对应的也是浮游植物丰度较低的样点(图 5)。NMDS排序图显示, 草鱼、乌鳢养殖池塘3个养殖时期归为一类, 云斑尖塘鳢3个养殖时期也归为一类, 说明整个采样期这些养殖品种池塘浮游植物功能群差异不大; 而大口黑鲈3个时期的前两个时期归为一类, 养殖后期则归为另一类, 但相距不远, 说明养殖过程中浮游植物功能群组成出现了一定变化, 总体上仍较稳定。
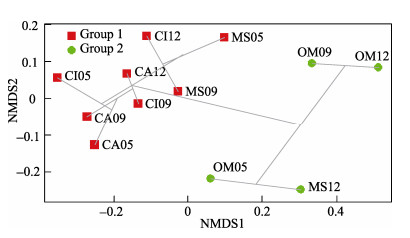
|
图 5 采样期各养殖品种池塘浮游植物功能群的非度量多维尺度(NMDS)分析 CI:草鱼池塘; MS:大口黑鲈池塘; OM:云斑尖塘鳢池塘; CA:乌鳢池塘. 05:养殖早期(5月); 09:养殖中期(9月); 12:养殖晚期(12月). Fig.5 Nonmetric multidimensional scaling(NMDS) analysis of phytoplankton functional groups CI: Ctenopharyngodon idellus; MS: Micropterus salmoides; OM: Oxyeleotris marmoratus; CA: Channa argus. 05: early stage of culture (May); 09: middle stage of culture (Septemer); 12: advanced stage of culture (December). |
通过对环境因子进行相关性分析和主成分分析, 筛选出TP、TN、NH4+-N、WT、DO、pH、N : P、SD、TDS、CODMn和Chla等11项因子, 对浮游植物优势功能群和这11项因子进行RDA分析。结果显示: SD、TP、WT、DO、pH、N : P、TDS、CODMn和Chl a这9项因子是主要影响因子(图 6), 轴1、轴2的特征根分别为1.0876和0.4178, 累计解释率为64.88%. RDA图中轴1方向的主要环境因子是TP、DO、pH、N:P、SD、CODMn和Chl a等7项因子, 相关系数分别为-0.65, 0.49, 0.56, 0.35, 0.58, -0.85, -0.71, 与M, Lo, W1, Y, N, J, F等功能群分布关系密切; 轴2方向的主要环境因子是WT和TDS,相关系数分别为-0.42, 0.48, 主要与MP, W1, Y功能群分布关系密切。
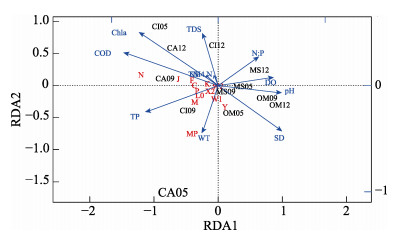
|
图 6 采样池塘浮游植物优势功能群与环境因子的冗余分析 CI:草鱼池塘; MS:大口黑鲈池塘; OM:云斑尖塘鳢池塘; CA:乌鳢池塘; 05:养殖早期(5月); 09:养殖中期(9月); 12:养殖晚期(12月). COD:高锰酸盐指数(CODMn). Fig.6 Redundancy analysis(RDA) of the dominant phytoplankton functional groups and environmental factors in the sampling ponds CI: Ctenopharyngodon idellus pond; MS: Micropterus salmoides pond; OM: Oxyeleotris marmoratus pond; CA: Channa argus pond; 05: early stage of culture (May); 09: middle stage of culture (September); 12: advanced stage of culture (December). COD: potassium permanganate index (CODMn). |
本研究对珠江三角洲地区高密度精养池塘中的浮游植物功能群动态特征进行了分析。所鉴定出的197种藻类(含变种变型)可以划分出A、B、C、D、F、G、G2、H1、J、K、L1、LM、L0、M、MP、N、P、S1、S2、T、TD、W1、W2、WS、X1、X2、XPh、Y共计28个功能群。与一些江河、湖泊以及水库相比[24-25], 池塘水体浮游植物物种数更为丰富, 但是功能群并未明显增加, 主要是由于很多同一属下面的很多物种、以及同一藻门下的很多属, 甚至不同藻门的藻类由于功能特征相似, 生活环境近似从而被归入了同一功能群。
养殖池塘中, 功能群C、F、J、K、M、MP、W1、X2的频率为100%, 适宜于各养殖期和养殖品种池塘环境, 出现频率较高, 为高频广布功能群。这些类群藻类的生境特征为流动性小、营养程度高和有机质含量高的静水水体[6], 非常符合池塘水体环境特征, 因此在采样池塘中呈普遍分布, 它们反映的是精养池塘浮游植物群落的共同状况。功能群G、P、Y、D、L0、N、T、W2、XPh、B、G2、H1、WS出现频率在50%~100%, 这部分功能群偶尔会受到水环境条件的限制, 但是多数情况下会出现, 是常见功能群。分析发现, 这些功能群特征主要是: (1)可显示水体富营养程度等级的功能群[26], 如功能群D、P、H1等, 这些类群的动态变化可能与养殖过程中水体的营养盐浓度变化有关; (2)蛋白质含量丰富, 营养价值较高的饵料型藻类, 如功能群G、XPh、W1、T、W2、Ws、Y等, 它们在不同养殖品种池塘中出现频率不同, 可能与养殖鱼类的摄食有关[25]; (3)功能群S1、S2、A、LM、X1出现频率在10%~50%, 这部分功能群受水环境条件的限制, 出现频率略低, 这些功能群所对应的藻类也都是水体中不太常见的种类; (4)剩余的L1、TD类群出现频率在10%以下, 对应的藻类生物量也很低, 被视为偶见种。
浮游植物优势功能群分析结果得到, C、F、J、K、L0、M、MP、N、P、W1、W2、X2、Y为主要优势功能群, 这些功能群在养殖池塘中生物量大, 出现频率高, 浮游植物群落在这些类群间演替, 说明精养池塘环境和浮游植物群落稳定, 整个养殖过程水体的生态功能比较单一。对采样池塘浮游植物优势功能群的NMDS排序图亦显示, 在整个养殖期间草鱼、云斑尖塘鳢和乌鳢池塘浮游植物变化不大, 而大口黑鲈池塘尽管养殖后期与前期和中期不归为一类, 但是在NMDS排序图中相距不远, 表明各采样池塘养殖过程中水环境状况较为稳定, 各养殖品种间变化也不大[27]。
3.2 不同养殖品种池塘浮游植物功能群异同分析本研究所调查的4个养殖品种池塘中, 草鱼与乌鳢池塘浮游植物功能群数相近, 分别为27种和25种, 大口黑鲈与云斑尖塘鳢池塘浮游植物功能群数相近, 分别为22种和21种, 与大部分环境指标的测定结果相符。4个养殖品种池塘优势功能群数为7~9个。其中J、W1、Y类群在4个养殖品种中, 在几乎所有时期均为主要优势功能群, 这与这3个功能群所包含的浮游植物种类数较多和生境特征相似有关: J类群主要包括栅藻属、空星藻属、十字藻属、四角藻属、集星藻属、纤维藻属、月牙藻属等小型绿藻门浮游植物, 特别适宜于浅且有机营养丰富的水体; W1类群包括裸藻属、扁裸藻属、鳞孔藻属等大多数的裸藻, 适宜于富含有机质水体; Y类群主要是隐藻, 在有机质丰富时也会形成优势[25]。这3个类群都非常适宜于所调查的富营养化程度高和有机质含量丰富的精养池塘环境。在实际生产中, 对于J、W1、Y类群藻类长期占优势的水体, 需要采取除氮磷和去有机质措施。与大口黑鲈、云斑尖塘鳢和乌鳢池塘及一些富营养化程度较高的湖泊库湾等水体不同的是, 尽管草鱼池塘中有机质、营养盐和叶绿素含量非常高, 但是该池塘并未出现明显可见的蓝藻水华, M类群(主要包括蓝藻门微囊藻属)并未长期占据优势, 这可能是由于在饲养过程中投喂了大量水草, 对蓝藻的生长产生一定抑制作用[28]; 另一方面, 由于蓝藻漂浮于水体表层, 水草投入后, 极易黏附于水草从而连带被鱼类摄食。在大口黑鲈池塘, 从前期到中期, F类群占据优势, F类群包括卵囊藻属、蹄形藻属、四胞藻属、肾形藻属、并联藻属等藻类, 与J、W1类群不同的是, F类群指示的水体环境营养水体略低, 其生境特征为中度以上富营养型水体[25-26]。F类群仅在大口黑鲈池塘为长期优势类群, 显示大口黑鲈池塘水体氮、磷营养盐水体要低于其他池塘, 从TN、TP均值水平来看, 两者判断结果相符。在4个养殖品种中, N类群主要在草鱼和乌鳢池塘占据优势, 这与两者的养殖密度有关, 草鱼和乌鳢池塘养殖密度远高于其他两品种, 而且套养鱼类密度较大, 高密度及不同食性养殖鱼类的活动会使得水体混合更为均匀, 这为N类群(鼓藻属)占优势提供了条件。从养殖时期来看, 所调查的4个精养池塘中, 基本都呈现养殖中期优势功能群多于养殖前期和末期的状况, 由于优势功能群单一往往意味着水质状况的恶化, 养殖中期优势功能群增多表明尽管这一时期属高温水质易恶化期, 但采样池塘并未出现严重水质问题。这可能因为这一时期处在南方雨季, 降水增多, 自然降水的持续汇入导致池塘水体形成直排, 加大了池塘水体的交换量。最为突出的是大口黑鲈和云斑尖塘鳢池塘, 这两个品种池塘处于河堤附近, 进出水渠多, 属于珠江三角洲河网区池塘, 池塘水体与外界交换比其他池塘充分。在云斑尖塘鳢池塘前期出现蓝藻水华, 中后期一度出现W2(囊裸藻属藻类)为优势类群的状况, 其生境特征为流动性较大的水体, 说明对于高密度精养池塘, 保证充足的水体交换, 是高温期防控水质恶化的重要措施[29]。
3.3 浮游植物功能群与池塘水质状况将浮游植物作为水体环境的指示生物, 在国内外多条河流的水质评价方面发挥出良好的作用, 已有的依据浮游植物多样性指数的水质状况评定标准[2]见表 5。由该评价标准及本研究的分析数据得出:采样池塘水体属于“中污-寡污型”水体, 有些时期甚至处于“寡污-清洁型”水平。这与现场的水体表观、分析测定的水体理化因子指标和水质评价状况不符。前期对池塘水环境质量状况的评价结果显示, 水体污染较为严重[23], 而根据浮游植物细胞密度和Chl a含量方法亦可判断水体呈现极重度富营养化状况[30]。本研究对池塘浮游植物功能群及其生境特征分析结果显示, 池塘水体长期以指示富营养化水体中的C、F、J、K、M、P、W1、Y等类群为优势功能群, 其中指示重度富营养化及高有机质含量的J、W1类群几乎在整个研究期间的所有池塘都占据优势地位。可见, 单独从浮游植物多样性指数角度并不能真实反映池塘的水质状况。分析认为, 尽管池塘藻类物种丰富, 基于物种数计算得到的各项多样性指数较高, 但是由于很多藻类隶属于同一属, 或者是同一种藻类的变种/变型, 它们的生态功能相近, 指示的环境状况大致相同, 由此导致依据传统分类方法的物种多样性指数水质评价结果与实际测定的水质因子指标相去甚远。因此, 从浮游植物功能类群的角度, 并结合水体理化环境的测定结果进行养殖池塘的水质状况分析, 这样可能会比从浮游植物物种多样性角度或者单一依据理化环境结果开展池塘水质状况评研究更具有指导意义[8, 11]。
|
|
表 5 基于Shannon-Weaver多样性指数(H)、Margalef多样性指数(M)、Evenness多样性指数(E)的水质评价标准[2] Tab.5 Evaluation criteria of water quality based on Shannon-Weaver index(H), Margalef index(M) and Evenness index(E) |
本研究对主要环境因子与优势浮游植物功能群进行RDA分析, 发现SD、TP、WT、DO、pH、N:P、TDS、CODMn和Chl a等9项因子是主要影响因子, 与M、Lo、W1、Y、N、J、F和MP等优势功能群呈明显的相关关系。从相关性系数大小来看, 环境因子对浮游植物功能群影响的大小顺序为CODMn > TP > SD > pH > DO > TDS > WT > N:P.在水体中, CODMn显示的是有机物质含量, TP和N:P代表着池塘的营养水平, SD、pH、DO、TDS和WT则反映的是水体物理环境状况。以上结果表明池塘水体中浮游植物功能群影响的综合因素中:首要因素是有机质含量, 其次为营养物质含量水平, 最后为水体物理环境。在河流湖库中, 水文水动力学因素被认为是影响水体中浮游植物功能群变化的重要驱动因子[7-8, 10, 31], 水力物理因素的改变使得河流水库水体内部动力学特征和水体的稳定性骤然改变, 会使得浮游植物在很短的时间内发生剧烈变化[12]。不同于自然河流、湖泊水体的是, 在池塘水体中, 水力学流动条件较小, 日常开增氧机、少量换水使得水体的pH、DO等指标不会发生太大变化, 南方温暖的气候使得养殖期水温波动较小, 而且高密度养殖下鱼类活动干扰使得水体中的悬浮颗粒沉降缓慢, 因此, 池塘的物理指标变化不大, 对浮游植物功能群的影响比较有限。然而, 养殖过程中投喂人工饵料, 会使得水体的有机质和营养盐浓度逐渐升高[15-16], 因此水体的有机质含量和营养物质含量水平成了浮游植物功能群动态变化的最主要影响因素。
| [1] |
Liang W F, Li Z J, Chen S W, et al. Investigation and analysis on characteristics of microalgae community in prawn ponds[J]. South China Fisheries Science, 2007, 3(5): 33-39. [梁伟峰, 李卓佳, 陈素文, 等. 对虾养殖池塘微藻群落结构的调查与分析[J]. 南方水产, 2007, 3(5): 33-39. DOI:10.3969/j.issn.2095-0780.2007.05.006] |
| [2] |
Li J, Jiang Z F, Huo T B, et al. Dynamics of phytoplankton diversity and water quality evaluation in the middle reaches of Heilongjiang River[J]. Journal of Fishery Sciences of China, 2012, 19(4): 671-678. [李拮, 姜作发, 霍堂斌, 等. 黑龙江中游浮游植物多样性动态变化及水质评价[J]. 中国水产科学, 2012, 19(4): 671-678.] |
| [3] |
Ravikumar P, Mehmood V M A, Somashekar R K. Water quality index to determine the surface water quality of Sankey tank and Mallathahalli lake, Bangalore urban district, Karnataka, India[J]. Applied Water Science, 2013, 3(1): 247-261. DOI:10.1007/s13201-013-0077-2 |
| [4] |
Tang Y, Zheng Y H, Liu J H, et al. Analysis on community structure and diversity of phytoplankton in the middle and lower reaches of the Hengjiang River in spring[J]. Freshwater Fisheries, 2016, 46(1): 51-58. [唐毅, 郑永华, 刘建虎, 等. 横江中下游春季浮游植物群落结构及多样性分析[J]. 淡水渔业, 2016, 46(1): 51-58. DOI:10.3969/j.issn.1000-6907.2016.01.009] |
| [5] |
Reynolds C S, Huszar V, Kruk C, et al. Towards a functional classification of the freshwater phytoplankton[J]. Journal of Plankton Research, 2002, 24(5): 417-428. DOI:10.1093/plankt/24.5.417 |
| [6] |
Padisák J, Crossetti L O, Naselli-Flores L. Use and misuse in the application of the phytoplankton functional classification:a critical review with updates[J]. Hydrobiologia, 2009, 621(1): 1-19. DOI:10.1007/s10750-008-9645-0 |
| [7] |
Becker V, Huszar V L M, Crossetti L O. Responses of phytoplankton functional groups to the mixing regime in a deep subtropical reservoir[J]. Hydrobiologia, 2009, 628(1): 137-151. DOI:10.1007/s10750-009-9751-7 |
| [8] |
Abonyi A, Leitāo M, Padisák, J, et al. Phytoplankton functional groups as indicators of human impacts along the River Loire (France)[J]. Hydrobiologia, 2012, 698(1): 233-249. DOI:10.1007/s10750-012-1130-0 |
| [9] |
Edwards K F, Litchman E, Klausmeier C A. Functional traits explain phytoplankton community structure and seasonal dynamics in a marine ecosystem[J]. Ecology Letters, 2013, 16(1): 56-63. DOI:10.1111/ele.12012 |
| [10] |
Devercelli M, O'Farrell I. Factors affecting the structure and maintenance of phytoplankton functional groups in a nutrient rich lowland river[J]. Limnologica, 2013, 43(2): 67-78. DOI:10.1016/j.limno.2012.05.001 |
| [11] |
Pálffy K, Présing M, Vǒrǒs L. Diversity patterns of trait-based phytoplankton functional groups in two basins of a large, shallow lake (Lake Balaton, Hungary) with different trophic state[J]. Aquatic Ecology, 2013, 47: 195-210. DOI:10.1007/s10452-013-9434-3 |
| [12] |
Zhu K X, Bi Y H, Hu Z Y. Responses of phytoplankton functional groups to the hydrologic regime in the Daning River, a tributary of Three Gorges Reservoir, China[J]. Science of the Total Environment, 2013, 450-451: 169-177. DOI:10.1016/j.scitotenv.2013.01.101 |
| [13] |
Salmaso N, Naselli-Flores L, Padisák J. Functional classifications and their application in phytoplankton ecology[J]. Freshwater Biology, 2015, 60(4): 603-619. DOI:10.1111/fwb.2015.60.issue-4 |
| [14] |
Zhong G F, Deng H Z, Wu H S, et al. Researches on Pond System in the Pearl River Delta[M]. Beijing: Science Press, 1987: 65-67, 98-115. [钟功甫, 邓汉增, 吴厚水, 等. 珠江三角洲基塘系统研究[M]. 北京: 科学出版社, 1987: 65-67, 98-115.]
|
| [15] |
Zhou J F, Wen Y M, Li Y C. Establishment of water quality model of farming ponds in the Pearl River Delta and its application[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2010, 49(1): 119-124. [周劲风, 温琰茂, 李耀初. 珠江三角洲养殖池塘水质模型建立及其应用研究[J]. 中山大学学报:自然科学版, 2010, 49(1): 119-124.] |
| [16] |
Li F. The necessity of the establishment of aquaculture sediment quality criteria (SQC) in Pearl River Delta[J]. Fisheries Science, 2007, 26(6): 362-365. [利锋. 建立珠江三角洲水产养殖水体SQC的必要性[J]. 水产科学, 2007, 26(6): 362-365. DOI:10.3969/j.issn.1003-1111.2007.06.014] |
| [17] |
The Compilation Committee of Analysis Methods of Water and Exhausted Water Monitoring Belonging to State Environmental Protection Administration. Analysis Methods of Water and Exhausted Water Monitoring[M]. 2002: 243-257. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水检测分析方法[M]. 2002: 243-257.]
|
| [18] |
Zhu K X. Studies on phytoplankton community dynamics and eutrophication in the Three Gorges Reservoir[D]. Wuhan: Institute of Hydrobiology, Chinese Academy of Sciences, 2013: 77. [朱孔贤.三峡水库浮游植物群落动态与富营养化研究[D].武汉: 中国科学院水生生物研究所, 2013: 77.] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2333231
|
| [19] |
Hu H J, Wei Y X. The Freshwater Algae of China Systematics, Taxonomy and Ecology[M]. Beijing: Science Press, 2006: 5-950. [胡鸿钧, 魏印心. 中国淡水藻类一系统、分类及生态[M]. 北京: 科学出版社, 2006: 5-950.]
|
| [20] |
Zhang Z S, Huang X F. Freshwater Plankton Research Methods[M]. Beijing: Science Press, 1991: 340-344. [章宗涉, 黄祥飞. 淡水浮游生物研究方法[M]. 北京: 科学出版社, 1991: 340-344.]
|
| [21] |
State Environmental Protection Bureau. GB11607-1989, Water Quality Standard for Fisheries[S]. Beijing: China Environmental Science Press, 1990. [国家环境保护局. GB 11607-1989, 渔业水质标准[S].北京: 中国环境科学出版社, 1990.]
|
| [22] |
Liu M H, Yu H X, Liu Q G, et al. Water quality evaluation index system of freshwater aquaculture pond[J]. Journal of Anhui Agricultural Sciences, 2011, 39(24): 14569-14572. [刘曼红, 于洪贤, 刘其根, 等. 淡水养殖池塘水质评价指标体系研究[J]. 安徽农业科学, 2011, 39(24): 14569-14572. DOI:10.3969/j.issn.0517-6611.2011.24.020] |
| [23] |
Liu Q F, Lai Z N, Yang W L, et al. Assessment of water quality of intensive ponds in the Pearl River Delta region[J]. South China Fisheries Science, 2014, 10(6): 36-43. [刘乾甫, 赖子尼, 杨婉玲, 等. 珠江三角洲地区密养淡水鱼塘水质状况分析与评价[J]. 南方水产科学, 2014, 10(6): 36-43. DOI:10.3969/j.issn.2095-0780.2014.06.005] |
| [24] |
Lan Y Q, Yuan Y W, Peng L, et al. Cage cultural eutrophication and phytoplankton functional groups as bio-indicators in Jianggu Reservoir (Zhaoqing City, Guangdong Province)[J]. Ecology and Environmental Sciences, 2015, 24(6): 1028-1036. [蓝于倩, 袁一文, 彭亮, 等. 江谷水库鱼类网箱养殖富营养化及浮游植物功能群的指示作用[J]. 生态环境学报, 2015, 24(6): 1028-1036.] |
| [25] |
Huang X H, Hu R, Lei L M, et al. Seasonal succession of phytoplankton functional groups in typical small and medium-sized reservoirs in southern China[J]. Ecology and Environmental Sciences, 2013, 22(2): 311-318. [黄享辉, 胡韧, 雷腊梅, 等. 南亚热带典型中小型水库浮游植物功能类群季节演替特征[J]. 生态环境学报, 2013, 22(2): 311-318. DOI:10.3969/j.issn.1674-5906.2013.02.023] |
| [26] |
Hu R, Lan Y Q, Han B P, et al. The concepts, classification and application of freshwater phytoplankton functional groups[J]. Journal of Lake Science, 2015, 27(1): 11-23. [胡韧, 蓝于倩, 韩博平, 等. 淡水浮游植物功能群的概念、划分方法和应用[J]. 湖泊科学, 2015, 27(1): 11-23.] |
| [27] |
Wu H M, Jiang J F, Li C Y, et al. Analysis and comparison of water quality among three ponds with different species farmed[J]. Freshwater Fisheries, 2016, 46(2): 82-86. [吴会民, 姜巨峰, 李春艳, 等. 三种不同养殖品种池塘水质变化特征分析及比较[J]. 淡水渔业, 2016, 46(2): 82-86. DOI:10.3969/j.issn.1000-6907.2016.02.014] |
| [28] |
Xiao X. Allelopathic inhibition of Cyanobacteria by barley straw and its mechanism[D]. Hangzhou: Zhejiang University, 2012: 29-48. [肖溪.大麦秸秆对蓝藻化感抑制作用与机理的研究[D].杭州: 浙江大学, 2012: 29-48.] http://cdmd.cnki.com.cn/Article/CDMD-10335-1013153476.htm
|
| [29] |
Wang L, Cai Q H, Xu Y Y, et al. Weekly dynamics of phytoplankton functional groups under high water level fluctuations in a subtropical reservoir-bay[J]. Aquatic Ecology, 2011, 45(2): 197-212. DOI:10.1007/s10452-010-9346-4 |
| [30] |
Li L, Li Q H, Jiao S L, et al. Response of phytoplankton functional groups to eutrophication in summer at Xiaoguan reservoir[J]. Environmental Science, 2015, 32(12): 4436-4443. [李磊, 李秋华, 焦树林, 等. 小关水库夏季浮游植物功能群对富营养化特征的响应[J]. 环境科学, 2015, 32(12): 4436-4443.] |
| [31] |
Tian C, Pei H Y, Hu W R, et al. Variation of phytoplankton functional groups modulated by hydraulic controls in Hongze Lake, China[J]. Environmental Science and Pollution Research, 2015, 22(22): 18163-18175. DOI:10.1007/s11356-015-4830-y |
 2018, Vol. 25
2018, Vol. 25

