刺参(Apostichopus japonicus Selenka)又称仿刺参, 隶属棘皮动物门(Echinodermata), 海参纲(Holoth uu roidea), 楯手目(Aspidochirota), 刺参科(Sticho po didae), 仿刺参属, 具有极高的营养和保健价值[1], 深受消费者的青睐, 近年来养殖产业规模发展迅速[2]。在刺参养殖产业的各生产环节中, 大规格苗种养成是决定产出效益的关键时期[3-4], 并且目前多以池塘养殖模式为主。
池塘养殖易受水温、盐度等多种外界环境因素影响, 其中氨氮也是关键因子之一[5]。刺参池塘养殖在其规模拓展过程中, 普遍存在着清塘不及时或池塘老化等问题, 同时也存在着为片面追求高产而过量投喂、管理不科学等现象, 致使养殖池底废弃物、粪便等积累、氨化分解[6]。尤其是近年来沿海近岸浒苔(Enteromorpha prolifera)灾害性频繁暴发, 亦导致了夏季因浒苔大量繁生、腐烂等因素而使养殖水环境恶化, 水体氨氮含量升高[7], 各种不利因素不同程度的影响了刺参活力、摄食、生长及生存, 氨氮胁迫已成为当前刺参养殖业的一大制约因素。
水生动物的生长发育离不开对食物的消化吸收, 消化酶活力的高低是决定刺参消化吸收能力的决定性因素, 而消化酶的合成、分泌与饲料的营养水平有关[8], 众多学者对水生动物的消化酶开展过大量研究工作[9-14]。随着近年来刺参产业发展与相关科研的深入, 有关刺参消化酶的实验研究工作也较为细致地陆续开展[15-17], 如Fu等[15]以体重为100~120 g的刺参为研究对象, 发现了刺参肠道蛋白酶的特性。但在目前开展的相关研究工作中, 关于氨氮胁迫对刺参消化酶的影响尚未见报道。此外, 结合环境恶变导致的刺参池塘养殖损失情况看, 养殖受损程度与刺参规格关联性也不明确。因此, 基于目前刺参养殖多采用大规格苗种养殖, 本实验通过为期14 d的慢性氨氮胁迫, 研究了在氨氮胁迫条件下对几种大规格刺参摄食与消化酶活性的影响, 旨在探明氨氮胁迫下刺参大规格苗种阶段的消化生理状态, 为刺参养殖水体环境的有效调控和刺参健康养殖提供基础数据与技术支撑。
1 材料与方法 1.1 实验材料实验刺参为山东省海洋生物研究院种质资源研究中心选育刺参。选用体表正常、活力旺盛、摄食正常的大规格苗种, 按体重分为小(S)、中(M)、大(L) 3个规格, 体重分别为(15.13±0.12) g、(28.42±0.32) g、(60.14±0.88) g。实验刺参置于容积为1.0 m3的圆形玻璃钢水槽中暂养, 小规格刺参100~150 ind/m3, 中规格刺参60~80 ind/m3, 大规格刺参30~50 ind/m3。养殖用水为经沉淀砂率的自然海水, 盐度31±0.4, 水温(16±1.5)℃, pH 8.1± 0.2。实验期间日换水1次, 连续充气, 每天投喂1次配合饲料(购自青岛塞格林生物工程有限公司, 主要成分为粗蛋白16%、粗脂肪5%、粗纤维8%、总磷6%、粗灰分25%、赖氨酸0.8%、水分10%), 暂养适应7 d后进行实验。
1.2 实验设计根据实验暂养的不同规格刺参进行急性氨氮毒性预实验, 以实验结果96 h氨氮半致死浓度的10%为基础(96 h LC50, T-AN: 103.8mg/L), 设置2 mg/L、4 mg/L、6 mg/L、8 mg/L、10 mg/L共5个氨氮浓度梯度, 通过计算得出非离子氨浓度分别为0.066 mg/L、0.131 mg/L、0.197 mg/L、0.263 mg/L、0.328 mg/L。各组氨氮浓度均用1000 mg/L的NH4Cl母液进行调节。同时, 以总氨氮(T-AN)低于0.05 mg/L的自然海水为对照组, 浓度设定为0 mg/L。各实验组与对照组实验刺参均为15 ind, 放养在整理箱(80 cm×60 cm×48 cm)中, 每实验组设5组平行。养殖条件与日常管理同暂养期, 每日换水前以虹吸法吸出残饵, 干燥箱内70℃烘干12 h称重, 获得残饵量。换水后用奈氏试剂法[18]测定并及时校正水中氨氮浓度。实验于2016年5月5日开始共进行14 d。
1.3 样品采集与数据测定 1.3.1 非离子态氨计算实验水体中非离子态氨采用以下公式计算:
NH3=[NH3+NH4+]/[1+10(pKa-pH)]
式中, pKa为离解常数, pKa=0.09018+2729.92/T; T为开尔文温度, T=273+t(℃)。
1.3.2 刺参生长与摄食情况测定刺参特定生长率(SGR)采用以下公式计算:
SGR(%/d)=100%×(lnWt−lnW0)/t
通过测定摄食率(feeding rate, FR)与食物转化率(food conversion efficiency, FCE), 观察氨氮胁迫对刺参摄食的影响。计算公式如下:
FR=2F/[t(Wt+W0)]×100%
FCE=100%×(Wt−W0)/F
| $ F = \sum\limits_{i = 1}^{\rm{t}} {({{F}_t} - {{R}_t})} $ |
式中, W0为体重初始值(g), Wt为测定值(g), t为实验时间(d), F为饲料总摄入量(g), Ft为第t天投喂量(g), Rt为第t天残饵量(g)。
1.3.3 刺参消化酶测定实验结束后将刺参取出, 使其自行排净体内海水, 用灭菌纱布擦干体表水分后放入玻璃培养皿中, 沿腹部剪开, 取出消化道, 剔除呼吸树, 用超纯水冲洗干净, 在−80℃超低温冰箱中保存。实验时取肠组织置于玻璃匀浆器中, 加入10倍体积预冷的超纯水, 在冰浴条件下匀浆20 min, 在高速冷冻离心机中(0~4℃, 1000 r/min)离心30 min, 所得上清液置于冰箱保存待测。
蛋白酶、淀粉酶和脂肪酶等消化酶指标均采用南京建成生物工程研究所研制的试剂盒测定。蛋白酶活力测定采用钼酸铵法, 每毫克组织蛋白37℃每分钟分解蛋白生成1 μg氨基酸相当于1个酶活力单位; 淀粉酶(AMS)含量测定采用比浊法, 组织中每毫克蛋白在37℃与底物作用30 min, 水解10 mg淀粉定义为1个淀粉酶活力单位; 脂肪酶(LPS)活力测定采用黄嘌呤氧化酶法, 在37℃条件下, 每克组织蛋白在本反应体系中与底物反应1 min, 每消耗1 μmol底物为1个活力单位。
酶液中蛋白质含量的测定:按南京建成生物工程研究所生产的BCA蛋白浓度测定试剂盒上的说明进行测定。
1.3.4 数据处理实验数据以平均值±标准差(x± SD)表示, 用SPSS 18.0及Excel软件进行数据分析统计, 不同处理组数据间的差异采用单因素方差分析(one-way ANOVA), Duncan’s检测法进行多重比较, 以P < 0.05作为显著性差异的标志。
2 结果与分析 2.1 慢性氨氮胁迫对刺参存活与生长的影响不同规格刺参经氨氮胁迫14 d后的存活率与生长情况如表 1所示。当氨氮浓度为0~4 mg/L时, 3种规格刺参存活率均为100%, 均能正常活动、摄食、生长, 未表现出异常状况, 实验结束时体重均有所增长; 当氨氮浓度为6 mg/L时, 小规格实验刺参(S)出现死亡个体, 存活率为97.3%, 其余2种规格刺参无死亡现象, 全部实验组刺参均呈现活动减少、生长停滞现象, 其中大规格实验刺参(L)出现体重负增长; 当氨氮浓度为8~10 mg/L时, 3种规格刺参均出现不同程度排脏、化皮并最终导致死亡现象, 死亡率最高的为氨氮浓度10 mg/L时的S5组, 存活率为81.3%, 体重呈现负增长。
|
|
表 1 氨氮胁迫对不同规格刺参生长的影响 Tab.1 The survival rate and growth of three size Apostichopus japonicus at different ammonia nitrogen concentrations |
当氨氮浓度为2 mg/L时, 实验结束时同规格刺参末体重与对照组相比无显著差异(P > 0.05), 大规格实验组(L)特定生长率(SGR)为(0.549± 0.034)%/d, 较对照组显著降低(P < 0.05), 其余各实验组SGR与对照组无显著差异(P > 0.05);当氨氮浓度高于2 mg/L时, 随着氨氮浓度升高, 刺参末体重与SGR均呈现显著下降趋势。其中, 中规格实验刺参体重下降幅度最大, SGR最低, 为(−1.462±0.189)%/d。
2.2 慢性氨氮胁迫对刺参摄食的影响如表 2所示, 实验期间, 当氨氮浓度为0~ 8 mg/L时, 随着氨氮浓度的增加, 各规格刺参摄食率组内差异不显著(P > 0.05);当氨氮浓度为10 mg/L时, 小(S)、中(M)规格刺参摄食率达到最大值, 分别为(3.110±0.193)%与(2.359±0.164)%, 与对照组出现显著差异(P < 0.05);大规格刺参(L)在不同氨氮浓度胁迫下的摄食率组内差异不显著(P > 0.05)。此外, 从表中可以明显看出, 在同一氨氮浓度下刺参摄食率的高低与其体重呈反比关系。
|
|
表 2 氨氮胁迫对不同规格刺参摄食率(FR)的影响 Tab.2 The feeding rate of three size Apostichopus japonicus at different ammonia nitrogen concentrations |
如表 3所示, 从表中可看出, 氨氮胁迫对刺参食物转化率的影响极为显著, 所有氨氮胁迫实验组的FCE均显著低于对照(P < 0.05);实验组中FCE最高的是氨氮浓度2 mg/L时的实验组(S1, M1, L1), 分别为41.500%、40.930%和45.234%。
|
|
表 3 氨氮胁迫对不同规格刺参食物转化率(FCE)的影响 Tab.3 The food conversion efficiency of three size Apostichopus japonicus at different ammonia nitrogen concentrations |
如图 1所示, 在氨氮浓度为2 mg/L时, 小(S1)、大(L1)规格刺参蛋白酶活性较对照均呈现逐渐降低的趋势, 中规格(M1)刺参蛋白酶活性虽有小幅升高, 但与对照组差异不显著(P > 0.05)。在氨氮浓度为4 mg/L时, 3种规格刺参蛋白酶活性均有所降低, 但与对照组差异不显著(P > 0.05)。在氨氮浓度为6 mg/L时, 3种规格刺参蛋白酶活性持续降低, 小规格(S3)刺参蛋白酶活性较对照组出现显著差异(P < 0.05)。在氨氮浓度为8 mg/L和10 mg/L时, 所有实验组刺参蛋白酶活性均出现较大降幅, 显著低于对照组(P < 0.05), 最低为中规格(M5)刺参蛋白酶活性, 为1.23 U/mg(prot)。
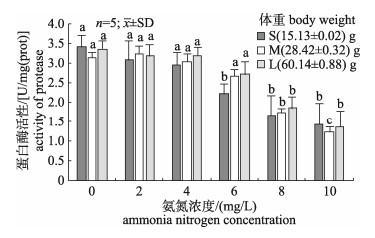
|
图 1 不同氨氮浓度对3种不同规格刺参蛋白酶活性影响 不同字母的表示显著性差异(P < 0.05). Fig.1 Effect of different ammonia nitrogen concentrations on the activity of protease of three size Apostichopus japonicus Different letters mean significant differences (P < 0.05). |
通过图 2可以看出, 不同规格刺参淀粉酶活性随氨氮浓度的升高均呈现先升高后降低的变化趋势。小(S)、中(M)、大(L)3种规格刺参消化道淀粉酶活性均在氨氮浓度为2 mg/L时达到峰值, 分别为0.52 U/mg(prot)、0.50 U/mg(prot)、0.47 U/mg(prot), 但与对照组相比差异并不显著(P > 0.05)。当氨氮浓度在2~8 mg/L范围时, 随着氨氮浓度的升高, 中、大规格实验组刺参淀粉酶活性呈下降趋势, 但与对照组差异并不显著(P > 0.05)。当氨氮浓度为6 mg/L时, 小规格(S3)刺参的消化道淀粉酶活性降低到0.30 U/mg(prot), 与对照组出现显著差异(P < 0.05)。当氨氮浓度为10 mg/L时, 3种规格刺参消化道淀粉酶活性均显著低于对照组(P < 0.05)。
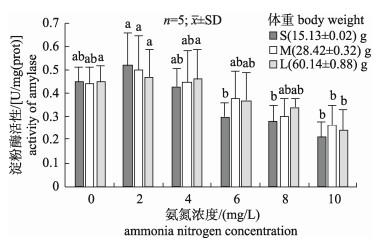
|
图 2 不同氨氮浓度对3种不同规格刺参淀粉酶活性影响 不同字母的表示显著性差异(P < 0.05). Fig.2 Effect of different ammonia nitrogen concentrations on the activity of amylase of three size Apostichopus japonicus Different letters mean significant differences (P < 0.05). |
从图 3可以看出, 不同规格刺参消化道脂肪酶活性随氨氮浓度的升高均呈现先升高后降低的变化趋势, 小(S)、中(M)、大(L) 3种规格刺参消化道脂肪酶活性均在氨氮浓度为2 mg/L时达到峰值, 分别为2.48 U/mg(prot)、2.65 U/mg(prot)、2.63 U/mg(prot); 随后3种规格刺参脂肪酶活性逐渐降低, 在氨氮浓度从6 mg/L到8 mg/L时, 脂肪酶活性发生急剧变化, 显著低于对照组; 当氨氮浓度为10 mg/L时, 3种规格刺参脂肪酶活性持续降低, 中规格(M5)刺参降至最低, 为0.53 mg/L, 与对照组差异极显著(P < 0.01)。
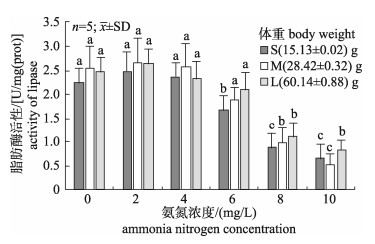
|
图 3 不同氨氮浓度对3种不同规格刺参脂肪酶活性影响 不同字母的表示显著性差异(P < 0.05). Fig.3 Effect of different ammonia nitrogen concentrations on the activity of lipase of three size Apostichopus japonicus Different letters mean significant differences (P < 0.05). |
在水产养殖中, 残饵、粪便以及动植物尸体等含氮有机物的分解是水体中氨氮主要来源, 其非离子态具有较高脂溶性, 容易透过细胞膜使养殖动物中毒, 还会降低其能量代谢活动[19]。本实验设置的氨氮处理组浓度范围为2~10 mg/L (经换算, 相对应的非离子氨的浓度范围为0.066~0.328 mg/L), 而《国家标准渔业水质标准》(GB 11607-89)规定非离子氨浓度的允许范围上限为0.020 mg/L。本实验研究表明, 过量非离子氨会对刺参存活与正常生长造成不利影响。当养殖水环境中的氨氮浓度低于6 mg/L时, 实验期间3种规格刺参均能正常活动、摄食, 未表现出异常状况, 表明对刺参的生活与生长是安全的; 但当氨氮浓度超过8 mg/L时, 实验后期3种不同规格刺参均出现了吐肠、化皮, 直至死亡。另外, 研究发现不同规格刺参对氨氮的耐受能力不同[20], 在本实验中当氨氮浓度为10 mg/L时, 至实验结束时不同规格刺参的存活率存在差异, 大规格刺参存活率最高, 为88.0%, 小规格最低, 为81.3%, 表明当氨氮浓度超过刺参耐受极限时, 体重规格较大的刺参对高氨氮水环境具有更强的耐受能力与抗逆性。
3.2 慢性氨氮胁迫对刺参摄食与生长的影响研究表明, 刺参摄食生理受多重因素影响, 包括体重、光照、盐度以及自身状态等[21-23], 而有关氨氮对其摄食影响的报道至今较少。本实验中, 通过测定摄食率FR与食物转化率FCE分别衡量了氨氮胁迫下不同规格刺参日摄食情况及其对投入饲料的转化效率。在同一体重规格范围内, 刺参摄食率在不同氨氮浓度胁迫下变化不大, 仅10 mg/L氨氮浓度组摄食率显著高于对照组, 其原因主要是本研究采用的摄食率计算公式是以平均体重为参照的相对日摄食率, 而在高浓度氨氮胁迫下的刺参末体重下降较大, 因此使其摄食率计算值偏高。据Wong等[24]研究发现, 为了满足生长和代谢的能量需求, 海洋生物可通过自身调节来补偿因外界条件变化而对其造成的负面影响, 实验刺参可能随着氨氮胁迫程度的加剧, 增加了对能量的相对摄入量, 以减少因外界环境不断恶化对机体造成的损伤。从实验中食物转化率FCE的结果也可看出, 尽管相对摄食率变化不大, 但随着氨氮胁迫浓度升高至4 mg/L以上时, 刺参对食物的转化利用率急剧下降, 实验中尤其表现在中、小规格实验组刺参, 可见高氨氮对刺参摄食生理造成了显著影响, 并且对体重偏小的个体影响更大。
当水体中非离子氨增加, 导致水生动物饲料转化率降低后, 机体大部分能量用于自身消耗, 用于生长的能量大幅减少, 这在刺参、鱼类、甲壳类水生动物都有相关报道[25-29], 本实验结果也表明同样存在着这一变化规律。当氨氮浓度高于2 mg/L时, 随着氨氮浓度升高, 刺参体重与SGR等指标均显著下降, 甚至出现负增长, 在相同投喂量下, 食物转化率的下降与非离子氨的毒性作用等原因共同导致了刺参生长停滞并呈现负增长现象。此外, 在氨氮胁迫下, 水生动物会提高代谢消耗以应对氨氮的胁迫作用, 同时排粪量也会增加, 导致体重下降[30]。
3.3 慢性氨氮胁迫对刺参3种消化酶活性的作用机理消化酶在水生动物消化、吸收过程中起至关重要的作用, 其活性是反映水生动物生理消化机能的一项重要指标, 决定着动物对营养物质消化吸收的能力, 从而决定生长发育速度[31-32]。水产动物消化酶活性随种类、规格和生理状况的不同而有所差异, 同时也受水温、盐度、饵料成分和丰度等因素影响[33]。刺参体内无消化腺, 但在消化道的前肠和中肠内具有多种消化酶[11], 其中起主要作用的3种消化酶是蛋白酶、淀粉酶、脂肪酶[34]。蛋白酶在刺参体内分布广泛, 存在于刺参肠道的各个部位[35-36]。付雪艳[37]研究得出刺参消化道蛋白酶的特性与刺参生长有着密切关系。本实验发现, 不同规格刺参蛋白酶活性与刺参特定生长率变化呈现相同的变化趋势, 均随氨氮胁迫浓度的上升而呈下降趋势, 这说明在氨氮胁迫下刺参个体生长与蛋白酶活性的关联性最强。
Hassett等[38]指出, 为了适应环境并从环境中获得足够的食物, 动物能够调节自身的酶活性。本实验中, 氨氮浓度的升高对刺参的生存、生长形成了胁迫, 刺参蛋白酶、淀粉酶、脂肪酶活性有着明显的峰值变化。实验结果显示:当氨氮浓度为0~4 mg/L时, 刺参脂肪酶、淀粉酶活性处于较高状态, 这说明相对于对照组, 低氨氮浓度在一定程度上促进了脂肪酶、淀粉酶等消化酶的活性。Stebbing[39]曾认为在毒物作用下生物酶会出现增益现象, 并将这种刺激反应现象称为“毒物兴奋效应”。对于低氨氮浓度下刺参消化酶活性的短暂升高, 可理解为氨氮胁迫短时间内刺参消化酶活力升高, 提高了机体的消化吸收利用能力, 用于补偿因环境应激所需的能量消耗, 满足机体应激代谢的能量需求。而一旦氨氮胁迫浓度持续超过一定范围, 高氨氮浓度便会抑制消化酶的活性, 使其表现出显著降低趋势, 在本实验中这种氨氮浓度临界值在小规格实验组中出现在4 mg/L, 中、大规格实验组为6 mg/L。
氨氮胁迫与低盐胁迫一样, 同属环境胁迫的一种, 孙双双等[40]研究发现, 在刺参可承受的盐度范围内, 盐度胁迫对刺参消化酶有以下三种作用:刺激作用、无作用和抑制作用, 本实验结果在一定程度上与之契合。有学者指出, 无机离子可以直接影响刺参消化酶的活性[41], 且无机离子浓度不同对消化酶的影响程度也不相同[23]。本实验以1000 mg/L的氯化铵母液调节海水中氨氮浓度, 其在水体中以NH4+和Cl-的形式存在, 随着氨氮浓度的升高, 两种无机离子不断改变着刺参养殖水体中无机离子的含量, 并影响刺参消化酶的活性。同时, 有研究指出, 氨氮胁迫下水生动物消除体内氨氮的主要途径是通过非离子态氨的自由扩散[42], 其在刺参消化道内的影响机理还有待于进一步的组织学研究证实。
4 结论本研究结合摄食行为与能量分配角度进行了综合分析, 从理论上阐明了氨氮胁迫对刺参生长、摄食、消化生理的影响机制。氨氮胁迫会对体重大于15 g刺参的摄食、消化与生长产生影响, 在氨氮浓度4 mg/L以下时, 刺参消化酶活性短期可被显著诱导上调, 高氨氮浓度对消化酶活性起抑制效应并可导致生理紊乱, 且此响应存在体重规格上的差异。有关中国海水氨氮的水生生物基准研究曾报道, 海水环境中总氨氮的连续基准浓度(CCC)为0.007~4.999 mg/L[43], 综上, 为保持刺参旺盛摄食与生长, 维持正常的消化吸收水平, 刺参养殖水环境的总氨氮浓度最好控制在4 mg/L以内。
| [1] |
Moon J H, Ryu H S, Yang H S, et al. Antimutagenic and anticancer effects of glycoprotein and chondroitin sulfates from sea cucumber (Stichopus japonicus)[J]. The Korean Society of Food Science and Nutrition, 1998, 27(2): 350-358. |
| [2] |
Li C L, Song A H, Hu W, et al. Status analysis and sustainable development strategy of sea cucumber Apostichopus japonicus selenka aquaculture industry in Shandong Province[J]. Progress in Fishery Sciences, 2010, 31(4): 126-132. [李成林, 宋爱环, 胡炜, 等. 山东省刺参养殖产业现状分析与可持续发展对策[J]. 渔业科学进展, 2010, 31(4): 126-133. DOI:10.3969/j.issn.1000-7075.2010.04.018] |
| [3] |
Chang Y Q, Sui X L, Li J. The current situation, problem and prospect on the Apostichopus japonicas aquaculture[J]. Fisheries Science, 2006, 25(4): 198-201. [常亚青, 隋锡林, 李俊. 刺参增养殖业现状、存在问题与展望[J]. 水产科学, 2006, 25(4): 198-201. DOI:10.3969/j.issn.1003-1111.2006.04.010] |
| [4] |
Liu X Y, Jiang C J, Wang G H, et al. Strategic thoughts on promoting the sustainable development of sea cucumber aquaculture[J]. China Fisheries, 2012(2): 76-78. [刘锡胤, 姜成嘉, 王国华, 等. 推进刺参养殖业可持续发展的战略思考[J]. 中国水产, 2012(2): 76-78. DOI:10.3969/j.issn.1002-6681.2012.02.030] |
| [5] |
Le Moullac G, Haffner P. Environmental factors affecting immune responses in Crustacea[J]. Aquaculture, 2000, 191(1-3): 121-131. DOI:10.1016/S0044-8486(00)00422-1 |
| [6] |
Zeng Q T, Yu H N, Lin X T, et al. Effects of ammonia-nitrogen on locomotor performance and the energy budget of Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2016, 23(1): 198-206. [曾庆婷, 于赫男, 林小涛, 等. 氨氮胁迫下凡纳滨对虾运动行为与能量分配模式变化[J]. 中国水产科学, 2016, 23(1): 198-206.] |
| [7] |
Li X, Wang Y, Wu Z H, et al. Effect of Enteromorpha prolifera on growth of Apostichopus japonicas[J]. Journal of Fishery Sciences of China, 2013, 20(5): 1092-1099. [李晓, 王颖, 吴志宏, 等. 浒苔对刺参幼参生长影响的初步研究[J]. 中国水产科学, 2013, 20(5): 1092-1099.] |
| [8] |
Pan L Q, Liu H Y, Xiao G Q. A review on digestive enzyme of crustacean larvae[J]. Journal of Fishery Sciences of China, 2006, 13(3): 492-501. [潘鲁青, 刘泓宇, 肖国强. 甲壳动物幼体消化酶研究进展[J]. 中国水产科学, 2006, 13(3): 492-501. DOI:10.3321/j.issn:1005-8737.2006.03.026] |
| [9] |
Lee-Shing F, Shu-Fen C. Effect of salinity on the activities of digestive proteases from the tilapia fish, Oreochromis niloticus in different culture environments[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1989, 93(2): 439-443. DOI:10.1016/0300-9629(89)90063-7 |
| [10] |
Aoe H, Masuda I, Abe I, et al. Nutrition of protein in young carp-I[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1970, 36(4): 407-413. DOI:10.2331/suisan.36.407 |
| [11] |
He Z. Studies on the effects of different diets on the growth, body composition, non-specific immunity and digestive enzymes activities of sea cucumber, Apostichopus japon icas[D]. Dalian: Dalian Ocean University, 2014. [何舟.不同饲料对刺参生长、体成分、免疫相关酶和消化酶活性的影响[D].大连: 大连海洋大学, 2014.] http://cdmd.cnki.com.cn/Article/CDMD-10158-1014035840.htm
|
| [12] |
Zhang M Y, Wang C A, Xu Q Y. Effects of myo-inositol on growth performance, body composition, and digestive enzyme activity in Hucho taimen[J]. Journal of Fishery Sciences of China, 2014, 21(3): 560-566. [张美彦, 王常安, 徐奇友. 肌醇对哲罗鲑生长性能、体成分及消化酶活性的影响[J]. 中国水产科学, 2014, 21(3): 560-566.] |
| [13] |
Feng D, Gao Q F, Dong S L. Effect of feeds with different protein contents on the growth of sea cucumbers (Apostichopus japanicus) and activity of their digestive enzymes[J]. Periodical of Ocean University of China, 2014, 44(2): 35-40. [冯丹, 高勤峰, 董双林. 不同蛋白水平饲料对刺参生长和消化酶活性的影响[J]. 中国海洋大学学报:自然科学版, 2014, 44(2): 35-40.] |
| [14] |
Xu W J, Pan L Q, Yue F, et al. Effects of ammonia-N stress on digestive enzyme activities of swimming crab portunus trituberculatus[J]. Periodical of Ocean University of China, 2011, 41(6): 35-40. |
| [15] |
Fu X Y, Xue C H, Miao B C, et al. Characterization of proteases from the digestive tract of sea cucumber (Stichopus japonicus): high alkaline protease activity[J]. Aquaculture, 2005, 246(1): 321-329. |
| [16] |
Fan Y J, Li X D, Luo Z, et al. Effects of replacement of dietary fish meal by soybean meal on growth, body composition and digestive enzyme activities in sea cucumber Apostichopus japonicas juveniles[J]. Journal of Dalian Fisheries University, 2010, 25(1): 71-75. [樊月居, 李晓东, 罗智, 等. 饲料中用豆粕替代鱼粉对仿刺参幼参生长、体成分及消化酶活性的影响[J]. 大连水产学院学报, 2010, 25(1): 71-75. DOI:10.3969/j.issn.1000-9957.2010.01.015] |
| [17] |
Jang L X, Yang N, Li J, et al. Effect of temperature and pH on the activities of digestive enzymes in Apostichopus japonicas[J]. Oceanologia et Limnologia Sinica, 2007, 38(5): 476-480. [姜令绪, 杨宁, 李建, 等. 温度和pH对刺参(Apostichopus japonicus)消化酶活力的影响[J]. 海洋与湖沼, 2007, 38(5): 476-480. DOI:10.3321/j.issn:0029-814x.2007.05.013] |
| [18] |
Chen J R. The Instruction of Water Chemistry Experi ment[M]. Beijing: China Agriculture Press, 1996: 136-139.
|
| [19] |
Ren H, Li J, Li J T, et al. Effects of acute ammonia stresses on antioxidant enzyme activities and GPx gene expression in Exopalaemon carinicauda[J]. Journal of Agro-Environment Science, 2014, 34(4): 647-655. [任海, 李健, 李吉涛, 等. 急性氨氮胁迫对脊尾白虾(Exopalaemon carinicauda)抗氧化系统酶活力及GPx基因表达的影响[J]. 农业环境科学学报, 2014, 34(4): 647-655.] |
| [20] |
Zang Y Q, Tian X L, Dong S L, et al. The activities of immunoenzymes and heat shock protein 70 content of sea cucumber, Apostichopus japonicus (Selenka) to chronic stress of ammonical nitrogen[J]. Periodical of Ocean University of China, 2012, 42(S1): 60-66. [臧元奇, 田相利, 董双林, 等. 氨氮慢性胁迫对刺参免疫酶活性及热休克蛋白表达的影响[J]. 中国海洋大学学报:自然科学版, 2012, 42(S1): 60-66.] |
| [21] |
Zhao Y J, Zhang H. Ingestion and absorption of organic deposition by Apostichopus japonicus at various water temperatures[J]. Fisheries Science, 2004, 23(7): 1-4. [赵永军, 张慧. 不同温度下刺参对有机沉积物的摄食与吸收[J]. 水产科学, 2004, 23(7): 1-4. DOI:10.3969/j.issn.1003-1111.2004.07.001] |
| [22] |
Chen Y, Gao F, Liu G S, et al. The effects of temperature, salinity and light cycle on the growth and behavior of Apostichopus japonicas[J]. Journal of Fisheries of China, 2007, 31(5): 687-691. [陈勇, 高峰, 刘国山, 等. 温度、盐度和光照周期对刺参生长及行为的影响[J]. 水产学报, 2007, 31(5): 687-691.] |
| [23] |
Li G, Tang X X, Dou Y, et al. Effects of salinity on digestive enzyme activities of Apostichopus japonicas[J]. Marine Environmental Science, 2011, 30(1): 61-63. [李刚, 唐学玺, 窦勇, 等. 盐度对刺参(Apostichopus japonicus)消化酶活力的影响[J]. 海洋环境科学, 2011, 30(1): 61-63. DOI:10.3969/j.issn.1007-6336.2011.01.014] |
| [24] |
Wong W H, Cheung S G. Feeding behaviour of the green mussel, Perna viridis (L[J]. Journal of Experimental Marine Biology and Ecology, 1999, 236(2): 191-207. DOI:10.1016/S0022-0981(98)00207-X |
| [25] |
Chi S, Zeng Y, Zhao Z J, et al. Variation of water quality in culture ponds for Apostichopus japonicas[J]. Journal of Uni versity of Jinan: Science and Technology, 2013, 27(3): 239-244. |
| [26] |
Hong M L, Chen L Q, Gu S Z, et al. Effects of ammonia exposure on immunity indicators of haemolymph and histological structure of hepatopancreas in Chinese mitten crab (Eriocheir sinensis)[J]. Journal of Fishery Sciences of China, 2007, 14(3): 412-418. [洪美玲, 陈立侨, 顾顺樟, 等. 氨氮胁迫对中华绒螯蟹免疫指标及肝胰腺组织结构的影响[J]. 中国水产科学, 2007, 14(3): 412-418. DOI:10.3321/j.issn:1005-8737.2007.03.010] |
| [27] |
Li B, Fan Q X, Yang K, et al. Effects of chronic ammonia stress on foraging, growth, and haematological parameters of yellow catfish (Pelteobagrus fulvidraco) juveniles[J]. Chin ese Journal Applied Environment Biology, 2011, 17(6): 824-829. [李波, 樊启学, 杨凯, 等. 慢性氨氮胁迫对黄颡鱼摄食、生长及血液指标的影响[J]. 应用与环境生物学报, 2011, 17(6): 824-829.] |
| [28] |
Lu G Y, Liu G X, Li J J, et al. Effect of ammonia nitrogen on function of antioxidant system in Procambarus clarkii[J]. Acta Agriculturae Jiangxi, 2014, 26(2): 129-133. [芦光宇, 刘国兴, 李佳佳, 等. 氨氮对克氏原螯虾抗氧化功能的影响[J]. 江西农业学报, 2014, 26(2): 129-133. DOI:10.3969/j.issn.1001-8581.2014.02.034] |
| [29] |
Xiao W, Li D Y, Xu Y, et al. Effects of chronic external ammonia stress on growth, immunity and metabolism of juvenile GIFT tilapia (Oreochromis niloticus)[J]. South China Fisheries Science, 2015, 11(4): 81-87. [肖炜, 李大宇, 徐杨, 等. 慢性氨氮胁迫对吉富罗非鱼幼鱼生长、免疫及代谢的影响[J]. 南方水产科学, 2015, 11(4): 81-87. DOI:10.3969/j.issn.2095-0780.2015.04.012] |
| [30] |
Huang H J, Jiang M, Li L, et al. Effects of ration level and ammonia exposure on food digestion and growth of juvenile mullet Liza haematocheil[J]. Asian Journal of Ecotoxicology, 2013, 8(4): 521-528. [黄厚见, 蒋玫, 李磊, 等. 摄食水平和氨氮对  鱼幼鱼食物消化及生长的影响[J]. 生态毒理学报, 2013, 8(4): 521-528.] 鱼幼鱼食物消化及生长的影响[J]. 生态毒理学报, 2013, 8(4): 521-528.] |
| [31] |
Garling D L Jr, Wilson R P. Optimum dietary protein to energy ratio for channel catfish fingerlings, Ictalurus punctatus[J]. Nutrition, 1976, 106(9): 1368-1375. DOI:10.1093/jn/106.9.1368 |
| [32] |
Natalia Y, Hashim R, Ali A, et al. Characterization of digestive enzymes in a carnivorous ornamental fish, the Asian bony tongue Scleropages formosus (Osteogloss idae)[J]. Aquaculture, 2004, 223(1-4): 305-320. |
| [33] |
Hidalgo M C, Urea E, Sanz A. Comparative study of digestive enzymes in fish with different nutritional habits[J]. Aquaculture, 1999, 170(3): 267-283. |
| [34] |
Dong X L. Ecological and physiological effects on low salt stress in sea cucumber (Apostichopus japonicas)[D]. Qingdao: Ocean University of China, 2013: 23-25. [董晓亮.低盐胁迫对刺参(Apostichopus japonicus)生理生态学影响的研究[D].青岛: 中国海洋大学, 2013: 23-25.] http://cdmd.cnki.com.cn/Article/CDMD-10423-1013368957.htm
|
| [35] |
Wang J Q, Tang L, Xu C, et al. Histological observation of alimentary tract and annual changes of four digestive enzymes in sea cucumber (Apostichopus japonicus)[J]. Fisheries Science, 2007, 26(9): 481-484. [王吉桥, 唐黎, 许重, 等. 仿刺参消化道的组织学及其4种消化酶活力的周年变化[J]. 水产科学, 2007, 26(9): 481-484. DOI:10.3969/j.issn.1003-1111.2007.09.001] |
| [36] |
Tang L, Wang J Q, Xu C, et al. Activities of four digestive enzymes in various developmental larvae and in alimentary canals at various sizes of Apostichopus japonicas[J]. Fisheries Science, 2007, 26(5): 275-277. [唐黎, 王吉桥, 许重, 等. 不同发育期的幼体和不同规格刺参消化道中四种消化酶的活性[J]. 水产科学, 2007, 26(5): 275-277. DOI:10.3969/j.issn.1003-1111.2007.05.007] |
| [37] |
Fu X Y. Study of proteases from digestive tract of sea cucumber (Stichopus japonicus)[D]. Qingdao: Ocean University of China, 2004: 15-29. [付雪艳.海参(Stichopus japonicus)消化蛋白酶的初步研究[D].青岛: 中国海洋大学, 2004: 15-29.] http://cdmd.cnki.com.cn/article/cdmd-10423-2004131646.htm
|
| [38] |
Hassett R P, Landry M R. Seasonal changes in feeding rate, digestive enzyme activity and assimilation efficiency of Calanus pacificus[J]. Marine Ecology Progress Series, 1990, 62: 203-210. DOI:10.3354/meps062203 |
| [39] |
Stebbing A R D. Hormes is the stimulation of growth by low levels of inhibitors[J]. The Science of The Total Environment, 1982, 22(3): 213-234. DOI:10.1016/0048-9697(82)90066-3 |
| [40] |
Sun S S, Zhang Y. Effects of salinity on enzymes activities in digestive tract of Apostichopus japonicas[J]. China Feed, 2009(24): 28-31. [孙双双, 张云. 盐度对刺参消化酶活力的影响[J]. 中国饲料, 2009(24): 28-31. DOI:10.3969/j.issn.1004-3314.2009.24.011] |
| [41] |
Chen P J, Wang C G, Zheng S L. Effects of salinity on digestive enzyme activity of Pagrosomus major young fish[J]. Journal of Xiamen University: Natural Science, 1998, 37(5): 134-136. [陈品健, 王重刚, 郑森林. 盐度影响真鲷幼鱼消化酶活力的研究[J]. 厦门大学学报:自然科学版, 1998, 37(5): 134-136.] |
| [42] |
Liu H Z, Zheng F R, Sun X Q, et al. Effect of exposure to ammonia nitrogen stress on immune enzyme of holothurian Apostichopus japonicas[J]. Marine Sciences, 2012, 36(8): 47-52. [刘洪展, 郑风荣, 孙修勤, 等. 氨氮胁迫对刺参几种免疫酶活性的影响[J]. 海洋科学, 2012, 36(8): 47-52.] |
| [43] |
Zheng L, Zhang J, Yan Z G, et al. Development of seawater aquatic life criteria for ammonia in China[J]. Acta Ocean ologica Sinica, 2016, 38(4): 109-119. [郑磊, 张娟, 闫振广, 等. 我国氨氮海水质量基准的探讨[J]. 海洋学报, 2016, 38(4): 109-119. DOI:10.3969/j.issn.0253-4193.2016.04.010] |
 2018, Vol. 25
2018, Vol. 25

