2. 上海海洋大学 水产与生命学院, 上海 201306
2. College of Fishery and Life Science, Shanghai Ocean University, Shanghai 201306, China
传染性造血器官坏死病毒(Infectious Hematopoietic Necrosis Virus, IHNV)隶属于弹状病毒科(Rhabdoviridae)诺拉外弹状病毒属(Novirhabdovirus), 是传染性造血器官坏死病(Infectious Hematopoietic Necrosis, IHN)的病原体。IHN是严重危害鲑鳟类的病毒性疾病, 可造成鱼苗或幼鱼70%~ 90%的死亡率, 在某些病例中甚至接近100%, 对世界鲑鳟鱼类养殖业造成了巨大的经济损失[1]。世界动物卫生组织(Office International Des Epizooties, OIE)将其列为必须申报的动物疫病, 在中国为二类疫病[2-3]。目前国内外学者针对IHNV已经开展了疫苗的研发、免疫佐剂及病毒复制干扰物的筛选等大量研究[4-6]。研究过程中发现核酸疫苗在诱导鱼类的体液免疫和细胞免疫反应方面非常有效[7], 并且核酸疫苗在保护鱼类免受某些病毒性疾病攻击上取得了很好的成效[8-9]。
核酸疫苗是由含保护性抗原基因的质粒构成, 其在导入机体后被宿主细胞摄取、表达、加工并提呈给免疫系统诱导特异性体液免疫和细胞免疫[10]。Leong等[11]用致死剂量的IHNV攻击虹鳟, 免疫核酸疫苗的虹鳟存活率达到100%, 而对照组的存活率仅为10%~15%。尽管国外已经证明了IHN核酸疫苗的高效性, 并且针对IHN核酸疫苗也开展了大量的研究工作, 但目前仍未见关于核酸疫苗载体中的抗性基因是否会对免疫虹鳟及环境微生物造成影响的研究报道, 而从核酸疫苗自身的安全性考虑, 这是很有必要的。IHNV表面糖蛋白具有良好的免疫原性和免疫反应性[12]。因此, 本研究在巨细胞病毒(cytomegolovirus, CMV)启动子控制下用中国IHNV-XJ-13病毒株的G基因构建了IHN核酸疫苗, 命名为pIHNxj-G。在系统验证所构建的IHN核酸疫苗有效性的基础上, 通过对免疫虹鳟肠道内容物、粪便和水环境中的氨苄青霉素抗性菌总类及数量的定点监测来分析疫苗载体中的氨苄青霉素抗性基因能否对虹鳟体内和体外环境中细菌的抗性产生影响。本研究为IHN核酸疫苗的安全评价提供了基础数据。
1 材料和方法 1.1 菌株、载体及细胞IHNV分离株XJ-13[13]由本实验室分离保存; 真核表达载体pcDNA3.1(+)购自Invitrogen公司; Fathead minnow上皮瘤细胞(epithelioma papulosum cyprinid, EPC)由中国水产科学研究院长江水产研究所鱼类病害研究室曾令兵教授惠赠。
1.2 主要试剂SV Total RNA Isolation System购自Promega; One Step SYBR® PrimeScript RT-PCR Kit II(Perfect Real Time)试剂盒、PrimeScript™ One Step RT-PCR Kit Ver2.0试剂盒、DNA Marker、pMD19- T simple载体、限制性内切酶购自大连宝生物公司; 质粒大量提取试剂盒购自Tiangen生物公司; MEM细胞培养基、胰酶购自Hyclone公司; 胎牛血清购自Gibco。
1.3 引物设计与合成利用Premier5.0软件设计扩增IHNV-XJ-13分离株的G基因序列的引物序列, F: 5'-GGATCCATG GACGCCATGATCACCACTCCGC-3'; R: 5'-CTCGAGTTAGGACCTGTTTGCCAGGTGATAC-3'。用于菌种鉴定的是16S rDNA通用引物其序列; 16sF: 5'-AGAGTTTGATCMTGGCTCAG-3'; 16sR: 5'-GRTACC TTGTTACGACTT-3', 所有引物均由哈尔滨博仕生物公司合成。
1.4 IHNV病毒增殖取保存于‒80℃冰箱的IHNV-XJ-13分离株培养悬液, 按照MOI为0.01的比例接种EPC单层细胞上, 于15℃下孵育1 h, 弃去含有病毒的细胞液, 加入5 mL细胞维持液(含有2%胎牛血清的MEM培养液)于细胞培养瓶内, 于15℃培养。当70%以上细胞出现细胞病变(cytopathic effect, CPE), 收集细胞培养液(即病毒悬液), 分装保存于-80℃冰箱备用。
1.5 RNA的提取以及目的片段扩增将保存于-80℃冰箱的病变细胞冻融2~3次, 吸取病毒悬液0.125 mL, 12000 g离心5 min, 弃去细胞碎片等沉淀, 利用SV Total RNA Isolation system试剂盒提取上清液中的病毒RNA。
提取IHNV-XJ-13基因组RNA, 利用RT-PCR一步反应试剂盒以F/R为引物扩增扩增G基因, 大小为1700 bp; 同时将从无病变的EPC细胞提取的RNA设为阴性对照组, PCR扩增反应体系: 2×One Step buffer 25 μL, enzyme mix 2 μL, F/R引物(10 pmol/μL)各1 μL, RNA 10 μL, 用无菌水补充至50 μL。PCR扩增程序: 50℃ 30 min, 94℃预变性5 min, 94℃变性1 min, 53℃退火1 min, 72℃延伸50 s, 25个循环, 72℃终延伸10 min。PCR产物进行1%琼脂糖凝胶电泳分析, 对目的条带进行胶回收, 然后将回收产物送上海生工生物公司进行测序。
1.6 重组质粒pIHNxj-G的构建及制备将1.5步骤的胶回收产物, 利用BamH Ⅰ和Xho Ⅰ对回收产物进行双酶切, 胶回收后与BamH Ⅰ/Xho Ⅰ双酶切的pcDNA3.1(+)载体在室温连接30 min, 然后转化E.coli DH5α, 37℃培养于含氨苄青霉素(100 μg/mL)的LB平板, 16 h后, 挑取单菌落于20 mL的液体LB培养基中扩大培养, 14 h后提取质粒, 用BamH Ⅰ/Xho Ⅰ双酶切鉴定, 将结果为阳性的单菌落委托上海生工生物工程技术服务有限公司测序。对已经确定的阳性菌在500 mL的液体LB培养基扩大培养。把扩大培养的菌液利用Tiangen质粒大量提取试剂盒提取质粒, 制备核酸疫苗pIHNxj-G。保证质粒的浓度在1000 ng/μL以上。
1.7 虹鳟的免疫及攻毒试验将虹鳟(5±0.5) g随机分2组, 每组200尾, 暂养于水温15℃的循环水池(60 cm×60 cm×50 cm)中, 7 d后从虹鳟背鳍基部进行肌肉注射, 试验前禁食2 d。实验组注射的核酸疫苗免疫剂量为2 μg/尾(50 μL/尾磷酸盐溶液), 同时设空白对照pcDNA3.1免疫组。注射后将各组虹鳟重新置于循环水池内暂养。
在免疫后的第4天和第30天分别进行攻毒试验, 试验前禁食2 d。利用磷酸盐缓冲液(phosphate buffered saline, PBS)以100 TCID50剂量的IHNV强毒株XJ-13, 采用腹腔注射的方式对免疫虹鳟(n= 50)进行攻毒。注射后将各组虹鳟重新置于循环水池内暂养, 连续观察21 d, 记录各组虹鳟发病及死亡情况。根据公式计算疫苗免疫保护率(relative percent survival, RPS): RPS=[1-(免疫组死亡率/对照组死亡率)]×100。
1.8 Mx-1基因检测及中和抗体效价测定于免疫后第4天和第7天采集虹鳟(n=5)头肾和接种部位肌肉组织, 利用RNA提取试剂盒提取组织RNA。然后利用One Step SYBR® PrimeScript RT-PCR Kit Ⅱ(Perfect Real Time)试剂盒, 以β- actin为内参基因, 对Mx-1基因实时荧光定量PCR检测, 以注射pcDNA3.1的虹鳟为对照, 所用Real- time PCR仪器为ABI7500。数据分析采用比较CT法(ΔΔCT)。相对表达量=2-ΔΔCT=2-(ΔCT处理-ΔCT对照)= 2-[(CT处理-CT内参)-(CT对照-CT内参)], 数据取3次重复的平均值。
于免疫后第4天和第30天采取尾缘静脉取血的方式各分别收集10尾虹鳟的血液, 置于4℃冰箱过夜, 800 g室温离心10 min, 收集血清。参照LaPatra等[14]的方法, 将EPC接种到96孔细胞培养板上长成单层细胞, 然后将倍比稀释的血清与病毒悬液于15℃提前孵育1 h。按照100 TCID50浓度每孔分别接种100 μL血清抗体混合液, 15℃细胞培养箱中孵育1 h, 吸去孵育液, 加入新鲜的细胞维持液。置于15℃二氧化碳细胞培养箱中恒温培养, 连续观察10 d, 记录出现CPE的孔数。以只接病毒组为参照, 使细胞病变孔数减少一半的血清稀释度即为抗体效价[14]。
1.9 核酸疫苗抗性基因环境释放的监测分别在免疫后的第1、3、5、7、14、21、35、49、65天的时间点, 采集循环水池里的虹鳟粪便、水以及5尾虹鳟的肠内容物。将湿重0.1 g的粪便在无菌500 μL PBS中进行充分搅拌, 并在4℃放置30 min, 利用尼龙布过滤掉残渣。吸取过滤液涂布含有氨苄青霉素的LB平板, 2个重复, 分别在37℃和18℃下倒置培养过夜。挑取平板上的所有单菌落, 并在含有氨苄青霉素的LB液体培养基中培养过夜。阳性菌液利用通用引物16S rDNA进行PCR扩增, 将PCR产物送至生物公司进行序列测定。采集的肠内容物做相同处理。而来自每个时间点的水样品直接涂布含有氨苄青霉素的LB平板, 其他步骤与上述相同。设置来自注射PBS的虹鳟的样本为对照组。将测序所得序列输入到NCBI进行Blast检索, 对所分离的细菌种类进行初步分析, 然后对实验组和对照组的不同来源的抗性菌数量进行统计学分析。
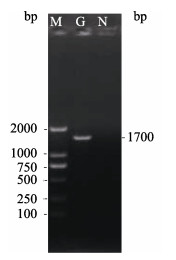
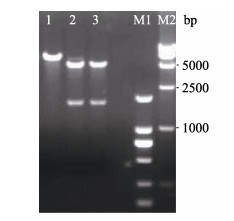
2 结果与分析 2.1 G基因的扩增与重组质粒pIHNxj-G的构建以提取的IHNV-XJ-13病毒悬液RNA为模板, 利用RT-PCR一步反应试剂盒扩增IHNV-XJ-13分离株的G基因, 然后进行琼脂糖凝胶电泳分析, 在1700 bp的位置出现特异性条带(图 1), 序列分析结果显示该基因序列与目的基因序列相同, 说明已获得G基因。将该G基因片段与商业化载体pcDNA3.1(+)连接, 转化大肠杆菌DH5α, 随机挑取单菌落扩大培养, 提取质粒, 利用酶切方法进行鉴定, 鉴定结果与预期相符(图 2)。该结果表明已成功获得重组质粒pIHNxj-G。
|
图 1 G基因PCR扩增产物的凝胶电泳分析 G:阳性样本PCR产物; N:阴性对照; M: DL2000 DNA marker. Fig.1 Gel electrophoresis of PCR product of the G gene G: G gene PCR products; N: negative control; M: DL2000 DNA marker. |
|
图 2 pIHNxj-G酶切产物的凝胶电泳分析 1: pIHNxj-G质粒; 2, 3: pIHNxj-G酶切产物; M1: DL2000 DNA marker; M2: DL15000 DNA marker. Fig.2 Gel electrophoresis of digestion products of the pIHNxj-G 1: pIHNxj-G plasmid; 2, 3: pIHNxj-G digestion product; M1: DL2000 DNA marker; M2: DL15000 DNA marker. |
利用Tiangen质粒大量提取试剂盒制备核酸疫苗pIHNxj-G。并以2 μg/尾的剂量采用背鳍基部肌肉注射的方式对虹鳟进行免疫, 于免疫后第4天和第30天进行攻毒试验。结果显示, 免疫组虹鳟的存活率均为90%以上, 而PBS对照组虹鳟存活率仅为6%~8%。利用公式可计算出该疫苗在免疫后4 d和30 d可提供93.5%和91.5%的相对保护率。上述结果表明核酸疫苗pIHNxj-G对虹鳟具有良好的保护效果, 能够抵抗IHNV对虹鳟的进攻。具体结果如表 1所示。
|
|
表 1 核酸疫苗pIHNxj-G保护效力分析 Tab.1 Protection efficacy analysis of the DNA vaccine pIHNxj-G |
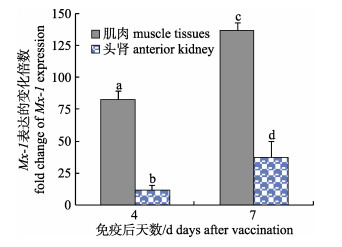
对免疫后第4天和第7天的头肾及接种部位肌肉组织RNA中Mx-1基因的定量分析结果显示, 与pcDNA3.1(+)对照组相比, 在免疫后第4天, Mx-1基因在接种部位肌肉组织中表达量平均上调了82.8倍, 在头肾组织中平均上调了12.2倍; 在免疫后第7天, 上述两种组织中的Mx-1基因表达量分别上调了139倍和32倍。统计分析结果显示, 各组数据间均存在显著差异(图 3, P < 0.05)。
|
图 3 免疫虹鳟Mx-1基因水平的实时定量分析 不同字母表示不同组织间数据差异极显著(P < 0.01). Fig.3 Real time analyses of Mx-1 gene expression level in immunized rainbow trout Values with different letters indicated extremely significant differences (P < 0.01). |
利用EPC细胞检测免疫后第4天和30天的虹鳟血清中和抗体的效价, 结果如表 2所示, 在免疫后第4天, 所有血清中均不存在中和抗体(效价均 < 20);在免疫后第30天, 只有两尾鱼的血清中不存在中和抗体, 而剩余的8尾鱼血清中均存有效价不同的中和抗体, 其中最高效价高达160。该结果说明核酸疫苗pIHNxj-G能够刺激虹鳟特异性免疫反应, 而使免疫虹鳟产生中和IHNV的抗体。
|
|
表 2 免疫虹鳟血清中和抗体效价 Tab.2 Neutralizing antibody titers of serum from immunized rainbow trout |
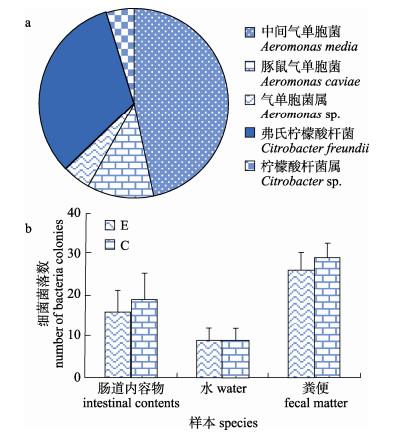
共分离得到105株氨苄青霉素抗性菌。用16S rDNA通用引物PCR扩增获得抗性菌株的16S rDNA基因片段, 把所有的PCR阳性产物进行测序, 将测序所得序列输入到NCBI进行Blast检索。所分离的抗性菌主要有以下几种:中间气单胞菌(Aeromonas media)、豚鼠气单胞菌(A. caviae)、气单胞菌属(Aeromonas sp.)、弗氏柠檬酸杆菌(Citrobacter freundii)和柠檬酸杆菌属(Citrobacter sp.)。中间气单胞菌占47%, 弗氏柠檬酸杆菌占了32%, 豚鼠气单胞菌占了11%, 还有10%的菌只能确定到气单胞菌属和柠檬酸杆菌属, 具体分布见图 4a。上述菌是从免疫后的虹鳟的粪便、肠道内容物和环境水中分离而来的, 对照组为从注射PBS后的虹鳟的粪便、肠道内容物和环境水中分离出来的细菌。统计分析发现, 实验组和对照组虹鳟养殖水体、粪便和肠道内容物的氨苄青霉素抗性菌的数量没有发生统计学意义上的改变(P > 0.05, 图 4b), 且各组氨苄青霉素抗性分离菌的种类也保持一致, 具体结果如图 5~7所示。
|
图 4 从虹鳟养殖环境中分离的氨苄青霉素抗性的细菌 E:实验组; C:对照组. Fig.4 The isolated ampicillin resistant bacteria from the environment of rainbow trout culture E: experiment group; C: control group. |
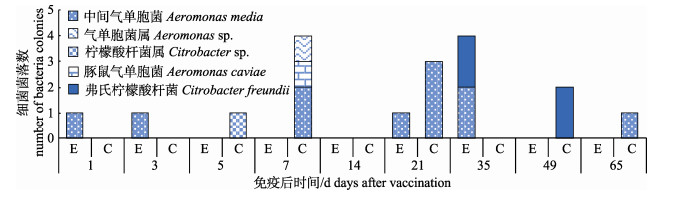
|
图 5 来自养殖环境水中的氨苄青霉素抗性细菌 E:实验组; C:对照组. Fig.5 Ampicillin resistant bacteria from water E: experiment group; C: control group. |
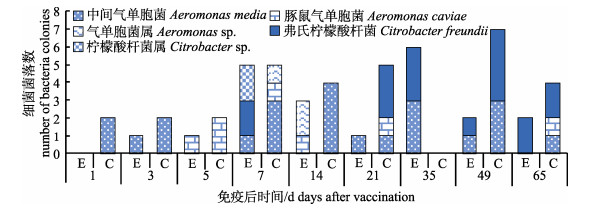
|
图 6 来自粪便的氨苄青霉素抗性细菌 E:实验组; C:对照组. Fig.6 Ampicillin resistant bacteria from feces E: experiment group; C: control group. |
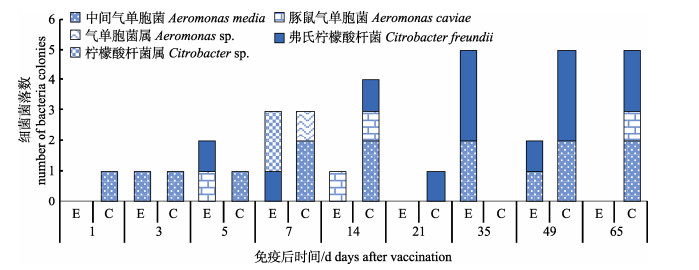
|
图 7 来自肠道内容物的氨苄青霉素抗性细菌 E:实验组; C:对照组. Fig.7 Ampicillin resistant bacteria from gut contents E: experiment group; C: control group. |
核酸疫苗接种后抗原蛋白质在宿主细胞内表达, 直接与组织相容性复合物MHCI或Ⅱ类分子结合, 免疫反应刺激机体产生比较广泛的细胞免疫和体液免疫, 对疾病的防治更加有效[15], 并且前期研究结果显示, 纳克免疫剂量的IHN核酸疫苗即能对虹鳟幼鱼提供高达80%~100%的相对保护率[16]。本研究利用IHNV-XJ-13分离株的主要保护性抗原G基因连接载体pcDNA3.1(+), 成功获得IHN核酸疫苗pIHNxj-G, 通过背鳍基部肌肉注射免疫虹鳟, 2 μg/尾剂量的该疫苗对(5±0.5) g虹鳟的相对保护率不管是在免疫后第4天还是第30天均能达到90%以上。LaPatra等[17]研究也发现了IHN核酸疫苗在免疫后第4天虹鳟即能对免疫虹鳟产生有效的保护, 但此时免疫虹鳟血清中并不存在IHNV中和抗体。干扰素信号通路的关键蛋白因子Mx-1已成为评价核酸疫苗刺激鱼类非特异性免疫的一个指标[18-19], 本研究发现第4天时, 头肾和接种部位肌肉中Mx-1基因均显著上调表达, 这一结果为IHN核酸疫苗的早期非特异性免疫保护提供了合理的解释。免疫后第30天的中和抗体效价分析结果显示大多数免疫虹鳟血清中均存在中和抗体, 其中最高效价高达160, 此时攻毒试验结果显示该核酸疫苗的相对保护率高于90%, 该结果说明该核酸疫苗在免疫后第30天即可提供特异性免疫保护。综上所述, 该核酸疫苗不但能够刺激鱼体产生非特异性免疫反应而提供早期保护, 而且能够刺激鱼体产生特异性免疫反应而提供长期特异性保护。
核酸疫苗作为一种新型疫苗, 它的安全性是一个非常值得重视的问题, 例如核酸疫苗所携带的抗性基因是否能够发生基因漂移而使环境中的其他细菌获得抗性。本研究分离所得的抗性菌主要为中间气单胞菌和弗氏柠檬酸杆菌, 并没有分离到包括大肠杆菌在内的转基因环境释放试验的指示菌。气单胞菌在自然界分布广泛, 普遍存在于淡水、污水、淤泥、土壤和人类粪便中[20]。柠檬酸杆菌属于肠杆科菌, 是动物和人肠道内的正常菌群, 普遍分布在自然环境中[21]。而这些菌均为天然抗氨苄青霉素菌[22-23], 因此不是核酸疫苗载体的抗性基因漂移所致。本研究发现, 实验组和对照组的虹鳟养殖水中、粪便和肠道内容物的氨苄青霉素抗性菌的种类和数量没有发生统计学意义上的变化, 说明该核酸疫苗的抗性基因并未对环境中的抗性菌数量和种类产生影响, 因此可以初步判断核酸疫苗的氨苄青霉素抗性基因不会产生基因漂移, 不会使体内及体外环境中其他微生物获得抗性。目前, 加拿大已经有商品化的IHN核酸疫苗(Apex-IHN), 尽管在已有的文献报道中并没有关于疫苗载体抗性基因对环境微生物抗性影响的研究, 但是Apex-IHN的成功上市进一步证明了核酸疫苗的安全特性。
综上所述, 本研究不但提供了一株高效的IHN核酸疫苗, 而且初步证明了该核酸疫苗的抗性基因对免疫虹鳟的体内及体外微生物都是安全的。本研究为IHN核酸疫苗的安全评价提供了基础数据。
| [1] |
Meng Z N, Liu M. Epidemiology of contagious IHNV and research progress of its detection technique[J]. Scientific Fish Farming, 2010(11): 50-52. [孟兆娜, 刘敏. 传染性造血组织坏死病病毒(IHNV)的流行病学及检测技术研究进展[J]. 科学养鱼, 2010(11): 50-52.] |
| [2] |
LaPatra S E. The use of serological techniques for virus surveillance and certification of finfish[J]. Annual Review of Fish Diseases, 1996, 6: 15-28. DOI:10.1016/S0959-8030(96)90003-4 |
| [3] |
Wolf K. Fish Viruses and Fish Viral Diseases[M]. Ithaca: Cornell University Press, 1988.
|
| [4] |
Alonso M, Chiou P P, Leong J A. Development of a suicidal DNA vaccine for infectious hematopoietic necrosis virus (IHNV)[J]. Fish & Shellfish Immunology, 2011, 30(3): 815-823. |
| [5] |
Chiou P P, Lin C M, Perez L, et al. Effect of cecropin B and a synthetic analogue on propagation of fish viruses in vitro[J]. Marine Biotechnology, 2002, 4(3): 294-302. DOI:10.1007/s10126-002-0021-1 |
| [6] |
Anderson E, Clouthier S, Shewmaker W, et al. Inactivated infectious haematopoietic necrosis virus (IHNV) vaccines[J]. Journal of Fish Diseases, 2008, 31(10): 729-745. DOI:10.1111/jfd.2008.31.issue-10 |
| [7] |
Boudinot P, Blanco M, Kinkelin P D, et al. Combined DNA immunization with the glycoprotein gene of viral hemorrhagic septicemia virus and infectious hematopoietic necrosis virus induces double-specific protective immunity and nonspecific response in rainbow trout[J]. Virology, 1998, 249(2): 297-306. |
| [8] |
Evensen Ø, Leong J A. DNA vaccines against viral diseases of farmed fish[J]. Fish & Shellfish Immunology, 2013, 35(6): 1751-1758. |
| [9] |
Hølvold L B, Myhr A I, Dalmo R A. Strategies and hurdles using DNA vaccines to fish[J]. Veterinary Research, 2014, 45(1): 21. DOI:10.1186/1297-9716-45-21 |
| [10] |
Donnelly J J, Ulmer J B, Shiver J W, et al. DNA vaccines[J]. Immunology, 1997, 15(15): 771-774. |
| [11] |
Leong J C, Johnson M, Jordan D, et al. Genetic vaccination of rain bow trout[C]. 8th International Symposium of Society of Chinese Bioscientists In America, HongKong, 1999.
|
| [12] |
徐黎明, 刘红柏, 尹家胜, 等. 传染性造血器官坏死病毒糖蛋白原核表达及免疫原性分析[J]. 病毒学报, 2013, 29(5): 529-534. |
| [13] |
Zhao Y H, Xu L M, Liu M, et al. Isolation and identification of an infectious hematopoietic necrosis virus from Xinjiang Uygur Autonomous Region[J]. Chinese Journal of Fisheries, 2016, 29(1): 12-16. [赵羽涵, 徐黎明, 刘淼, 等. 传染性造血器官坏死病毒新疆株的分离与鉴定[J]. 水产学杂志, 2016, 29(1): 12-16. DOI:10.3969/j.issn.1005-3832.2016.01.003] |
| [14] |
LaPatra S E, Turner T, Lauda K A, et al. Characterization of the humoral response of rainbow trout to infectious hematopoietic necrosis virus[J]. Journal of Aquatic Animal Health, 1993, 5(3): 165-171. DOI:10.1577/1548-8667(1993)005<0165:COTHRO>2.3.CO;2 |
| [15] |
Zhang J X, Zheng F R, Qu L Y, et al. Study on safety of DNA vaccine to lymphocystis disease in flounder[J]. Scientific Fish Farming, 2010(9): 55-57. [张进兴, 郑风荣, 曲凌云, 等. 牙鲆淋巴囊肿病DNA疫苗的安全性研究[J]. 科学养鱼, 2010(9): 55-57.] |
| [16] |
Corbeil S, Lapatra S E, Anderson E D, et al. Evaluation of the protective immunogenicity of the N, P, M, NV and G proteins of infectious hematopoietic necrosis virus in rainbow trout oncorhynchus mykiss using DNA vaccines[J]. Diseases of Aquatic Organisms, 1999, 39(1): 29-36. |
| [17] |
LaPatra S E, Corbeil S, Jones G R, et al. Protection of rainbow trout against infectious hematopoietic necrosis virus four days after specific or semi-specific DNA vaccination[J]. Vaccine, 2001, 19(28-29): 4011-4019. DOI:10.1016/S0264-410X(01)00113-X |
| [18] |
Schneider-Schaulies S, Schneider-Schaulies J, Schuster A, et al. Cell type-specific MxA-mediated inhibition of measles virus transcription in human brain cells[J]. Journal of Virology, 1994, 68(11): 6910-6917. |
| [19] |
Pavlovic J, Zürcher T, Haller O, et al. Resistance to influenza virus and vesicular stomatitis virus conferred by expression of human MxA protein[J]. Journal of Virology, 1990, 64(7): 3370-3375. |
| [20] |
Li H. Research progress of aeromonas and its infection[J]. Journal of North China Coal Medical University, 2008, 10(6): 769-771. [李皇. 气单胞菌及其感染研究进展[J]. 河北联合大学学报:医学版, 2008, 10(6): 769-771.] |
| [21] |
Zhou J L. RFLP typing of citrobacter O antigen gene cluster and the interpretation of five O-serogroups[D]. Tianjin: Nankai University, 2011. [周加利.柠檬酸杆菌O抗原基因簇RFLP分型及5个O血清型基因簇的破译[D].天津: 南开大学, 2011.] http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_Y2002810
|
| [22] |
Qu F, Cui E B, Bao C M, et al. Resistant genes of aeromonas[J]. Chinese Journal of Nosocomiology, 2005, 15(3): 249-252. [曲芬, 崔恩博, 鲍春梅, 等. 气单胞菌的耐药基因研究[J]. 中华医院感染学杂志, 2005, 15(3): 249-252. DOI:10.3321/j.issn:1005-4529.2005.03.003] |
| [23] |
Zhu M, Xu Y H. Study on antibiotic resistance from Citrobacter freundii[J]. International Journal of Laboratory Medicine, 2006, 27(12): 1136-1138. [朱梅, 徐元宏. 枸橼酸杆菌耐药机制的研究[J]. 国际检验医学杂志, 2006, 27(12): 1136-1138. DOI:10.3969/j.issn.1673-4130.2006.12.033] |
 2018, Vol. 25
2018, Vol. 25

