2. 厦门大学 海洋生物多样性与全球变化研究中心, 厦门大学 海洋与地球学院, 福建 厦门 361102;
3. 厦门大学 海洋生物制备技术国家地方联合工程实验室, 厦门大学 海洋与地球学院, 福建 厦门 361102
2. Marine Biodiversity and Global Change Research Center, College of Ocean and Earth Sciences, Xiamen University, Xiamen 361102, China;
3. State-Province Joint Engineering Laboratory of Marine Bioproducts and Technology, College of Ocean and Earth Sciences, Xiamen University, Xiamen 361102, China
石斑鱼(Epinephelidae)是一类具有重要商业价值的鱼类, 广布于三大洋的热带与亚热带海域。石斑鱼类营养丰富, 肉质细嫩洁白, 类似鸡肉, 因而有“海鸡肉”之称, 是热带亚热带近岸岩滩和珊瑚礁渔业资源的重要代表。由于色彩鲜艳, 体态优雅, 部分石斑鱼如驼背鲈(Chromileptes altivelis)、黄鳍石斑(Epinephelus flavocaeruleus)等还是水族馆常见的观赏鱼类。基于生态学角度, 石斑鱼类是珊瑚礁生态系食物链的顶级捕食者之一, 是稳定珊瑚礁生态系统重要的生态类群。遗憾的是, 由于人们对石斑鱼渔业资源及其环境的过度开发利用, 特别是石斑鱼养殖业兴起加剧对野生资源的索取利用, 石斑鱼类许多物种正面临濒危甚至灭绝的趋势。目前国内外对于石斑鱼资源与环境的保护管理尚未给予足够关注。本文主要综述当前石斑鱼类生物生态学特性、系统分类、资源现状、人工养殖育种制种等的最新研究概况, 期望为石斑鱼资源的合理利用、养护及其养殖产业的可持续发展提供有益参考。
1 石斑鱼类生物学 1.1 形态特征石斑鱼隶属鲈形目(Perciformes)、鲈亚目(Percoidei)、石斑鱼科(Epinephelidae), 其形态特征可归结为:体一般呈椭圆或长椭圆形, 侧扁; 头长大于体高; 背鳍鳍棘部强大, 与鳍条部相连, 背鳍鳍棘7~11根, 鳍条10~21根; 臀鳍鳍棘3根, 一般第2根最为强大, 臀鳍鳍条数7~13根; 胸鳍宽大, 位低, 一般呈圆形; 腹鳍位于胸鳍下方; 口大, 两颌齿内行齿倾倒; 体被小栉鳞; 侧线达尾鳍基部; 尾鳍圆形、截形或凹型[1]。不同种类的石斑鱼体型差异较大, 30%以上的石斑鱼种类体长可达1 m以上, 超大体型者可超过2 m, 如鞍带石斑鱼(E. lanceolatus)、伊氏石斑鱼(E. itajara)、东太平洋石斑鱼(E. quinquefasciatus)等, 而体型小者甚至小于20 cm, 如红鳍九棘鲈(Cephalopholis aitha)、短身石斑鱼(E. trophis)、多斑九棘鲈(C. polyspila)等。石斑鱼属(Epinephelus)作为石斑鱼科中种类最多的属, 其体型大小变化较大, 从小型到大型均有分布; 而另一种类数较多的九棘鲈属(Cephalopholis)除了红九棘鲈(C. sonnerati)外都是体长小于50 cm的小型石斑鱼。此外, 石斑鱼类的仔稚鱼发育过程中存在背鳍鳍棘和腹鳍鳍棘显著延长及收缩的现象, 这是石斑鱼类发育过程中较为独特的一个特征[2]。
1.2 生活习性石斑鱼为底栖性鱼类, 其成鱼主要栖息于珊瑚礁及近岸岩礁区域, 也有部分栖息于底质为沙质、泥质或淤泥质的海域, 如青铜石斑鱼(E. aeneus)、褐石斑鱼(E. bruneus)及宝石石斑鱼(E. areolatus)等, 其幼鱼则偏爱选择海草床、红树林等生境。石斑鱼类一般栖息于100 m以浅的水域, 如白线光腭鲈(Anyperodon leucogrammicus)和横带九棘鲈(C. boenak)等, 也有一些种类栖息于100~200 m的水层中, 如橙点九棘鲈(C. aurantia)[1]。大多数石斑鱼为独居性鱼类, 除了在繁殖期集群外一般不成群; 但也有些种类的生活方式为一尾雄鱼和若干尾雌鱼组成的小群体, 如横带九棘鲈和青星九棘鲈(C. miniata)[3-4]。一些研究表明石斑鱼类通常可在特定的礁区定居较长的一段时间, 这种定居习性及较长的生活史等特征使得石斑鱼类易受到过度捕捞的影响。
1.3 摄食特性石斑鱼类是珊瑚礁生态系统的顶级捕食者, 绝大多数为肉食性, 主要以其他鱼类、甲壳类及头足类为食。但也不乏一些滤食性的石斑鱼类, 如副花
大部分石斑鱼类为雌性先熟的雌雄同体鱼类, 即初次性成熟时为雌性, 作为雌性参与繁殖后的一年至数年后, 雌鱼开始性逆转成为雄鱼。然而也存在着少量可由幼鱼直接发育成雄鱼的初级雄性个体(primary males), 其比例随不同物种而异, 如养殖条件下斜带石斑鱼(E. coioides)和驼背鲈仅有1%~3%的初级雄性个体, 而赤点石斑鱼(E. akaara)的初级雄性个体可达15%左右[8-10]。这种差异也可能与生长环境相关, 目前尚未有野生天然初级雄性个体的报道。此外, 在人工养殖的石斑鱼类中也发现了双向性逆转的雌雄同体横带九棘鲈[11]。甚至还有个别种类的石斑鱼为雌雄异体, 如豹纹喙鲈(Mycteroperca rosacea)和拿骚石斑鱼(E. striatus)[12-13]。对于石斑鱼的性逆转机制, 一些研究者认为可能是环境与遗传因素共同作用的结果[14], 并证实了外源性雄性类固醇激素可成功诱导多种石斑鱼的雌鱼发生性逆转[15-17]。
大多石斑鱼类为多批产卵鱼类, 卵巢内同时具有不同时相的卵母细胞, 雌鱼在一个繁殖期内, 卵子分批成熟, 如青石斑鱼(E. awoara)、点带石斑鱼(E. malabaricus)和云纹石斑鱼(E. moara)等[18-20]。一些石斑鱼类有着较为固定的产卵场, 因此需要进行产卵洄游, 部分种类洄游的距离较短, 如大堡礁区的豹纹鳃棘鲈的产卵洄游距离通常为数百米至数千米[21]; 有的种类则需要洄游上百千米往返于产卵场, 如佛罗里达沿岸的拿骚石斑鱼(E. striatus), 产卵场距离定居地距离可达240 km[22]。一些石斑鱼在繁殖期间会配对产卵, 如赤点石斑鱼, 其产卵时间一般为傍晚, 产卵开始时, 雄鱼追逐雌鱼后并游, 通过尾柄激烈颤动完成产卵、排精动作, 这一产卵行为需1~2 min, 随后不久可重复类似行为并持续2 h左右[23-24]。另一些种类如拿骚石斑鱼则具有集群产卵的行为, Smith[25]报道了拿骚石斑鱼在巴哈马附近海域水深29~38 m的岩礁珊瑚礁海域集群产卵的现象, 数量有30000~100000尾之多。石斑鱼类产卵期一般从每年的春末延续至初秋, 主要受水温影响, 因而沿海各地石斑鱼产卵时间随纬度不同而变化。如福建沿海的赤点石斑鱼生殖季节为5—9月, 5—6月为产卵盛期, 香港和台湾则为4—7月[26]。石斑鱼的个体怀卵数因体型而异, 产卵总量在7万~100万粒不等, 大型石斑鱼种类可达1000万粒[27]。
1.5 早期发育石斑鱼受精卵在盐度30以上的海水中呈浮性[28]。石斑鱼类的早期发育过程中具有变态现象, 要经过卵黄囊吸收、背腹鳍鳍棘的延长及收缩、色素的逐渐沉着、从浮游习性转变为底栖生活等过程[29]。石斑鱼类的胚胎发育一般分为卵裂期、囊胚期、原肠胚期、神经胚期、器官形成期, 其胚胎发育时间因物种而异, 如七带石斑鱼(Hyporthodus septemfasciatus)在(20.5±0.5)℃水温下历时38 h 45 min完成胚胎发育[30], 云纹石斑鱼在(22±0.2)℃水温下历时40 h 37 min完成胚胎发育[18], 点带石斑鱼在水温26~28℃的条件下, 受精卵经21~26 h完成胚胎发育[31]等。除此之外, 石斑鱼类的受精率、孵化率、成活率和胚胎发育还与的水温、盐度等外源环境密切相关[32-33], 尤其是存在明显的温度效应, 即在一定温度范围内, 石斑鱼类胚胎发育速度随温度升高而加快[34]。
石斑鱼类的胚后发育, 一般可依据卵黄囊的有无、鳍棘的伸长与收缩、体色的变化及鳞片的出现等特征分为仔鱼期、稚鱼期和幼鱼期[35], 其中仔鱼期包括早期仔鱼和晚期仔鱼。早期仔鱼是仔鱼孵出后到卵黄囊和油球即将完全消失的一段时期, 该阶段营养主要来源于卵黄囊和油球, 卵黄囊的存在为此阶段的主要特征; 晚期仔鱼则为卵黄囊消失至各鳍鳍条基本形成这一阶段。稚鱼期各鳍鳍条基本形成至鳞被逐渐形成, 腹鳍棘和第二背鳍棘收缩, 色素沉着及身体斑纹形成; 幼鱼期则全身覆盖鳞片, 鱼体特有斑纹形成, 此阶段除生殖腺尚未发育成熟外, 幼鱼与成鱼在形态、体色及习性上均相似[18, 35-36]。不同种类石斑鱼早期仔鱼阶段时间因种而异, 如驼背鲈和鞍带石斑鱼为孵化后2 d[35, 37], 斜带石斑鱼为孵化后5 d[38]。在石斑鱼类的胚后发育中出现第二背鳍鳍棘与腹鳍鳍棘先伸长随后收缩的现象, 这是石斑鱼类胚后发育中较为独特的一个现象, 在许多石斑鱼类的胚胎发育过程的观察中均有报道[35, 39-40]。目前, 石斑鱼类胚后发育过程中腹鳍鳍棘和背鳍鳍棘的伸缩的生物学意义仍不甚明确, 一般认为其可能有增加浮力及恐吓敌害的作用, 使石斑鱼类度过漫长的变态期[19, 37]。石斑鱼类胚后发育过程中存在着3个死亡率较高的危险期:一是仔鱼开口阶段, 该阶段仔鱼从生理生态上出现与摄食、运动相关的器官发育的急剧变化, 完成从内源性营养到外源性营养的过渡, 死亡率极高。石斑鱼类的成鱼口裂较大, 但初开口的仔鱼口径则显著小于石首鱼类、鲷科鱼类等其他鲈形目鱼类, 自然环境中的石斑鱼仔鱼一般以适口的桡足类无节幼体为主要饵料生物[41], 在养殖实践中则以牡蛎受精卵、担轮幼虫等作为开口饵料。二是仔鱼向稚鱼发育过渡阶段, 该阶段仔鱼不断生长, 口径逐渐增大, 游泳能力及摄食能力亦随之增强, 其生存环境中的饵料生物种类和丰富度都会严重影响仔鱼的进一步生长及存活[42]。三是稚幼鱼期, 该时期鱼体生长迅速, 摄食能力及游泳能力进一步增强, 容易出现因个体密度过高而导致鱼苗相互残食的现象。
2 石斑鱼的分类和系统进化 2.1 分类地位与现状石斑鱼类通指隶属于鲈形目石斑鱼科的所有鱼类。但是在早年的分类学中, 石斑鱼科鱼类一度被归属于














除了从亚科提升至科之外, 近年来石斑鱼分类的另一较大的变更是从原有的15个属扩展成为16个属。在1993年版的FAO物种目录之中罗列了石斑鱼的15个属:烟鲈属(Aethaloperca)、鸳鸯





目前全球有记录的石斑鱼种类已超过160种, 其中东太平洋石斑鱼(E. quinquefasciatus)、云纹石斑鱼(E. moara和E. geoffroyi)近10年来才被确认为有效种。东太平洋石斑鱼原被认为是伊氏石斑鱼的太平洋种群, 其与伊氏石斑鱼的大西洋种群在形态上并无显著差异, 但分子数据却显示这两个群体间的遗传距离已经达到种间水平。从约三百万年前, 巴拿马地峡开始逐渐变窄直到最终合拢, 伊氏石斑鱼的太平洋和西大西洋种群开始出现地理隔离; 直到一个世纪前巴拿马运河建成, 才又有了少量的基因交流。现在, 伊氏石斑鱼的大西洋群体还保留原拉丁名E. itajara (Lichtenstein, 1822), 而其太平洋群体则恢复了早年被当做E. itajara同种异名的拉丁名E.quinquefasciatus(Bocourt 1868), 中文名称为东太平洋石斑鱼[57]。对于云纹石斑鱼(Temminck and Schlegel, 1842)来说, 即便其在国内早被认为是有效种[58], 但由于和褐石斑鱼(E. bruneus)(Bloch, 1793)外部形态极其相似, 分布区域也大致相同, 在国际上云纹石斑鱼一直都被认为是褐石斑鱼的同种异名。Guo等[59]和Liu等[60]基于云纹石斑鱼和褐石斑鱼在DNA序列上的分化, 并进一步分析了两者在体色、前鳃盖骨后缘、背鳍鳍条数、鳃耙数和幽门盲囊分支数等形态学性状上的显著差异, 最终确定了云纹石斑鱼是区别于褐石斑鱼的一个有效种。E. geoffroyi (Klunzinger, 1870)原被认为是网纹石斑鱼(E. chlorostigma) (Valenciennes, 1828)的同种异名, 然而2013年Randall等[61]通过细致的形态学研究, 发现在红海和亚丁湾的网纹石斑鱼种群与其他地方相比, 在鳃耙数、臀鳍形状、腹部斑点分布特征等方面存在显著差异, 不应被归为同一种类。因此, E. geoffroyi被重新启用来命名这些分布在红海和亚丁湾的类群。
2.2 系统进化1993年, Baldwin等[49]通过形态学研究, 首次提出了石斑鱼类为单系起源。2001年, Craig等[62]基于分子数据的分析结果证实了Baldwin等[49]的观点, 且发现其中的石斑鱼属和九棘鲈属均非单系群。随后, Maggio等[63]又研究了东大西洋8种石斑鱼, 并综合Craig等[62]的数据重新构建系统树; 庄轩等[64]和Ding等[65]通过对中国沿海6属28种石斑鱼类的研究, 均得出了相同结论, 即石斑鱼属内主要存在两大分支, 但其分支间的拓扑结构却与两大区系的地理分布无相关性, 且石斑鱼系群中还包含了整个喙鲈属以及两个单属单种白线光腭鲈和驼背鲈; 而九棘鲈系群中则囊括了单属单种的烟鲈(A. rogaa)与白边纤齿鲈(G. albomarginata), 以及只有两个种类的副花





石斑鱼的分类一直是鱼类系统分类学的一个难题, 其原因包括: (1)石斑鱼的种类丰富, 全球共有16属160余种, 且仅石斑鱼属就有80余种; (2)大多数石斑鱼类为定居性鱼类, 长期以来相似生活环境造成的平行演化使得它们在骨骼及外部形态上都表现出较高趋同性, 许多石斑鱼类之间缺乏可用于比较的同源性状, 分类上多以条纹、斑点及体色作为主要依据; (3)许多石斑鱼易于在不同外部环境或生理条件诱导下出现体色和斑纹的变化, 导致同种个体存在体色斑纹差异, 而异种个体则呈现相似体色斑纹; (4)部分石斑鱼幼体和成体形态差异较大, 易被错认为不同种类; (5)早年命名混乱导致石斑鱼中存在许多同种异名和同名异种现象; (6)近年来人工繁育的杂交石斑鱼种类和数量急剧增加, 杂交石斑鱼在外部形态上常常同时具有双方亲本的特征, 且极容易变异, 进一步导致鉴别难度的增加。由于存在以上因素, 一些鱼类志和分类学网站上对石斑鱼的分类鉴定仍存在不少错误, 如横带九棘鲈的正式拉丁名为Cephalopholis boenak Bloch, 1790, 但在部分国内的鱼类志里, 横带九棘鲈仍在沿用旧的拉丁名C. pachycentron (Valenciennes in Cuvier and Valenciennes, 1828), 而C. boenak(或者C. bonack)则多被误作台湾九棘鲈(C. formosa, Shaw, 1812)的拉丁名。
由于石斑鱼类分类和鉴定均存在较大难度, 仅仅凭借形态学特征有时并不足以区分相似种。近10年来, 随着分子生物学技术的飞速发展, 尤其是DNA测序技术的日益完善, 使得分子鉴定技术已经成为了石斑鱼种类鉴定的重要辅助手段。2018年, Qu等[55]通过DNA条形码技术, 发现清水石斑鱼(E. polyphekadion)、纹波石斑鱼(E. ongus)、蜂巢石斑鱼(E. merra)白线光腭鲈等多个石斑鱼广布种存在显著种内分化, 中国台湾海峡、印度-澳大利亚岛链是潜在的地理隔离屏障。虽然上述种类在形态学上尚未发现特征性差异, 但其分子分化程度已达种间水平, 因而极有可能有隐存种的存在。而黄鳍石斑鱼(E. flavocaeruleus)和细点石斑鱼(E. cyanopodus)的情况却恰好相反, 它们在分子条码序列方面几乎没有差异, 形态学上也没有任何可数可量性状的差别, 唯一的区别在于成体体色的不同:黄鳍石斑鱼各鳍和下颌均为黄色, 而细点石斑鱼则全身为蓝色。由于石斑鱼体色易随环境等因素变化, 仅依靠体色差异定种似乎说服力欠佳, 因此黄鳍石斑和细点石斑鱼很有可能是同种异名。
另外, 近年来石斑鱼养殖业的兴起虽然在一定程度上缓解了对其野生资源的捕捞压力, 但也带来了新的问题。石斑鱼种间亲缘关系较近, 约有三分之二的种类在近500万年才形成[53], 因此种间生殖隔离并不显著, 易出现种间杂交。这种易发生种间杂交的特性在许多珊瑚礁鱼类中均有发现, 据推测可能是珊瑚礁鱼类新种形成的推动力之一[67]。在野外, 天然杂交个体在鳃棘鲈属、九棘鲈属和石斑鱼属中均有发现[55, 68-69]; 在生产上, 采用种间杂交手段来获得品质更为优良的石斑鱼已被广为应用[70]。然而, 杂交石斑鱼通常具有两种不同亲本的形态特征, 进一步增加了鉴别难度。由于传统条形码基因(如COI)来自线粒体, 具有母系遗传特征, 因此无法独立用于鉴别杂交种。核基因包含了双方亲本的遗传信息, 理论上可以用作杂交种的鉴别, 但国际上尚未确定杂交种鉴定的标准基因。2018年, Qu等[55]通过对14个核基因的筛选, 发现RYR3基因在石斑鱼类中种内相对保守, 而种间则存在较大变异, 适合用来鉴定杂交石斑鱼, 从而建立了一套利用核基因RYR3与线粒体条形码结合的方法, 可快速鉴别杂交个体及其双亲。该方法不仅能够在渔业贸易中为杂交石斑鱼提供鉴定标准, 还可用于研究自然环境中石斑鱼类种间的遗传渐渗及评估人工杂交个体逃逸对石斑鱼野生资源的影响, 具有重要应用价值。
3 石斑鱼资源概况 3.1 地理分布石斑鱼类广泛分布于大西洋、印度洋和太平洋的热带和亚热带海域。根据石斑鱼几乎不做长距离洄游、较高温度适应性的生理生态特性及巴拿马地峡和苏伊士地峡的地理阻隔, 本文将其地理分布划分为大西洋(Atlantic, AT)、东太平洋(East Pacific, EP)、印度-西太平洋(Indian-West Pacific, IW)3大区系。其中, 分布于印度-西太平洋区系的石斑鱼类有114种, 东太平洋区系有19种, 大西洋区系(含地中海)有33种。印度-西太平洋海域拥有种类最多的石斑鱼类, 这与该海域存在着海洋生物多样性最高的印度-澳大利亚群岛区(the Indo-Australian Archipelago)有关。由于石斑鱼属于热带亚热带鱼类, 难以跨过好望角和合恩角, 虽然苏伊士运河和巴拿马运河的开通为三大区系间的物种扩散提供了可能, 但目前的相关报道仅见于红海的斜带石斑鱼和马拉巴石斑鱼向地中海一定程度的扩散[1, 71]及东大西洋石斑鱼与墨西哥湾的伊氏石斑鱼之间的基因交流[57]。Qu等[55]指出印度-澳大利亚群岛区可能也是石斑鱼类的潜在地理隔离屏障, 基于此本文进一步将印度-西太平洋区系划分为印度洋(Indian Ocean, IN)和西太平洋(West Pacific, WP)两个海域, 统计发现仅分布于印度洋或西太平洋海域的石斑鱼类分别有24种和23种, 而有67种石斑鱼可跨两个海域分布。作为石斑鱼类中种数最多的4个属, 石斑鱼属、九棘鲈属和下美
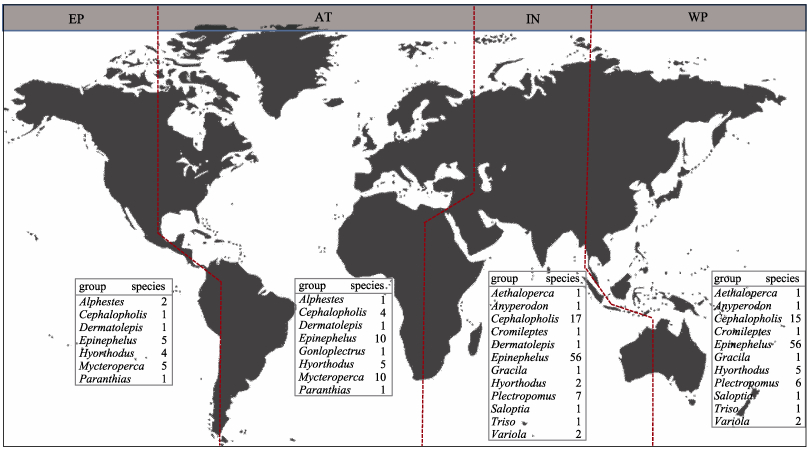
|
图 1 石斑鱼类四大海域种属分布图 EP:东太平洋; AT:大西洋; IN:印度洋; WP:西太平洋.
烟鲈属Aethaloperca, 光腭鲈属Anyperodon, 鸳鸯 属Alphestes, 九棘鲈属Cephalopholis, 驼背鲈属Cromileptes, 鳞 属Alphestes, 九棘鲈属Cephalopholis, 驼背鲈属Cromileptes, 鳞 属Dermatolepis, 石斑鱼属Epinephelus, 条纹 属Dermatolepis, 石斑鱼属Epinephelus, 条纹 属Gonioplectrus, 纤齿鲈属Gracila, 下美 属Gonioplectrus, 纤齿鲈属Gracila, 下美 属Hyporthodus, 喙鲈属Mycteroperca, 副花 属Hyporthodus, 喙鲈属Mycteroperca, 副花 属Paranthias, 鳃棘鲈属Plectropomus, 贫鲈属Saloptia, 鸢 属Paranthias, 鳃棘鲈属Plectropomus, 贫鲈属Saloptia, 鸢 属Triso, 侧牙鲈属Variola
Fig.1 Distribution of grouper species in four ocean region EP: East Pacific Ocean; AT: Atlantic Ocean; IN: Indian Ocean; WP: West Pacific Ocean. 属Triso, 侧牙鲈属Variola
Fig.1 Distribution of grouper species in four ocean region EP: East Pacific Ocean; AT: Atlantic Ocean; IN: Indian Ocean; WP: West Pacific Ocean.
|
中国沿海分布的石斑鱼类有11个属65种, 包括光腭鲈属、下美

从1988年开始, 国际自然保护联盟(International Union for Conservation of Nature, IUCN)开始对野外石斑鱼资源状况进行评估。经过20余年的调查, 发现石斑鱼的野外资源状况并不乐观, 若照目前趋势发展, 至少有20种石斑鱼类存在灭绝的风险。在IUCN濒危物种红色名录(IUCN Red List of Endangered Species)中, 德氏石斑鱼(E. drummondhayi)、伊氏石斑鱼和浅黑石斑鱼(H. nigritus)分别于2008年、2006年、2006年被定极危(critically endangered), 这是仅次于灭绝(extinct)和野外灭绝(extinct in the wild)的濒危等级, 制定和实施保护措施刻不容缓; 另外, 赤点石斑鱼、拿骚石斑鱼、东大西洋石斑鱼、灰喙鲈(M. fusca)和乔氏喙鲈(M. jordani)5个种类被定为濒危(endangered), 驼背鲈等12种被定为易危(vulnerable), 布氏石斑鱼(E. bleekeri)等22种被定为近危(near threatened)。然而, 除此以外的100余种石斑鱼并非均是资源量充足, 其中有近半数(52种)被定为data dificient, 即数据不足无法评估[74]。
目前, 对于石斑鱼类野外资源威胁最大的仍是人类的过度捕捞, 如赤点石斑鱼主要分布于日本、韩国南部及中国的东海、南海等地, 作为目前西太平洋海域唯一被IUCN列入濒危等级的石斑鱼类, 由于过度捕捞, 从20世纪80年代以来, 赤点石斑鱼的渔获量已急剧减少, 并且渔获物趋向低龄化和小型化[75]。浙江省在1980—1990这10年间, 单位捕捞努力量渔获量(catch per unit effort, CPUE)下降了近90%[76], 这些研究结果均显示赤点石斑鱼野生资源已经严重衰退。Sadovy等[77]认为, 石斑鱼类很有可能成为因人类捕捞而最先消失的珊瑚礁鱼类。由于许多石斑鱼种类具有集群产卵的习性, 因此容易在“渔汛”期间被一网打尽, 在短时间内造成野外资源量的急剧衰退, 如拿骚石斑鱼和喙鲈属的一些种类[77-79]。近年来, 随着大众环保意识的提高, 海洋保护区(Marine Protected Areas, MPAs)的数量显著增长[80-81], 但对于石斑鱼类野外资源的保护仍存在不少难点, 如有些石斑鱼栖息领域较广, 或有长距离洄游习性, 可能在保护区外被过度捕捞; 生活在深海的受保护种类被拖网误捕后, 即使放归也常因气压损伤而无法存活[53]。
3.3 渔业管理由于文化和饮食习惯, 包括香港和台湾地区在内的中国东南沿海是石斑鱼的主要市场。庞大的市场催生了著名的以石斑鱼类为主的珊瑚礁活体食用鱼贸易(live reef food fish trade, LRFFT)。LRFFT对于石斑鱼野外资源的影响是巨大的, 据统计, 每年约有3万吨珊瑚礁鱼类进入LRFFT, 其中50%~70%为野捕资源, 15%~40%为野捕较小个体后人工养殖到合适大小的半养殖资源, 仅有10%~15%为从受精卵孵化开始的完全人工养殖个体[82-83]。由于有着十分可观的经济效益, 随着鱼类活体运输技术的不断发展, 受到LRFFT影响而出现渔业过度捕捞的范围也在不断扩大: 20世纪70年代, 野捕范围还主要局限在南中国海和菲律宾一带; 80年代, 范围逐步过大到了马来西亚、泰国和印度尼西亚等东南亚海域; 到了90年代, 西至马尔代夫等印度洋中部海域、东至太平洋中部马绍尔群岛和基里巴斯岛、南至斐济和澳大利亚北部都受到了不同程度的影响[82]。
随着国际贸易的发展, 石斑鱼捕获量逐年增长。根据FAO 2015年数据, 野生石斑鱼捕获量接近38万吨, 相比十年前增长了50%以上。根据全球捕捞量统计, 横带九棘鲈是近十年来渔获量最高的物种, 2015年捕捞量超过5.8万吨, 其次是2004年开始有FAO捕捞记录的豹纹鳃棘鲈, 现捕捞量接近2.6万吨/年, 蜂巢石斑鱼捕捞产量超过2.0万吨/年, 位居第三(图 2)。由于对渔民而言, 准确的石斑鱼种类鉴定存在困难, 因此包括我国在内许多国家及地区的石斑类渔获仅以石斑鱼类大类纳入统计, 而未按具体种类单元进行归纳, 此外, 考虑到还有相当的渔获物未被统计就直接流入市场或直接消费, 实际的石斑鱼类捕捞量可能被低估了。
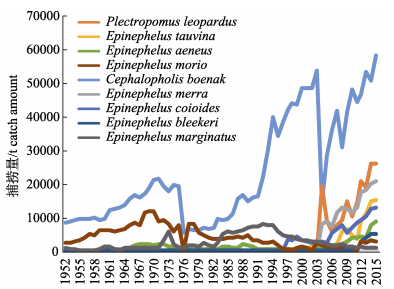
|
图 2 1952—2015年FAO统计的石斑鱼捕捞量趋势图 横带九棘鲈Cephalopholis boenak, 豹纹鳃棘鲈 Plectropomus leopardus, 蜂巢石斑鱼Epinephelus merra, 巨石斑鱼Epinephelus tauvina, 斜带石斑鱼Epinephelus coioides, 青铜石斑鱼Epinephelus aeneus, 布氏石斑鱼Epinephelus bleekeri, 黑缘石斑鱼Epinephelus morio, 乌鳍石斑鱼Epinephelus marginatus. Fig.2 Trends of global grouper catches from 1952 to 2015 by FAO |
此外由于大型种类被过度捕捞, 有些过去被认为不具经济价值的小型种类如尾纹九棘鲈(C. urodeta)也成为了新的渔业目标, 但迄今为止研究人员对其生物学特性所知甚少, 也导致了在渔业管理上的困难。国际上的一些国家和地区已开始通过立法规定可以捕捉的石斑鱼种类、规格与数目来保护石斑鱼资源。如澳大利亚昆士兰州, 横斑鳃棘鲈(P. laevis)的可捕规格为50~80 cm, 其他石斑鱼类则应不少于38 cm, 每人可带走的石斑鱼总数不多于7条(www.qld.gov.au/recreation/activities/boating-fishing/rec-fishing/rules/limits-tidal); 美国佛罗里达州禁止捕捞拿骚石斑鱼及伊氏石斑鱼, 对其他一些石斑鱼类的可捕规格及数量也进行了详细的规定(http://myfwc.com/fishing/saltwater/recreational/groupers/)。这些措施都值得我国渔业资源管理部门进行借鉴。此外, 在今后的工作中还应加强渔业部门的管理及科普宣传力度, 提高渔获物上岸数量统计的精确性, 为石斑鱼类资源可持续利用和保护提供参考依据。
4 石斑鱼人工繁育概况 4.1 养殖概况由于亚洲尤其是华人地区对活石斑鱼的高需求量, 1972年香港就开始对钓捕石斑鱼进行人工暂养, 这是石斑鱼养殖的最早记录, 而养殖对象为赤点石斑鱼, 其曾一度占据了香港90%以上的养殖产量。1975年第一家商业化网箱养殖企业诞生, 不仅由此推动了香港地区石斑鱼养殖、管理和购销技术的发展, 也刺激了周边地区和东南亚各国石斑鱼养殖业的跟进[84]。目前石斑鱼的主要养殖国家和地区包括东亚的中国(含港台)、日、韩和东南亚部分国家, 另外, 印度、阿联酋及北非的埃及、突尼斯等国也有相关养殖报道。
虽然早年石斑鱼市场主要依赖于野生捕捞, 但近年来随着石斑鱼养殖业的日益发展, 养殖石斑鱼的市场占有率正逐年增大。根据FAO 2015数据显示, 石斑鱼的养殖量逐年增加, 从20世纪70年代的30吨/年, 至2015年的养殖产量已达到15.5万吨/年(图 3)。而我国不仅是石斑鱼的消费大国, 也是石斑鱼的养殖大国, 2015年贡献了世界石斑鱼80%以上的养殖产量。根据中国渔业统计年鉴近年来的数据显示, 海南、广东和福建是大陆地区养殖产量最多的三个省份, 占据了中国95%以上的石斑鱼养殖产量, 其中广东稳居第一, 2015年产量达4.2万吨, 海南和福建的石斑鱼养殖量相当, 均在2.6万吨左右。
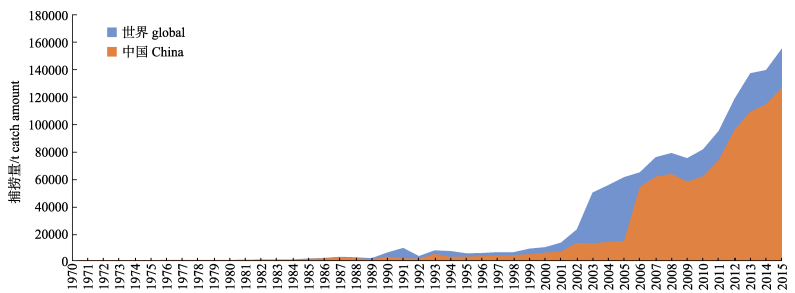
|
图 3 世界及中国石斑鱼养殖总量趋势图(FAO 1970—2015) Fig.3 Trends of global and China grouper aquaculture (FAO 1970—2015) |
根据文献资料, 目前有养殖记录的石斑鱼已达47种, 包括石斑鱼属36种、鳃棘鲈属4种、九棘鲈属4种, 以及烟鲈、驼背鲈和七带石斑鱼[85]。亚洲地区主要的养殖种类有斜带石斑鱼、点带石斑鱼、赤点石斑鱼、青石斑鱼、鞍带石斑鱼、褐点石斑鱼(E. fuscoguttatus)、云纹石斑鱼、七带石斑鱼、驼背鲈及豹纹鳃棘鲈等; 在美国和加勒比海域, 主要养殖种类为拿骚石斑鱼、伊氏石斑鱼等; 而地中海区域曾进行过东大西洋石斑鱼和青铜石斑鱼的人工养殖尝试[86]。
石斑鱼的养殖方式主要包括网箱养殖、池塘养殖和工厂化水泥池养殖等。网箱养殖常见于我国东南沿海各省及东南亚国家, 多数的网箱养殖使用的是中小尺寸的网箱, 由于近岸养殖产业的扩张, 石斑鱼养殖也开始向高密度聚乙烯大型环行深水网箱养殖模式发展[87-88]; 石斑鱼的池塘养殖在海南及东南亚的菲律宾和泰国等均有报道[89-91]; 而香港曾使用陆基的工厂化循环水养殖模式[90], 该模式目前在山东、河北等国内新兴的石斑鱼养殖省份也正在逐渐推行。不论是何种养殖模式, 石斑鱼的养殖过程都易受病原菌、病毒及寄生虫的威胁。常见的细菌性病原包括鳗弧菌(Vibrio anguillarunm)、哈维氏弧菌(Vibrio harveyi)等, 病毒性病原有神经坏死病毒(nervous necrosis virus, NNV)、虹彩病毒(grouper iridovirus, GIV)等, 常见的致病寄生虫则主要有刺激隐核虫(Cryptocaryon irritans)、水蛭(Whitmania)、椎体虫(Trypanosoma epinepheli)等。在所有致病病原中, 病毒是石斑鱼养殖业最为棘手的致病病原, 迄今为止仍无有效的治疗方案, 高效疫苗的研发或许是今后可能解决途径之一[92], 但目前降低石斑鱼养殖病害损失的方案仍是加强管理、防控为主。
4.2 育苗制种早期的人工养殖苗种主要依赖于野外捕捞, 苗种缺乏一度曾是石斑鱼养殖业发展的瓶颈。20世纪60年代初, 日本渔业协会对赤点石斑鱼的人工繁育进行过初步研究, 随后东南亚各国、科威特及我国东南沿海地区也都相继开展了石斑鱼人工繁育技术的研发。迄今为止, 已有25种石斑鱼有人工繁育成功的报道, 包括赤点石斑鱼、镶点石斑鱼(E. amblycephalus)、宝石石斑鱼、青石斑鱼、布氏石斑鱼、褐石斑鱼、莹点石斑鱼(E. coeruleopunctatus)、斜带石斑鱼、珊瑚石斑鱼(E. corallicola)、黑边石斑鱼(E. fasciatus)、荷氏石斑鱼(E. howlandi)、鞍带石斑鱼、长棘石斑鱼(E. longispinus)、点带石斑鱼、乌鳍石斑鱼(E. marginatus)、清水石斑鱼、玳瑁石斑鱼(E. quoyanus)、拿骚石斑鱼、三斑石斑鱼(E. trimaculatus)、蓝身大斑石斑鱼(E. tukula)、蓝点鳃棘鲈(P. areolatus)、横斑鳃棘鲈、豹纹鳃棘鲈、驼背鲈及七带石斑鱼[85], 但能实现稳定规模化育苗的种类仍然只有斜带石斑鱼、赤点石斑鱼、鞍带石斑鱼和褐点石斑鱼。除此之外, 云纹石斑鱼、七带石斑鱼和豹纹鳃棘鲈的育苗技术也正日益成熟。中国台湾是最早实现石斑鱼规模化育苗的地区, 同时也是石斑鱼苗的主要供应地, 其产量在1999年曾达到顶峰, 为养殖户提供了2.8亿尾石斑鱼苗[93]; 据台湾省渔农署资料记载, 近年的石斑鱼苗年供应量维持在6000万到8000万尾。海南省以其优越的地理位置, 石斑鱼的育苗产业亦发展迅速, 近几年的鱼苗供应量可达1亿尾左右(私人通讯)。在本国政府支持和技术引进的双重推动下, 近年来印度尼西亚和马来西亚的石斑鱼育苗产业发展迅速, 已成为亚太地区石斑鱼鱼苗的主要出口国之一[85, 94]。
大多数经济石斑鱼具有生活周期长、性成熟年龄晚及先雌后雄的繁殖特性, 使其难以进行常规的人工选育。但是, 基于石斑鱼类如前文所述具有易于发生种间杂交的特性, 21世纪初中国台湾即开始了石斑鱼种间杂交的育种尝试, 而随着龙虎斑(褐点石斑鱼♀×鞍带石斑鱼♂的杂交子代)在生长速度和抗逆性方面体现出明显的杂种优势后, 该杂交品种产量剧增, 目前已占据国内石斑鱼市场半壁江山, 并由此带来了石斑鱼育苗产业的杂交热潮。迄今为止, 国内外已在斜带石斑鱼、鞍带石斑鱼、云纹石斑鱼、驼背鲈、赤点石斑鱼等十余种常见养殖石斑鱼类中进行过杂交尝试[85], 斜带石斑鱼♀×鞍带石斑鱼♂的杂交子一代、云纹石斑鱼♀×七带石斑鱼♂的杂交子一代以及云纹石斑鱼♀×赤点石斑鱼♂的杂交子一代等杂交品种亦体现出了一定的优势经济性状[95-97]。然而必须清醒地意识到, 规模化的种间杂交, 不仅进一步增大了石斑鱼种类鉴定的难度, 而且在人们缺乏对石斑鱼杂交种生物学、生态学和遗传学特性透彻了解的前提下, 将难以准确评估大范围杂交个体逃逸造成的生物入侵对石斑鱼野生资源产生的冲击和危害。
首先, 野生当地种群资源之所以能作为养殖群体亲本基因库的重要补充, 主要源自于野生种群基因库的多样性丰富, 拥有经过长时间环境选择所保留的对当地环境最适应的基因组合(local adaptation gene complex)[98-100]。如果逃逸的人工杂交个体具有不弱于亲本纯系物种的繁殖能力, 并通过长时间的野外存活成功参与数代的繁殖行为, 将可能导致大量异种染色体短期内导入野生群体基因库, 造成当地适应性基因组合的破坏, 使野外种群经长时间进化所具备的各种适应当地环境的生态学优势从基因层面直接丧失, 最终导致野生纯系种群资源的衰减甚至灭绝。即便逃逸的人工杂交群体不具有亲本纯系物种的繁殖能力, 在融入当地野生种群后, 依然会参与繁殖行为, 骤然增加野生个体的繁殖竞争压力, 导致一方面大量与其交配的野生个体的生殖能量白白浪费, 另一方面一部分有繁殖能力的野生个体不能得到与其生态适应优势相对应的繁殖机会。其次, 即便人工育成的杂交个体有可能会在生长速度和抗逆性方面展现杂交优势, 但是必须指出, 这种杂交优势并不是一种有多代遗传几率的基因优势, 因而并不能随着杂交个体的逃逸为野生纯系群体带来基因层面的增益。相比于适应当地环境的基因组合的丧失, 有繁殖能力杂交个体的这种不可持续或仅存于有限世代的优势所带来的资源增益几乎可以忽略不计。而如果杂交个体不具有繁殖能力, 这种杂种优势会使其具有更高的生态竞争力, 间接地使更多野生纯系个体的生殖能量被浪费, 更多野生个体得不到充分的繁殖机会, 使群体行为习性更快地改变, 从而使野生种质资源的衰退更明显。因而, 人工育成的杂交个体如果逃逸, 不仅拥有纯系养殖个体逃逸对野生资源的一般性危害(病原体传染、群体野生适应性行为的破坏、挤占野生群体生存资源等), 还可能具有更严重的群体遗传学层面的危害。本文认为, 应在进一步加强石斑鱼杂交选育行业管理的同时, 开展杂交石斑鱼的基础生物学研究, 有效保护我国海域的野生石斑鱼资源, 为石斑鱼产业的长期健康发展提供保障。
致谢: 对庄志猛研究员、周时强教授、何嵩博士和庄轩博士于本文撰写过程中的有益建议及唐未研究生在文章作图方面的协助, 在此一并致谢。| [1] |
Heemstra P C, Randall J E. Groupers of the World (Family Serranidae, Subfamily Epinephelinae):An Annotated and Illustrated Catalogue of the Grouper, Rockcod, Hind, Coral Grouper, and Lyretail Species Known to Date[M]. Food and Agriculture Organization of the United Nations, 1993.
|
| [2] |
Helfman G, Collette B B, Facey D E, et al. The Diversity of Fishes:Biology, Evolution, and Ecology[M]. John Wiley & Sons, 2009.
|
| [3] |
Liu M, Sadovy Y J. Habitat association and social structure of the chocolate hind, Cephalopholis boenak (pisces:Serranidae:Epinephelinae), at ping chau island, northeastern hong kong waters[J]. Environmental Biology of Fishes, 2005, 74(1): 9-18. DOI:10.1007/s10641-005-2258-9 |
| [4] |
Shpigel M, Fishelson L. Territoriality and associated behaviour in three species of the genus Cephalopholis (pisces:Serranidae) in the gulf of aqaba, red sea[J]. Journal of Fish Biology, 1991, 38(6): 887-896. DOI:10.1111/jfb.1991.38.issue-6 |
| [5] |
Randall J E. Food Habits of Reef Gishes of the West Indies[M]. University of Miami: Insitute of Marine Science, 1967.
|
| [6] |
Vail A L, Manica A, Bshary R. Referential gestures in fish collaborative hunting[J]. Nature Communications, 2013, 4: 1765. DOI:10.1038/ncomms2781 |
| [7] |
Bshary R, Hohner A, Ait-el-Djoudi K, et al. Interspecific communicative and coordinated hunting between groupers and giant moray eels in the red sea[J]. PLoS Biology, 2006, 4(12): e431. DOI:10.1371/journal.pbio.0040431 |
| [8] |
Chan T T, Sadovy Y J. Reproductive biology, age and growth in the chocolate hind, Cephalopholis boenak (bloch, 1790), in hong kong[J]. Marine and Freshwater Research, 2002, 53(4): 791-803. DOI:10.1071/MF00071 |
| [9] |
Siau Y. Population structure, reproduction and sex-change in a tropical east atlantic grouper[J]. Journal of Fish Biology, 1994, 44(2): 205-211. DOI:10.1111/jfb.1994.44.issue-2 |
| [10] |
Tanaka H. Sexual maturation and sex reversal in red spotted grouper, Epinephelus akaara[J]. Bulletin of National Research Institute of Aquaculture, 1990, 17: 1-15. |
| [11] |
Liu M, Sadovy Y J. The influence of social factors on adult sex change and juvenile sexual differentiation in a diandric, protogynous epinepheline, Cephalopholis boenak (pisces, serranidae)[J]. Journal of Zoology, 2004, 264(3): 239-248. DOI:10.1017/S0952836904005631 |
| [12] |
Erisman B E, Rosales-Casián J A, Hastings P A. Evidence of gonochorism in a grouper, Mycteroperca rosacea, from the Gulf of California, Mexico[J]. Environmental Biology of Fishes, 2008, 82(1): 23-33. DOI:10.1007/s10641-007-9246-1 |
| [13] |
Sadovy Y J, Colin P. Sexual development and sexuality in the nassau grouper[J]. Journal of Fish Biology, 1995, 46(6): 961-976. DOI:10.1111/jfb.1995.46.issue-6 |
| [14] |
Zou J X, Tao Y B, Xiang W Z, et al. Histological evidence and mechanisim in artifical inducement of sex reversal of the grouper, Epinephelus malabaricus[J]. High Technology Letters, 2003, 13(6): 81-86. [邹记兴, 陶友宝, 向文洲, 等. 人工诱导点带石斑鱼性逆转的组织学证据及其机制探讨[J]. 高技术通讯, 2003, 13(6): 81-86. DOI:10.3321/j.issn:1002-0470.2003.06.019] |
| [15] |
Li G L, Liu X C, Lin H R. Aromatase inhibitor letrozole induces sex inversion in the protogynous red spotted grouper (Epinephelus akaara)[J]. Acta Physiological Sinica, 2005, 57(4): 473-479. [李广丽, 刘晓春, 林浩然. 芳香化酶抑制剂letrozole对赤点石斑鱼(Epinephelus akaara)性逆转的作用[J]. 生理学报, 2005, 57(4): 473-479. DOI:10.3321/j.issn:0371-0874.2005.04.010] |
| [16] |
Chen G H, Zhang B. Technique of implanting 17α-methyltestosterone to induce the sex reversal of Epinephelus malabaricus[J]. Chinese Journal of Applied Ecology, 2001, 12(2): 296-298. [陈国华, 张本. 埋植17α-甲基睾酮诱导点带石斑鱼性转化技术[J]. 应用生态学报, 2001, 12(2): 296-298. DOI:10.3321/j.issn:1001-9332.2001.02.033] |
| [17] |
Lee S, Kime D, Chao T, et al. In vitro metabolism of testosterone by gonads of the grouper (Epinephelus tauvina) before and after sex inversion with 17α-methyltestosterone[J]. General & Comparative Endocrinology, 1995, 99(1): 41-49. |
| [18] |
Song Z X, Chen C, Zhai J M, et al. Embryonic development and morphological characteristics of larval, juvenile and young Kelp bass, Epinephelus moara[J]. Progress in Fishery Sciences, 2012, 33(3): 26-34. [宋振鑫, 陈超, 翟介明, 等. 云纹石斑鱼胚胎发育及仔、稚、幼鱼形态观察[J]. 渔业科学进展, 2012, 33(3): 26-34. DOI:10.3969/j.issn.1000-7075.2012.03.004] |
| [19] |
Chen G H, Zhang B. Study on parent fish rearing, spawning and hatching of Epinephelus malabaricus (Bloch & Schneider)[J]. Oceanologia et Limnologia Sinica, 2001, 32(4): 428-435. [陈国华, 张本. 点带石斑鱼亲鱼培育、产卵和孵化的试验研究[J]. 海洋与湖沼, 2001, 32(4): 428-435. DOI:10.3321/j.issn:0029-814X.2001.04.012] |
| [20] |
Gui Y, Hu J, Zhou W X, et al. A study on the ovarium annual variation and sex transformation of Epinephelus awoara in north sea waters of Zhejiang Province[J]. Journal of Zhejiang College of Fisheries, 1984, 3(1): 11-19. [溎彦, 胡杰, 周婉霞, 等. 浙江北部水域青石斑鱼Epinephelus awoara卵巢周年变化及性转变的研究[J]. 浙江水产学院学报, 1984, 3(1): 11-19.] |
| [21] |
Zeller D C. Spawning aggregations:patterns of movement of the coral trout Plectropomus leopardus (Serranidae) as determined by ultrasonic telemetry[J]. Marine Ecology Progress Series, 1998, 162: 253-263. DOI:10.3354/meps162253 |
| [22] |
Bolden S K. Long-distance movement of a Nassau grouper (Epinephelus striatus) to a spawning aggregation in the central Bahamas[J]. Fishery Bulletin, 2000, 98(3): 642-645. |
| [23] |
Lei J L. Marine Fish Culture Theory and Technology[M]. Beijing: China Agriculture Press, 2005. [雷霁霖. 海水鱼类养殖理论与技术[M]. 北京: 中国农业出版社, 2005.]
|
| [24] |
Okumura S, Okamoto K, Oomori R, et al. Spawning behavior and artificial fertilization in captive reared red spotted grouper, Epinephelus akaara[J]. Aquaculture, 2002, 206(3-4): 165-173. DOI:10.1016/S0044-8486(01)00722-0 |
| [25] |
Smith C L. A spawning aggregation of nassau grouper, Epinephelus striatus (bloch)[J]. Transactions of the American Fisheries Society, 1972, 101(2): 257-261. DOI:10.1577/1548-8659(1972)101<257:ASAONG>2.0.CO;2 |
| [26] |
Hong W S, Zhang Q Y. Present status of Epinephelus akaara propagation, seeding fish and larvae lulturing study[J]. Marine Sciences, 1994, 18(5): 17-19. [洪万树, 张其永. 赤点石斑鱼繁殖生物学和种苗培育研究概况[J]. 海洋科学, 1994, 18(5): 17-19.] |
| [27] |
Ding T X. Advance in artificial breeding of groupers[J]. Journal of Zhejiang College of Fisheries, 1990, 9(1): 43-49. [丁天喜. 石斑鱼人工育苗技术的进展[J]. 浙江水产学院学报, 1990, 9(1): 43-49.] |
| [28] |
He Y L, Ou Y J, Li J E, et al. Advance in research on artificial breeding technique of groupers[J]. South China Fisheries Science, 2008, 4(3): 75-79. [何永亮, 区又君, 李加儿, 等. 石斑鱼人工繁育技术研究进展[J]. 南方水产, 2008, 4(3): 75-79. DOI:10.3969/j.issn.2095-0780.2008.03.013] |
| [29] |
De Jesus E G T, Toledo J D, Simpas M S. Thyroid hormones promote early metamorphosis in grouper (Epinephelus coioides) larvae[J]. General & Comparative Endocrinology, 1998, 112(1): 10-16. |
| [30] |
Chen C, Zhao M, Liu X Z, et al. Development and growth of embryos and early larvae of Epinephelus fasciatus[J]. Progress in Fishery Sciences, 2011, 32(5): 24-31. [陈超, 赵明, 柳学周, 等. 七带石斑鱼胚胎及仔稚鱼形态观察[J]. 渔业科学进展, 2011, 32(5): 24-31. DOI:10.3969/j.issn.1000-7075.2011.05.004] |
| [31] |
Shi Z H, Chen B, Peng S M, et al. The morphological change under salinity stress in development of yolk sac larvae of Epinephelus malabaricus[J]. Oceanologia et Limnologia Sinica, 2008, 39(3): 222-227. [施兆鸿, 陈波, 彭士明, 等. 盐度胁迫下点带石斑鱼(Epinephelus malabaricus)胚胎及卵黄囊仔鱼的形态变化[J]. 海洋与湖沼, 2008, 39(3): 222-227. DOI:10.3321/j.issn:0029-814X.2008.03.005] |
| [32] |
Liu L, Chen C, Kong X D. Effects of temperature changing on the early development and initial feeding of Epinephelus septemfaciatus[J]. Marine Fisheries, 2017, 39(4): 443-453. [刘莉, 陈超, 孔祥迪. 温度变化对七带石斑鱼早期发育及开口摄食的影响[J]. 海洋渔业, 2017, 39(4): 443-453. DOI:10.3969/j.issn.1004-2490.2017.04.010] |
| [33] |
Zhao M, Chen C, Liu X Z, et al. Effect of salinity on embryonic development and post-embryonic larval growth of Epinephelus septemfasciatus[J]. Progress in Fishery Sciences, 2011, 32(2): 16-21. [赵明, 陈超, 柳学周, 等. 盐度对七带石斑鱼胚胎发育和卵黄囊仔鱼生长的影响[J]. 渔业科学进展, 2011, 32(2): 16-21. DOI:10.3969/j.issn.1000-7075.2011.02.003] |
| [34] |
Lu Z K. Concise Aquaculture Encyclopaedia in China[M]. Beijing: China Agriculture Press, 2001. [陆忠康. 简明中国水产养殖百科全书[M]. 北京: 中国农业出版社, 2001.]
|
| [35] |
Zhang M Q, Chen C, Li Y L, et al. Developmental and morphological characteristics of embryo, larval, juvenile, and young fish, Chromileptes altivelis[J]. Progress in Fishery Sciences, 2014, 35(5): 145-153. [张梦淇, 陈超, 李炎璐, 等. 驼背鲈(Chromileptes altivelis)的胚胎发育及仔, 稚, 幼鱼形态观察[J]. 渔业科学进展, 2014, 35(5): 145-153.] |
| [36] |
Liu D E, Zhang Y Z, Wang H S. Feeding habits and growth of larval and juvenile Epinephelus coioide[J]. Journal of Oceanography in Taiwan Strait, 2007, 26(1): 99-107. [刘冬娥, 张雅芝, 王涵生. 斜带石斑鱼仔, 稚鱼的摄食与生长特性[J]. 台湾海峡, 2007, 26(1): 99-107. DOI:10.3969/j.issn.1000-8160.2007.01.013] |
| [37] |
Guo R X, Fu S Y, Yang W, et al. Study on the grouth and development of larva, juvenile and young fish of Epinephelus lanceolatus[J]. Journal of Aquaculture, 2011, 32(4): 8-13. [郭仁湘, 符书源, 杨薇, 等. 鞍带石斑鱼仔稚(幼)鱼的发育和生长研究[J]. 水产养殖, 2011, 32(4): 8-13. DOI:10.3969/j.issn.1004-2091.2011.04.003] |
| [38] |
Liu D E, Zhang Y Z, Fang Q S, et al. Study on morphological development of larval, juvenile and young Epinephelus coioides[J]. Journal of Oceanography in Taiwan Strait, 2008, 27(2): 180-189. [刘冬娥, 张雅芝, 方琼珊, 等. 斜带石斑鱼仔, 稚, 幼鱼的形态发育研究[J]. 台湾海峡, 2008, 27(2): 180-189. DOI:10.3969/j.issn.1000-8160.2008.02.009] |
| [39] |
Fu S Y, Wang Y B, Zheng F, et al. Observation on the morphology of the larva, juvenile and young fish of Plectropomus leopardus Lacépède[J]. Journal of Tropical Organisms, 2010, 1(2): 170-174. [符书源, 王永波, 郑飞, 等. 豹纹鳃棘鲈仔、稚、幼鱼的形态观察[J]. 热带生物学报, 2010, 1(2): 170-174. DOI:10.3969/j.issn.1674-7054.2010.02.014] |
| [40] |
Xie J, Ou Y J, Li J E, et al. Development of neural embryo and yolk sac larvae of Epinephelus septemfasciatus[J]. Marine Science Bulletin, 2009, 28(2): 41-49. [谢菁, 区又君, 李加儿, 等. 七带石斑鱼胚体和卵黄囊期仔鱼的发育[J]. 海洋通报(中文版), 2009, 28(2): 41-49.] |
| [41] |
Toledo J D, Golez S N, Doi M, et al. Food selection of early grouper, Epinephelus coioides, larvae reared by the semi-intensive method[J]. Aquaculture Science, 1997, 45(3): 327-337. |
| [42] |
Hunter J R. The Feeding Behavior and Ecology of Marine Fish Larvae[M]//Fish Behavior and its Use in the Capture of Fishes, Iclarm Conference Proceedings, 1980: 287-330.
|
| [43] |
Jordan D S, Eigenmann C H. A review of the genera and species of Serranidae found in the waters of America and Europe[M]. Washington Government Printing Office, 1890: 329-433.
|
| [44] |
Katayama M. Studies on the serranid fishes of Japan (i)[J]. Bulletin of the Faculty of Education, Yamaguchi University, 1959, 8(2): 103-180. |
| [45] |
Gosline W A. The limits of the fish family serranidae:With notes on other lower percoids[J]. Proceedings of the California Academy of Sciences, 1966, 33(4): 91-111. |
| [46] |
Johnson G D. Niphon spinosus:A primitive Epinepheline serranid, with comments on the monophyly and intrarelationships of the serranidae[J]. Copeia, 1983, 1983(3): 777-787. DOI:10.2307/1444346 |
| [47] |
Kendall Jr A. Serranidae:Development and relationships[M]. American Society of Ichthyologists and Herpetologists, 1984: 499-510.
|
| [48] |
Leis J M. Larval development in four species of indo-pacific coral trout Plectropomus (pisces:Serranidae:Epinephelinae) with an analysis of the relationships of the genus[J]. Bulletin of Marine Science, 1986, 38(3): 525-552. |
| [49] |
Baldwin C C, Johnson D G. Phylogeny of the Epinephelinae (teleostei:Serranidae)[J]. Bulletin of Marine Science, 1993, 52(1): 240-283. |
| [50] |
Froese R, Pauly D. Fishbase[DB/OL]. http://www.fishbase.org/search.php,2018-02/2018-02.
|
| [51] |
Smith W L, Craig M T. Casting the percomorph net widely:The importance of broad taxonomic sampling in the search for the placement of serranid and percid fishes[J]. Copeia, 2007, 2007(1): 35-55. DOI:10.1643/0045-8511(2007)7[35:CTPNWT]2.0.CO;2 |
| [52] |
Zhuang X, Qu M, Zhang X, et al. A comprehensive description and evolutionary analysis of 22 grouper (Perciformes, Epinephelidae) mitochondrial genomes with emphasis on two novel genome organizations[J]. PLoS ONE, 2013, 8(8): e73561. DOI:10.1371/journal.pone.0073561 |
| [53] |
Craig M T, Sadovy Y J, Heemstra P C. Groupers of the World:A Field and Market Guide[M]. Grahamstown: National Inquiry Services Centre, 2011.
|
| [54] |
Ma K Y, Craig M T, Choat J H, et al. The historical biogeography of groupers:Clade diversification patterns and processes[J]. Molecular Phylogenetics & Evolution, 2016, 100: 21-30. |
| [55] |
Qu M, Tang W, Liu Q, et al. Genetic diversity within grouper species and a method for interspecific hybrid identification using DNA barcoding and ryr3 marker[J]. Molecular Phylogenetics & Evolution, 2018, 121: 46-51. |
| [56] |
Craig M T, Hastings P A. A molecular phylogeny of the groupers of the subfamily Epinephelinae (serranidae) with a revised classification of the Epinephelini[J]. Ichthyological Research, 2007, 54(1): 1-17. DOI:10.1007/s10228-006-0367-x |
| [57] |
Craig M T, Graham R T, Torres R, et al. How many species of goliath grouper are there? Cryptic genetic divergence in a threatened marine fish and the resurrection of a geopolitical species[J]. Endangered Species Research, 2009, 7(3): 167-174. |
| [58] |
Zhang Y J, Guo Q, Wu Z Y. Ultrastructural histopathological study on lymphocystis of kelp bass, Epinephelus moara[J]. Oceanologia et Limnologia Sinica, 1997, 28(4): 406-410. [张永嘉, 郭青, 吴泽阳. 云纹石斑鱼淋巴囊肿病病变过程的超微研究[J]. 海洋与湖沼, 1997, 28(4): 406-410. DOI:10.3321/j.issn:0029-814X.1997.04.011] |
| [59] |
Guo M, Su Y, Wang J. Comparative studies on morphology of Epinephelus moara and E. Bruneus[J]. Acta Oceanologica Sinica, 2008, 30(6): 1016-114. |
| [60] |
Liu M, Li J L, Ding S X, et al. Epinephelus moara temminck and schlegel, 1842:A valid species of the family Epinephelidae (pisces:Perciformes) with highly commercial importance[J]. Journal of Fish Biology, 2013, 82(5): 1684-1699. DOI:10.1111/jfb.12112 |
| [61] |
Randall J E, Bogorodsky S V, Krupp F, et al. Epinephelus geoffroyi (klunzinger, 1870) (pisces:Serranidae), a valid species of grouper endemic to the red sea and gulf of aden[J]. Zootaxa, 2013, 3641(5): 524. DOI:10.11646/zootaxa.3641.5 |
| [62] |
Craig M T, Pondella D J, Franck J P C, et al. On the status of the serranid fish genus Epinephelus:Evidence for paraphyly based upon 16s rdna sequence[J]. Molecular Phylogenetics & Evolution, 2001, 19(1): 121-130. |
| [63] |
Maggio T, Andaloro F, Hemida F, et al. A molecular analysis of some eastern atlantic grouper from the Epinephelus and Mycteroperca genus[J]. Journal of Experimental Marine Biology and Ecology, 2005, 321(1): 83-92. DOI:10.1016/j.jembe.2005.01.004 |
| [64] |
Zhuang X, Ding S X, Guo F, et al. Molecular phylogenetic relationships of grouper species in China seas based on Cytochrome b gene fragment sequence[J]. Science in China Ser, C Life Sciences, 36(1): 27-34. [庄轩, 丁少雄, 郭丰, 等.基于细胞色素b基因片段序列研究中国近海石斑鱼类系统进化关系[J].中国科学C辑生命科学, 2006, 36(1): 27-34.]
|
| [65] |
Ding S X, Zhuang X, Guo F, et al. Molecular phylogenetic relationships of china seas groupers based on cytochrome b gene fragment sequences[J]. Science in China Series C, 2006, 49(3): 235-242. DOI:10.1007/s11427-006-0235-y |
| [66] |
Craig M T, Hastings P A, Pondella D J, et al. Phylogeography of the flag cabrilla Epinephelus labriformis (serranidae):Implications for the biogeography of the tropical eastern pacific and the early stages of speciation in a marine shore fish[J]. Journal of Biogeography, 2006, 33(6): 969-979. DOI:10.1111/jbi.2006.33.issue-6 |
| [67] |
Linder C R, Moret B M, Nakhleh L, et al. Network (reticulate) evolution: biology, models, and algorithms[C]. A tutorial presented at the Ninth Pacific Symposium on Biocomputing (PSB), 2004.
|
| [68] |
Payet S D, Hobbs J P A, DiBattista J D, et al. Hybridisation among groupers (genus Cephalopholis) at the eastern indian ocean suture zone:Taxonomic and evolutionary implications[J]. Coral Reefs, 2016, 35(4): 1157-1169. DOI:10.1007/s00338-016-1482-4 |
| [69] |
Harrison H B, Berumen M L, Saenz-Agudelo P, et al. Widespread hybridization and bidirectional introgression in sympatric species of coral reef fish[J]. Molecular Ecology, 2017, 26(20): 5692-5704. DOI:10.1111/mec.14279 |
| [70] |
Huang W, Liu Q, Xie J, et al. Characterization of triploid hybrid groupers from interspecies hybridization (Epinephelus coioides ♀×Epinephelus lanceolatus ♂)[J]. Aquaculture Research, 2016, 47(7): 2195-2204. DOI:10.1111/are.2016.47.issue-7 |
| [71] |
Ben-Tuvia A, Lourie A. A red sea grouper Epinephelus tavvina caught on the mediterranean coast of israel[J]. Israel Journal of Zoology, 1969, 18(2-3): 245-247. |
| [72] |
Dai C F. Biotic reefs and reef biotops in Taiwan area[J]. Journal of Palaeogeography, 2010, 12(5): 565-576. [戴昌凤. 台湾地区生物礁及其生境[J]. 古地理学报, 2010, 12(5): 565-576.] |
| [73] |
Qi X J. Brief introduction of morphology, geology, and earthquake in Taiwan Straits[J]. West-China Exploration Engineering, 1999, 11(4): 4-6. [戚筱俊. 台湾海峡地形、地质及地震概述[J]. 西部探矿工程, 1999, 11(4): 4-6.] |
| [74] |
IUCN. IUCN 2016. Iucn red list of threatened species. Version 2016.3. IUCN, 2016.
|
| [75] |
Zhang Q Y, Hong W S. Analysis on the status of fishery resources of Epinephelus akaara along the coast of Fujian[J]. Journal of Fujian Fisheries, 1992(4): 1-3. [张其永, 洪万树. 福建沿海赤点石斑鱼资源状况的分析[J]. 福建水产, 1992(4): 1-3.] |
| [76] |
Liu M, Sadovy Y J. Exploitation History, Mariculture and Trade Status of the Threatened Honk Kong Grouper (Epinephelus akaara) throughout its Geographic Range[M]. University of Hong Kong, 2009.
|
| [77] |
Sadovy Y J, Craig M T, Bertoncini A A, et al. Fishing groupers towards extinction:A global assessment of threats and extinction risks in a billion dollar fishery[J]. Fish and Fisheries, 2013, 14(2): 119-136. DOI:10.1111/faf.2013.14.issue-2 |
| [78] |
Koenig C C, Coleman F, Collins L A, et al. Reproduction in gag (Mycteroperca microlepis) (pisces: Serranidae) in the Eastern Gulf of Mexico and the consequences of fishing spawning aggregations[C]//Proceedings of the Conference on Biology, Fisheries and Culture of Tropical Groupers and Snappers, 1996, 48: 307-323.
|
| [79] |
Sadovy Y J. The case of the disappearing grouper: Epinephelus striatus, the Nassau grouper, in the Caribbean and Western Atlantic[C]//Proceedings of the Forty-Fifth Annual Gulf and Caribbean Fisheries Institute, 1999, 45: 5-22.
|
| [80] |
Andrello M, Mouillot D, Beuvier J, et al. Low connectivity between mediterranean marine protected areas:A biophysical modeling approach for the dusky grouper Epinephelus marginatus[J]. PLoS ONE, 2013, 8(7): e68564. DOI:10.1371/journal.pone.0068564 |
| [81] |
Edgar G J, Stuart-Smith R D, Willis T J, et al. Global conservation outcomes depend on marine protected areas with five key features[J]. Nature, 2014, 506(7487): 216-220. DOI:10.1038/nature13022 |
| [82] |
Sadovy Y J, Donaldson T J, Graham T R, et al. While Stocks Last:The Live Reef Food Fish Trade[M]. Manila, Philippines: Asia Development Bank, 2003.
|
| [83] |
Sadovy Y. Regional survey for fry/fingerling supply and current practices for grouper mariculture: evaluating current status and long-term prospects for grouper mariculture in South East Asia. Final report to the Collaboration APEC grouper research and development network (FWG01/99)[R]. Hong Kong: University of Hong Kong, 2000: 1-77.
|
| [84] |
Tseng W Y. Prospects for commercial netcage culture of red grouper (Epinephelus akaara T. & S.) in hong kong[J]. Journal of the World Aquaculture Society, 2010, 14(1-4): 650-660. |
| [85] |
Rimmer M A, Glamuzina B. A review of grouper (Family Serranidae: Subfamily Epinephelinae) aquaculture from a sustainability science perspective[J]. Reviews in Aquaculture, in press.
|
| [86] |
Tucker J W. Grouper culture[J]. World Aquaculture Baton Rouge, 2003, 34(3): 32-40. |
| [87] |
Kongkeo H, Wayne C, Murdjani M, et al. Current practices of marine finfish cage culture in China, Indonesia, Thailand and Vietnam[J]. Aquaculture Asia, 2010, 15(2): 32-40. |
| [88] |
Jiaxin C, Changtao G, Hao X, et al. A review of cage and pen aquaculture: China[M]//Halwart M, Soto D, Arthur J R (eds), Cage Aquaculture: Regional Reviews and Global Overview. Food & Agriculture Organizations, 2007.
|
| [89] |
Yashiro R. Overview of grouper aquaculture in Thailand[M]. Taiwan: Aquaculture of Grouper High Point Press, 2008: 143-154.
|
| [90] |
Liu M, Sadovy Y. Grouper aquaculture in Mainland China and Hong Kong[M]//Liao I C, Le no E M (eds). The Aquaculture of Groupers. Asian Fisheries Society, World Aquaculture Society, Fisheries Society of Taiwan, National Taiwan Ocean University, Quezon City, Philippines, 2008: 111-142.
|
| [91] |
Pomeroy R S, Agbayani R, Duray M, et al. The financial feasibility of small-scale grouper aquaculture in Philippines[J]. Aquaculture Economics & Management, 2004, 8(1-2): 61-83. |
| [92] |
Lin H R. The establishment of grouper cultural technology and the ideas for sustained development of grouper aquaculture industry[J]. Journal of Fujian Fisheries, 2012, 34(1): 1-10. [林浩然. 石斑鱼类养殖技术体系的创建和石斑鱼养殖产业持续发展的思考[J]. 福建水产, 2012, 34(1): 1-10. DOI:10.3969/j.issn.1006-5601.2012.01.001] |
| [93] |
Chang C Y, Chiu C C, Christopher J J A. Prophylaxis for iridovirus and nodavirus infections in cultured grouper in Taiwan[M]//Liao I C, Le no E M (eds). The Aquaculture of Groupers. Asian Fisheries Society, World Aquaculture Society, Fisheries Society of Taiwan, National Taiwan Ocean University, Quezon City, Philippines, 2008: 207-224.
|
| [94] |
Sugama K, Insan I, Koesshahrani I. Hatchery and grow-out technology of groupers in Indonesia[M]//Liao I C, Le no E M (eds). The Aquaculture of Groupers. Asian Fisheries Society, World Aquaculture Society, Fisheries Society of Taiwan, National Taiwan Ocean University, Quezon City, Philippines, 2008: 61-78.
|
| [95] |
Yang Q H. Embryonic development and growth of hybrid from the hybridization of Epinephelus moara (♀)×E. akaara (♂)[J]. Marine Fisheries, 2014, 36(3): 224-231. [杨求华. 云纹石斑鱼(♀)×赤点石斑鱼(♂)杂交子代胚胎发育及生长[J]. 海洋渔业, 2014, 36(3): 224-231. DOI:10.3969/j.issn.1004-2490.2014.03.005] |
| [96] |
Wang Y, Zhang Y, Zhang H F, et al. Comparison of morphology between two kinds of hybrid groupers and their parents[J]. Journal of Fisheries of China, 2014, 38(6): 778-785. [王燕, 张勇, 张海发, 等. 两种杂交石斑鱼及其亲本的形态差异分析[J]. 水产学报, 2014, 38(6): 778-785.] |
| [97] |
Li Y L, Wang Q Y, Chen C, et al. Embryonic and morphological development in larva, juvenile, and young stages of F1 by Epinephelus moara (♀)×E.septemfasciatus (♂)[J]. Journal of Fishery Sciences of China, 2012, 19(5): 821-832. [李炎璐, 王清印, 陈超, 等. 云纹石斑鱼(♀)×七带石斑鱼(♂)杂交子一代胚胎发育及仔稚幼鱼形态学观察[J]. 中国水产科学, 2012, 19(5): 821-832.] |
| [98] |
Eizaguirre C, Lenz T. Major histocompatibility complex polymorphism:Dynamics and consequences of parasite-mediated local adaptation in fishes[J]. Journal of Fish Biology, 2010, 77(9): 2023-2047. DOI:10.1111/j.1095-8649.2010.02819.x |
| [99] |
Kirkpatrick M, Barton N. Chromosome inversions, local adaptation and speciation[J]. Genetics, 2006, 173(1): 419-434. DOI:10.1534/genetics.105.047985 |
| [100] |
Taylor E B. A review of local adaptation in salmonidac, with particular reference to pacific and atlantic salmon[J]. Aquaculture, 1991, 98(1-3): 185-207. DOI:10.1016/0044-8486(91)90383-I |
 2018, Vol. 25
2018, Vol. 25
