2. 西藏自治区农牧科学院, 西藏 拉萨 850000
2. Tibet Academy of Agriculture and Animal Husbandry Sciences, Lhasa 850000, China
雅鲁藏布江位于西藏地区, 是世界上海拔最高的大河之一, 特产裂腹鱼亚科(Schizothoracinae)鱼类, 在中游区域裂腹鱼亚科共有4属6种[1-2], 分别为拉萨裂腹鱼(Schizothorax waltoni)、异齿裂腹鱼(Schizothorax o’connori)、巨须裂腹鱼(Schizothorax macropogon)、拉萨裸裂尻鱼(Schizothorax younghusbandi)、双须叶须鱼(Ptychobarbus dipogon)和尖裸鲤(Oxygymnocypris stewarti)。2015年5月调查发现, 在雅鲁藏布江中游的干流水域除了已有记载的6种裂腹鱼外, 还存在另外1种形态特征明显区别于其他种的裂腹鱼群体, 但该种吻、口裂、下唇、须等头部形态特征又居于拉萨裂腹鱼和异齿裂腹鱼之间, 疑似为拉萨裂腹鱼和异齿裂腹鱼的自然杂交种。此前, 在雅鲁藏布江的支流拉萨河曾发现过类似的疑似杂交种[3-4], 但未进行深入研究, 对于是否为拉萨裂腹鱼和异齿裂腹鱼的自然杂交种, 还是另有分类地位尚无定论, 而在雅鲁藏布江的干流水域中还没有发现该物种的报道, 相关研究还存在空白。
自然杂交是生物适应性进化的一种基本方式, 在物种演化过程中发挥着重要的作用[5-7], 鱼类不同属种间在自然界中发生杂交的现象比较普遍[8-14]。自然杂交有利于新物种的形成[8-9]、丰富遗传多样性[16]、适应环境变化[17]等, 也可能产生遗传同质化[18]、外来基因入侵[19-20]、种群资源衰退[21]等影响。由于青藏高原特殊的生态环境, 鱼类在种类特征、地理分布和起源进化上具有其独特性[1-2, 22], 裂腹鱼类是青藏高原的优势类群, 其演化过程与青藏高原的隆起密切相关[23], 但许多裂腹鱼类仍处于物种分化阶段, 鱼类分类性状仍不稳定[2], 特别是存在着特殊进化机制的孤立小群体和共存于小生境的形态相似种群[24], 高原特有裂腹鱼的形态相似种或自然杂交种的分类鉴定及进化机制还存在复杂情况。目前, 青藏高原地区裂腹鱼在自然界中能够杂交的情况还不多见, 而雅鲁藏布江的拉萨裂腹鱼和异齿裂腹鱼之间可能存在着自然杂交现象, 这对于了解西藏高原地区鱼类的自然杂交机制、鉴定分类地位、探讨物种演化过程, 以及保护物种资源具有重要的研究价值。
鱼类杂交后代的形态性状一般居于双亲之间, 具有偏向于双亲的某些特征[8-14, 25], 并在基因上含有双亲的遗传物质[12-14, 26-28], 判定自然杂交种主要依据于形态学性状和遗传学特性。鱼类的线粒体DNA遵从母性遗传[29], 是研究自然杂交遗传进化方面的有效分子手段, 基于COI基因的DNA条形码技术能够为鱼类物种识别和鉴定提供可靠的遗传学依据和支撑[30-32]。本研究拟在比较雅鲁藏布江干流拉萨裂腹鱼、异齿裂腹鱼及其疑似自然杂交种的主要形态学特征差异的基础上, 利用线粒体DNA的COI基因序列进一步分析疑似杂交种与双亲的遗传亲缘关系, 以其从DNA条形码进行物种识别和鉴定, 为确定其物种地位提供理论依据。
1 材料与方法 1.1 样本采集与保存2015年5月, 在雅鲁藏布江干流的桑日(29°15'10.92"N, 92°28'32.29"E, 海拔3335 m)、朗县(29°503.492'N, 92°558.728'E, 海拔3116 m)等江段, 主要使用电捕方式随机捕获样本(采捕工作得到西藏自治区农牧厅的批准和支持), 获得拉萨裂腹鱼、异齿裂腹鱼及拉萨裂腹鱼和异齿裂腹鱼的疑似自然杂交种样本。现场对鱼类进行分类鉴定、拍照、统计渔获物, 对桑日段的杂交种个体进行随机编号(共采集到15个样本, 编号为WO1~ WO15), 新鲜鱼体样本带回实验室进行形态学分析。取鳍条组织, 置于无水乙醇中保存, 用于线粒体DNA基因序列分析, 杂交种的分子样本数据编号与形态学样本一一对应, 用于形态和遗传分析的样本信息如表 1所示。
|
|
表 1 拉萨裂腹鱼、异齿裂腹鱼群体及其疑似自然杂交种形态学分析的样本信息 Tab.1 Sample information of morphological comparison between Schizothorax waltoni, Schizothorax o'connori and their natural hybrid in the Yarlung Zangbo River |
按照雅鲁藏布江裂腹鱼属的分类学形态特征对拉萨裂腹鱼与异齿裂腹鱼进行物种鉴定[1], 杂交种主要依据头部形态中的头、吻、口裂、下唇、须等特征居于拉萨裂腹鱼与异齿裂腹鱼之间并明显区别于其它种裂腹鱼进行鉴别, 对拉萨裂腹鱼和异齿裂腹鱼选择与疑似杂交种规格相近的个体用于形态特征比较分析。形态测量与分析方法参照《内陆渔业自然资源调查手册》[33], 数据统计分析使用Excel 2007、SPSS19.0等软件。
1.3 线粒体DNA COI基因序列分析裂腹鱼总DNA利用UNIQ-10柱式DNA抽提试剂盒提取, 线粒体DNA的COI基因扩增引物为FishF1: 5'-TCAACCAACCACAAAGACATTGGCAC- 3'和FishR1: 5'-TAGACTTCTGGGTGGCCAAAGAATCA-3' [34]。PCR反应体系为10×buffer 5 μL, 25 mmol/L的MgCl2 3 μL, 10 mmol/L的dNTPs 1 μL, 10 mmol/L的引物各2 μL, Taq酶2.0 U, 以及100 ng/μL的DNA模板1 μL, 加双蒸水至50 μL。PCR反应条件为: 94℃预变性3 min; 94℃变性45 s, 55℃退火45 s, 72℃延伸45 s, 共30个循环; 最后72℃延伸8 min。扩增产物经琼脂糖凝胶电泳后用柱式DNA回收试剂盒回收, PCR产物经纯化后, 送至生物公司进行测序, 测序用引物为扩增引物FishF1。
利用Clustal X软件对测定的拉萨裂腹鱼、异齿裂腹鱼及其疑似自然杂交种群体的COI基因序列进行对位排列, 利用DnaSP 4.10软件进行单倍型分析, 利用Mega 5.1软件中双参数法计算遗传距离。选择桑日段的巨须裂腹鱼(1个样本)进行比对, 使用邻接法(NJ)构建系统树, 应用自举检验(bootstrap test)估计系统树中节点的置信度, 设置为1000次重复。
2 结果与分析 2.1 疑似杂交种的地理分布及群体资源2015年5月, 在雅鲁藏布江中游干流长约1300 km范围内, 自上而下设置了仲巴、萨嘎、拉孜、谢通门、日喀则、仁布、贡嘎、桑日、加查、朗县、米林、派镇共12个鱼类调查段面, 仅在朗县、桑日江段发现拉萨裂腹鱼和异齿裂腹鱼的疑似杂交种。共采集具有杂交种类型的个体16尾, 其中, 桑日段为15尾, 朗县段仅1尾, 在雅鲁藏布江干流的其他江段还未发现。在桑日段水域, 还分布有裂腹鱼属的异齿裂腹鱼、拉萨裂腹鱼、巨须裂腹鱼, 以及少数的拉萨裸裂尻鱼等。在总计捕获鱼类263尾中, 异齿裂腹鱼为优势种, 占63.5%;其次为拉萨裂腹鱼, 占24.3%;疑似杂交种占渔获物的5.7%。在朗县段水域, 疑似杂交种稀少, 仅占渔获物的0.9%, 在此后的2016年和2017年调查时再未发现, 而桑日段还有分布。
2.2 形态特征分析在体型上, 疑似杂交种与拉萨裂腹鱼、异齿裂腹鱼相近, 略偏向于异齿裂腹鱼, 体侧有少数的黑色斑点, 拉萨裂腹鱼和异齿裂腹鱼的体测具有较多的黑色斑点(也有部分个体黑色斑点较少)。头部的外部形态存在明显差别, 主要表现在吻端、口部、下颌、须长等外部形态特征(图 1, 表 2)。体长相近的个体相比, 拉萨裂腹鱼的头长、吻尖、口型为马蹄形, 下颌边缘较柔软; 下唇两叶皮褶肥大, 唇须长并远伸过眼后缘下方; 异齿裂腹鱼头短、吻圆钝, 口型呈横直形, 下颌角质边缘锐利, 下唇无皮褶, 唇须短不达眼中间下方; 疑似杂交种的头略长, 与异齿裂腹鱼相近, 吻略尖, 口型为弧形, 下颌边缘较锐利, 下唇两叶皮褶略大, 颌须略长, 伸过眼中间下方而接近眼后缘。疑似杂交种的头部形态特征居于拉萨裂腹鱼和异齿裂腹鱼之间, 并明显区别于拉萨裂腹鱼和异齿裂腹鱼, 且15尾个体(WO1~WO15)的头部形态稳定一致, 均具有典型的中间型特征, 个体间没有明显差异, 即从外部形态判断, 这些个体都可列为拉萨裂腹鱼和异齿裂腹鱼的疑似杂交种类型。
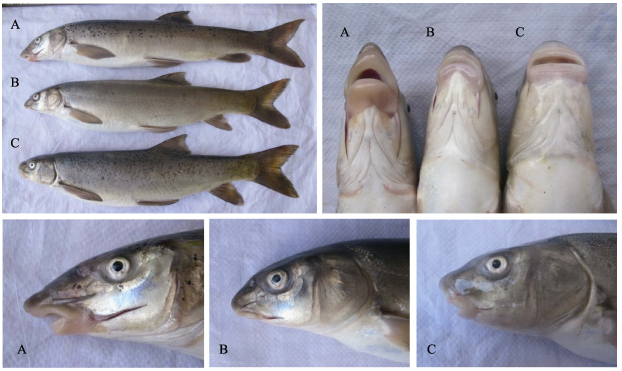
|
图 1 雅鲁藏布江中游拉萨裂腹鱼、异齿裂腹鱼及其疑似自然杂交种 A:拉萨裂腹鱼; B:拉萨裂腹鱼与异齿裂腹鱼的疑似杂交种; C:异齿裂腹鱼. Fig.1 Schizothorax waltoni, Schizothorax o'connori and their hybrid in the Yarlung Zangbo River A. Schizothorax waltoni; B. hybrid of Schizothorax waltoni and Schizothorax o'connori; C. Schizothorax o'connori. |
|
|
表 2 拉萨裂腹鱼、异齿裂腹鱼群体及其疑似杂交种主要头部形态特征比较 Tab.2 Morphological comparison of heads between Schizothorax waltoni, S. o'connori and hybrid of both in the Yarlung Zangbo River |
在主要的可比性状中, 拉萨裂腹鱼、异齿裂腹鱼及其疑似杂交种的差异主要表现在头部特征上, 对拉萨裂腹鱼和异齿裂腹鱼进行群体的区间分析, 对杂交种的比例特征进行个体的一一对应分析(表 3)。拉萨裂腹鱼与异齿裂腹鱼存在显著差异, 其中在头长/头厚、头长/吻长、头长/眼间距、吻须长/眼径、颌须长/眼径、口裂宽/下颌长等数值上完全没有交叉, 而表现为拉萨裂腹鱼比异齿裂腹鱼的吻要长, 头要窄, 眼间距离要小, 吻须和颌须要长, 口裂要小。杂交种(WO1~WO15)在上述性状中, 除少数个体的最大值和最小值与拉萨裂腹鱼和异齿裂腹鱼接近或略有交叉外, 大部分居于两者之间, 且个体之间的数值分布连续, 群体中没有出现极端值, 表明杂交种的外部形态均一稳定, 处于群体内的正常分布区间。
|
|
表 3 拉萨裂腹鱼、异齿裂腹鱼群体及其疑似杂交种头部的主要可比性状比较 Tab.3 Measurements comparison of head between Schizothorax waltoni, Schizothorax o'connori and their hybrid in the Yarlung Zangbo River |
利用线粒体DNA COI基因片段序列, 对疑似杂交种的15个样本与同域分布的拉萨裂腹鱼(12个样本)、异齿裂腹鱼(12个样本)、巨须裂腹鱼(1个样本)等3种裂腹鱼类进行比对分析。经测序比对后, 获得4种鱼的线粒体DNA COI基因部分序列长度为644 bp。其中, 拉萨裂腹鱼群体中未检测到变异位点, 定义1个单倍型; 异齿裂腹鱼群体中检测到4个变异位点, 约占总序列长度的0.62%, 单一变异位点4个, 简约信息位点0个, 共定义4个单倍型; 疑似杂交种群体中检测到9个变异位点, 约占总序列长度的1.39%, 单一变异位点2个, 简约信息位点7个, 共定义5个单倍型。
用Mega 5.1软件的邻接法(NJ)构建系统进化树(图 2), 4种裂腹鱼类形成3个大的分支, 分别对应着拉萨裂腹鱼、异齿裂腹鱼和巨须裂腹鱼。疑似杂交种群体中, 编号为WO1、WO5、WO10和WO11的个体(设为A群体)聚类到拉萨裂腹鱼群体中, 并与拉萨裂腹鱼共享同一个单倍型; 剩余个体(设为B群体)聚类到异齿裂腹鱼群体中, 除WO7和WO8各自独享单倍型外, 其他个体都能与异齿裂腹鱼的个体共享单倍型。即在疑似杂交种群体的线粒体DNA COI基因中, 既有可归为拉萨裂腹鱼的个体(4个), 又有可归为异齿裂腹线粒的个体(11个), 且属于异齿裂腹鱼的个体要远多于属于拉萨裂腹鱼的个体。
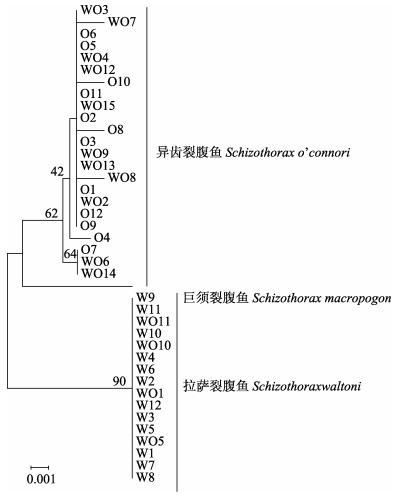
|
图 2 基于线粒体DNA CO I序列构建的NJ树 节点处的数字为1000次bootstrap检验的置信度. Fig.2 A neighbor-joining tree of the genus Schizothorax in resulted from mitochondrial DNA COI sequence Numbers at nodes are confidence degree in bootstrap analysis (1000 replicates). |
基于COI基因序列的Kimura 2-parameter遗传距离如表 4所示, 疑似杂交种的A群体与异齿裂腹鱼的遗传距离最近, 序列分歧为0; B群体与拉萨裂腹鱼的遗传距离最近, 序列分歧为0.000~ 0.003, 而拉萨裂腹鱼、异齿裂腹鱼和巨须裂腹鱼3个种间的遗传分歧为0.008~0.014。结果表明, A群体和B群体分别与拉萨裂腹鱼和异齿裂腹的遗传分化远低于同域分布3种裂腹鱼类种间水平, 各自应属于种内变异, 即在亲缘关系上, A群体应属于拉萨裂腹鱼, B群体应属于异齿裂腹鱼。
|
|
表 4 基于线粒体DNA COI序列的Kimura 2-parameter遗传距离 Tab.4 Kimura 2-parameter distance on mitochondrial DNA COI sequences |
鱼类杂交后代的形态性状一般居于双亲之间, 具有偏向于双亲的某些特征[10-16, 27]。经形态学分析, 疑似杂交种裂腹鱼类的头部形态特征处于拉萨裂腹鱼和异齿裂腹鱼的中间类型, 没有明显偏向任何一方(图 1, 表 3), 但更似乎像是拉萨裂腹鱼和异齿裂腹鱼的中间过渡类型, 与同域分布的巨须裂腹鱼、拉萨裸裂尻鱼等其他鱼类也相差甚远。疑似杂交种在渔获物中数量较多, 形成了相对稳定的群体, 表明这些个体不应是拉萨裂腹鱼或异齿裂腹鱼的个体特殊变异。若拉萨裂腹鱼和异齿裂腹可以杂交, 则该种具有符合杂交后代的形态特征, 应该具有稳定的亲本来源。
鱼类的线粒体DNA遵从母性遗传, 后代中具有母本的遗传物质[29], 是判断母本来源的重要信息。经线粒体DNA COI基因条形码分析, 在疑似杂交种的群体中(15个样本)可分别鉴定出含有拉萨裂腹鱼(4个样本)和异齿裂腹鱼(11个样本)的同缘遗传信息的个体(图 2, 表 4), 即从遗传特性上疑似杂交种应分属于这2种鱼, 这暗示拉萨裂腹鱼和异齿裂腹鱼都可以作为疑似杂交种的母本。事实上拉萨裂腹鱼和异齿裂腹鱼不可能通过自繁而都产生相同的具中间形态类型的后代, 进而推测拉萨裂腹鱼和异齿裂腹鱼确实能够自然杂交, 且都可以作为母本, 而另一种可以做父本, 从而杂交后代群体中可以出现既含有拉萨裂腹鱼母本基因的个体, 也含有异齿裂腹鱼母本基因的个体。
综合上述研究可以确认, 在雅鲁藏布江中游的桑日、朗县等地发现的具有中间类型的裂腹鱼类应为拉萨裂腹鱼和异齿裂腹鱼的自然杂交种, 可分别由拉萨裂腹鱼和异齿裂腹鱼作母本产生杂交后代, 且杂交种个体之间的形态特征没有明显差异而保持一致。基于线粒体COI基因条形码可以对拉萨裂腹鱼和异齿裂腹鱼进行鉴别, 但由于两者的自然杂交可以互为母本, 杂交种群体中会分别含有拉萨裂腹鱼和异齿裂腹鱼的亲本基因, 则对于杂交种的条形码识别需要结合形态学特征, 即可先通过形态学进行杂交种的识别, 再利用COI基因条形码对照拉萨裂腹鱼和异齿裂腹鱼进行亲本来源鉴定。
3.2 拉萨裂腹鱼和异齿裂腹鱼自然杂交现象的发生在鱼类中, 由于体外排卵受精、生态位重叠、竞争有限的产卵场等原因[9], 鱼类的杂交情况一般发生在特定的环境。拉萨裂腹鱼、异齿裂腹鱼为雅鲁藏布江的广布种[2], 在中游干流各段均有分布, 而拉萨裂腹鱼与异齿裂腹鱼杂交种仅在桑日、朗县有发现, 在中游干流的其他水域尚未发现, 支流中也仅在拉萨河可能出现过[3], 说明该杂交种并非广泛分布, 应该也只在特定区域存在, 且杂交种在桑日段渔获物中所占数量较多(5.7%), 表明这种自然杂交现象主要出现在桑日段。
雅鲁藏布江的裂腹鱼类大多在浅滩流水处, 底质为砾石粗砂的环境中产卵繁殖[2]。桑日段处于山南宽谷段和加查峡谷段之间, 其中山南河谷段水面宽阔, 流速缓慢, 底质为沙土[35]; 加查峡谷段山体陡峭, 河道狭窄, 水流湍急[36], 这些区域的环境条件可能不适合裂腹鱼的自然产卵繁殖。桑日段上下连接着山南宽谷和加查峡谷, 为过度区域, 流速合适, 底质主要以砾石为主, 推测是裂腹鱼类的主要产卵场, 但区域有限, 仅长10余km。实际调查显示, 雅鲁藏布江中游下段(桑日至派镇)裂腹鱼的自然繁殖时期为4—5月, 栖息于峡谷和宽谷内的裂腹鱼类均在产卵时期汇聚到桑日河段进行产卵, 因此, 由于产卵场重叠, 产卵时期相近, 且产卵场的区域狭小, 推测拉萨裂腹鱼和异齿裂腹鱼就出现了能够自然杂交的现象。这种自然杂交在桑日段应该为普遍发生, 并能保持一定数量的杂交后代群体, 而其他区域可能不具备这种特殊的水域环境, 仅在朗县段发现有杂交种, 但数量极少, 自然杂交应该为偶然发生。
3.3 拉萨裂腹鱼和异齿裂腹鱼自然杂交机制拉萨裂腹鱼和异齿裂腹鱼能够杂交, 且杂交种生长正常、数量较多并形成了稳定的后代群体, 表明对环境具有较强的适应能力, 显示出裂腹鱼类在高原特殊环境下长期演化过程中形成的一种独特的自然现象, 杂交种的发现不仅丰富了雅鲁藏布江鱼类物种多样性, 也提示了这可能是裂腹鱼类适应性进化的一种方式。研究表明, 鱼类双亲间的染色体组型越相近, 杂交亲和性越强且成功概率也越高[37], 拉萨裂腹鱼和异齿裂腹鱼具有相同的染色体数和相近的核型[38], 遗传同质性较高, 可能是两者能够在自然水域杂交的重要遗传物质基础。拉萨裂腹鱼和异齿裂腹鱼均可以作为母本, 而产生的杂交种的形态学特征却还能保持一致, 也没有明显偏向某一方亲本, 且还不清楚杂交种是否可育, 以及对双亲的遗传影响作用, 相关的杂交遗传机制尚值得深入研究。
| [1] |
Wu Y F, Wu C Z. The Fishes of the Qinghai-Xizang Plateau[M]. Chengdu: Sichuan Publishing House of Science & Technology, 1992. [武云飞, 吴翠珍. 青藏高原鱼类[M]. 成都: 四川科学技术出版社, 1992.]
|
| [2] |
Bureau of Aquatic Products, Tibet, China. Fishes and Fish Resources in Xizang, China[M]. Beijing: China Agriculture Press, 1995. [西藏自治区水产局. 西藏鱼类及其资源[M]. 北京: 中国农业出版社, 1995.]
|
| [3] |
Ren B, Ren M L. Notes on fishes from Dangqu River of northern Xizang[J]. Chinese Journal of Fisheries, 2003, 16(2): 1-11. [任波, 任慕莲. 西藏当曲河的鱼类[J]. 水产学杂志, 2003, 16(2): 1-11. DOI:10.3969/j.issn.1005-3832.2003.02.001] |
| [4] |
Chen F, Chen Y F. Investigation and protection strategies of fishes of Lhasa River[J]. Acta Hydrobiologica Sinica, 2010, 34(2): 278-283. [陈锋, 陈毅锋. 拉萨河鱼类调查及保护[J]. 水生生物学报, 2010, 34(2): 278-283.] |
| [5] |
Dowling T E, Secor C L. The role of hybridization and introgression in the diversification of animals[J]. Annual Review of Ecology and Systematics, 1997, 28: 593-619. DOI:10.1146/annurev.ecolsys.28.1.593 |
| [6] |
Barton N H. The role of hybridization in evolution[J]. Molecular Ecology, 2001, 10: 551-568. |
| [7] |
Seehausen O. Hybridization and adaptive radiation[J]. Trends in Ecology & Evolution, 2004, 19: 198-207. |
| [8] |
Xue Z Y, Yu Z T. Natural hybrids of Hemibarbus maculates and Hemibarbus labeo[J]. Acta Hydrobiologica Sinica, 1959(2): 229-230. [薛镇宇, 余志堂. 花䱻和重唇鱼的天然杂交种[J]. 水生生物学集刊, 1959(2): 229-230.] |
| [9] |
Yu C R, Wang W, Chen D G. A preliminary observation on a natural bastard of the Parasilurus asotus and Silurus soldatovi[J]. Transactions of Oceanology and Limnology, 1982(1): 41-44. [于常荣, 王炜, 陈大刚. 鲶鱼Parasilurus asotus与六须鲶Silurus soldatov天然杂交种的初步观察[J]. 海洋湖沼通报, 1982(1): 41-44.] |
| [10] |
Campton D E, Utter F M. Natural hybridization between steelhead trout (Salmo gairdneri) and coastal cutthroat trout (S. clarki) in two Puget Sound streams[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1985, 42: 110-119. DOI:10.1139/f85-014 |
| [11] |
de Leániz C G, Verspoor E. Natural hybridization between Atlantic salmon, Salmo salar and brown trout, Salmo trutta, in northern Spain[J]. Journal of Fish Biology, 1989, 34: 41-46. DOI:10.1111/jfb.1989.34.issue-1 |
| [12] |
Jordan W C, Verspoor E. Incidence of natural hybrids between Atlantic salmon, Salmo salar L., and brown trout, Salmo trutta L., in Britain[J]. Aquaculture Research, 1993, 24(3): 373-377. DOI:10.1111/j.1365-2109.1993.tb00559.x |
| [13] |
Vetešn k L, Halačka K, Papoušek I, et al. The first record of a natural hybrid of the roach Rutilus rutilus and nase Chondrostoma nasus in the Danube River basin, Czech Republic:morphological, karyological and molecular characteristics[J]. Journal of Fish Biology, 2009, 74(7): 1669-1676. DOI:10.1111/jfb.2009.74.issue-7 |
| [14] |
Müller T, Taller J, Kolics B, et al. First record of natural hybridization between pikeperch Sander lucioperca and Volga pikeperch S. volgensis[J]. Journal of Fish Biology, 2010, 26(3): 481-484. |
| [15] |
May-McNally S L, Quinn T P, Taylor E B. Low levels of hybridization between sympatric Arctic char (Salvelinus alpinus) and Dolly Varden char (Salvelinus malma) highlights their genetic distinctiveness and ecological segregation[J]. Ecology & Evolution, 2015, 5(15): 3031-3045. |
| [16] |
Selz O M, Thommen R, Maan M E, et al. Behavioural isolation may facilitate homoploid hybrid speciation in cichlid fish[J]. Journal of Evolutionary Biology, 2014, 27(2): 275-289. DOI:10.1111/jeb.2014.27.issue-2 |
| [17] |
Bittner D, Excoffier L, Largiader C R. Patterns of morphological changes and hybridization between sympatric whitefish morphs (Coregonus spp.) in a Swiss lake:arole for eutrophication?[J]. Molecular Ecology, 2010, 19(10): 2152-2167. DOI:10.1111/mec.2010.19.issue-10 |
| [18] |
Fabien C L, Christopher S, Amandine M, et al. Dynamics of introgressive hybridization assessed by SNP population genomics of coding genes in stocked brook charr (Salvelinus fontinalis)[J]. Molecular Ecology, 2012, 21(12): 2877-2895. DOI:10.1111/j.1365-294X.2012.05579.x |
| [19] |
Muhlfeld C C, McMahon T E, Thomas E, et al. Spatial and temporal spawning dynamics of native westslope cutthroat trout, Oncorhynchus clarkii lewisi, introduced rainbow trout, Oncorhynchus mykiss, and their hybrids[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2009, 66: 1153-1168. DOI:10.1139/F09-073 |
| [20] |
Winkler K A, Pamminger-Lahnsteiner B, Wanzenb ck J, et al. Hybridization and restricted gene flow between native and introduced stocks of Alpine whitefish (Coregonus sp.) across multiple environments[J]. Molecular Ecology, 2011, 20: 456-472. DOI:10.1111/mec.2011.20.issue-3 |
| [21] |
Kimmo K K, Kjartan Ø, Chris H. Speciation in reverse:morphological and genetic evidence of the collapse of a three-spined stickleback (Gasterosteus aculeatus) species pair[J]. Molecular Ecology, 2011, 20(18): 3838-3855. DOI:10.1111/mec.2011.20.issue-18 |
| [22] |
Wu Y F, Tan Q J. Characteristics of the fish-fauna of the characteristics of Tibetan Plateau and its geological distribution and formation[J]. Acta Zoologica Sinica, 1991, 37(2): 135-152. [武云飞, 谭齐佳. 青藏高原鱼类区系特征及其形成的地史原因分析[J]. 动物学报, 1991, 37(2): 135-152. DOI:10.3321/j.issn:0001-7302.1991.02.001] |
| [23] |
Zhao Y H, Zhang J, Zhang C G. Fish diversity in the Tibetan Plateau[J]. Biology Bulletin, 2008, 43(7): 8-10. [赵亚辉, 张洁, 张春光. 青藏高原鱼类的多样性[J]. 生物学通报, 2008, 43(7): 8-10. DOI:10.3969/j.issn.0006-3193.2008.07.003] |
| [24] |
Qi D L, Guo S C, Tang W J, et al. Molecular systematics of morphologically similar fishes in the Schizothoracinae in Nanmenxia River, with implication for morphological convergent evolution[J]. Acta Zoologica Sinica, 2006, 52(5): 862-870. [祁得林, 郭松长, 唐文家, 等. 南门峡裂腹鱼亚科鱼类形态相似种的分类学地位——形态趋同进化实例[J]. 动物学报, 2006, 52(5): 862-870.] |
| [25] |
Zhang Y, Liu X Y, Qu Q Z, et al. Comparative discriminate analysis of morphological traits among Acipenser schrenckii, Huso dauricus and their hybrid (A. schrenckii (♂)×H. dauricus (♀))[J]. Freshwater Fisheries, 2012, 42(6): 27-32. [张颖, 刘晓勇, 曲秋芝, 等. 达氏鳇、施氏鲟及其杂交种(施氏鲟♂×达氏鳇♀)形态差异与判别分析[J]. 淡水渔业, 2012, 42(6): 27-32. DOI:10.3969/j.issn.1000-6907.2012.06.005] |
| [26] |
Baxter J S, Taylor E B, Devlin R H, et al. Evidence for natural hybridization between Dolly Varden (Salvelinus malma) and bull trout (Salvelinus confluentus) in a northcentral British Columbia watershed[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1997, 54: 421-429. DOI:10.1139/f96-289 |
| [27] |
Gratton P, Allegrucci G, Gandolfi A, et al. Genetic differentiation and hybridization in two naturally occurring sympatric trout Salmo spp. forms from a small karstic lake[J]. Journal of Fish Biology, 2013, 82(2): 637-657. DOI:10.1111/jfb.12022 |
| [28] |
Solem Ø, Berg O K, Verspoor E, et al. Morphological and genetic comparison between naturally produced smolts of Atlantic salmon, brown trout and their hybrids[J]. Fisheries Management and Ecology, 2014, 21(5): 357-365. DOI:10.1111/fme.2014.21.issue-5 |
| [29] |
Vaughn K C, Debonte L R, Wilson K G. Organelle alteration as mechanism for matermal inheritance[J]. Science, 1980, 208: 196-197. DOI:10.1126/science.208.4440.196 |
| [30] |
Li Q, Zou S M, Zheng X D, et al. DNA barcoding and its applications in marine organisms[J]. Periodical of Ocean University of China, 2010, 40(8): 43-47. [李琪, 邹山梅, 郑小东, 等. DNA条形码及其在海洋生物中的应用[J]. 中国海洋大学学报, 2010, 40(8): 43-47.] |
| [31] |
Liu S F, Chen L L, Dai F Q, et al. Applicaction of DNA barcoding gene COI for classifying family. Sciaenidae[J]. Oceanologia et Limnologia Sinica, 2010, 40(2): 223-232. [柳淑芳, 陈亮亮, 戴芳群, 等. 基于线粒体COI基因的DNA条形码在石首鱼科(Sciaenidae)鱼类系统分类中的应用[J]. 海洋与湖沼, 2010, 40(2): 223-232.] |
| [32] |
Liu S F, Li X R, Du T F, et al. DNA barcoding and electronic microarray for common fish species in Shandong coastal waters[J]. Journal of Fishery Sciences of China, 2016, 23(4): 777-790. [柳淑芳, 李献儒, 杜腾飞, 等. 山东近海习见鱼类DNA条形码及其电子芯片分析[J]. 中国水产科学, 2016, 23(4): 777-790.] |
| [33] |
Zhang J M, He Z H. Handbook of Fisheries Natural Resources Survey for Inland Waters[M]. Beijing: Agriculture Press, 1991. [张觉民, 何志辉. 内陆水域渔业自然资源调查手册[M]. 北京: 农业出版社, 1991.]
|
| [34] |
Robert D W, Tyler S Z, Bronwyn H I, et al. DNA barcoding australia's fish species[J]. Philosophical Transactions of the Royal Society, 2005, 360: 1847-1857. DOI:10.1098/rstb.2005.1716 |
| [35] |
Yuan L, Shen W S, Li H D, et al. Evolution and causes of aeolian desertification of the middle reaches of Yarlung Zangbo River, China[J]. Journal of Ecology and Rural Environment, 2010, 26(4): 301-305. [袁磊, 沈渭寿, 李海东, 等. 雅鲁藏布江中游河谷区域风沙化土地演变趋势及驱动因素[J]. 生态与农村环境学报, 2010, 26(4): 301-305. DOI:10.3969/j.issn.1673-4831.2010.04.003] |
| [36] |
Zhu S, Zhao X T, Wu Z H. Response of fluvial landform of the Gyaca sector of the Yarlung Zangbo River to tectonic movement and climate[J]. Acta Geoscientica Sinica, 2011, 32(3): 349-356. [祝嵩, 赵希涛, 吴珍汉. 雅鲁藏布江加查段河流地貌对构造运动和气候的响应[J]. 地球学报, 2011, 32(3): 349-356. DOI:10.3975/cagsb.2011.03.10] |
| [37] |
Wang Z X, Zhang J X, Jin G Q. Study on the incompatibility of fish hybridization[J]. Acta Hydrobiologica Sinica, 1986, 10(2): 171-179. [王祖熊, 张锦霞, 靳光琴. 鱼类杂交不亲和性的研究[J]. 水生生物学报, 1986, 10(2): 171-179.] |
| [38] |
Yu X Y, Li Y C, Zhou D. Karyotype studies of Cyprinid fishes in China-comparative study of the karyotypes of 8 species of Schizothoracine fishes[J]. Journal of Wuhan University (Natural Science Edition), 1990(2): 97-104. [余祥勇, 李渝成, 周敦. 中国鲤科鱼类染色体组型研究——8种裂腹鱼亚科鱼类核型研究[J]. 武汉大学学报(自然科学版), 1990(2): 97-104.] |
 2018, Vol. 25
2018, Vol. 25

