2. 中国水产科学研究院黑龙江水产研究所, 黑龙江 哈尔滨 150070;
3. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心, 上海 201306
2. Heilongjiang Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin 150070, China;
3. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding; Shanghai Ocean University, Shanghai 201306, China
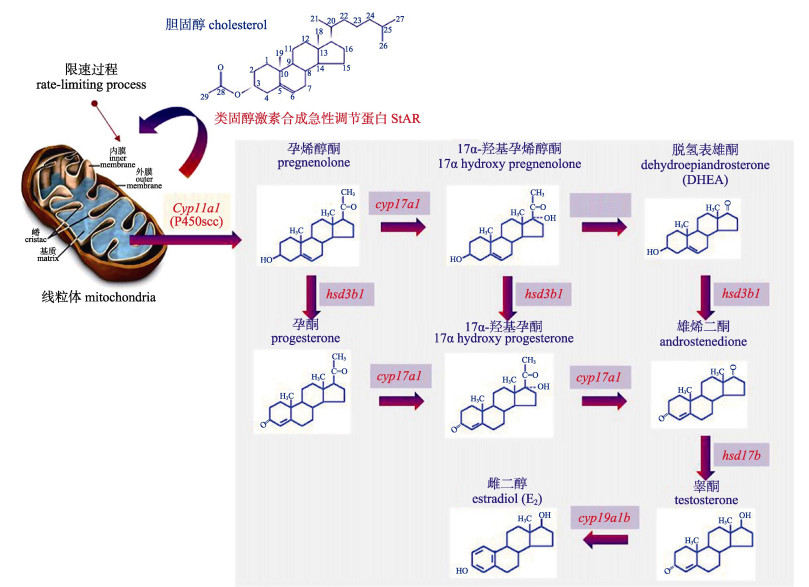
虹鳟(Oncorhynchus mykiss)自20世纪50年代引进中国以来, 因其较高的经济价值和食用价值受到养殖者的青睐。相比于二倍体虹鳟, 三倍体虹鳟具有生长快、个体大、经济效益更高的特点, 近年来受到广泛关注。但三倍体虹鳟性腺发育迟缓, 从8月龄开始, 雌性性腺发育出现异常, 不能产生正常的卵细胞, 雄性同样不能产生正常的精子[1]。与哺乳动物不同, 调节硬骨鱼类神经形成进而影响性腺发育的神经类固醇物质的合成起始于脑部。而相关的神经类固醇生成酶由细胞色素P450家族的部分基因编码[2], 这些基因在虹鳟性腺未分化时(35~63 dpf, days post fertilization)就已开始表达, 且其调控通路较为复杂, 相互之间产生影响[3-4]。首先细胞色素P450侧链裂解酶(P450scc, 由Cyp11a1基因编码)催化胆固醇转化为孕烯醇酮, 启动生物体内类固醇激素合成的第一步, 之后3β-羟化类固醇脱氢酶(Hsd3b编码)催化Δ5类固醇转化成Δ4类固醇, 即将孕烯醇酮转化成孕酮, 沿着此通路17-羟化酶和17, 20-裂解酶(由Cyp17a1编码)将孕酮转化成雄激素。而11β-羟化酶(由Cyp11b2编码)参与特异性雄激素(11-氧化雄激素)的产生, 此特异性雄激素能够活化类固醇使其产生生物活性。
而Cyp19a1b作为脊椎动物脑性别分化的关键要素, 它能够将雄激素转化成雌激素, 最终决定动物性别[5-7]。脑芳香化酶活性在鱼脑中的表达随着年龄和性类固醇水平的提高而增加[8]。Cyp19a1b高表达是通过雌激素和芳香化的雄激素上调芳香化酶的表达得以实现的, 这表明脑芳香化酶活性与性类固醇水平密切相关。芳香化是发生在内质网中的氧化反应, 3 mol NADPH和3 mol O2可生成1 mol雌激素。NADPH-细胞色素P450还原酶运送NADPH到P450arom(芳香化酶), 芳香化酶与雄激素结合, 氧原子加到雄激素分子上, 将雄激素A环芳香化, 脱去19位上的碳原子, 并将1位上的羰基转化为羟基, 从而使雄烯二酮和睾酮等雄激素分别转化为雌酮和雌二醇[9]。通过显微解剖或穿孔技术, 对大脑芳香化酶活性分布研究发现, 三刺鱼(Gasterosteus aculeatus)间脑中芳香化酶的活性最高, 尤其是在下丘脑室周区域, 包括视束前核结节外侧核和垂体[10]。同样在欧洲海鲈(Dicentrarchus labrax)中, 嗅球、中脑和下丘脑中的芳香化酶活性与脑垂体的接近, 而视顶盖、小脑和髓质的活性则较低[8]。原位杂交结果表明, 虹鳟Cyp19a1b在前脑的视周层、端脑、间脑和中脑表达较高, 在某种程度上与珍蟾鱼(Porichthys notatus)相似, 下丘脑、视前区和脑垂体杂交信号较强[11], 而在视周层的半规隆凸、视顶盖和第四脑室的杂交信号较弱, 而脑芳香化酶的最终作用是将睾酮转化为雌二醇, 这说明Cyp19a1b参与脑–垂体–性腺轴的介导过程, 通过经典的内分泌调节通路影响鱼类性腺发育。
本研究选取全雌三倍体虹鳟为研究对象, 以相同发育阶段的二倍体雌性虹鳟为对照, 利用荧光定量PCR(qRT-PCR)检测受精后31~68 dpf阶段二倍体、三倍体雌性虹鳟脑组织中的Cyp19a1b、Cyp11a1、Cyp17a1、Hsd3b1、Cyp11b2基因的表达, 并通过酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)分别检测二倍体、三倍体雌性虹鳟不同发育阶段脑芳香化酶的活性, 以期探明三倍体雌性虹鳟性腺发育异常的关键原因及其作用途径。
1 材料与方法 1.1 实验材料全雌性三倍体虹鳟发眼卵和同期二倍体鱼卵(二倍体和三倍体发眼卵均为雌性)置于黑龙江水产研究所渤海冷水性鱼试验站孵化, 水温为10℃, 待其破膜后转移至养殖车间饲育, 水温平均为6℃。自31~50 dpf期间, 每天采集1次鱼头组织, 每次采集3份, 每份30个鱼头组织; 51~69 dpf期间, 每隔2天采集1次鱼头组织, 每次同样为3份每份30个鱼头组织, 采集的鱼头迅速置于液氮中保存。
1.2 实验方法 1.2.1 RNA提取使用Trizol试剂(ambion公司)提取总RNA。利用琼脂糖凝胶电泳检查所提取的RNA片段完整性, 并用Analytik Jena公司的ScanDrop核酸分析仪检测RNA浓度和纯度。
1.2.2 cDNA合成用TOYOBO公司的Revertra Ace qPCR RT Kit试剂盒按说明书要求操作, 反转录体系为4 μL5×RT Buffer(Reaction Buffer+ MgCl2+ dNTPs), 1 μL Enzyme Mix, 1 μL Primer (Random Primer+Oligo(dT)Primer)根据实际测得的RNA浓度计算模板加入量, 最后补Rnase-free水至20 μL。设置37℃, 15 min; 98℃, 5 min; 进行PCR反应。将产物放置于-20℃保存。
1.2.3 Real-time荧光定量PCR在NCBI(美国国立生物技术信息中心)数据库中找到Cyp19a1b、Cyp11a1、Cyp17a1、Cyp11b2、Hsd3b1基因序列。用Primer 5.0软件设计荧光定量PCR引物(由Invitrogen公司合成), 以β-actin为内参(序列如表 1所示)。荧光定量PCR反应体系为20 μL, 使用罗氏公司的SYBR Green Master: SYBR Green 10 μL, 上下游引物各0.4 μL, cDNA模板1 μL, 加ddH2O至20 μL。PCR反应条件为:预变性95℃, 10 min; 95℃, 10 s; 60℃, 30 s; 共计40个循环。PCR反应结束后, 分析熔解曲线, 检查反应特异性, 并对数据进行处理用2–ΔΔCt法计算基因的表达量。
|
|
表 1 荧光定量PCR引物序列 Tab.1 Nucleotide sequences of Real-time PCR primers |
使用鱼细胞色素P450 19a1b酶联免疫吸附测定试剂盒(根据实验要求交由生产厂家设计适用于虹鳟CYP19A1B的试剂盒, 上海江莱生物公司)对鱼脑芳香化酶活性进行测定。将采集到的样品每份分别取出15个鱼脑组织分别磨碎混匀成匀浆液, 5000×g离心取上清, 之后按说明书操作进行, 用Synergy2多功能酶标仪(美国BIOTEK公司)在450 nm波长处测定OD值, 绘制标准曲线回归方程, 按曲线方程计算各样本浓度值。
1.2.5 数据处理与分析使用SPSS 19.0进行数据处理, 利用one-way方差分析进行显著性检验, P < 0.05为差异性显著。
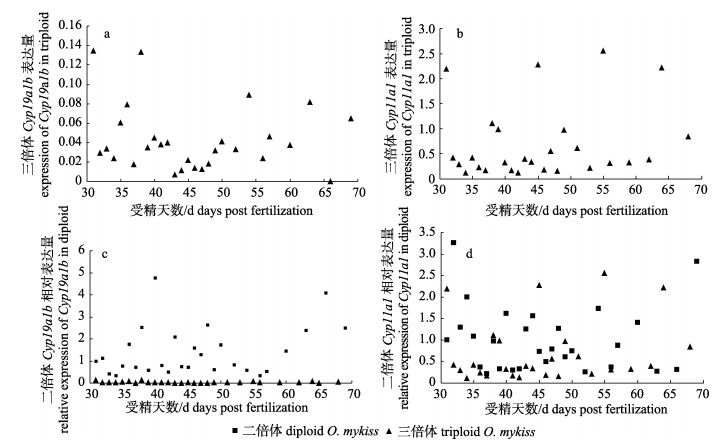
2 结果与分析 2.1 芳香化酶通路基因在三倍体雌性虹鳟早期不同发育阶段的表达分别提取31~69 dpf三倍体雌性虹鳟的脑组织RNA, 经琼脂糖凝胶电泳和ScanDrop核酸分析仪检测, RNA片段完整性良好, 将RNA反转录得到cDNA, 经内参β-actin检测可用于荧光定量PCR。实验结果如图 1、图 2所示。二倍体和三倍体Cyp19a1b基因的表达量的整体趋势基本一致, 且在35~45 dpf时期该基因在二者脑组织中的表达均达到高峰, 但二倍体的表达量较三倍体高近30倍(P < 0.05);在65 dpf时, Cyp19a1b基因在二倍体和三倍体中的表达量出现第二次高峰, 此时都与其自身第一次高峰的表达一致, 二倍体的表达量仍是三倍体的30倍(P < 0.05)(图 1a, 图 1c)。在30~50 dpf时期, 二倍体虹鳟的Cyp11a1基因的表达量维持较高水平; 在38 dpf时, 三倍体虹鳟Cyp11a1基因表达量首次达到峰值, 较二倍体有所延迟, 之后开始下降, 在49 dpf时出现第二次高峰(图 1b, 图 1d)。
|
图 1 雌性三倍体虹鳟和二倍体虹鳟不同时间的基因表达结果
a.三倍体虹鳟Cyp19a1b的表达量; b.三倍体虹鳟Cyp11a1的表达量; c.二倍体和三倍体虹鳟Cyp19a1b的相对表达量; d.二倍体和三倍体虹鳟Cyp11a1的相对表达量.每个数据对应3个样品, 每个样品做3次重复试验.
Fig.1 The gene expression profiles in gonads of triploid and diploid Oncorhynchus mykiss
a. Expression of Cyp19a1b in triploid O. mykiss; b. Expression of Cyp11a1 in triploid O. mykiss; c. Relative expression of Cyp19a1b in triploid and diploid O. mykiss; d. Relative expression of Cyp11a1 in triploid and diploid O. mykiss. Each data corresponds to three samples, and each sample is repeated three times. |
|
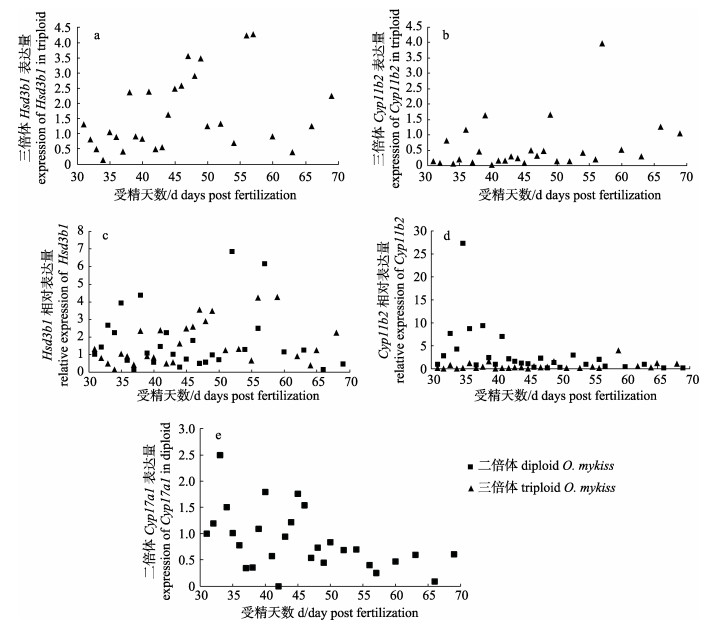
图 2 雌性三倍体虹鳟和二倍体虹鳟不同时间的基因表达结果 a.三倍体虹鳟Hsd3b1的表达量; b.三倍体虹鳟Cyp11b2的表达量; c.二倍体和三倍体虹鳟Hsd3b1的相对表达量; d.二倍体和三倍体虹鳟Cyp11b2的相对表达量; e.二倍体虹鳟Cyp17a1的表达量.每个数据对应3个样品, 每个样品做3次重复实验. Fig.2 The gene expression profiles in gonads of triploid and diploid Oncorhynchus mykiss a. Expression of Hsd3b1 in triploid O. mykiss; b. Expression of Cyp11b2 in triploid O. mykiss; c. Relative expression of Hsd3b1 in triploid and diploid O. mykiss; d. Relative expression of Cyp11b2 in triploid and diploid O. mykiss; e. Expression of Cyp17a1 in diploid O. mykiss. Each data corresponds to three samples, and each sample is repeated three times. |
在33~42 dpf时期, 二倍体虹鳟的Hsd3b1基因表达量维持较高水平, 在38 dpf时出现高峰; 在47~59 dpf时期, 三倍体虹鳟Hsd3b1基因表达量较高, 高峰时期明显晚于二倍体, 且峰值低于二倍体虹鳟(图 2a, 图 2c)。35 dpf时的二倍体和三倍体虹鳟Cyp11b2的基因表达量同时到达高峰, 但二倍体表达水平较三倍体高近5倍(P < 0.05); 41~69 dpf时期二倍体虹鳟Cyp11b2基因表达量开始下降并且维持在较平稳的水平, 此时间段内三倍体在65 dpf时出现小幅上升, 且表达量与同期二倍体水平一致(图 2b, 图 2d)。二倍体虹鳟Cyp17a1基因的表达量在35~46 dpf时逐渐上升, 在45 dpf时达到高峰之后直至69 dpf逐渐下降, 并且维持在较为平稳的水平上, 但是在相同的实验条件下未检测到同一时期三倍体虹鳟Cyp17a1基因的表达量(图 2e)。
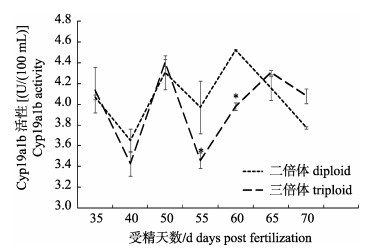
2.2 脑芳香化酶在二、三倍体雌性虹鳟不同发育阶段的活性在发育早期阶段, 二倍体与三倍体雌性虹鳟脑芳香化酶活性(CYP19A1B酶)整体趋势大体一致, 在40 dpf时二者的脑芳香化酶活性到达高峰, 但在40~60 dpf时期, 二倍体雌性虹鳟脑芳香化酶活性显著高于同期三倍体雌性虹鳟, 尤其在45 dpf和50 dpf时, 二倍体该酶活性分别较三倍体的高1.15倍和1.12倍。在62 dpf时两条曲线交叉, 之后二者同时下降, 且活性相差较小(图 3)。
|
图 3 脑芳香化酶在二倍体、三倍体雌性虹鳟不同发育阶段的活性
*表示二倍体与三倍体差异显著(P < 0.05).
Fig.3 Aromatase activity in developing brains of Oncorhynchus mykiss
* denotes significant difference between triploid and diploid Oncorhynchus mykiss (P < 0.05). |
虹鳟的性别由性别决定基因Sdy (Y染色体性别决定基因)决定, 但同样又存在性别重塑机制[12]。性类固醇对虹鳟性腺发育至关重要, 通过外源性类固醇激素诱导能够将其性别逆转[14]。虹鳟仔鱼卵黄囊吸收完毕, 直到开始摄食外源性食物时, 其性腺开始分化, 此时影响性腺分化的Cyp11a1、Cyp19a1b、Cyp11b2、Cyp17a1、Hsd3b1等基因的表达量开始逐步发生变化[15-16]。在雌二醇生成的整个过程中, 第一步酶促反应开始于细胞色素P450胆固醇侧链裂解酶(P450scc), 该酶由Cyp11a1基因编码, 所以Cyp11a1基因表达量可在一定程度上反映生物体内类固醇激素合成量。3β-HSD是一种类固醇合成关键酶, 通过氧化和异构作用催化孕烯醇酮转化成孕酮, 经过这种氧化过程后类固醇由没有活性或活性较低的类固醇转化为活性较高的类固醇激素, 该过程能够诱导类固醇发挥生物作用[17]。Cyp17a1能够编码P450 17α羟化酶和17, 20裂解酶, 首先17α-羟化酶催化孕酮或黄体酮转化成17α-羟基孕酮[18], 之后17, 20裂解酶催化17α-羟基孕酮转化成雄烯二酮, 最后雄烯二酮在17β-HSD作用下生成睾酮[19]。这时睾酮作为雌激素的前体物质, 最终由Cyp19a1b负责将其转化成雌二醇, 进而影响虹鳟的性腺分化, 也就是说Cyp19a1b的表达量直接关系到虹鳟的性腺分化和决定其性别(图 4)[20]。
11β-羟化酶(由Cyp11b2编码)能够产生11-氧化雄激素或类固醇底物, 而11-氧化雄激素是促使鱼类性腺分化的天然类固醇[21]。Cyp11a1是调节类固醇合成的上游基因, Cyp11a1 mRNA表达量的高低直接影响睾酮和雌二醇的生成[22], Cyp11a1在三倍体中的表达量峰值明显晚于二倍体, 这可能会对后续的类固醇生成产生重要影响。相同的状况同样出现在Hsd3b1基因的表达中, 三倍体较二倍体的表达峰值延迟了近7 d, Hsd3b1基因编码的3β-羟化类固醇脱氢酶的缺少会导致孕酮、17α-羟基孕酮以及雄烯二酮的合成减少, 以至于影响睾酮和雌二醇的生成。雌二醇能够穿越哺乳动物子宫细胞膜, 与细胞膜上的雌激素受体结合, 随后雌激素受体构象发生改变, 二者形成复合体。形成复合体之后雌二醇对DNA的亲和力大大加强, 这个复合体从细胞质中转移到细胞核中与染色质结合, 使原来转录活性不太高的结构基因表现出极大的转录活性, 合成大量专一的mRNA, 再合成大量的特异性蛋白质, 从而促进子宫生长[23]。睾酮的作用过程与雌二醇类似, 游离的睾酮会被转运送至目标组织细胞的细胞质中, 与雄激素受体结合, 或被5α-还原酶转化为血清双氢睾酮(DHT), DHT同样会与雄激素受体结合(这种结合更稳固, DHT的雄性激素强度约是睾酮的2.5倍)。睾酮受体或血清双氢睾酮受体会进行结构性的转变, 并让它们进入细胞核, 与染色体DNA内特定的核苷酸结合, 结合的区域称为激素反应元件(HRE), 并影响某些基因的复制活动, 产生雄性激素效用[24]。尽管鱼类生理结构与哺乳动物不同, 但雌二醇和睾酮的作用机理与此类似, 所以雌二醇和睾酮的缺失必将导致鱼类性腺分化的迟缓。而对雌二醇产生直接作用的脑芳香化酶(由Cyp19a1b基因编码), 能够直接将睾酮转化成雌二醇, 本研究中二倍体和三倍体虹鳟Cyp19a1b基因的表达趋势在时间上是一致的, 即在35~50 dpf阶段都维持在较高水平, 但Cyp19a1b在三倍体中表达量显著低于二倍体(P < 0.05), 这可能是导致三倍体雌性虹鳟性腺分化迟缓的重要原因。在相同时间段内(31~69 dpf)二倍体的脑芳香化酶活性高于三倍体, 尤其是在45 dpf和50 dpf该酶活性分别较三倍体高1.15倍和1.12倍。Cyp19a1b基因的作用直接体现在脑芳香化酶上, 而酶活性的高低最终影响雌二醇的合成, 进而影响性腺发育。此外, Bourguiba等[25]发现雄激素和雌激素对芳香化酶的调节具有很强的作用, 雄激素能够上调芳香化酶的表达, 而雌激素则能抑制其表达。这可能就是三倍体虹鳟在36~47 dpf之间Cyp19a1b的表达量下调, 40~45 dpf脑芳香化酶活性降低的原因。11β-羟化酶催化产生11-氧化雄激素, 其编码基因Cyp11b2在三倍体和二倍体虹鳟中存在显著性差异, 尽管二者在时间上的表达趋势一致, 但在性腺分化的关键时期(30~50 dpf)三倍体表达量显著性低于二倍体(P < 0.05), 二者在50~69 dpf阶段表达量相接近, 但由于Cyp11b2在关键时期(30~50 dpf)的显著低表达最终造成三倍体虹鳟性腺分化的延迟。此外在相同生长环境和相同实验条件下, 三倍体虹鳟中没有检测到Cyp17a1基因的表达, 该基因在二倍体虹鳟中的表达同样是先上升后下降, 35~45 dpf时维持在较高水平, 之后逐渐下降。
通过Cyp11a1、Cyp11b2、Cyp17a1、Cyp19a1b和Hsd3b1基因的表达水平可以得出, 影响虹鳟性腺分化是多种基因相互之间调控的结果, 三倍体雌性虹鳟细胞色素等相关基因表达的异常, 导致脑芳香化酶活性降低, 最终可能导致性类固醇激素的合成与分泌出现异常。
4 结论相比于二倍体雌性虹鳟, 三倍体雌性虹鳟脑组织中Cyp11a1、Cyp11b2、Cyp17a1、Cyp19a1b和Hsd3b1基因呈现低表达或延迟表达的趋势, 这可能会造成性类固醇激素的合成减少或延迟, 导致其性腺分化和发育受阻, 这可能是三倍体雌性虹鳟性腺不能正常发育的重要原因之一。
| [1] |
Liu G H, Hao Q R, Huang T Q, et al. Apoptosis in ovarian development of female triploid rainbow trout (Oncorhynchus mykiss) and the expression of ovarian development genes[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(17): 15-18, 287. [柳广昊, 郝其睿, 黄天晴, 等. 三倍体虹鳟卵巢发育中细胞凋亡与发育相关基因的表达[J]. 黑龙江畜牧兽医, 2016(17): 15-18, 287.] |
| [2] |
Do Rego J L, Seong J Y, Burel D, et al. Neurosteroid bio-synthesis:enzymatic pathways and neuroendocrine regulation by neurotransmitters and neuropeptides[J]. Frontiers in Neuroendocrinology, 2009, 30(3): 259-301. DOI:10.1016/j.yfrne.2009.05.006 |
| [3] |
Yaron Z, Levavi-Sivan B. Hormonal control of reproduction and growth endocrine regulation of fish reproduction[J]. Encyclopedia of Fish Physiology, 2011, 15(1): 1500-1508. |
| [4] |
Xu G F, Mou Z B, Chen H F, et al. The regulatory mechanism of ovary differentiation and abortion of triploid female rainbow trout Oncorhynchus mykiss[J]. Oceanologia et limnologia Sinica, 2017, 48(2): 358-367. [徐革锋, 牟振波, 陈怀发, 等. 三倍体虹鳟(Oncorhynchus mykiss)卵巢分化及滞育的调控机制研究[J]. 海洋与湖沼, 2017, 48(2): 358-367.] |
| [5] |
MacLusky N J, Naftolin F. Sexual differentiation of the central nervous system[J]. Science, 1981, 211(4488): 1294-1302. DOI:10.1126/science.6163211 |
| [6] |
Simpson E R, Mahendroo M S, Means G D, et al. Aromatase cytochrome P450, the enzyme responsible for estrogen biosynthesis[J]. Endocrine Reviews, 1994, 15(3): 342-355. |
| [7] |
Lephart E D. A review of brain aromatase cytochrome P450[J]. Brain Research Reviews, 1996, 22(1): 1-26. DOI:10.1016/0165-0173(96)00002-1 |
| [8] |
González A, Piferrer F. Aromatase activity in the European sea bass (Dicentrarchus labrax L.) brain. Distribution and changes in relation to age, sex, and the annual reproductive cycle[J]. General and Comparative Endocrinology, 2003, 132(2): 223-230. DOI:10.1016/S0016-6480(03)00086-8 |
| [9] |
Wang H, Li X, Zhang Y H. Research perspectives of expression of CYP19 and aromatase activity regulation factors[J]. Chinese Journal of Histochemistry and Cytochemistry, 2010, 19(3): 304-308. [王慧, 李霞, 张育辉. CYP19基因表达与芳香化酶活性调控因子的研究进展[J]. 中国组织化学与细胞化学杂志, 2010, 19(3): 304-308. DOI:10.3870/zgzzhx.2010.03.019] |
| [10] |
Borg B, Timmers R J, Lambert J G. Aromatase activity in the brain of the three-spined stickleback, Gasterosteus aculeatus. I. Distribution and effects of season and photoperiod[J]. Journal of Experimental Biology, 1987, 47(2): 63-68. |
| [11] |
Gonzalez A, Piferrer F. Aromatase activity in the European sea bass (Dicentrarchus labrax L.) brain. Distribution and changes in relation to age, sex, and the annual reproductive cycle[J]. General and Comparative Endocrinology, 2003, 132(2): 223-230. DOI:10.1016/S0016-6480(03)00086-8 |
| [12] |
Menuet A, Anglade I, Le Guevel R, et al. Distribution of aromatase mRNA and protein in the brain and pituitary of female rainbow trout:Comparison with estrogen receptor α[J]. Journal of Comparative Neurology, 2003, 462(2): 180-193. DOI:10.1002/(ISSN)1096-9861 |
| [13] |
Ayaka Y, Barbara N, Eloige J, et al. The sexually dimorphic on the Y-chromosome gene (sdY) is a conserved male-specific Y-chromosome sequence in many salmonids[J]. Evolutionary Applications, 2013, 6(3): 486-496. DOI:10.1111/eva.12032 |
| [14] |
Feist G, Yeoh C G, Fitzpatrick M S, et al. The production of functional sex-reversed male rainbow trout with 17α-methyltestosterone and 11β-hydroxyandrostenedione[J]. Aquaculture, 1995, 131(1-2): 145-152. DOI:10.1016/0044-8486(94)00336-M |
| [15] |
Li M, Wu F, Gu Y, et al. Insulin-like growth factor 3 regulates expression of genes encoding steroidogenic enzymes and key transcription factors in the Nile tilapia gonad[J]. Biology of Reproduction, 2012, 86(5): 1-10. |
| [16] |
Christelle D, Anne-Sophie G, Jean-Jacques L, et al. Differential expression patterns of three aromatase genes and of four estrogen receptors genes in the testes of trout (Oncorhynchus mykiss)[J]. Molecular Reproduction & Development, 2015, 82(9): 694-708. |
| [17] |
Yang M J. Molecular cloning of goose HSD3B1, sequence analysis, and primary functional research in ovary follicle of goose[D]. Yaan: Sichuan Agricultural University, 2012. [杨明军.鹅HSD3B1基因编码区克隆、序列分析及其在卵泡中的功能初探[D].雅安: 四川农业大学, 2012.] http://cdmd.cnki.com.cn/Article/CDMD-10626-1013157522.htm
|
| [18] |
Lavoie H A, King S R. Transcriptional regulation of steroidogenic genes:StARD1, CYP11A1 and HSD3B[J]. Experimental Biology and Medicine, 2009, 234(8): 880-907. DOI:10.3181/0903-MR-97 |
| [19] |
Chen X H, Qiu X M, Hao W W, et al. Expression of CYP11a1 in different developmental phases of gonad in zebrafish Danio rerio[J]. Journal of Dalian Ocean University, 2015, 30(1): 13-17. [陈孝红, 仇雪梅, 郝薇薇, 等. 斑马鱼CYP11a1基因在不同性腺发育时期的表达[J]. 大连海洋大学学报, 2015, 30(1): 13-17. DOI:10.3969/J.ISSN.2095-1388.2015.01.003] |
| [20] |
Nagarajan G, Aruna A, Chang C F. Neurosteroidogenic enzymes and their regulation in the early brain of the protogynous grouper Epinephelus coioides during gonadal sex differentiation[J]. General and Comparative Endocrinology, 2013, 181: 271-287. DOI:10.1016/j.ygcen.2012.10.013 |
| [21] |
Liu S, Govoroun M, D'Carreras H, et al. Expression of cytochrome P45011b (11b-hydroxylase) gene during gonadal sex differentiation and spermatogenesis in rainbow trout, Oncorhynchus mykiss[J]. Journal of Steroid Biochemistry & Molecular Biology, 2000, 75(4-5): 291-298. |
| [22] |
Shao K, Zhou J, Wu X X, et al. The developmental patterns and correlation of adiponectin receptors, LRH, CYP11A1 and StAR mRNA expression in testis of Wannan Hua pig[J]. Chinese Journal of Animal and Veterinary Sciences, 2011, 42(12): 1680-1685. [邵康, 周杰, 吴小雪, 等. 猪睾丸中脂联素受体与LHR、CYP11A1、StAR基因表达的发育变化及其相关性研究[J]. 畜牧兽医学报, 2011, 42(12): 1680-1685.] |
| [23] |
Wang J Y. Biochemistry (third edition)[M]. Beijing: Higher Education Press, 2002: 567-570. [王镜岩. 生物化学(第三版)[M]. 北京: 高等教育出版社, 2002: 567-570.]
|
| [24] |
Fu H, Wen J F. Research of testin[J]. Journal of Clinical and Pathological Research, 2006, 26(4): 367-368. [付华, 文继舫. 睾丸素的研究进展[J]. 国际病理科学与临床杂志, 2006, 26(4): 367-368.] |
| [25] |
Bourguiba S, Lanbard S, Carreau S. Steroids control the aromatase gene expression in purified germ cells from the adult adult male rat[J]. Journal of Molecular Endocrinology, 2003, 31(1): 83-94. |
 2018, Vol. 25
2018, Vol. 25