2. 水产科学国家级实验教学示范中心(上海海洋大学), 上海 201306;
3. 青岛海洋科学与技术国家实验室, 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071;
4. 日照海辰水产有限公司, 山东 日照 276805
2. National Demonstration Center for Experimental Fisheries Science Education(Shanghai Ocean University), Shang-hai 201306, China;
3. Functional Laboratory of Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
4. Haichen Aquatic Products Co. Ltd., Rizhao 276805, China
pH是水产养殖环境中的重要因子之一, pH突变会对甲壳动物的生长、繁殖、免疫和抗氧化能力等产生重要影响[1-3]。如水环境中pH过高会使对虾血淋巴pH升高, 腐蚀鳃组织, 造成呼吸障碍, 还可能造成机体组织DNA损伤及免疫相关酶活性和抗病力下降[4-6]。水环境中pH过低则会使虾血液pH下降, 削弱其载氧能力, 造成缺氧症, 影响虾的矿化作用,从而诱发一系列疾病, 如黄鳃、锈壳、黑死病等[7-8]。甲壳动物应对pH胁迫过程中, 如何调节其体内酸碱平衡的机理尚未见报道。
钠/氢交换体(Na+/H+-exchanger, NHE)是机体维持酸碱平衡的膜离子转运系统中一类重要的膜蛋白, 其主要功能是调控细胞内的pH和细胞体积, 也可能通过增加细胞内pH而影响细胞分裂[9]。目前有关NHE的研究主要集中在调控肿瘤细胞内外酸碱平衡方面[10]; 在水产动物中关于其酸碱调节的功能研究较少。在鲦(Tribolodon hakonensis)和青鳉(Oryzias latipes)适应酸性环境实验中, Hirata等[11]和Liu等[12]研究发现NHE可以与碳酸酐酶、碳酸氢根转运体发挥协调作用; Evans等[13]研究发现鱼类机体内Na+/H+交换体系主要分布于鳃上皮顶部细胞膜, 水环境中的Na+和细胞内代谢出来的H+主要是通过此交换体系进行交换; 目前NHE基因在甲壳动物中的研究相对更少, 且主要集中于其组织定位及在渗透调节中的作用[2, 14]。马金武等[15]克隆获得了三疣梭子蟹NHE3基因, 并研究了其在盐度胁迫下的调控作用。但是目前有关该基因在甲壳动物酸碱胁迫下的功能研究尚未见报道。
中国明对虾是我国黄渤海地区主要养殖对象[16], 养殖过程中大量换水、浮游动植物种群的突然改变和残饵等因素均可能导致水体pH突变, 从而影响其养殖产量。本研究通过静水毒性实验法[17-18]测定中国明对虾对pH的耐受性, 并确定了其酸碱半致死pH, 其后采用RACE技术克隆获得FcNHE3基因cDNA全长序列, 研究其在不同组织及pH胁迫下的表达特征, 最后通过RNA干扰实验探究FcNHE3基因在响应pH胁迫中的重要作用。本研究旨在了解NHE3在中国明对虾适应pH胁迫中的作用机制, 并为中国明对虾耐pH新品系的选育提供参考。
1 材料与方法 1.1 实验动物与样品采集实验用虾为100日龄中国明对虾‘黄海3号’品种, 体重(3.0±0.5) g。实验在山东省昌邑市海丰水产养殖有限责任公司进行, 暂养7 d, 实验全程保持充气维持水体含氧量, 水温维持在(25±1)℃, 每天换水清污1次, 换水量为1/3;暂养期间, 早晚喂食常规条状颗粒饲料各1次。实验设置低pH组(pH梯度为4.6、5.1、5.6、6.1和6.6)、高pH组(pH梯度为8.1、8.5、8.9、9.3和9.7)以及自然海水对照组(pH 7.9), 每个pH梯度设置3个平行, 每个平行10尾虾, 水体pH调节利用盐酸(AR)、氢氧化钠(AR)和碳酸氢钠(AR), 与自然海水混匀调制, 实验前水体经过充分曝气, 实验期间的投喂和饲养管理与暂养期相同。胁迫后3 h、6 h、12 h、24 h、48 h及72 h记录死亡数目, 计算累计死亡率, 并根据结果运用寇氏法[19]计算出酸性及碱性半致死pH, 然后以此作为胁迫pH进行实验, 每组设置3个平行, 每个平行30尾虾。以胁迫0 h作为空白对照组, 分别在胁迫后3 h、6 h、12 h、24 h、48 h、72 h取鳃组织置于液氮罐中保存。另取未经胁迫的中国明对虾各组织用以检测基因在组织中的表达分布情况, 包括鳃、肝胰腺、脑、肌肉、触角腺、肠和心脏置于液氮罐中保存。
1.2 FcNHE3基因cDNA全长克隆Trizol法提取组织的总RNA, 用琼脂糖凝胶电泳和微量紫外分光光度计监测RNA的完整度和质量, 使用SMARTTM RACE cDNA Amplification Kit按照说明书要求操作, 分别合成3′和5′RACE的cDNA第一链。应用本实验室中国明对虾转录组文库检索到的FcNHE3基因EST序列, 通过PCR反应并测序验证其序列正确性。随后利用Primer Premier 5.0软件设计3′和5′RACE特异性引物(表 1), 引物在生工生物工程股份(上海)有限公司合成。随后进行巢式PCR, 对目的基因的3′和5′末端序列进行快速扩增。利用琼脂糖凝胶分别检测扩增产物, 胶回收过程使用回收试剂盒, 连接转化使用载体为pEASY-T1, 感受态细胞为TransT1。最后取阳性单克隆进行菌落PCR鉴定, 目的单克隆菌液送到上海生工公司进行测程序。
|
|
表 1 实验用PCR引物序列 Tab.1 Primer used in the study |
利用DNAStar软件进行再拼接, 得到FcNHE3基因cDNA全长, 采用ORF Finder进行基因开放阅读框预测, 用Blast程序分析基因与其他物种的同源性和一致性, 使用DNAMAN软件比对多个物种同一基因序列。其他基因编码蛋白的基本物理性质、结构域、信号肽等利用ProtParam tool、SMART、TMHMM Server v.2.0和SignalP-3.0等在线工具检测。利用MEGA 7.0软件采用邻接法构建NJ系统进化树。
1.4 反转录实时荧光定量PCR(RT-qPCR)取Trizol法提取的各组中国明对虾鳃、肝胰腺、脑、肌肉、触角腺、肠、心脏等组织的总RNA, 使用TaKaRa Prime ScriptTM RT试剂盒进行反转录合成cDNA。根据FcNHE3基因开放阅读框序列, 利用Primer Premier 5.0软件设计荧光定量引物, 内参选择18S rRNA, 于生工生物工程股份(上海)有限公司合成。使用ABI 7500 Real Time PCR仪和TaKaRa SYBR® Premix Ex Taq Ⅱ试剂对中国明对虾各组织及pH胁迫下基因的表达进行分析。反应体系采用TaKaRa SYBR® Premix Ex Taq Ⅱ说明书中20 μL体系标准, PCR反应程序为: 95℃ 30 s; 95℃ 5 s, 60℃ 34 s, 40个循环; 95℃ 15s, 60℃ 1 min, 95℃ 15 s。FcNHE3基因的相对表达分析采用2–ΔΔCt法, 数据处理使用SPSS 17.0软件进行单因素方差分析(One-Way ANOVA)和Duncan检验, 利用Origin Pro 9.0对统计结果进行作图, P < 0.05表示具有显著差异性。
1.5 RNA干扰实验在RNA干扰(RNA interference, 简称RNAi)实验中, 根据Elbashir S的siRNA设计规则[20-21], 利用siDirectversion2.0在线软件(http://sidirect2.rnai.jp/)设计FcNHE3基因的3个siRNA靶序列, 3对siRNA(si-1, si-2, si-3, 见表 1)均在生工生物工程股份(上海)有限公司合成, 另有1对阴性对照siRNA(NC)。本次干扰实验用虾体重为(3.0±0.5) g, 在进行干扰实验之前, 通过预实验确定了干扰试剂的使用浓度, 发现1 μg/g和2 μg/g的注射浓度影响差异不大, 确定1 μg/g足以达到干扰目的, 因此本实验注射剂量为1 μg/g。将50尾虾平均分成5组, 每组10尾, 以只注射DEPC水和注射了NC siRNA的虾作为阴性对照组, 注射si-1、si-2、si-3的虾为实验组, 于注射后3 h和6 h, 每组分别取3尾虾的鳃, 用RNA组织保存液保存, 根据2.4节所述方法检测FcNHE3基因的表达情况。另设置相同的一系列实验组, 每组3个平行, 每个平行10尾虾, 调节水体pH至5.2, 定时调节保持后期pH值稳定, 观察并记录注射siRNA后0~24 h期间(1、3、6、12、24 h)死亡个体数量, 计算对虾在pH胁迫下的存活率。
2 结果与分析 2.1 pH胁迫72 h累计死亡率及半数致死pH各个pH梯度胁迫下死亡率结果如表 2所示, pH为4.6和9.7时, 72 h累计死亡率达到100%, pH为6.6和8.1时出现极少量死亡个体, 通过寇氏法计算出中国明对虾酸性半致死pH值及碱性半致死pH分别为5.2和9.1。
|
|
表 2 各pH下中国明对虾平均死亡率 Tab.2 The mortality of Fenneropenaeus chinensis under different pH stress |
FcNHE3 cDNA全长3508 bp, GenBank登录号MF373587, 其5′和3′端非编码区分别为530 bp和173 bp, 开放阅读框(ORF)长2805 bp, 编码934个氨基酸(图 1), 预测蛋白的分子量为104.8 kD, 理论等电点为6.66。SMART分析预测表明该基因具有信号肽, 编码蛋白结构域包括12个跨膜螺旋结构M1-M12(图 1) (5~24 aa、79~101 aa、114~131 aa、141~163 aa、170~192 aa、207~226 aa、279~301 aa、321~343 aa、363~385 aa、395~417 aa、436~458 aa和468~490 aa)。Blast对比分析表明, FcNHE3基因编码氨基酸序列与青蟹(Carcinus maenas)、三疣梭子蟹(Portunus trituberculatus)、端足虫(Hya lella azteca)、澳洲蓝螯虾(Cherax cainii)、体虱(Pediculus humanus corporis)和柑橘凤蝶(Papilio xuthus)的同源性分别为74%、66%、60%、59%、57%和55%。氨基酸序列多重比对分析表明, FcNHE3基因氨基酸序列在110~700氨基酸区段内保守性较高。

|
图 1 中国明对虾FcNHE3基因cDNA序列及推导的氨基酸序列 起始密码子用方框标注, 终止密码子用星号标注, 单下划线代表信号肽序列, 12个跨膜结构域用阴影标注. Fig.1 Nucleotide and deduced amino acid sequence of FcNHE3 cDNA in Fenneropenaeus chinensis The initiation codon (ATG) is tagged with a box, and the assigned termination codon (TAG) is indicated by the asterisk; the sequence for signal peptide is underlined, and the putative transmembrane domains are shadowed. |
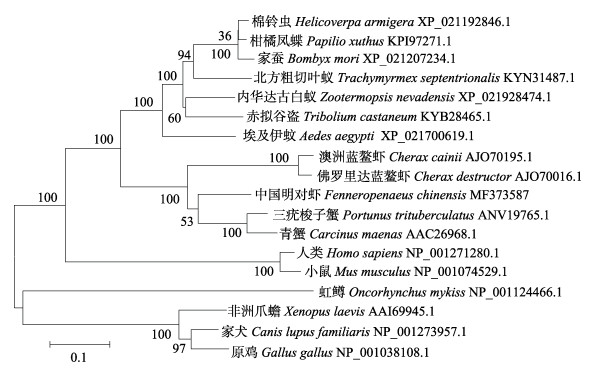
系统发育进化树显示, 中国明对虾FcNHE3与三疣梭子蟹和青蟹亲缘关系最近, 聚为一支, 然后与澳洲蓝鳌虾和佛罗里达蓝鳌虾聚为一类, 与昆虫类和脊椎动物亲缘关系较远(图 2)。
|
图 2 基于NHE氨基酸序列的NJ系统进化树 节点上的数字表示为bootstrap的置信度. Fig.2 The Neighbor-Joining phylogenetic tree of NHE from Fenneropenaeus chinensis and other animals Bootstrap values are indicated at nodes. |
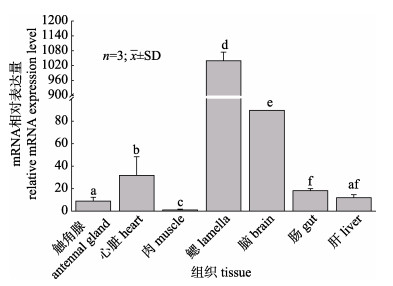
利用RT-qPCR分析了FcNHE3基因在不同组织中的表达分布情况, 结果显示, FcNHE3基因在鳃中表达量最高, 显著高于其他组织(P < 0.05), 其次为脑和心脏, 在肌肉中表达量最低(图 3)。
|
图 3 FcNHE3基因在中国明对虾各组织表达情况 不同字母代表差异显著(P < 0.05). Fig.3 FcNHE3 gene expression in various tissues of healthy Fenneropenaeus chinensis Different letters indicate significant difference (P < 0.05). |
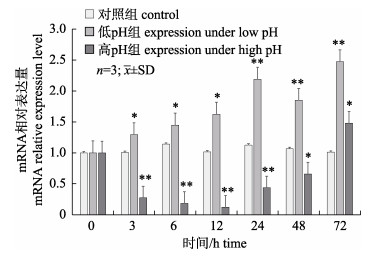
如图 4所示, 低pH胁迫后, 相较于0 h, 中国明对虾鳃组织中FcNHE3基因在整个实验阶段均显著上调表达(P < 0.05), 且表达量呈逐渐上升趋势。高pH胁迫后3~48 h, 中国明对虾鳃组织中FcNHE3基因表达量相比空白对照组明显下调(P < 0.05), 在12 h表达量最低, 随后有回升趋势, 至72 h表达量上调。
|
图 4 pH胁迫下各实验组中国明对虾FcNHE3基因表达情况
*代表各胁迫时间点与0 h差异显著(P < 0.05), **代表各胁迫时间点与0 h差异极显著(P < 0.01).
Fig.4 FcNHE3 gene expressions under pH stress in different Fenneropenaeus chinensis groups
* indicates significant difference (P < 0.05); ** indicates highly significant difference (P < 0.01). |
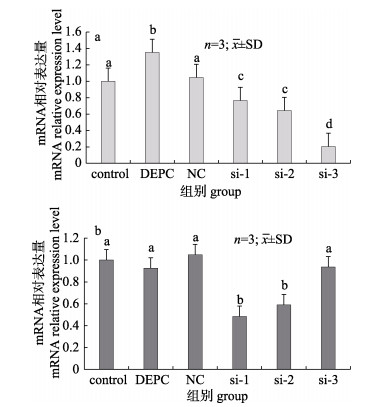
如图 5所示, 注射试剂3 h后, si-1、si-2、si-3三组实验组的FcNHE3基因表达均有不同程度下调趋势; 干扰3 h后, 相比NC对照组, si-1、si-2和si-3的干扰效率分别达到23.4%、35.7%和79.5%。6 h后si-1和si-2两组仍处于下调水平, 干扰效率分别为51.7%和41%, 而si-3组FcNHE3基因表达则恢复至对照组水平。
|
图 5 注射siRNA3 h (a)和6 h (b)后各实验组FcNHE3基因表达情况 不同字母代表差异显著(P < 0.05). Fig.5 FcNHE3 gene expression after RNA interference for 3 h (a) and 6 h (b) in different Fenneropenaeus chinensis groups Different letters indicate significant difference (P < 0.05). |
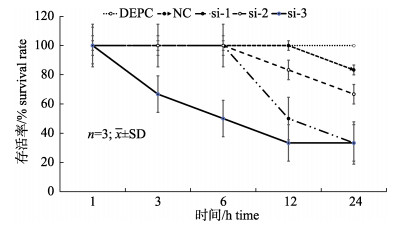
低pH胁迫下, 在分别注射FcNHE3基因的3个干扰siRNA后进行累计存活计算, 发现注射干扰靶点siRNA1和siRNA2后, 对虾均在12 h开始出现死亡个体, 至24 h存活率分别为33.3%和66.7%。注射干扰靶点siRNA3后, 对虾在3 h即出现死亡个体, 随后存活率不断下降, 至24 h累计存活率达到66.7%, 明显低于对照组和NC组(图 6)。
|
图 6 pH胁迫下注射siRNA后各实验组对中国明虾存活率 Fig.6 Survival rates after RNA interference under pH stress in different Fenneropenaeus chinensis groups |
本研究通过RACE技术克隆得到FcNHE3基因cDNA全长, 预测编码蛋白934个, 编码蛋白质结构中含有信号肽, 并有12个跨膜结构域, 其中第3~12个跨膜区域与家族其他成员身份一致, 且第6和第7个跨膜结构具有高度保守性, 可预测该片段与离子的跨膜转运相关性[22-24]。这与之前报道的三疣梭子蟹、青蟹、蓝鳌虾等生物一致, 均属于NHE家族。系统进化分析表明, FcNHE3基因与甲壳类亲缘关系较近, 且在110~700氨基酸区段内保守性较高, 表明这一区域所含结构对于其功能是非常重要的, 也提示该基因在不同生物中可能有着相似的功能; 而与昆虫类和脊椎动物亲缘关系较远, 显示了甲壳类进化的特异性及NHE在进化中随物种进化而发生同源性改变。
不同pH胁迫后的累计死亡率说明中国明对虾的安全pH范围是6.6~8.1, 半致死胁迫实验得出的高pH和低pH半数致死pH分别为9.1和5.2, 本研究所得安全pH范围比之前一些研究得出的pH范围稍大[1, 25-27]。如房文红等[6]研究发现, 在20℃, pH9.4的环境下, 24 h中国明对虾全部死亡; 王芸等[25]研究发现, 1天4次调节水pH, 水温30℃下, pH 7即对中国明对虾产生低pH胁迫作用; 推测适宜pH范围可能受温度和水环境pH调节周期综合影响。
RT-qPCR分析结果表明FcNHE3基因的表达具有组织特异性, 鳃中FcNHE3基因表达量显著高于其他组织(P < 0.05), 推测鳃组织可能是FcNHE3响应pH胁迫的靶器官。鳃在中华绒螯蟹(Eriocheir sinensis)、凡纳滨对虾(Litopenaeus vannamei)等甲壳动物中是最重要的渗透调节器官[22], 主要的离子转运酶均在其中大量分布[2]。该结果与本研究中NHE3在三疣梭子蟹鳃中极显著表达一致[14]。
根据pH胁迫过程中各实验组和对照组鳃组织中FcNHE3基因的表达规律及特点, 可以看出FcNHE3基因在机体适应高低pH环境过程中均起到一定的作用。由于在pH为5.1时, 中国明对虾死亡率随着胁迫时间延长逐渐升高, 并且FcNHE3基因在低pH胁迫实验组(pH 5.2)中始终处于上调表达水平, 推测该基因在对虾抵御低pH胁迫过程中起到正调控的作用, 以使其适应酸性环境。这类似于鱼类适应酸性环境的调节机制, 在碳酸酐酶(CA), Na+-K+-ATPase, Na+-HCO3– cotransporter (NBC)和NHE等多种基因的作用下, 排出体内多余的H+, 吸入外界的Na+, 以维持机体在酸性环境的生长[11]。在三疣梭子蟹等多种甲壳动物中NHE3也是以同样的机制维持渗透平衡[14]。而高pH组(pH9.1)中该基因表达在前期受到抑制, 仅在72 h出现表达上调。分析不同pH胁迫下的死亡率发现, 在pH 8.9时中国明对虾72 h累计死亡率仅为16.67%, 而在pH 9.3时72 h累计死亡率升高至73.33%, 说明pH 8.9~9.3是影响中国明对虾存活的关键区间, 而本实验中是在半致死pH 9.1的碱性环境中检测FcNHE3基因表达情况, 正好在此范围内, 可能由于在前期胁迫程度较大, 严重影响对虾的存活, 抑制了该基因的表达, 后期逐渐适应碱性环境, FcNHE3基因表达上调, 开始发挥调节作用。该结果与马金武等[15]得出的三疣梭子蟹在高盐环境下NHE3表达下调结果一致, 推测是因为高盐度或高pH环境对基因表达产生抑制。而在凡纳滨对虾碳酸氢钠协同转运蛋白(NBC)响应pH胁迫的作用机制研究中, 发现高pH胁迫下NBC基因上调表达[28]。本研究发现酸性半致死pH胁迫下FcNHE3基因仍然能发挥正调节作用, 而在碱性半致死pH胁迫下该基因受到一定程度的抑制, 推测中国明对虾在高pH胁迫下, NHE3可能并非主要作用基因, 而是类似于依赖NBC排出大量HCO3–缓解生存压力。
根据干扰实验中基因表达和死亡率的结果, 可知三组干扰试剂干扰效果不甚相同, 但均起到一定的干扰效果, si-1的干扰效果从3 h到6 h逐渐显现, si-2的干扰效果不明显且稳定, si-3初期干扰效果明显, 而后失效也快。而对虾存活率与不同干扰靶点干扰效率相符合, 即注射干扰效率最高的靶点后中国明对虾在低pH胁迫下出现较高的死亡率。此结果进一步表明FcNHE3基因在中国明对虾响应pH胁迫中发挥的重要作用。推测FcNHE3基因可能与对虾体内一些重要的生物过程相关联, 在基因表达水平降低时触发一种未知的反馈机制。与此前关于淡水鱼离子调控相关基因研究结果一致[29-30]。研究青鳉等海水鱼的渗透调节机理的工作中, 同样发现NHE3基因在离子转运的重要作用[12]。
综合以上结果得出:通过对中国明对虾NHE3基因的克隆、鉴定以及表达分析, 发现该基因主要在鳃中表达, 并在低pH胁迫下始终高表达, 高pH胁迫下表达受到一定程度抑制, 干扰该基因表达后中国明对虾在低pH胁迫下的存活率显著降低。初步明确了该基因的序列特征及其在适应pH胁迫过程中的生理作用, 为水生甲壳动物NHE3基因分子方面的研究和中国明对虾耐pH抗性品种选育提供一定的理论参考。
| [1] |
Yu T J, Li J, Li J T, et al. The effects of pH changes on antioxidant enzyme activities of ridgetail white prawn (Palaemon carinicauda)[J]. Marine Sciences, 2015, 39(5): 47-53. [于天基, 李健, 李吉涛, 等. pH胁迫对脊尾白虾抗氧化酶活力的影响[J]. 海洋科学, 2015, 39(5): 47-53.] |
| [2] |
Pan L Q, Liu H Y. Review on the osmoregulation of crustacean[J]. Journal of Fisheries of China, 2005, 29(1): 109-114. [潘鲁青, 刘泓宇. 甲壳动物渗透调节生理学研究进展[J]. 水产学报, 2005, 29(1): 109-114.] |
| [3] |
Wang Y, Li J, Li J T, et al. Effects of pH stress on antioxidant system enzyme activities and gene expression of Fenneropenaeus chinensis[J]. Journal of Fishery Sciences of China, 2011, 18(3): 556-564. [王芸, 李健, 李吉涛, 等. pH胁迫对中国明对虾抗氧化系统酶活力及基因表达的影响[J]. 中国水产科学, 2011, 18(3): 556-564.] |
| [4] |
Li C, Chen J. The immune response of white shrimp Litopenaeus vannameiand its susceptibility to Vibrio alginolyticus under low and high pH stress[J]. Fish & Shellfish Immunology, 2008, 25(6): 701-709. |
| [5] |
Wang W, Zhou J, Wang P, et al. Oxidative stress, DNA damage and antioxidant enzyme gene expression in the Pacific white shrimp, Litopenaeus vannamei when exposed to acute pH stress[J]. Comparative Biochemistry and Physiology C: Toxicology and Pharmacology, 2009, 150(4): 428-435. DOI:10.1016/j.cbpc.2009.06.010 |
| [6] |
Fang W H, Wang H, Lai Q F, et al. Toxicity of carbonate-alkalinity and pH to larval Penaeus chinensis[J]. Journal of Fishery Sciences of China, 2000, 7(4): 78-81. [房文红, 王慧, 来琦芳, 等. 碳酸盐碱度、pH对中国对虾幼虾的致毒效应[J]. 中国水产科学, 2000, 7(4): 78-81. DOI:10.3321/j.issn:1005-8737.2000.04.018] |
| [7] |
Zhang P D, Zhang X M, Li J, et al. The effects of body weight, temperature, salinity, pH, light intensity and feeding condition on lethal DO levels of whiteleg shrimp, Litopenaeus vannamei (Boone, 1931)[J]. Aquaculture, 2006, 256(1-4): 579-587. DOI:10.1016/j.aquaculture.2006.02.020 |
| [8] |
Walton W E, Compton S M, Allan J D, et al. The effect of acid stress on survivorship and reproduction of Daphnia pulex (Crustacea: Cladocera)[J]. Canadian Journal of Zoology, 2011, 60(4): 573-579. |
| [9] |
Padan E, Landau M. Sodium-Proton (Na+/H+) Antiporters: Properties and Roles in Health and Disease[J]. Metal Ions in Life Sciences, 2016, 16: 391-458. DOI:10.1007/978-3-319-21756-7 |
| [10] |
Loo S Y, Chang M K, Chua C S, et al. NHE-1: A promising target for novel anti-cancer therapeutics[J]. Current Pharmaceutical Design, 2012, 18(10): 1372-1382. DOI:10.2174/138161212799504885 |
| [11] |
Hirata T, Kaneko T, Ono T, et al. Mechanism of acid adaptation of a fish living in a pH 3.5 lake[J]. American Journal of Physiology Regulatory Integrative and Comparative Physiology, 2003, 284(5): 1199-1212. DOI:10.1152/ajpregu.00267.2002 |
| [12] |
Liu S T, Horng J L, Chen P Y, et al. Salt secretion is linked to acid-base regulation of ionocytes in seawater-acclimated medaka: new insights into the salt-secreting mechanism[J]. Scientific Reports, 2016, 6: 31433. DOI:10.1038/srep31433 |
| [13] |
Evans D H, Piermarini P M, Choe K P, et al. The multifunctional fish gill: Dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous waste[J]. Physiological Reviews, 2005, 85(1): 97-177. DOI:10.1152/physrev.00050.2003 |
| [14] |
Zhou S L, Jiang N C, Lu J P, et al. Progress of the study on osmotic regulation in crustaceans Ⅰ. The gill's structure and function and its' concerned factors[J]. Donghai Marine Science, 2001, 19(1): 44-51. [周双林, 姜乃澄, 卢建平, 等. 甲壳动物渗透压调节的研究进展Ⅰ.鳃的结构与功能及其影响因子[J]. 东海海洋, 2001, 19(1): 44-51. DOI:10.3969/j.issn.1001-909X.2001.01.006] |
| [15] |
Ma J W, Lü J J, Liu P, et al. Na+/H+-exchanger in swimming crab (portunus trituberculatus): cloning, characterization and mRNA expression under salinity stress[J]. Acta Hydrobiologica Sinica, 2016, 40(5): 902-907. [马金武, 吕建建, 刘萍, 等. 三疣梭子蟹Na+/H+-exchanger基因克隆鉴定及在盐度胁迫下的表达分析[J]. 水生生物学报, 2016, 40(5): 902-907.] |
| [16] |
Li J, Liu P, He Y Y. Artificial selection in the new breed of Fenneropenaeus chinensis named "Yellow Sea 1" based on fast growth trait[J]. Journal of Fisheries of China, 2005, 29(1): 1-5. [李健, 刘萍, 何玉英. 中国对虾快速生长新品种"黄海1号"的人工选育[J]. 水产学报, 2005, 29(1): 1-5.] |
| [17] |
Yang F Y, Sun L M, Yang X Q. Toxicity of Carbonate alkalinity to Penaeus vannamei Juveniles[J]. Fisheries Science, 2004, 23(9): 3-6. [杨富亿, 孙丽敏, 杨欣乔. 碳酸盐碱度对南美白对虾幼虾的毒性作用[J]. 水产科学, 2004, 23(9): 3-6. DOI:10.3969/j.issn.1003-1111.2004.09.002] |
| [18] |
Yang F Y, Shao Q C, Li J L, et al. Toxicity of pH and carbonatealkalinity on tadpoles of frog Rana chensinensis[J]. Journal of Fishery Sciences of China, 2005, 12(1): 43-48. [杨富亿, 邵庆春, 李景林, 等. 碳酸盐碱度和pH对中国林蛙蝌蚪的毒性作用[J]. 中国水产科学, 2005, 12(1): 43-48. DOI:10.3321/j.issn:1005-8737.2005.01.009] |
| [19] |
Pan R W, Ma L, Zhang Y C, et al. Comparison between Up-and-Down Procedure and Karber test in determining tetanus toxin LD50 in mice[J]. Chinese Journal of Comparative Medicine, 2012, 22(12): 28-30. [潘若文, 马力, 张勇朝, 等. Up and Down法与寇氏法测定破伤风毒素LD50的比较[J]. 中国比较医学杂志, 2012, 22(12): 28-30. DOI:10.3969/j.issn.1671.7856.2012.012.008] |
| [20] |
Elbashir S M, Harborth J, Weber K, et al. Analysis of gene function in somatic mammalian cells using small interfering RNAs[J]. Methods, 2002, 26(2): 199-213. DOI:10.1016/S1046-2023(02)00023-3 |
| [21] |
Bu Z Y, Fu H T, Sun S M, et al. Molecular characterization and developmental expression of Ras-related nuclear protein in the oriental river prawn Macrobrachium nipponense and the effects of RNA interference on ovarian maturation[J]. Journal of Fishery Sciences of China, 2017, 24(3): 459-469. [卜宗元, 傅洪拓, 孙盛明, 等. 青虾Ran基因的克隆、表达及其在卵巢发育中的功能[J]. 中国水产科学, 2017, 24(3): 459-469.] |
| [22] |
Orlowski J, Grinstein S. Na+/H+ exchangers of mammalian cells[J]. The Journal of Biological Chemistry, 1997, 272(36): 22373-22376. DOI:10.1074/jbc.272.36.22373 |
| [23] |
Numata M, Petrecca K, Lake N, et al. Identification of a mitochondrial Na+/H+ exchanger[J]. The Journal of Biological Chemistry, 1998, 273(12): 6951-6959. DOI:10.1074/jbc.273.12.6951 |
| [24] |
Dibrov P, Fliegel L. Comparative molecular analysis of Na+/H+ exchangers: a unified model for Na+/H+ antiport?[J]. FEBS Letters, 1998, 424(1-2): 1-5. DOI:10.1016/S0014-5793(98)00119-7 |
| [25] |
Wang Y, Li J, Zhang Z, et al. Effects of pH and ammonia-N stresses on HSP90 gene expression of Fenneropenaeus chinensis[J]. Progress in Fishery Sciences, 2013, 34(5): 43-50. [王芸, 李健, 张喆, 等. pH、氨氮胁迫对中国对虾HSP90基因表达的影响[J]. 渔业科学进展, 2013, 34(5): 43-50. DOI:10.3969/j.issn.1000-7075.2013.05.007] |
| [26] |
Li Y Q. Effects of pH stress on activities of phosphatase in Exopalaemon carinicauda Holthuis[J]. Journal of Southern Agriculture, 2014, 45(6): 1098-1101. [李玉全. pH胁迫对脊尾白虾代谢酶活力的影响[J]. 南方农业学报, 2014, 45(6): 1098-1101. DOI:10.3969/j:issn.2095-1191.2014.6.1098] |
| [27] |
Zhao X Y, Li J, Chen P, et al. Effects of pH stress on survival rate and activities of iontransport enzyme, immunerelated enzymes in three species of shrimps[J]. Journal of Shanghai Ocean University, 2011, 20(5): 720-728. [赵先银, 李健, 陈萍, 等. pH胁迫对3种对虾存活率、离子转运酶和免疫酶活力的影响[J]. 上海海洋大学学报, 2011, 20(5): 720-728.] |
| [28] |
Cai Y M, Chen T, Ren C H, et al. Molecular characterization of Pacific white shrimp (Litopenaeus vannamei) sodium bicarbonate cotransporter (NBC) and its role in response to pH stress[J]. Fish & Shellfish Immunology, 2017, 64: 226-233. |
| [29] |
Dymowska A, Hwang P P, Goss G G, et al. Structure and function of ionocytes in the freshwater fish gill[J]. Respiratory Physiology and Neurobiology, 2012, 184(3): 282-292. DOI:10.1016/j.resp.2012.08.025 |
| [30] |
Uchiyama M, Komiyama M, Yoshizawa H, et al. Structures and immunolocalization of Na+-K+-ATPase, Na+/H+ exchanger 3 and vacuolar-type H+-ATPase in the gills of blennies (Teleostei: Blenniidae) inhabiting rocky intertidal areas[J]. Journal of Fish Biology, 2012, 80(6): 2236-2252. DOI:10.1111/j.1095-8649.2012.03277.x |
 2018, Vol. 25
2018, Vol. 25

