2. 湛江市碧海湾水产科技有限公司, 广东 湛江 524382
2. Zhanjiang Green Bay Aquatic Science and Technology Co, Ltd. Zhanjiang 524382, China
光裸星虫(Sipunculus nudus)又名裸体方格星虫, 俗称“沙虫”, 为星虫动物门习见种, 广泛分布于热带、亚热带和温带水域的沿海地区, 我国沿海均有分布, 其中北部湾沿海资源量最为丰富。光裸星虫具有很高的经济价值, 但其来源长期依赖于捕捉自然种群。目前在广东、广西以及海南等地已逐渐开展光裸星虫的人工增养殖技术研究和生产实践[1-3]。
星虫的胚胎和幼体发育是繁殖生物学研究的重点, 国外较早开展了相关研究。Rice等[4-8]在20世纪70—80年代先后报道了阿氏革囊星虫(Phascolosoma agassizii)、倭革囊星虫属的Phascolion cryptus、邱米管体星虫(Siphonosoma cumanense)、光裸星虫等多种星虫胚胎和幼体发育过程。近年来, Adrianov等[9-11]观察了日本海域的黑色缨心星虫(Thysanocardia nigra)、枝触星虫属的Themiste pyroides和阿氏革囊星虫的发育过程, 并与已有文献相比较, 发现日本海域与加拿大海域的T. pyroides发育过程存在显著差异。国内关于星虫动物发育的研究集中在可口革囊星虫(P. esculenta)和光裸星虫两个经济物种。吴洪喜等[12]、金春华等[13]先后通过人工授精获得了可口革囊星虫的胚胎和幼体, 观察和记录了发育过程的形态学特征, 初步分析了温度、盐度、水体pH等环境因子对胚胎和幼体发育的影响。Long等[14]发现可口革囊星虫精子入卵位置是随机的, 精卵结合后形成受精锥, 卵细胞继续进行减数分裂和极体的排放。吴斌[15]和兰国宝等[16]利用光学显微镜观察了光裸星虫的发育过程, 记录了实验条件下各阶段的发育时间。但是, 受样品来源和研究手段的限制, 已有研究对光裸星虫的胚胎和幼体发育过程的观察描述较为简略。本研究利用光学显微镜和扫描电镜技术详细观察了光裸星虫卵裂、囊胚、原肠胚、担轮幼虫、海球幼体和匍匐幼体的形态结构, 旨在积累光裸星虫发育形态学资料, 为光裸星虫生殖调控与人工繁育研究提供理论参考。
1 材料与方法 1.1 实验材料实验用光裸星虫于2016年7月采集自广东省湛江市草潭镇潮间带。将星虫活体带回养殖场, 清洗干净体表沙子进行称重, 星虫体质量为(9.86±2.50) g。选择钻沙有力、体表无损伤的健康个体经阴干和流水刺激后置于铺有15 cm细沙的水泥池中, 不投饵、充气条件下暂养, 定时检查。镜检水体, 发现精卵大量排放后开始计时, 受精卵发育至担轮幼虫后, 利用200目纱绢网收集幼体, 转移至3个铺有3~5 mm细沙的1000 L的孵化桶中继续培养, 养殖密度控制在1个/mL; 观察发现担轮幼虫开始出膜后每日3次向孵化桶中投喂湛江叉鞭金藻(Dicrateria zhanjiangensis)和亚心形扁藻(Platymonas subcordiformis), 投喂量随幼体发育逐渐增加。海球幼体开始附着后, 向孵化桶中每日3次投喂适量底栖硅藻和亚心形扁藻。期间, 海水盐度为30, 水温为30~31.5℃, 24 h不间断微充气, 每天根据水质情况换水20%~50%。
1.2 实验方法胚胎和幼体发育过程中, 利用Olympus BX51正立显微镜和Leica M205 FA体视显微镜观察、拍照并记录发育时间。使用200目、80目、50目以及18目的纱绢网分别收集卵裂期胚胎、担轮幼虫、海球幼体和匍匐幼体, 用预冷的2.5%戊二醛固定, 12 h后更换一次固定液。将固定的各时期样品置于4℃冰箱保存备用。
取上述固定样本, 用过滤灭菌海水洗涤3次; 1%锇酸固定2 h; 过滤灭菌海水洗涤3次; 30%~ 100%乙醇逐级脱水; Leica EM CPD300全自动临界点干燥仪干燥1.5 h; JFC-1600离子溅射仪中表面镀膜180 s; JSM-6360 LV扫描电子显微镜观察、拍照。利用电镜成像系统软件对细胞及幼体进行测量, 测量5次后取平均值。
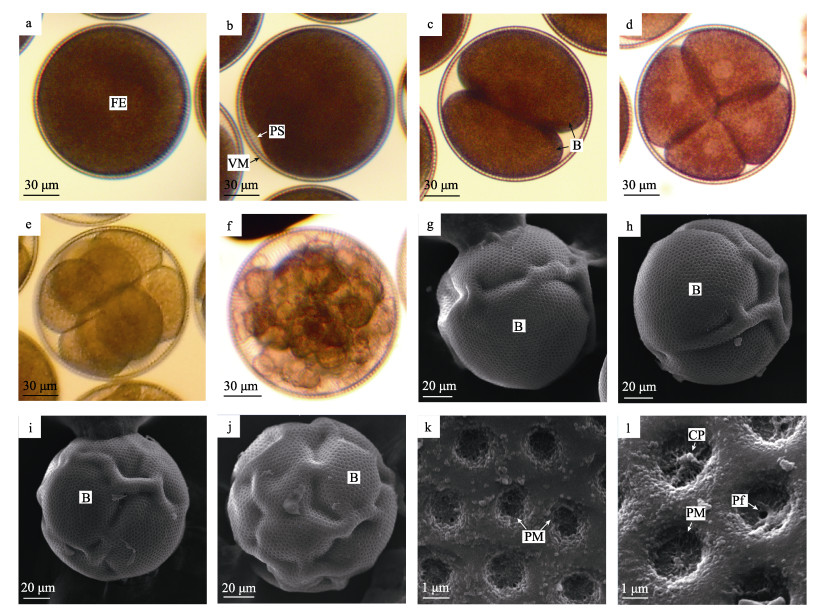
2 结果与分析 2.1 胚胎发育 2.1.1 卵裂和囊胚光裸星虫成熟卵子经肾管排出体外, 呈饱满的圆球形, 直径为135~160 μm。卵外只有1层卵膜, 即卵黄膜, 没有滤泡细胞和胶质膜包裹(图 1a)。受精后, 卵子质膜开始收缩, 与卵膜分离形成卵周隙(图 1b)。受精约30 min后受精卵开始进行螺旋式完全卵裂, 其中, 第1次为经裂, 形成的卵裂球大小不等(图 1c); 第2、第3次卵裂分别为经裂和横裂(图 1d, 1e)。随卵裂不断进行, 逐渐形成球形囊胚(图 1f)。扫描电镜下, 卵膜随卵裂的进行出现明显的皱缩或隆起, 可清晰分辨出前4次卵裂(图 1g~图 1j)。卵膜表面布满漏斗状膜孔, 卵裂早期卵膜孔向内凹陷, 整体较为平坦(图 1k), 与未受精的成熟卵一致。随发育进行, 卵膜孔中央逐渐外突, 并最终形成一个贯穿卵膜的小孔洞, 其直径约为260 nm(图 1l)。
|
图 1 光裸星虫卵裂和囊胚 a.经肾管排出的成熟卵, 卵外无滤泡细胞和胶质膜. b.受精卵, 示刚开始形成的卵周隙. c.第1次卵裂. d.第2次卵裂. e.第3次卵裂. f.囊胚. g.第1次卵裂, 可见一条卵裂沟. h.第2次卵裂, 经裂. i.第3次卵裂, 纬裂. j.第4次卵裂. k.卵裂早期的卵膜局部, 卵膜孔呈漏斗形. l.卵膜局部, 示有的膜孔中央外凸, 有的已贯穿形成小孔洞. a-f为光镜观察, g-l为扫描电镜观察. FE:受精卵; PS:卵周隙; VM:卵膜; B:卵裂球; PM:卵膜微孔; CP:中央突起; Pf:卵膜微孔中央小孔. Fig.1 Cleavage and blastocyst of Sipunculus nudus a. Mature egg excreted from nephridioduct without follicle cells and jelly coat. b. Fertilized egg, showing the initially formed perivitelline space. c. The first cleavage. d. The secondary cleavage. e. The third cleavage. f. Blastula. g. The first cleavage, showing cleavage furrow. h. The second cleavage (meridional cleavage). i. The third cleavage (latitudinal cleavage). j. The fourth cleavage. k. Egg envelope in early cleavage, showing the infundibuliform pore. l. Partial egg envelope, showing the central protrusion and perforation in some pore of egg envelope. a-f. Optical microscope. g-l. Scanning electron microscope. FE: fertilized egg; PS: perivi telline space; VM: egg envelope; B: blastomere; PM: pore of egg envelope; CP: centre protrusion; Pf: perforation. |
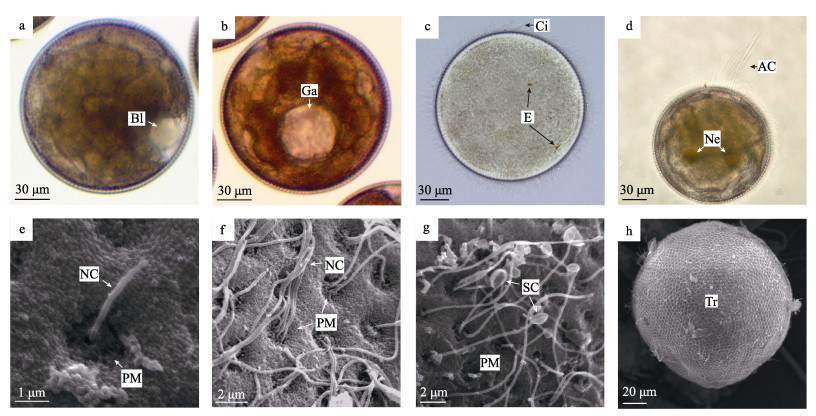
受精后约2 h, 囊胚开始以内陷方式形成胚孔, 并进入原肠胚阶段(图 2a), 原肠腔逐渐增大(图 2b)。随着细胞数量的快速增加, 光镜下无法继续清楚分辨胚胎的中胚层形成及细胞分化。随后, 胚体纤毛通过卵膜孔上的小孔伸出膜外, 此时胚胎发育为担轮幼虫。受精后约4 h, 80%以上的个体发育到担轮幼虫阶段。早期担轮幼虫纤毛较短, 光镜下不明显, 可在水中做缓慢的旋转式游动。随着发育进行, 担轮幼虫纤毛逐渐伸长, 密布于体表, 并出现橙红色眼点, 具有趋光性(图 2c)。担轮幼虫中期, 幼体逐渐在胚顶处形成一束长达80 μm以上的顶纤毛; 担轮幼虫后期, 胚体中后部出现橙黄色的肾管(图 2d), 此时依靠顶纤毛和密集的纤毛的摆动, 担轮幼虫可作快速的旋转游动。
|
图 2 光裸星虫的原肠胚与担轮幼虫 a.囊胚向原肠胚发育, 示胚孔. b.原肠胚. c.初期担轮幼虫, 示眼点和纤毛. d.后期担轮幼虫, 示肾管和顶纤毛. e.卵膜局部, 从膜孔的中央小孔刚伸出的纤毛, 长度较短. f.卵膜局部, 每个中央小孔可伸出1-4条普通纤毛. g.卵膜局部, 示大量勺状纤毛, 其末端膨大部分长径约1.7 μm, 短径约为1 μm. h.担轮幼虫, 示幼体表面浓密纤毛. a-d为光镜观察, e-h为扫描电镜观察. Bl:胚孔; Ga:原肠腔; E:眼点; Ci:纤毛; AC:顶纤毛; Ne:肾管; NC:普通纤毛; SC:勺状纤毛; Tr:担轮幼虫. Fig.2 Gastrula and trochophore of Sipunculus nudus a. Blastocyst development into gastrula, showing the blastopore. b. Gastrula. c. Pre-trochophore larva, showing the eyespot and cilia. d. Late-trochophore larva, showing the nephridioduct and apical cilia. e. Partial egg envelope, showing the short cilia that just passed through the perforation. f. Partial egg envelope, showing the 1-4 cilia pierced through the perforation. g. Partial egg envelope, showing lots of spoon cilia with the length and width being 1.7 μm and 1 μm, respectively. h. Trochophore larva, which is covered with cilia on the surface. a-d. The optical microscope. e-h. The scanning electron microscope. Bl: gastropore; Ga: gastrocoele cavity; E: eyespot; Ci: cilia; AC: apical cilia; Ne: nephridioduct; NC: normal cilia; SC: scoop-shaped cilia; Tr: trochophore. |
扫描电镜下, 可清晰观察到担轮幼虫纤毛从卵膜孔中央小孔伸出, 并逐渐延伸的过程。每个小孔可伸出1~4条纤毛(图 2e~图 2g)。纤毛具有两种类型, 一种为末端不膨大的普通纤毛(图 2f), 其纤毛直径约为150 nm, 长约14 μm; 另一种为末端膨大呈圆形或者椭圆形并形成凹陷的勺状纤毛, 其膨大部分长径约1.7 μm, 短径为1 μm(图 2g)。担轮幼虫期, 整个胚体饱满, 卵膜平滑, 没有明显的皱缩或隆起(图 2h)。
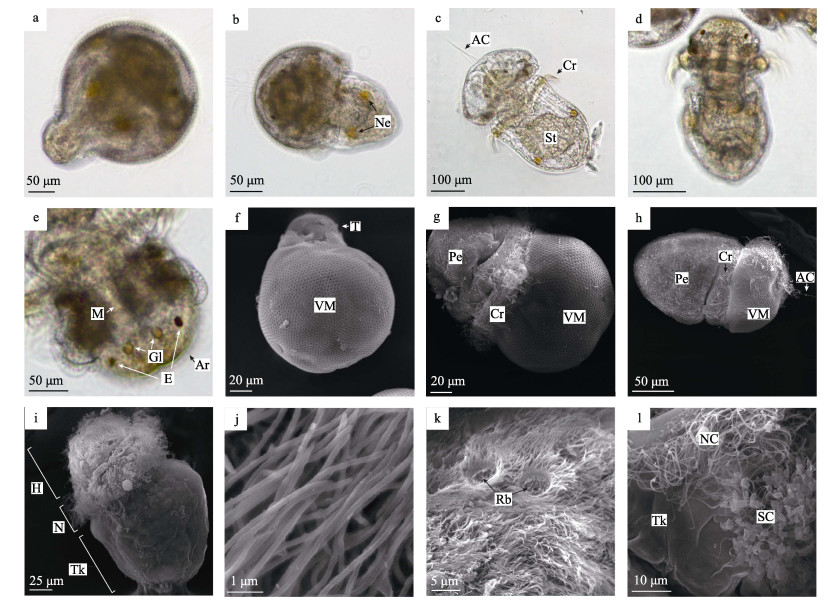
2.2 幼体发育 2.2.1 前期海球幼体受精后约24 h, 担轮幼虫开始出膜成为前期海球幼体。刚出膜的前期海球幼体体长约300 μm, 胃中无食物, 出膜后不久开始摄食单胞藻。前期海球幼体分为头部、颈部和躯干部, 身体伸缩能力强, 自然舒展呈圆筒形。出膜过程发生时, 与顶纤毛相对一端的卵膜发生破裂, 幼体的后端首先从裂口处钻出(图 3a)。随后, 躯干部和颈部也相继钻出卵膜, 其颈部具有长纤毛聚集形成的口后纤毛环, 是幼体的游泳器官; 躯干部体壁未形成明显的肌肉束, 肾管明显; 消化道已基本形成, 其中胃膨大, 占据躯干部体腔的大部分空间(图 3b、3c), 肛门不明显。卵膜形似“头盔”包裹在海球幼体头部。最后, 头部与卵膜分离, 卵膜脱落, 孵化出前期海球幼体(图 3d)。头部前端具有短纤毛聚集形成的口前纤毛环, 有辅助摄食的功能。头部前端约1/3处的两侧各有1个红色眼点, 眼点内侧各有1个圆形的神经节; 中后部的中央有1条纵向裂缝状的口沟(图 3e)。
|
图 3 光裸星虫前期海球幼体
a.海球幼体从顶纤毛相对一端开始出膜. b.出膜一半的海球幼体, 肾管明显. c.躯干部已出膜的海球幼体, 示顶纤毛、口后纤毛环、胃. d.刚完成出膜的海球幼体. e.前期海球幼体头部, 示神经节、眼点、口沟. f.开始出膜的海球幼体, 卵膜光滑. g.出膜一半的海球幼体, 示口后纤毛环. h.躯干部出膜的海球幼体, 躯干部表面粗糙, 示顶纤毛、口后纤毛环. i.海球幼体, 躯干部体表光滑, 示口前纤毛环、口后纤毛环. j.构成口前纤毛环的大量短纤毛. k.口前纤毛环中的圆形裸露区域. l.口后纤毛环局部, 示普通纤毛和勺状纤毛. a-e为光镜观察, f-l为扫描电镜观察. Cr:口后纤毛环; St:胃; Gl:神经节; M:口沟; Ar:口前纤毛环; T:尾部; Pe:海球幼体; H:头部; N:颈部; Tk:躯干部; Rb:圆形裸露区. Fig.3 Pre-pelagospheric larva of Sipunculus nudus a. Pelagospheric larva was hatching from the reverse of apical cilia. b. Pelagospheric larva with obvious nephridioduct. c. Pelagospheric larva, showing the apical cilia and postoral ciliary ring. d. Newly hatched pelagospheric larva. e. The head of pre-pelagospheric larva, showing the ganglion, eyespot and mouth. f. Pelagosphesric larva that just begun to hatch have smooth egg envelope. g. Pelagospheric larva whose half body hatched, showing the postoral ciliary ring. h. Pelagospheric larva that trunk out of egg envelope with rough surface, showing the apical cilia and postoral ciliary ring. i. Pelagospheric larva with smooth trunk surface, showing the anterior ciliary ring and postoral ciliary ring. j. A large amount of short cilia constituted the anterior ciliary ring. k. The round bare region in the anterior ciliary ring. l. Postoral ciliary ring, showing the normal cilia and scoop-shaped cilia. a-e. The optical microscope. f-l. The scanning electron microscope. Cr: postoral ciliary ring; St: stomach; Gl: ganglion; M: mouth; Ar: anterior ciliary ring; T: tail; Pe: pelagospheric larva; H: head; N: neck; Tk: trunk; Rb: round bare. |
电镜观察下, 可见少数个体在开始出膜时, 卵膜裸露, 纤毛和顶纤毛均已脱落或仅有少量残存(图 3f、3g), 但多数个体在出膜过程中, 胚体原来的纤毛和顶纤毛依然存在(图 3h)。海球幼体躯干部刚伸出卵膜时, 体表黏附有一些碎屑物(图 3g、3h), 经过一段时间的游动后, 体表逐渐整洁光滑(图 3i)。口前纤毛环和口后纤毛环具有显著差异。其中, 口前纤毛环由末端不膨大的短小纤毛密集丛生形成, 纤毛长4~6 μm, 宽约为160 nm (图 3j); 部分区域的短小纤毛缺失形成圆形裸露区域, 裸露区直径约4 μm, 其功能未知(图 3k)。口后纤毛环上的纤毛分为普通纤毛和勺状纤毛两种, 普通纤毛比口前纤毛环的纤毛长, 勺状纤毛与担轮幼虫卵膜表面的勺状纤毛长度相近(图 3l)。
2.2.2 中期海球幼体生物饵料充足的情况下, 海球幼体体长快速增长。中期海球幼体体长达500 μm以上, 游动速度快, 且身体伸缩迅速有力, 头部和颈部均可收缩到躯干部内, 极度收缩时身体近球形(图 4a)。口前纤毛环和口后纤毛环始终保持高频摆动。随着身体延长, 海球幼体的食道延长(图 4b), 胃在躯干部的相对位置逐渐前移, 肠逐渐延长并回折为U型, 在躯干部中段体壁可见一个不明显的外凸, 即为肛门所在位置(图 4c)。电镜观察, 中期海球幼体口沟为纵向的裂缝状, 长28~30 μm, 宽3~5 μm(图 4d), 颈部有一圈连续的“领”(图 4d、4e), 高倍镜显示, “领”实际上是高度发达的口后纤毛环, 纤毛密集且相互粘连, 使得纤毛环呈片块状(图 4f)。由于体壁肌肉束的发展, 躯干部体壁逐渐出现许多丘状突起, 开始出现成体的方格状体壁的雏形(图 4g); 体壁中段上有一个不明显的肛门, 开口直径7~10 μm (图 4g); 头部和颈部收缩到躯干部后, 体壁交接处形成许多辐射状褶皱(图 4h)。
|
图 4 光裸星虫中期海球幼体
a.身体收缩呈球形的海球幼体. b.中期海球幼体头部, 食道明显延长, 示眼点、神经节. c.中期海球幼体, 胃充满食物而膨大, 肠回折为U形, 躯干部中段体壁出现外凸的肛门. d.中期海球幼体, 示口沟. e.中期海球幼体头部, 口后纤毛环发达. f.口后纤毛环局部, 纤毛密集. g.中期海球幼体体表出现丘状突起, 开始出现成体的方格状体壁的雏形, 示肛门. h.回缩的颈部与躯干部体壁交接处形成辐射状褶皱. a-c为光镜观察, d-h为扫描电镜观察. Es:食道; An:肛门; I:肠道. Fig.4 Mid-pelagospheric larva of Sipunculus nudus a. Pelagospheric larva shrinked as a spherical. b. The head of mid-pelagospheric larva, showing the significantly prolonged esophagus, the eyespot and ganglion. c. Mid-pelagospheric larva with plump stomach and the intestine spiral into a U-shaped, the anus of middle trunk appeared. d. Mid-pelagospheric larva with the mouth. e. The head of mid-pelagospheric larva with developed postoral ciliary ring. f. Postoral ciliary with dense cilia. g. Mid-pelagospheric larva surface exhibited hilly protrusion and a mature body wall began to appear. h. The radial fold was formed at the junction of neck and trunk. a-c. The optical microscope. d-h. The scanning electron microscope. Es: esophagus; An: anus; I: intestine. |
后期海球幼体体长进一步增加, 但游泳活动减少, 常以体后端附着于其他物体表面, 运动方式逐渐向匍匐爬行转变。颈部开始延伸, 体壁增厚, 纵肌束明显, 头部和颈部的纤毛逐渐脱落减少, 摆动频率降低。胃在身体的相对位置明显前移, 充满单胞藻呈明显的绿色, 肠道延伸形成螺旋(图 5a), 可见细线状的收吻肌(图 5b)。电镜观察下, 后期海球幼体体壁发生明显变化, 躯干部体壁纵肌束和环肌束进一步发育, 在体壁上形成清晰的纵横交错的方格状肌痕(图 5c、5d), 口前纤毛环逐渐变得稀疏(图 5d), 口后纤毛环大量脱落甚至完全脱落(图 5e)。随发育进行, 身体前端逐渐伸长, 将发育为匍匐幼体的吻。吻表面粗糙, 具有许多细小的颗粒状乳突(图 5f)。肛门在体壁上突起明显, 其开口有所增大, 直径13~14 μm, 高为8~9 μm(图 5c、5g)。

|
图 5 光裸星虫后期海球幼体
a.后期海球幼体, 胃上移, 肠道延长. b.海球幼体头部, 示收吻肌. c.身体收缩的后期海球幼体, 体表呈方格状, 示肛门. d.后期海球幼体, 口前纤毛环稀疏. e.后期海球幼体颈部, 纤毛大量脱落, 已有部分区域裸露. f.即将变态的海球幼体的吻部体表有大量细小的乳突. g.肛门明显外凸. a-b为光镜观察, c-g为扫描电镜观察. Rm:收吻肌; IN:吻部. Fig.5 Late-pelagospheric larva of Sipunculus nudus a. Late-pelagospheric larva with stomach moving up and introvert prolongation. b. The head of late-pelagospheric larva, showing the retractor muscle. c. Body of late-pelagospheric larva was contracted and the lattice trunk surface was shown. d. Late-pelagospheric larva with sparse anterior ciliary ring. e. The neck of late-pelagospheric larva (A large number of cilia were falling off and some areas exposed). f. The impending metamorphosis pelagospheric larva had a large number of small mastoid on the surface of introvert. g. Anus obviously bulged. a-b. The optical microscope. c-g. The scanning electron microscope. Rm: retractor muscle; IN: introvert. |
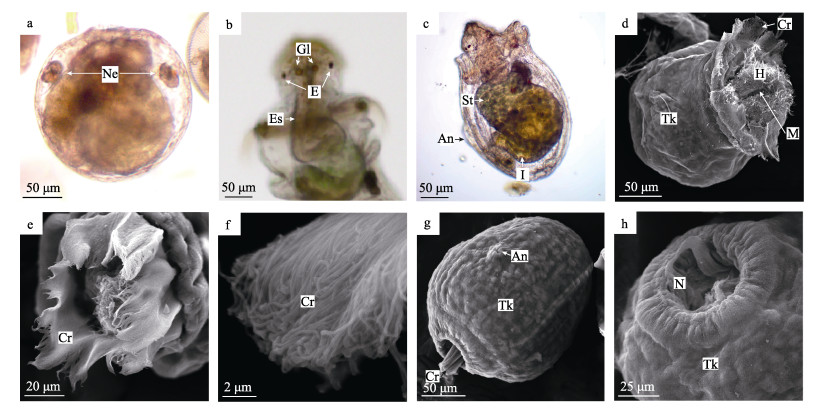
受精后约8~9 d, 后期海球幼体体长增长至1000 μm左右时, 基本不再游动, 转变为完全的匍匐运动。食性也从摄食浮游植物转变为吞食沙砾, 进入匍匐幼体阶段(图 6a)。匍匐幼体已没有明显的头部, 口前纤毛环和口后纤毛环消失; 吻部继续伸长, 伸缩能力很强; 身体末端中央外凸形成近球形的尾器(图 6a)。吻表面有很多规则排列的乳突, 吻部顶端前突, 形成两片宽大的突起, 将发育为触手(图 6b)。匍匐幼体收吻肌有所增粗, 其一端与吻部前端相连接, 另一端连接在躯干中部。肾管粗短, 近球形, 无明显延长(图 6c)。胃与肠的分界不明显, 肠道继续延长形成螺旋缠绕, 其内充满细沙砾(图 6a)。周围有很多细丝状的固肠肌联系肠壁和体壁(图 6d)。腹神经索明显, 并可见到神经索发出的神经纤维(图 6e)。
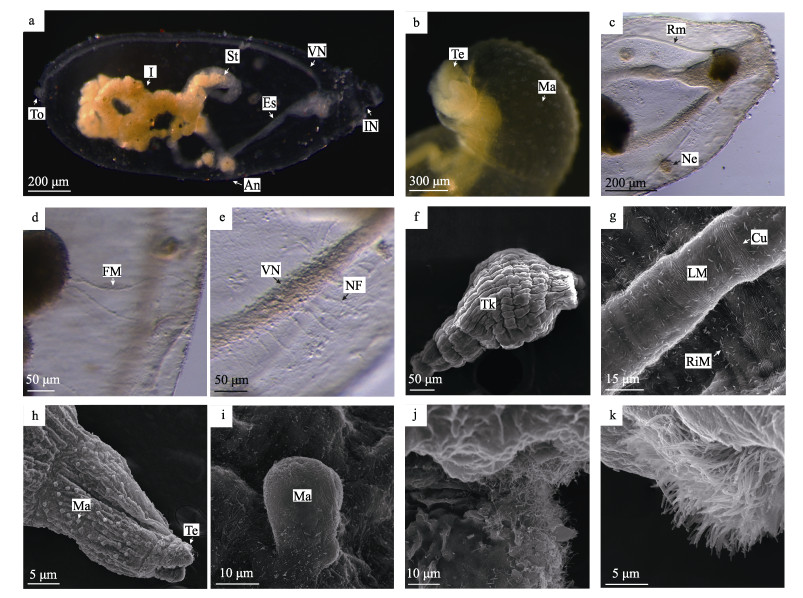
|
图 6 光裸星虫的匍匐幼体
a.匍匐幼体, 肠道形成许多螺旋, 肠中充满沙砾, 体末端中央形成尾器突起. b.匍匐幼体局部, 示乳突和触手. c.匍匐幼体局部, 收吻肌与吻部前端相连, 肾管呈近球形. d.匍匐幼体局部, 示固肠肌. e.腹神经索局部, 示神经索发出许多神经纤维. f.匍匐幼体, 体壁肌肉发达, 在表面形成显著的方格状纹理. g.匍匐幼体体壁局部, 角质层形成细小的褶皱, 环肌束小, 纵肌束大且不连续. h.匍匐幼体局部, 吻部表面布满乳突, 吻前端形成两片突起. i.吻部局部, 示乳突结构. j.吻部前端突起局部, 示突起前端具有少量纤毛. k.肛门周围成簇的纤毛. a-e为光镜观察, f-k为扫描电镜观察. To:尾器; Te:触手; Ma:乳突; FM:固肠肌; VN:腹神经索; NF:神经纤维; LM:纵肌束; RiM:环肌束; Cu:角质层. Fig.6 Creeping larva of Sipunculus nudus a. Creeping larva whose intestine formed many spirals and were filled with gravel, and the end of the body formed a tail protrusion. b. The mastoid and tentacles of creeping larva. c. The retractor muscle of creeping larva connected to the anterior of introvert, and the nephridioduct was spherical. d. The fixing muscles of creeping larva. e. Nerve cord and a large amount of nerve fibers. f. Creeping larva with strong muscle formed a significant grid-like texture. g. The corneum of creeping larva trunk formed some tiny folds. The circumferential muscle bundle was thin and the longitudinal muscle bundle was thick and discontinuous. h. The surface of the introvert of the creeping larvae was covered with mastoids, and the front end of the introvert formed two protrusions. i. The mastoid of introvert. j. A small amount of cilia at the front end of the protrusion of the introvert. k. Clustered cilia around the anus. a-e. The optical microscope. f-k. The scanning electron microscope. To: terminal organ; Te: tentacles; Ma: mastoid; FM: fixing muscles; VN: ventral nerve cord; NF: nerve fibers; LM: longitudinal muscle; RiM: circumferential muscle; Cu: corneum. |
电镜观察, 匍匐幼体体壁肌肉非常发达, 纵肌与环肌交错排列形成的方块状纹理比海球幼体更加显著(图 6f), 环肌束小、排列较整齐紧密; 纵肌束粗大, 彼此分离(图 6g); 体表有一层极薄的角质层, 并形成细小的褶皱(图 6g)。匍匐幼体吻部表面布满规则排列的乳突(图 6h); 乳突表面光滑, 没有褶皱或其他表皮衍生物, 高20~30 μm (图 6i)。吻前端形成两片突起, 表面褶皱明显(图 6h), 前端具有少量纤毛(图 6j)。肛门进一步隆起, 周围着生成簇的纤毛(图 6k)。
3 讨论 3.1 星虫动物的发育模式尽管星虫动物门仅有2纲4目6科17属163个物种[17], 却存在多样化的发育模式。Rice[18]将星虫动物的发育模式分为4种类型: (1)胚胎直接发育为稚虫, 无具有纤毛的幼体阶段(Ⅰ型); (2)胚胎经卵黄营养的担轮幼虫阶段, 发育为稚虫(Ⅱ型); (3)胚胎经担轮幼虫和海球幼体发育为稚虫, 担轮幼虫和海球幼体均为卵黄营养(Ⅲ型); (4)胚胎经担轮幼虫和海球幼体发育为稚虫, 担轮幼虫为卵黄营养, 海球幼体以浮游植物为营养来源(Ⅳ型)。Adrianov等[11]整理了源于1883—2008年的15篇文献中12属22种星虫发育的相关资料, 统计发现Ⅳ型发育模式最普遍, 共有10个物种, Ⅲ型次之, 共7个物种, 而Ⅰ型和Ⅱ型分别只有3个和2个物种。金春华等[13]报道我国特有种可口革囊星虫的幼体发育过程属于Ⅳ型, 与已有的同属物种研究结果一致。本研究结果显示, 光裸星虫担轮幼虫在卵膜内的发育, 完全依靠卵黄营养, 海球幼体大量摄食浮游植物, 胃内常常因充满单胞藻而呈黄绿色, 发育过程是典型的Ⅳ型, 与Rice[8]的报道一致。
重新整理上述资料后可分析这4种发育模式与星虫系统发生之间的关系。从现有资料看, 已有报道的7种革囊星虫纲物种的发育过程全部属于Ⅳ型, 这7个物种分属2目2科4属, 分别占革囊星虫纲的目、科、属、种数量的100%、100%、57.14%和14%, 可以推测革囊星虫纲可能全部以Ⅳ型模式发育, 或仅有少数例外。另一方面, 方格星虫纲物种的发育方式却表现出显著的多样性, 上述4种类型全部存在, 而且不仅在纲、目、科等高级分类阶元存在明显差异, 甚至同属的物种也有不同。例如, 同为倭革囊星虫属的P. cryptus为直接发育类型, 属于Ⅰ型, 但倭革囊星虫属的P. strombi却有担轮幼虫期, 属于Ⅱ型; 戈芬星虫属物种均有担轮幼虫和海球幼体时期, 但长戈芬星虫(Golfingia elongate)、戈芬星虫属的G. pugettensis和普通戈芬星虫(G. vulgaris)的海球幼体依靠卵黄营养, 属于Ⅲ型, 戈芬星虫属的G. pellucida却是Ⅳ型, 海球幼体摄食浮游植物。分析结果显示, 革囊星虫纲发育模式一致, 而方格星虫纲发育模式多样化, 推测方格星虫纲的遗传分化也可能高于革囊星虫纲, 但还需要更多分子证据。
3.2 光裸星虫胚胎和幼体发育的特点及应用本研究发现光裸星虫胚胎和幼体发育包括卵裂、囊胚、原肠胚、担轮幼虫、海球幼体、匍匐幼体等主要阶段, 既符合上述星虫的第Ⅳ型发育模式基本过程, 也有自身特点。
星虫卵黄膜表面密布微孔, 一般认为, 这些微孔的形成与星虫卵子在体腔液中游离发育方式相关, 可作为外源性物质进入卵子的通道[19-20]。本研究中发现光裸星虫胚胎发育在卵膜内进行, 随着胚胎发育的进行, 卵膜这些微孔中央逐渐外凸并形成一个小孔洞, 担轮幼虫的纤毛从小孔洞中伸出。因此, 微孔还是光裸星虫胚胎纤毛伸出卵膜的通道。我们的前期工作发现, 光裸星虫成熟卵子的卵膜可厚达9~12 μm, 并且较为致密, 而膜孔处卵膜不仅比其他区域薄, 而且超微结构也有明显不同[20], 这些差异可能是纤毛从膜孔中伸出的决定性因素。由于现有文献未述及卵膜孔与担轮幼虫纤毛之间的关系, 尚不确定这是星虫动物的普遍现象, 还是光裸星虫特有的情况。与阿氏革囊星虫的卵膜会发育为海球幼体的表皮[21]不同, 光裸星虫担轮幼虫孵化出膜的过程中, 卵膜与幼体分离, 最后被抛弃。
已有研究表明, 星虫动物担轮幼虫均具有发达的纤毛, 其中, 一束较长的纤毛集中于体轴前端形成顶纤毛, 另一些纤毛在胚体中部环绕胚体一周[9]。光裸星虫担轮幼虫顶纤毛与其他星虫一致, 但其余纤毛着生部位不局限于胚体中部, 而是密布于整个胚体。Rice[8]推测光裸星虫担轮幼虫胚胎中的纤毛细胞从赤道向两极延伸并最终包裹着整个胚胎, 因此才使得光裸星虫担轮幼虫的整个表面都布满纤毛。郑燕玲等[22]引述他人意见认为这是光裸星虫发育成前担轮的基细胞沿着卵膜内极度扩张的结果。由于光裸星虫的卵裂、原肠胚和担轮幼虫是在卵膜内发育, 难以直接观察, 因此对其担轮幼虫纤毛来源和发生过程尚无定论。我们对担轮幼虫和出膜中的海球幼体的纤毛形态作了仔细的甄别后发现, 光裸星虫海球幼体口前纤毛环(前担轮)的纤毛短小、无勺状纤毛, 与担轮幼虫表面纤毛差异较大, 推测来源不一致, 因而不支持郑燕玲等[22]的观点; 而口后纤毛环与担轮幼虫的纤毛长度相似, 都具有勺状纤毛, 推测二者具有一定的同源性, 与Rice[8]意见基本一致。
如上所述, 光裸星虫担轮幼虫和海球幼体具有特殊的勺状纤毛, 在担轮幼虫阶段, 勺状纤毛着生在体轴前端; 海球幼体阶段, 勺状纤毛集中于口后纤毛环。这在星虫动物已有研究[4-13, 18]中还未见报道。范瑞青等[23]和王宜艳等[24]分别利用扫描电镜观察, 发现菲律宾蛤仔(Ruditapes philip pinarum)的唇瓣和紫彩血蛤(Nuttallia olivacea)的外套膜内表皮存在勺状纤毛, 其形态特征与本研究所观察到的勺状纤毛基本一致, 即纤毛末端膨大呈圆形或椭圆形并形成一凹陷。有学者认为这些着生在唇瓣和外套膜的勺状纤毛有助于贝类的摄食和气体交换[24]。光裸星虫栖息在暖水性潮间带, 担轮幼虫和海球幼体阶段依赖纤毛的摆动在水中进行游动, 作者认为, 末端膨大的勺状纤毛可为光裸星虫幼体的运动提供更大的水流反冲力, 节约能量消耗并有利于幼体应对潮间带多变的环境。
光裸星虫海球幼体的口前纤毛环具有辅助摄食的功能, 可过滤水体中的单胞藻, 并将食物推送到口沟处。前期海球幼体孵化时, 口前纤毛环已经形成, 并在出膜后不久即开始大量摄食, 说明卵黄营养已经消耗殆尽, 幼体亟需外源性营养供给身体发育和运动。我们在利用育苗车间水泥池进行规模化光裸星虫苗种繁育时, 有少数幼体开始出膜时, 就开始少量投喂浮游植物, 随着出膜幼体数量增加而逐渐提高投饵量, 以满足海球幼体的摄食需求[3]。在生物饵料的选择上, 兰国宝等[25]报道水产育苗常用的亚心形扁藻、叉鞭金藻(Dicrateriasp.)等9种海产单细胞藻类和面包酵母(Saccharomyce cerevisiae)都是光裸星虫海球幼体的良好饵料。我们根据湛江水文条件对藻类生长的影响, 借鉴多年珍珠贝育苗的经验, 混合投喂亚心形扁藻、湛江叉鞭金藻和小球藻(Chlorella sp.), 取得较好的生产效果。
在光裸星虫后期海球幼体附着变态为匍匐幼体过程中, 口前纤毛环逐渐脱落, 难以继续摄食浮游植物, 幼体改为吞食沙砾, 以沙砾表面附着的底栖硅藻和有机碎屑为食。因此, 育苗池沙砾粒径和底栖硅藻密度对幼体变态后的存活率有显著影响。在育苗生产上, 我们采取车间内采光、在幼体池铺设细沙层、提前培育底栖硅藻的方式, 可有效提高幼体变态后的存活率和生长率[3]。
水温对水生动物胚胎发育和幼体变态有显著影响, 但不同温度条件下发育速度与存活率之间没有必然联系。梁俊平等[26]报道在15.3~28.1℃范围内, 脊尾白虾(Exopalaemon carinicauda)胚胎和幼体变态发育速度随着温度的升高而加快, 但幼体变态过程中存活率呈明显的阶梯式下降趋势。孔宁等[27]研究表明, 14~28℃条件下, 水温对皱纹盘鲍(Haliotis discus hannai)选群的变态率、变态幼体存活率影响极显著(P < 0.01), 其中, 24℃时变态率最高, 18℃时变态幼体存活率最高。兰国宝等[1]分析了水温(21.5~34℃)对光裸星虫幼体发育和变态的影响, 结果显示, 海球幼体从孵化到附着变态的时间随温度升高而缩短, 30℃以下时, 幼体变态后存活率不足1%, 30℃以上进行幼体变态率和变态后成活率都明显提高。我们在育苗生产中发现, 水温在32℃以上时, 尽管幼体在体长700 μm左右就可以变态, 但变态后存活率会下降。我们认为较高的温度可能导致了光裸星虫纤毛环的过早脱落, 但消化系统的发育尚不完善, 无法适应食性的转变。湛江地区光裸星虫的主要繁殖季节为5—9月[28], 水温较高的年份, 4月中下旬也可以繁殖。根据我们长期积累的水温记录, 4月中旬到7月上旬间, 湛江地区室内育苗池水温多在25~30℃, 7月中旬到9月中旬多在30~ 32.5℃; 同期, 室外水泥育苗池水温分别在27~ 33℃和32~36℃(内部资料, 未发表)。因此, 在本地进行光裸星虫苗种生产时, 7月中旬以前利用室外水泥池育苗, 7月中旬以后利用室内水泥池育苗更符合星虫幼体发育对水温的需求。
4 结论光裸星虫胚胎和幼体发育包括卵裂、囊胚、原肠胚、担轮幼虫、海球幼体、匍匐幼体等主要阶段, 符合星虫Ⅳ型发育模式, 各发育时期, 胚胎和幼体具有复杂的形态和结构变化。首次报道了卵膜微孔作为担轮幼虫纤毛伸出的通道, 以及担轮幼虫和海球幼体具有特殊的勺状纤毛。
| [1] |
Lan G B, Liao S M, Yan B. Effect of water temperature on larval development and metamorphosis of Sipunculus nudus[J]. Journal of Fisheries of China, 2007, 31(5): 633-638. [兰国宝, 廖思明, 阎冰. 水温对方格星虫幼体发育及变态的影响[J]. 水产学报, 2007, 31(5): 633-638.] |
| [2] |
Chen Z G, Ban T H, Chen Z H, et al. Breeding technical regulation of Sipunculus nudus in mud pond[J]. Ocean and Fishery, 2015(8): 62-63. [陈振国, 班庭辉, 陈振华, 等. 方格星虫土池育苗技术规程[J]. 海洋与渔业, 2015(8): 62-63. DOI:10.3969/j.issn.1672-4046.2015.08.028] |
| [3] |
Wang Q H, Deng Y W, Zhang J W, et al. Method for cultivating larvae of Sipunculus nudus indoors: China, 201610500667.7[P]. 2016-10-26. [王庆恒, 邓岳文, 张家炜, 等.一种光裸星虫室内苗种培育的方法: 中国, 201610500667.7[P]. 2016-10-26.]
|
| [4] |
Rice M E. Morphology, behavior, and histogenesis of the pelagosphera larva of Phascolosoma agassizii (Sipuncula)[J]. Smithsonian Contributions to Zoology, 1973, 132: 1-51. |
| [5] |
Rice M E. Larval development and metamorphosis in Sipuncula[J]. American Zoologist, 1976, 16(3): 563-571. DOI:10.1093/icb/16.3.563 |
| [6] |
Rice M E, Reichardt H F. Larval development and metamorphosis of Siphonosoma cumanense (Keferstein, 1867)[J]. American Zoologist, 1984, 24: 47. |
| [7] |
Rice M E. Factors influencing larval metamorphosis in Golfingia misakiana (Sipuncula)[J]. Bulletin of Marine Science, 1986, 39(2): 362-375. |
| [8] |
Rice M E. Observations on development and metamorphosis of Siphonosoma cumanense with comparative remarks on Sipunculus nudus (Sipuncula, Sipunculidae)[J]. Bulletin of Marine Science, 1988, 42(1): 1-15. |
| [9] |
Adrianov A V, Maiorova A S, Malakhov V V. Embryonic and larval development of the peanut worm Themiste pyroides (Sipuncula: Sipunculoidea) from the Sea of Japan[J]. Invertebrate Reproduction & Development, 2008, 52(3): 143-151. |
| [10] |
Adrianov A V, Maiorova A S, Malakhov V V. Meiofaunal stages in the development of the sipunculans Thysanocardia nigra (Ikeda, 1904) and Themiste pyroides (Chamberlin, 1920) from the Sea of Japan (Sipuncula: Sipunculidea)[J]. Meiofauna Marina, 2009, 17: 83-96. |
| [11] |
Adrianov A V, Maiorova A S. Reproduction and development of common species of peanut worms (Sipuncula) from the Sea of Japan[J]. Russian Journal of Marine Biology, 2010, 36(1): 1-15. DOI:10.1134/S1063074010010013 |
| [12] |
Wu H X, Ying X P, Chen C, et al. Embryo and larval development of Phasocolosom aesculenta[J]. Acta Zoologica Sinica, 2006, 52(4): 765-773. [吴洪喜, 应雪萍, 陈琛, 等. 可口革囊星虫胚胎与幼体的发育[J]. 动物学报, 2006, 52(4): 765-773.] |
| [13] |
Jin C H, Zhu J Q, Xu S J, et al. Study on the embryonic and larval development of Phascolosoma esculenta[J]. Oceano logia et Limnologia Sinica, 2011, 42(1): 94-100. [金春华, 竺俊全, 许式见, 等. 可口革囊星虫(Phascolosoma esculenta)胚胎及幼虫发育研究[J]. 海洋与湖沼, 2011, 42(1): 94-100.] |
| [14] |
Long L L, Sheng Z, Xu S J, et al. The cytological changes of sperm and oocyte nuclei during fertilization in Phascolosoma esculenta (Sipuncula: Phascolosomatidea)[J]. Italian Journal of Zoology, 2015, 82(3): 327-337. DOI:10.1080/11250003.2015.1045045 |
| [15] |
Wu B. Development of genital cells and embryo of Sipunculus nudus[J]. Guangxi Sciences, 1999, 6(3): 222-226. [吴斌. 光裸方格星虫(Sipunculus nudus L.)生殖细胞及胚胎发育[J]. 广西科学, 1999, 6(3): 222-226. DOI:10.3969/j.issn.1005-9164.1999.03.021] |
| [16] |
Lan G B, Yan B, Liao S M. A study on embryonic and larval developments of Sipunculus nudus[J]. Journal of Tropical Oceanography, 2003, 22(6): 70-75. [兰国宝, 阎冰, 廖思明. 方格星虫胚胎与幼体发育的研究[J]. 热带海洋学报, 2003, 22(6): 70-75. DOI:10.3969/j.issn.1009-5470.2003.06.010] |
| [17] |
Cutler E B. The Sipuncula: their systematics, biology, and evolution[M]. Ithaca, NY: Cornell University Press, 1994: XV-XVII.
|
| [18] |
Rice M E. Reproduction of marine invertebrates[M]. Vol. 2. New York: Academic Press, 1975: 66-127.
|
| [19] |
Zhu J Q, Wang W, Ying X P, et al. Cytological changes of fertilization and early cleavage in Phascolosoma esculenta[J]. Acta Zoologica Sinica, 2008, 54(2): 290-298. [竺俊全, 王武, 应雪萍, 等. 可口革囊星虫受精过程及早期卵裂的细胞学变化[J]. 动物学报, 2008, 54(2): 290-298.] |
| [20] |
Wang Q H, Zhang J W, Hao R J, et al. Ultrastructure of oogenesis in coelomic fluid of Sipunculus nudus[J]. Oceano logia et Limnologia Sinica, 2017, 48(1): 57-66. [王庆恒, 张家炜, 郝瑞娟, 等. 光裸星虫体腔液中卵子发生的超微结构[J]. 海洋与湖沼, 2017, 48(1): 57-66.] |
| [21] |
Adrianov A V, Maiorova A S, Malakhov V V. Embryonic and larval development of the peanut worm Phascolosoma agassizii (Keferstein 1867) from the Sea of Japan (Sipuncula: Phascolosomatidea)[J]. Invertebrate Reproduction & Development, 2011, 55(1): 22-29. |
| [22] |
Zheng Y L, Feng D Q, Guo F, et al. Advance in the research on reproductive biology of Sipunculida[J]. Marine Sciences, 2006, 30(1): 84-87. [郑燕玲, 冯丹青, 郭丰, 等. 星虫动物繁殖生物学研究进展[J]. 海洋科学, 2006, 30(1): 84-87. DOI:10.3969/j.issn.1000-3096.2006.01.017] |
| [23] |
Fan R Q, Jiang M, Gao L, et al. Exterior structural studies on the labial palps of Ruditapes philippinarum[J]. Journal of Ocean University of Qingdao, 2003, 33(5): 671-674. [范瑞青, 姜明, 高澜, 等. 菲律宾蛤仔(Ruditapes philippinarum)唇瓣的表面结构[J]. 青岛海洋大学学报:自然科学版, 2003, 33(5): 671-674.] |
| [24] |
Wang Y Y, Du X D, Sun H S. Observation on the mantle of Nuttallia olivacea with scanning electron microscope[J]. Chinese Journal of Zoology, 2002, 37(2): 14-16. [王宜艳, 杜旭东, 孙虎山. 紫彩血蛤外套膜的扫描电镜观察[J]. 动物学杂志, 2002, 37(2): 14-16. DOI:10.3969/j.issn.0250-3263.2002.02.004] |
| [25] |
Lan G B, Liao S M, Yan B, et al. Natural food in larval peanut worm (Sipunculus nudus)[J]. Fisheries Science, 2005, 24(2): 1-4. [兰国宝, 廖思明, 阎冰, 等. 方格星虫幼体饵料研究[J]. 水产科学, 2005, 24(2): 1-4.] |
| [26] |
Liang J P, Li J, Li J T, et al. Effects of water temperature on the embryonic development, survival and development period of larvae of ridgetail white prawn (Exopalaemon carinicauda) reared in the laboratory[J]. Acta Ecologica Sinica, 2013, 33(4): 1142-1152. [梁俊平, 李健, 李吉涛, 等. 不同温度对脊尾白虾胚胎发育与幼体变态存活的影响[J]. 生态学报, 2013, 33(4): 1142-1152.] |
| [27] |
Kong N, Lian J W, Xue Y J, et al. Effects of water temperature and salinity on metamorphosis, post-larval survival, and growthof the sixth generation of "97" selective breeding population of Haliotis discus hannai Ino[J]. Marine Sciences, 2016, 40(10): 49. [孔宁, 连建武, 薛艳洁, 等. 水温和盐度对皱纹盘鲍"97"选群第6代变态及变态幼体生长存活的影响[J]. 海洋科学, 2016, 40(10): 49. DOI:10.11759//hykx20150107003] |
| [28] |
Wang Q H, Du X D, Huang H Y, et al. Development of germ cell sand reproductive cycle of Sipunculus nudus L. in Zhanjiang[J]. Journal of Zhanjiang Ocean University, 2005, 25(1): 5-9. [王庆恒, 杜晓东, 黄洪艳, 等. 湛江地区光裸星虫的生殖细胞发育和生殖周期[J]. 湛江海洋大学学报, 2005, 25(1): 5-9. DOI:10.3969/j.issn.1673-9159.2005.01.002] |
 2018, Vol. 25
2018, Vol. 25

