2. 农业农村部南方水产与畜禽饲料重点实验室, 广东 湛江 524074
2. Key Laboratory of Aquatic, Livestock and Poultry Feed Science and Technology in South China, Ministry of Agri-culture and Rural Affairs, Zhanjiang 524074, China
凡纳滨对虾(Litopenaeus vannamei)因其具有生长速度快、盐度适应广、高投入高回报等优点, 自引入我国以来养殖规模迅速扩大, 养殖产量已居对虾类第一[1]。但近年来, 频频发生的病害对对虾养殖产业造成相当大的经济损失, 严重阻碍其产业发展, 主要原因在于养殖规模过大[1], 抗生素的大量使用[2]等。因此, 寻找有效的病害防治措施, 就成为减少损失、增加养殖成功率的重要策略之一, 益生菌是指在一定范围内可以通过抑制有害微生物生长, 补充营养, 刺激免疫系统来增进宿主健康的活体微生物制剂[1-3]。因此, 越来越多的人选择用益生菌作为抗生素的替代品[2]。
嗜酸乳杆菌(Lactobacillus acidophilus)为革兰氏阳性菌, 在机体内释放乳酸和乙酸等抗菌物质, 抑制有害菌生长, 调节肠道微生态平衡[4]; 调节机体免疫功能, 维持肠道正常内环境[5]; 增强抗毒抗病能力[4]。近几年嗜酸乳杆菌在水产动物应用上的研究颇多, Sandeepa等[6]已经证实了饲喂含有嗜酸乳杆菌的饲料可显著提高凡纳滨对虾的增重率、抗病力及非特异性免疫酶活性。Hoseinifar等[7]用含有嗜酸乳杆菌的饲料投喂黑剑鱼(Xiphophorus helleri), 得出实验组鱼的存活率、增重率、特定生长率显著高于对照组的结果。有研究表明饲喂凡纳滨对虾含有嗜酸乳杆菌的饲料, 可以通过提高其非特异性免疫酶活性来提高免疫力[8-9]。嗜酸乳杆菌以其对肠道强大的黏附作用及良好的耐酸性, 适宜在机体肠道内定植[10-11]。因此, 本研究以嗜酸乳杆菌为材料, 在凡纳滨对虾幼虾饲料中添加不同比例进行实验, 以期寻找出嗜酸乳杆菌对机体影响的机理和最适添加量, 为实际生产提供更加细化的理论依据。
1 材料与方法 1.1 饲料配制实验饲料以鱼粉、豆粕、花生粕为主要蛋白源, 以鱼油、大豆油、大豆卵磷脂为主要脂肪源, 实验饲料组成与营养水平见表 1, 在加水过程中以菌液形式分别添加0%、0.1%、0.2%、0.4%、0.6%、0.8%和1.0%的嗜酸乳杆菌。饲料原料经粉碎后过80目筛, 准确称取各组分所需的添加量, 其中, 大宗原料先于Ⅴ型混合机混合10 min, 微量元素等通过逐级扩大法进行混合均匀。然后, 以双螺杆挤条机(F-26华南理工大学, 广州)配制成直径为1.5 mm的饲料, 置于60℃烘箱中后熟化30 min, 风干后分装于-20℃冰箱保存备用。取各组饲料样品检测有效活菌数, 0.1%组为0.72×108 cfu/g, 其他各组符合实验设计比例, 具体方法参照文献[12-13]。
|
|
表 1 实验饲料组成与营养水平(干物质%) Tab.1 Composition and nutrients levels of the experiment diets (DM %) |
养殖实验在广东湛江广东海洋大学东海岛海洋生物研究基地0.3 m3的玻璃纤维钢桶中进行, 实验虾苗购于湛江中联养殖有限公司。虾苗于室外水泥池暂养30 d, 挑选初始体重(0.58±0.01) g的健康个体, 以每桶40尾分成7个处理组, 饲喂对应的实验饲料, 每组设3个重复组。按照体重的8%~10%投喂, 每天投喂4次(7:00、11:00、17:00和21:00), 根据天气、摄食和生长情况相应调整投喂量, 实验前期每2 d换水, 后期每天换水, 换水量2/3。实验期间, 不断充气使溶解氧达到(5~ 6 mg/L), 水温为(30.5±0.8)℃, 盐度为29~31, pH 7.8~8.2, 氨氮低于0.03 mg/L, 养殖周期8周。
实验用嗜酸乳杆菌菌种来源于广东省微生物菌种保藏中心(GIM1.730), 采用MRS培养基进行复苏扩增培养, 培养方法参照说明书进行, 菌液浓度采用光电比浊法。攻毒用哈维弧菌(Vibrio harveyi)菌种由广东省水产经济动物病原生物学及流行病学重点实验室提供。
1.3 样品采集与测定实验结束样品采集前停喂24 h, 用一次性无菌注射器(1 mL)在腹部第五步足基部血窦处抽取虾血, 放进1.5 mL的离心管, 4℃冰箱中过夜后, 3500 r/min离心10 min (3K30, Sigma, 德国), 取上清液于1.5 mL的离心管中, 保存在-80℃超低温冰箱(Thermo Electron corporation, 美国)中备用。用无菌镊子及剪刀取肝脏和肠道放于装有RNA later的离心管中, 放于-80℃超低温冰箱保存, 用于过氧化氢酶、溶菌酶mRNA相对表达水平的测定。每桶取10尾虾以哈维弧菌(107 cfu/mL)肌肉注射进行攻毒实验。
计算公式:
| $ 增重率\left( {{\rm{weight gain rate, WGR, \% }}} \right) = \left( {末均重 - 初均重} \right)/初均重 \times 100; $ |
| $ 特定生长率\left( {{\rm{specific growth rate, SGR, \% /d}}} \right) = \\ \left( {\ln 末均重 - \ln 初均重} \right)/实验天数 \times 100; $ |
| $ 饲料系数\left( {{\rm{feed coefficient, FCE}}} \right) = 摄食量/\left( {末重 - 初重} \right); $ |
| $ 蛋白质效率\left( {{\rm{protein efficiency ratio, PER, \% }}} \right) = \\ \left( {末均重 - 初均重} \right)/\left( {摄食总量 \times 饲料粗蛋白含量} \right) \times 100; $ |
| $ 成活率\left( {{\rm{survival, SR, \% }}} \right) = \left( {实验结束时尾数/初始尾数} \right) \times 100。$ |
饲料和全虾的水分、粗蛋白、粗脂肪、粗灰分的测定参考AOAC[14], 水分的检测采用105℃干燥恒重法; 粗蛋白的检测采用凯氏定氮法(CP, N×6.25, KjeltecTM 8400, 瑞典); 粗脂肪的检测采用索氏抽提法; 粗灰分的检测采用箱式马福炉550℃灼烧法。血清中超氧化物歧化酶、过氧化氢酶、酸性磷酸酶、碱性磷酸酶活性采用南京建成生物工程研究所试剂盒测定, 具体操作严格按照各试剂盒说明书执行, 酚氧化物酶活性参照Huang等[15]的方法进行测定, 溶菌酶活性送至南京建成生物研究所测定。
1.4 过氧化氢酶、溶菌酶mRNA表达量的测定 1.4.1 引物设计CAT, LZM引物设计参照文献[16-20], 引物均由上海英潍捷基贸易有限公司合成, 内参基因β-actin和目的基因CAT、LZM的引物序列见表 2。
|
|
表 2 RT-PCR所用引物序列 Tab.2 Primers sequences for RT-PCR |
采用TRIzol (宝生物, 大连)法提取虾肝脏中的总RNA, 具体操作方法参照说明书和刘鹏飞等[18]。提取完成之后的总RNA用浓度为1.5%的琼脂糖凝胶进行电泳, 在凝胶成像仪上观察其完整性, 用Nano Drop 2000c (Thermo)定量检测RNA OD260nm/OD280nm, 将比值在1.8~2.0之间的RNA样品保存于-80℃用于后续实验。
采用TaKaRa公司的PrimeScript™ RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒将提取到的总RNA进行反转录反应, 合成cDNA, 具体操作步骤严格按照试剂盒说明书及参照黄旭雄等[21]的方法执行。
1.4.3 RT-PCR分析按照SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus) (宝生物, 大连)试剂说明操作, 在ABI 7500 Real Time PCR System进行RT-PCR。设定程序为: Stage 1:预变性, 95℃ 30 s; Stage 2: PCR反应, 95℃ 5 s, 60℃ 34 s。反应体系见表 3, mRNA表达结果采用相对表达量中的2-ΔΔCt法[22]分析计算。
|
|
表 3 荧光定量反应体系 Tab.3 Quantitative fluorescence reaction system |
实验数据用SPSS Version16.0软件进行统计分析, 先对数据作单因素方差分析(one-way ANOVA), 如有显著性差异(P < 0.05), 则做Duncan’s多重比较, 实验数据用平均数±标准差(x±SD)表示。
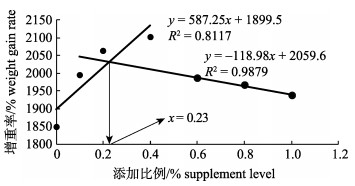
2 结果与分析 2.1 嗜酸乳杆菌对凡纳滨对虾幼虾生长性能的影响嗜酸乳杆菌对凡纳滨对虾幼虾生长性能的影响见表 4。由表 4可知, 嗜酸乳杆菌对凡纳滨对虾幼虾的成活率无显著影响(P>0.05);增重率与特定生长率呈先上升后下降趋势, 但均显著高于对照组(P < 0.05), 在0.4%组达到最大值; 当添加0.2%时, 饲料系数最低, 其他各组显著低于对照组(P < 0.05), 蛋白质效率的变化规律则与饲料系数相反。以WGR为判断依据(图 1), 根据折线模型得出其促进凡纳滨对虾幼虾生长的最适添加量为0.23%。
|
|
表 4 嗜酸乳杆菌对凡纳滨对虾幼虾生长性能的影响 Tab.4 Effects of Lactobacillus acidophilus on growth performance of juvenile Litopenaeus vannamei |
|
图 1 嗜酸乳杆菌添加比例与凡纳滨对虾幼虾增重率(WGR)关系模式图 Fig.1 Effects of supplement level of Lactobacillus acidophilus on weight gain rate of juvenile Litopenaeus vannamei |
嗜酸乳杆菌对凡纳滨对虾幼虾体成分的影响见表 5。由表 5可知嗜酸乳杆菌对凡纳滨对虾幼虾体成分均没有显著影响(P>0.05)。
|
|
表 5 嗜酸乳杆菌对凡纳滨对虾幼虾体成分的影响 Tab.5 Effects of Lactobacillus acidophilus on body composition of juvenile Litopenaeus vannamei |
嗜酸乳杆菌对凡纳滨对虾幼虾非特异性免疫酶活性的影响见表 6。由表 6可知, 血清酚氧化物酶(PO)、碱性磷酸酶(AKP)和酸性磷酸酶(ACP)活性先升后降, 嗜酸乳杆菌添加比例分别为0.4%、0.1%和0.2%时, 达到最大值; 当添加比例为0.2%、0.4%、0.8%、1.0%时血清中酚氧化物酶活性显著高于对照组(P < 0.05), 在添加比例0.4%达到最高值; 碱性磷酸酶除嗜酸乳杆菌添加0.8%、1.0%组活性略高于对照组外, 其余各组活性均显著高于对照组(P < 0.05);添加0.2%酸性磷酸酶活性达到最大, 其余各组活性呈递增趋势且显著高于对照组(P < 0.05);超氧化物歧化酶活性则随嗜酸乳杆菌添加比例增大而升高, 实验组活性均显著高于对照组(P < 0.05);添加比例0.6%时过氧化氢酶活性达到最大值, 其余各组活性均显著高于对照组(P < 0.05);溶菌酶活性呈逐级升高趋势, 在嗜酸乳杆菌添加1.0%达到最大值, 其余各组活性均显著高于对照组(P < 0.05)。
|
|
表 6 嗜酸乳杆菌对凡纳滨对虾幼虾非特异性免疫酶活性的影响 Tab.6 Effects of Lactobacillus acidophilus on nonspecific immune enzyme activities of juvenile Litopenaeus vannamei |
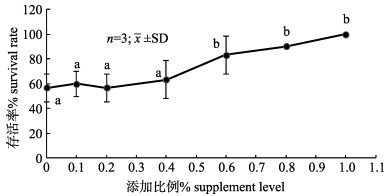
嗜酸乳杆菌对凡纳滨对虾幼虾抗病力的影响见图 2。由图 2可知哈维弧菌攻毒96 h凡纳滨对虾存活率随嗜酸乳杆菌添加比例的升高而增大, 当添加比例为0.6%、0.8%、1.0%时存活率显著高于对照组(P < 0.05), 在添加比例1.0%达到最大值。
|
图 2 哈维弧菌攻毒96 h凡纳滨对虾幼虾存活率标注不同字母表示差异显著(P < 0.05). Fig.2 Survival rate of juvenile Litopenaeus vannamei after 96 h challenged with Vibrio harveyi Different letters denote significant differencebetween groups (P < 0.05). |
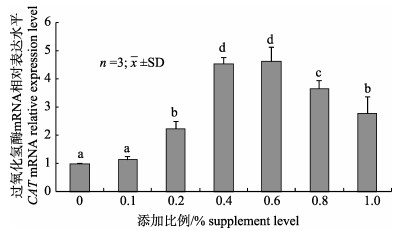
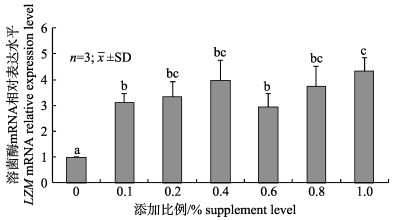
嗜酸乳杆菌对凡纳滨对虾幼虾相关酶mRNA表达的影响见图 3、图 4。由图 3可知过氧化氢酶mRNA表达水平呈先升后降趋势, 在嗜酸乳杆菌添加比例0.6%达到最大值, 除第2组外, 其余各组表达水平均显著高于对照组(P < 0.05)。嗜酸乳杆菌添加比例在0.4%、0.8%、1.0%时溶菌酶mRNA表达水平较高, 在添加比例1.0%时达到最大值, 其余各组均显著高于对照组(图 4)。
|
图 3 嗜酸乳杆菌对凡纳滨对虾幼虾肝脏CAT mRNA相对表达水平的影响 标注不同字母表示差异显著(P < 0.05). Fig.3 Effects of juvenile Lactobacillus acidophilus on the relative expression level of CAT mRNA in liver ofjuvenile Litopenaeus vannamei Different letters denote significant differencebetween groups (P < 0.05). |
|
图 4 嗜酸乳杆菌对凡纳滨对虾幼虾肝脏LZM mRNA相对表达水平的影响 标注不同字母表示差异显著(P < 0.05). Fig.4 Effects of Lactobacillus acidophilus on therelative expression level of LZM mRNA inliver of juvenile Litopenaeus vannamei Different letters denote significant differencebetween groups (P < 0.05). |
嗜酸乳杆菌是近几年常用的作为饲料添加剂的益生菌, 对水产动物等具有促进生长的作用[8]。本实验结果表明饲料中添加嗜酸乳杆菌可显著提高凡纳滨对虾幼虾增重率、特定生长率, 降低饵料系数, 但其作用效果与嗜酸乳杆菌添加的比例有关, 添加比例过高对凡纳滨对虾幼虾促生长效果不明显。在添加比例为0.2%和0.4%时凡纳滨对虾的增重率、特定生长率均显著高于对照组和1.0%组, 饲料系数显著低于对照组和1.0%组。以WGR为判断依据(图 1), 根据折线模型得出其促进凡纳滨对虾幼虾生长的最适添加量为0.23%, 显示出嗜酸乳杆菌添加比例是影响其作用效果的重要因素, 只有在饲料中添加适当比例的嗜酸乳杆菌才能更好促进凡纳滨对虾幼虾健康生长。这与研究者对凡纳滨对虾[23]、斑节对虾(Penaeus monodon)[24]等的研究结果类似。分析嗜酸乳杆菌促进凡纳滨对虾幼虾生长可能与其抑制有害菌生长, 调节肠道微生态平衡[6], 维持肠道正常内环境[7]等作用有关。但添加比例过高, 其促生长作用则不明显, 推测可能是因为过量的嗜酸乳杆菌会抑制其他有益菌生长, 造成肠道有益菌群生态失衡, 从而影响对虾生长, 具体作用机理还有待深入研究。
3.2 嗜酸乳杆菌对凡纳滨对虾幼虾非特异性免疫力和抗病力的影响酚氧化酶、溶菌酶活性是检测凡纳滨对虾非特异性免疫力的重要指标[25-32], 本研究中添加嗜酸乳杆菌组的血清酚氧化酶、溶菌酶活性呈升高趋势, 但两者趋势不一致, 说明添加嗜酸乳杆菌对酚氧化酶、溶菌酶活性起到积极促进作用, 这与刘迪等[9]的结果相似。超氧化物歧化酶、过氧化氢酶能够有效地清除自由基、活性氧, 防止生物分子方面的损伤, 起到免疫抗病作用[30, 33-36]。本研究中随嗜酸乳杆菌添加比例的变化, 过氧化氢酶和超氧化物歧化酶活性实验组均高于对照组, 证明添加适量嗜酸乳杆菌可以提高过氧化氢酶和超氧化物歧化酶活性, 这与王永胜[33]、李文芬等[37]的饲养结果相似。酸性磷酸酶和碱性磷酸酶参与生物体内物质的快速摄取与转运[36], 也是机体免疫抗病不可缺少的重要免疫酶[38-39]。本研究中随嗜酸乳杆菌添加比例变化, 碱性磷酸酶活性呈上升趋势, 酸性磷酸酶活性实验组均显著高于对照组, 说明添加嗜酸乳杆菌能够有效地提高酸性磷酸酶和碱性磷酸酶的活性, 提高机体免疫力, 这与隋大鹏[30]的实验结果类似。
本实验中养殖实验结束后用哈维弧菌对凡纳滨对虾幼虾肌肉注射, 观察记录96 h存活率, 结果表明凡纳滨对虾幼虾存活率随着嗜酸乳杆菌添加比例的升高而升高, 说明添加嗜酸乳杆菌能够很好地提高凡纳滨对虾幼虾的抗病力。这与刘文亮用副溶血弧菌(Vibrio parahaemolyticus)和白斑综合征病毒(WSSV)感染投喂过含有益生菌饲料的凡纳滨对虾[40], Kongnum等[41]用哈维弧菌注射饲喂过乳酸杆菌的凡纳滨对虾幼虾结果相似。
3.3 嗜酸乳杆菌对凡纳滨对虾幼虾相关酶mRNA表达的影响过氧化氢酶具有防止自由基形成, 维持免疫系统平衡, 保护个体组织免受病毒侵害的重要作用[42]; 溶菌酶在维持机体防御中具有重要作用, 可以辅助判断机体非特异性免疫机能[43], 研究这两种酶mRNA表达量可以更深入地探讨凡纳滨对虾幼虾的免疫机理。本研究中过氧化氢酶和溶菌酶mRNA相对表达量均较对照组要高, 说明添加嗜酸乳杆菌能够提高凡纳滨对虾非特异性免疫酶mRNA相对表达量。张盛静等[19]研究表明, 饲料中添加芽孢杆菌可有效提高以副溶血弧菌人工感染凡纳滨对虾抗感染能力, 并提高非特异性免疫基因表达水平; 此外, 添加复合益生菌类可提高凡纳滨对虾的酚氧化酶、超氧化物歧化酶和溶菌酶mRNA相对表达量[20]; 本研究结果与上述结果相一致, 推测嗜酸乳杆菌增强凡纳滨对虾幼虾抗病力, 提高非特异性免疫力可能是通过增加抗病相关基因的表达量而实现。
| [1] |
Zhao Y F, Song Q H. Overview of Litopenaeus vannamei culture and disease prevention and control measures[J]. Scientific Fish Farming, 2014, 30(7): 13-17. [赵永锋, 宋迁红. 南美白对虾养殖概况及病害防控措施[J]. 科学养鱼, 2014, 30(7): 13-17.] |
| [2] |
Balcazar J L, Blas I D, Ruiz Z I, et al. The role of probiotics in aquaculture[J]. Veterinary Microbiology, 2006, 114(3-4): 173-186. DOI:10.1016/j.vetmic.2006.01.009 |
| [3] |
Yu Y, Li H R, Li Y, et al. The application of probiotic preparation to aquaculture[J]. Journal of Fishery Sciences of China, 2001, 8(2): 92-96. [俞勇, 李会荣, 李筠, 等. 益生菌制剂在水产养殖中的应用[J]. 中国水产科学, 2001, 8(2): 92-96. DOI:10.3321/j.issn:1005-8737.2001.02.024] |
| [4] |
Si R G L, Zhang R P, Zhou R F. Physiological function and mechanism of Lactobacillus[J]. Feed and Livestock Husbandry, 2012(6): 49-51. [斯日古楞, 张润平, 周瑞峰. 乳酸菌的生理功能及其作用机理[J]. 饲料与畜牧, 2012(6): 49-51.] |
| [5] |
Wen G L, Yu M C, Li Z J, et al. Study on the use of herbal feed additives in aquaculture[J]. Guangdong Agricultural Sciences, 2011, 38(24): 114-119. [文国樑, 于明超, 李卓佳, 等. 中草药饲料添加剂在水产养殖中的应用研究[J]. 广东农业科学, 2011, 38(24): 114-119. DOI:10.3969/j.issn.1004-874X.2011.24.038] |
| [6] |
Sandeepa G M, Ammani K. Immunological and antioxidant response of Litopenaeus vannamei fed with Lactobacillus species under WSSV challenge[J]. Current Trends in Biotechnology & Pharmacy, 2017, 11(1): 43-52. |
| [7] |
Hoseinifar S H, Roosta Z, Hajimoradloo A, et al. The effects of Lactobacillus acidophilus as feed supplement on skin mucosal immune parameters, intestinal microbiota, stress resistance and growth performance of black swordtail (Xiphophorus helleri)[J]. Fish & Shellfish Immunology, 2015, 42(2): 533-538. |
| [8] |
Wang G X, Huang Y H, Zhou Y, et al. Effects of Lactobacillus on Growth performance, digestive enzyme activities and non-specific immunity of Litopenaeus vannamei[J]. Chinese Journal of Animal Nutrition, 2010, 22(1): 228-234. [王国霞, 黄燕华, 周晔, 等. 乳酸菌对凡纳滨对虾幼虾生长性能、消化酶活性和非特异性免疫的影响[J]. 动物营养学报, 2010, 22(1): 228-234. DOI:10.3969/j.issn.1006-267x.2010.01.035] |
| [9] |
Liu D, Dong X H, Tan B P, et al. Effects of Lactobacillus acidophilus on growth performance, immunit y and disease resistance in Pacific white leg shrimp Litopenaeus vannamei[J]. Fisheries Science, 2016, 35(1): 37-42. [刘迪, 董晓慧, 谭北平, 等. 嗜酸乳杆菌对凡纳滨对虾生长、免疫力和抗病力的影响[J]. 水产科学, 2016, 35(1): 37-42.] |
| [10] |
Zhang J G, Liu C L. Application of lactic acid bacteria instead of antibiotics in aquaculture[J]. China Fisheries, 2014(7): 66-68. [张家国, 刘翠玲. 乳酸菌代替抗生素在水产养殖上的应用[J]. 中国水产, 2014(7): 66-68. DOI:10.3969/j.issn.1002-6681.2014.07.029] |
| [11] |
Wang Y T. Lactic acid bacteria and its application in aquaculture[J]. China Fisheries, 2009(10): 56-58. [王玉堂. 乳酸菌及其在水产养殖业的应用[J]. 中国水产, 2009(10): 56-58. DOI:10.3969/j.issn.1002-6681.2009.10.025] |
| [12] |
Yang X F, Li C Z, Wang Y. Detection of viable cell counts of yeast and Lactobacillus in probiotic feed[J]. Livestock and Feed Science, 2003, 24(2): 28. [杨雪峰, 李翠枝, 王绎. 益生素饲料中酵母菌和乳酸杆菌活菌数的检测[J]. 畜牧与饲料科学, 2003, 24(2): 28. DOI:10.3969/j.issn.1672-5190.2003.02.009] |
| [13] |
He J, Zhao Q M. Accurate determination of the number of viable bacteria in microbial feed[J]. China Feed, 1998(6): 26-26. [何佳, 赵启美. 微生物饲料中有效活菌数的准确测定[J]. 中国饲料, 1998(6): 26.] |
| [14] |
AOAC. Official Methods of Analysis[S]. 15th ed. Arlington, VA: Association of Official Analytical Chemists, 1995.
|
| [15] |
Huang J, Yang Y, Wang A. Reconsideration of phenoloxidase activity determination in white shrimp Litopenaeus vannamei[J]. Fish and Shellfish Immunology, 2010, 28(1): 240-244. DOI:10.1016/j.fsi.2009.10.010 |
| [16] |
Zhang S J, Zhao X J, Song X L, et al. Effects of adding probiotics on promoting intestinal bacteria, Toll receptors, and lysozyme immune gene expression and resistance to Vibrio harveyi in Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2016, 23(4): 846-854. [张盛静, 赵小金, 宋晓玲, 等. 饲料添加益生菌对凡纳滨对虾肠道菌群、Toll受体及溶菌酶基因表达及抗感染的影响[J]. 中国水产科学, 2016, 23(4): 846-854.] |
| [17] |
Deng K Y, Kong J, Meng X H, et al. Effects of poly-β-hydroxybutyrate on non-specific immune gene expression and WSSV resistance in WSSV infected Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2015, 22(5): 877-886. [邓康裕, 孔杰, 孟宪红, 等. 聚β-羟基丁酸酯对凡纳滨对虾抗WSSV能力及免疫基因表达量的影响[J]. 中国水产科学, 2015, 22(5): 877-886.] |
| [18] |
Liu P F, Liu Q H, Wu Y, et al. Expression of TRx, Lv P38, CAT, and POD gene of Litopenaeus vannamei response to WSSV infection[J]. Progress in Fishery Sciences, 2015, 36(4): 89-93. [刘鹏飞, 刘庆慧, 吴垠, 等. 白斑综合征病毒感染凡纳滨对虾(Litopenaeus vannamei) TRx、LvP38、CAT、POD基因的表达[J]. 渔业科学进展, 2015, 36(4): 89-93.] |
| [19] |
Zhang S J, Song X L, Zhao X J, et al. Effects of adding probiotics to the feed on anti-infection and five kinds of immune gene expression of Litopenaeus vannamei[J]. Journal of Fisheries of China, 2015, 39(6): 899-907. [张盛静, 宋晓玲, 赵小金, 等. 饲料中添加益生菌对凡纳滨对虾抗感染和5种免疫基因表达的影响[J]. 水产学报, 2015, 39(6): 899-907.] |
| [20] |
Sun Y, Liu F, Song X L, et al. Effects of adding probiotics in the feed on nonspecific immune gene expression and disease resistance of Litopenaeus vannamei[J]. Oceanologia et Limnologia Sinica, 2012, 43(4): 845-851. [孙艳, 刘飞, 宋晓玲, 等. 饲料中添加益生菌对凡纳滨对虾(Litopenaeus vannamei)非特异免疫基因表达量和抗病力的影响[J]. 海洋与湖沼, 2012, 43(4): 845-851.] |
| [21] |
Huang X X, Luo C X, Wei L K, et al. Effects of dietary yeast extract supplementation on the immune-related gene expressions and vibrio-resistant ability in Litopenaeus vannamei[J]. Journal of Fisheries of China, 2014, 38(12): 2049-2058. [黄旭雄, 罗词兴, 危立坤, 等. 饲料中添加酵母提取物对凡纳滨对虾免疫相关基因表达及抗菌机能的影响[J]. 水产学报, 2014, 38(12): 2049-2058.] |
| [22] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2002, 25(4): 402-408. |
| [23] |
Zheng X T, Duan Y F, Dong H B, et al. Effects of Lactobacillus plantarum on growth performance, gut histology and activitof digestive enzymes in Pacific white leg shrimp, Litopenaeus vannamei[J]. Fisheries Science, 2016, 35(1): 1-6. [郑晓婷, 段亚飞, 董宏标, 等. 植物乳酸杆菌对凡纳滨对虾生长、消化酶活性和肠道组织形态的影响[J]. 水产科学, 2016, 35(1): 1-6.] |
| [24] |
Anand P S S, Kohli M P S, Kumar S, et al. Effect of dietary supplementation of biofloc on growth performance and digestive enzyme activities in Penaeus monodon[J]. Aquaculture, 2014, 418-419(5): 108-115. |
| [25] |
Tan C G, Leng X J, Li X Q, et al. Effects of polysaccharides, oligosaccharides and protease on growth, digestive enzyme activities and serum nonspecific immunity of white shrimp (Litopenaeus vannamei)[J]. Journal of Shanghai Ocean University, 2013, 22(1): 93-99. [谭崇桂, 冷向军, 李小勤, 等. 多糖、寡糖、蛋白酶对凡纳滨对虾生长、消化酶活性及血清非特异性免疫的影响[J]. 上海海洋大学学报, 2013, 22(1): 93-99.] |
| [26] |
Guang X J. Progress on the researches of humoral Immunity of crustacean[J]. Science Instruments, 2009, 7(6): 3-7. [管晓娟. 甲壳动物体液免疫相关酶及免疫因子研究概况[J]. 生命科学仪器, 2009, 7(6): 3-7. DOI:10.3969/j.issn.1671-7929.2009.06.001] |
| [27] |
Zou G Z, Sun H S. Research advances and prospect in aquatic crustaceans immunology[J]. Science Instruments, 2009, 7(6): 17-21. [邹广众, 孙虎山. 水产甲壳动物免疫学研究进展与前景展望[J]. 生命科学仪器, 2009, 7(6): 17-21. DOI:10.3969/j.issn.1671-7929.2009.06.004] |
| [28] |
Kurtz J, Sauer K P. Gender differences in phenoloxidase activity of Panorpa vulgaris hemocytes[J]. Journal of Invertebrate Pathology, 2001, 78(3): 53-55. |
| [29] |
Ha C X, Liu P, He Y Y, et al. Effect of ammonium chloride on immunity-related enzymes of "Huanghai No.1"population of shrimp Fenneropenaeus chinensis[J]. Progress in Fishery Sciences, 2009, 30(1): 34-40. [哈承旭, 刘萍, 何玉英, 等. 氯化铵对"黄海1号"中国对虾免疫相关酶类的影响[J]. 渔业科学进展, 2009, 30(1): 34-40. DOI:10.3969/j.issn.1000-7075.2009.01.006] |
| [30] |
Sui D P. The research of effects of microecologics on the growth and non-special immunity factors of Penaeus vannamei Boone[D]. Qingdao: Ocean University of China, 2003: 8-22. [隋大鹏.微生态制剂对南美白对虾生长和非特异性免疫因子影响的研究[D].青岛: 中国海洋大学, 2003: 8-22.]
|
| [31] |
Liu X L, Cao J M, Kuang Z S, et al. Effect of dietary Lactobacillus on growth performance, nonspecific immune enzymes activities and intestinal microflora of Oreochromis niloticus[J]. Guangdong Agricultural Sciences, 2013, 40(1): 123-126. [刘小玲, 曹俊明, 邝哲师, 等. 嗜酸乳酸菌对吉富罗非鱼生长、非特异性免疫酶活性和肠道菌群的影响[J]. 广东农业科学, 2013, 40(1): 123-126. DOI:10.3969/j.issn.1004-874X.2013.01.040] |
| [32] |
Yang Q H, Tan B P, Dong X H, et al. Effects of chromium on growth performance, serum biochemical indices and non-specific immune enzyme activities of Litopenaeus vannamei[J]. Chinese Journal of Animal Nutrition, 2013, 25(4): 795-804. [杨奇慧, 谭北平, 董晓慧, 等. 铬对凡纳滨对虾生长性能、血清生化指标及非特异性免疫酶活性的影响[J]. 动物营养学报, 2013, 25(4): 795-804. DOI:10.3969/j.issn.1006-267x.2013.04.017] |
| [33] |
Wang Y S. The effects of immune preparations, antibiotic and probiotics on nonspecific immune system in Litopenaeus vannamei[D]. Xiamen: the Third Institute of Oceanography, State Oceanic Administration, 2006: 25-47. [王永胜.免疫制剂、抗生素和有益微生物对凡纳滨对虾非特异性免疫效应的研究[D].厦门: 国家海洋局第三海洋研究所, 2006: 25-47.]
|
| [34] |
Rengpipat S, Rukpratanporn S, Piyatiratitivorakul S, et al. Immunity enhancement in black tiger shrimp (Penaeus monodon) by a probiont bacterium(Bacillus S11)[J]. Aquaculture, 2000, 191(4): 271-288. DOI:10.1016/S0044-8486(00)00440-3 |
| [35] |
Fan Z J, Liu Z H, Yang A G, et al. The effect of vitamin C on the activities of hydrolytic enzymes and antioxidant enzymes of Chlamys farreri[J]. Marine Fisheries Research, 2006, 27(4): 12-16. [樊甄姣, 刘志鸿, 杨爱国, 等. Vc对栉孔扇贝体内水解酶和抗氧化酶活性的影响[J]. 海洋水产研究, 2006, 27(4): 12-16.] |
| [36] |
Wei K Q, Xu Z R. Studies on immune mechanism in shrimp and strategies for disease prevention[J]. Chinese Journal of Veterinary Drug, 2004, 38(9): 25-29. [魏克强, 许梓荣. 对虾的免疫机制及其疾病预防策略的研究[J]. 中国兽药杂志, 2004, 38(9): 25-29. DOI:10.3969/j.issn.1002-1280.2004.09.008] |
| [37] |
Li W F, Yang S Y, Qi Y L, et al. Effects of probiotic bacterium on the growth performance and immunity of Litopenaeus vannamei[J]. Hubei Agricultural Sciences, 2016, 55(2): 437-440. [李文芬, 杨思毅, 齐延林, 等. 益生菌对南美白对虾生长和免疫力的影响[J]. 湖北农业科学, 2016, 55(2): 437-440.] |
| [38] |
Tang L, Lin Z, Li Y M, et al. Effects of different magnitudes of mechanical strain on proliferation and alkaline phosphatase activity in osteoblast in vitro[J]. Medical Journal of Chinese People's Liberation Army, 2006, 31(6): 580-581. [唐林, 林珠, 李永明, 等. 不同大小机械牵张力对成骨细胞增殖及碱性磷酸酶的影响[J]. 解放军医学杂志, 2006, 31(6): 580-581. DOI:10.3321/j.issn:0577-7402.2006.06.027] |
| [39] |
He H Q, Sun F. Studies on the characteristics of acid and alkaline phosphatases in Chinese shrimp, Penaeus chinensis[J]. Oceanologia et Limnologia Sinica, 1992, 23(5): 555-560. [何海琪, 孙凤. 中国对虾酸性和碱性磷酸酶的特性研究[J]. 海洋与湖沼, 1992, 23(5): 555-560.] |
| [40] |
Liu W L. Effect of dietary with probiotics on the growth rate, disease resistance and intestinal microflora of Litopenaeus vannamei[D]. Shanghai: Shanghai Ocean University, 2016: 25-45. [刘文亮.饲料中补充益生菌对凡纳滨对虾生长、抗病力及其肠道微生物组成的影响[D].上海: 上海海洋大学, 2016: 25-45.]
|
| [41] |
Kongnum K, Hongpattarakere T. Effect of Lactobacillus plantarum, isolated from digestive tract of wild shrimp on growth and survival of white shrimp (Litopenaeus vannamei), challenged with Vibrio harveyi[J]. Fish and Shellfish Immunology, 2012, 32(1): 170-177. DOI:10.1016/j.fsi.2011.11.008 |
| [42] |
Wang C, Yue X, Lu X, et al. The role of catalase in the immune response to oxidative stress and pathogen challenge in the clam Meretrix meretrix[J]. Fish Shellfish Immunol, 2013, 34(1): 91-99. DOI:10.1016/j.fsi.2012.10.013 |
| [43] |
Gao F Y, Ye X, Bai J J, et al. cDNA cloning and expression characterization of lysozyme gene in two freshwater prawn[J]. Acta Hydrobiologica Sinica, 2005, 29(6): 605-620. [高风英, 叶星, 白俊杰, 等. 两种沼虾溶菌酶基因ORF的克隆和罗氏沼虾溶菌酶基因的组织表达[J]. 水生生物学报, 2005, 29(6): 615-620. DOI:10.3321/j.issn:1000-3207.2005.06.003] |
 2018, Vol. 25
2018, Vol. 25

