肝肠胞虫(Enterocytozoon hepatopenaei, EHP)是近些年发现的一种主要寄生在虾类肝胰腺肝小管上皮细胞内的微孢子虫。2003年泰国斑节对虾(Penaeus monodon)养殖过程中出现了严重的生长缓慢综合征(Monodon slow growth syndrome, MSGS), 造成的损失可与对虾白斑综合征病毒暴发带来的影响相当[1], Chayaburakul等[2]进行组织病理学研究, 在多个器官中发现疑似病原, Anantasomboon等[3]和Sritunyalucksana等[4]在淋巴器官中发现球状体和多种病毒, 在受影响的肝胰腺细胞中有时能检测到单核杆状病毒和肝胰腺细小病毒以及一种未知的微孢子虫。Tourtip等[5-6]研究发现引起斑节对虾生长缓慢的是一种新的微孢子虫, 分别在2005年和2009年对该微孢子虫进行了详细的研究和描述, 并正式命名为Enterocytozoon hepatopenaei。Sritunyalucksana等[4]曾告诫亚洲对虾养殖人员和孵化场经营者要监测EHP病原, 但是由于人们过多地关注对虾急性肝胰腺坏死疾病(acute hepatopancreatic necrosis disease, AHPND), EHP并没有引起足够的重视。2013年Tangprasittipap等[7]发现EHP感染南美白对虾(Penaeus vannamei), 并且可以通过摄食病虾进行水平传播。后来, EHP在中国、印度尼西亚、马来西亚、越南、泰国和印度等亚洲南美白对虾重要养殖国家大面积暴发[7-11]。EHP主要感染斑节对虾和南美白对虾, 感染后一般不引起对虾死亡, 主要表现为对虾严重生长迟缓, 规格参差不齐, 饵料转化率(food conversation ration, FCR)升高[12], 伴随软壳、嗜睡、采食量减少和空肠空胃等症状[13], 还有研究认为EHP感染与对虾白便综合征(white feces syndrome, WFS)相关[14-16], 但也有学者不赞同这个观点[7]。
目前, 世界上南美白对虾主要养殖区域均出现EHP感染的报道, EHP感染在苗种培育和成虾养殖阶段均有出现, 严重影响对虾的生长速度和成虾品质, 给该产业带来巨大的经济损失, 在亚洲每年的损失上亿美元。该病原的诊断方法主要有光学显微镜观察、组织病理和细胞病理学观察、聚合酶链反应、环介导等温扩增、原位杂交和实时荧光定量PCR等[11, 17-19]。基于EHP小亚基(small subunit ribosomal RNA, ssu rRNA)基因的检测最为常见[7], 18S rRNA和孢子细胞壁蛋白也是诊断的目的基因[11]。实时荧光定量PCR研究发现, EHP的载量指数与对虾生长速率呈负相关, 肝胰腺中EHP载量在103copies, 代表了较高的风险水平[18]。感染后目前还没有有效的治疗方法。
江苏省是我国南美白对虾养殖重要省份, 其养殖面积约90万亩(1亩≈666.6 m2), 产量约20万t。2015—2016年, 该地区大面积出现对虾严重滞长现象, 导致该地区南美白对虾减产15%~30%, 超过一半的养殖户出现亏损, 经检测发现滞长虾EHP的小亚基基因(ssu rRNA)基因几乎全部阳性, 经分析发现该基因序列与印度、越南和泰国报道的序列同源性达到97%以上。为了分析江苏地区EHP孢子与国外报道在形态学方面是否存在差异, 本研究尝试以江苏省EHP感染的南美白对虾肝胰腺组织为材料, 初步建立EHP孢子分离纯化方法, 对其形态结构进行观察。
1 材料和方法 1.1 实验材料具有典型EHP寄生症状的南美白对虾取自江苏如东县某养殖场, 养殖时间86 d, 平均体重5.3 g(2.1~15.7 g)。按照Tangprasittipap等[7]设计的两组EHP ssu rRNA特异性引物(ENF779-5ʹ-CAGCAGGCGC GAAAATTGTCCA-3ʹ和ENR779-5ʹ- AAGAGATATTGTATTGCGCTTGCTG-3ʹ; ENF176- 5ʹ-CAACGCG GGAAAACTTACCA-3ʹ和ENR176- 5ʹ-ACCTGTTATTGCCTTCTCCCTCC-3ʹ)进行巢式PCR扩增。电泳结果得到预期大小的目标条带, 序列与基因库EHP ssu rRNA基因(KF362130)同源性达100%, 由此确认采集的南美白对虾样品EHP阳性。
1.2 试验方法 1.2.1 EHP分离取约100只EHP阳性的南美白对虾肝胰腺, 混合后于研钵中加入液氮研磨, 30℃水浴融化, 如此反复冻融5次, 组织匀浆液中加入2倍体积的PBS溶液稀释, 通过8层200目的筛绢过滤除去粗的组织碎片。滤出液于13000 r/min离心30 min, 弃上清, 加入PBS重悬沉淀, 重复该步骤2次; 300 r/min离心10 min, 取上清; 14000 r/min离心30 min, 弃上清; 沉淀用少量PBS重悬。取200 μL重悬液缓慢注入到预先铺制的两种蔗糖密度梯度试管表面(由上至下浓度依次为30%、40%、50%、60%和30%、35%、40%、45%、50%), 水平方向4500 r/min离心1.5 h。小心吸出各层可见物, 用PBS稀释10倍后14000 r/min离心10 min, 弃上清, 沉淀用少量PBS悬浮后4℃保存, 取适量悬浮液进行总DNA提取, 通过PCR扩增EHP的ssu rRNA基因进行确认。
1.2.2 EHP染色及计数吸取1 μL分离得到的EHP悬浮液, 滴在干净的细胞计数板上; 吸取1 μL荧光染色剂和1 μL10%的KOH与EHP悬浮液混匀; 静置染色3 min, 45°接触缓慢盖上盖玻片, 轻压盖玻片使悬浮液布满整个计数框。在荧光显微镜下利用汞灯及紫外滤光片观察。计数框在放大600倍后存在的视野数按公式(1)计算; 在计数框的中心和四角取5个大致区域, 每个区域随机找30个不重复视野计数EHP数目, 按公式(2)计算平均每个视野中EHP的数量; 按公式(3)估算整个计数框上EHP的总数; 通过EHP浓度计算公式(4)估算悬浮液中EHP的浓度。
| $ {S^2} = \frac{{{a^2}}}{{\pi {{\left( {\frac{1}{2} \times \frac{a}{6}} \right)}^2}}} \times 100\% $ | (1) |
| $ \mathit{\bar n = }\frac{1}{{5 \times 30}}\sum\limits_{i = 1}^{150} {{n_i}} $ | (2) |
| $ N = S\mathit{\bar n} $ | (3) |
| $ \mathit{C = }\frac{N}{V} $ | (4) |
式中, a为计数框每个小方格的边长;
取EHP分离纯化后的悬浮液50 μL, 10000 r/min离心5 min, 弃上清; 沉淀用500 μL三蒸水悬浮洗涤, 10000 r/min离心5 min, 弃上清, 重复该步骤两次; 将沉淀用100 μL三蒸水悬浮, 取1.5 μL悬液滴加于新揭开的云母上, 室温干燥。干燥后的样品使用Multimode Nanoscope V(Bruker AXS)原子力显微镜在气相下观察, 使用XSC11/AIBS探针在ScanAsyst模式下扫描。
1.2.4 扫描电镜观察吸取适量EHP悬浮液, 8000 r/min离心3 min, 弃上清, 沉淀用2.5%的戊二醛溶液重悬, 固定3 h; 以5000 r/min离心5 min, 弃上清, 沉淀用冰预冷的0.2 mol/L PBS (pH7.4)重悬洗涤, 4℃静置15 min, 重复该步骤3次; 1%的锇酸固定5 h, 以5000 r/min离心5 min, 弃上清, 沉淀用冰预冷的0.2 mol/L PBS(pH7.4)洗涤3次; 依次用浓度为10%、30%、50%、70%、80%、90%、100%的乙醇溶液对样品进行脱水, 每个梯度脱水15 min。用含有脱水剂的无水乙醇将脱水后的样品混匀, 滴加在擦镜纸上, 二氧化碳临界干燥箱干燥2 h, 将形成的粉末状样品粘在金属样品台上, 轻摇尽量分散样品, 真空蒸发器中喷镀一层胶体金。然后通过日立-S4800场发射扫描电镜观察和拍照。
1.2.5 透射电镜观察取EHP寄生的南美白对虾肝胰腺样品, 用2.5%的戊二醛固定, 用0.1 mol/L磷酸漂洗液漂洗3次, 每次15 min, 1%锇酸固定液固定2~3 h, 再次用0.1 mol/L磷酸漂洗液以相同的方法漂洗3次。脱水: 50%乙醇15~20 min, 70%乙醇15~0 min, 90%乙醇15~20 min, 90%乙醇90%丙酮(1:1)15~20 min, 90%丙酮15~20 min (以上在4度冰箱内进行), 100%丙酮室温处理3次, 每次15~20 min。包埋:纯丙酮+包埋液(2:1)室温3~4 h, 纯丙酮+包埋液(1:2)室温过夜, 纯包埋液37℃ 2~3 h。固化: 37℃过夜, 45℃ 12 h, 60℃ 24 h。超薄切片50~60 nm, 3%醋酸铀-枸橼酸铅双染色, 透射电镜观察及拍照。
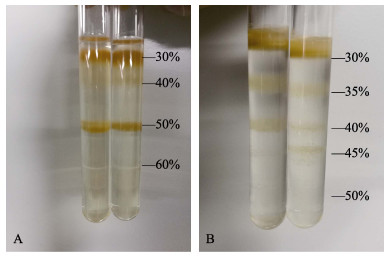
2 结果与分析 2.1 EHP的分离通过30%、40%、50%、60%的不连续密度梯度蔗糖溶液分离EHP悬浮液, 可见悬浮液主要被分成3层(图 1A)。第1层为30%、40%、50%的蔗糖溶液上层。EHP悬浮液通过30%、35%、40%、45%、50%的不连续密度梯度蔗糖溶液分离后, 结果主要分为4层(图 1B), 分别为30%、35%、40%和45%的蔗糖溶液上层。从各层中提取总DNA, 用EHP ssu rRNA基因的巢式PCR引物进行扩增, 结果发现从图 1A中的30%和50%层面和图 1B的30%、45%层面提取的DNA, 巢式第一步PCR检测为阴性, 第二步检测为阳性; 图 1A的40%层面和图 1B的35%、40%层面提取的DNA, 巢式PCR的第一步和第二步均检测到高亮度目标条带。说明EHP主要分布在35%~40%的蔗糖层面。
|
图 1 EHP孢子分离纯化结果 A. 30%、40%、50%和60%的蔗糖浓度梯度离心; B. 30%、35%、40%、45%和50%的蔗糖浓度梯度离心. Fig.1 The isolation and purification result of EHP spores A. sucrose concentration gradients centrifugation of 30%, 40%, 50% and 60%; B. sucrose gradient centrifugationof 30%, 35%, 40%, 45% and 50%. |
EHP悬浮液经Fluorescent Brightener 28荧光染色剂染色, 紫外光激发后, 只有35%和40%两个蔗糖梯度浓度层面的悬浮液在显微镜下可观察到散发青蓝色荧光的卵圆形孢子(图 2)。其中图 2A为放大200倍后的照片, 图 2B为放大600倍后的照片。通过计算, 每1 μL EHP悬浮液平铺在计数框中, 在600倍显微镜下存在4586个视野, 计数150个视野中EHP的数量(数据未列出)后可算得平均每个视野中存在39.32个EHP, 由此可算得悬浮液中EHP成熟孢子浓度约为1.8×108个/mL。

|
图 2 EHP孢子荧光染色剂染色结果 A.放大400倍; B.放大1000倍. Fig.2 The fluorescent stain result of EHP spores A. magnified by 400 times; B. magnified by 1000 times. |
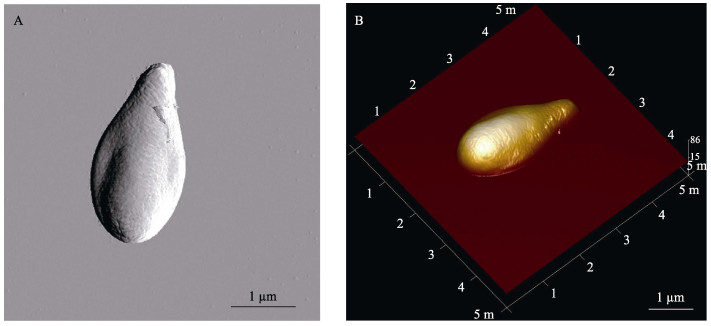
原子力显微镜扫描后可观察EHP呈梨形, 一端钝圆, 另一端尖细(图 3A、图 3B)。EHP表面部分区域有凹陷, 表面有细小的褶皱, 特别在尖细一端较为明显。
|
图 3 EHP孢子原子力显微镜观察结果 A.平面图; B.立体图. Fig.3 Observation of EHP spores by atomic force microscopy A. plane diagram; B. stereogram. |
扫描电镜结果可见悬浮液中有大量椭圆形的孢子, 同时也可见大量组织碎片夹杂在EHP中(图 4A:放大9000倍); EHP约为1.7 μm×0.9 μm的椭圆形状, 外壁并不光滑, 有大量白色的突起物(图 4B:放大50000倍)。

|
图 4 EHP孢子扫描电镜观察结果 A.放大9.0×103倍; B.放大5.0×104倍. Fig.4 Observation of EHP spores by scanning electron microscopy A. magnified by 9.0×103 times; B. magnified by 5.0×104 times. |
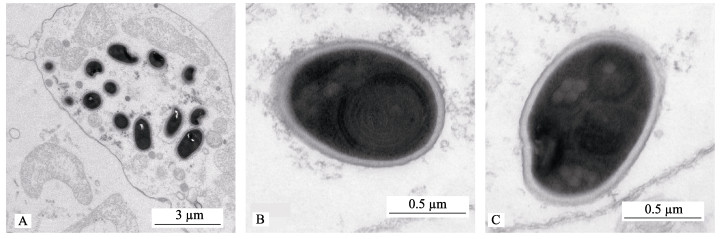
对EHP寄生的南美白对虾肝胰腺组织进行超薄切片, 在透射电镜下可见肝胰腺细胞核仁裂解, 线粒体嵴减少, 成熟的EHP孢子分布在肝胰腺细胞的细胞质中(图 5A)。超微结构显示成熟的EHP孢子呈椭圆形, 孢子约为1.1 μm×0.8 μm, 一个细胞核, 4~6圈极丝, 一个后位空泡, 一个锚盘附在极丝上, 细胞壁由一相对薄的电子透亮的孢子内壁(约10 m)和电子致密的孢子外壁(约2 nm)组成(图 5B、图 5C)。
|
图 5 EHP孢子透射电镜观察结果 A.肝胰腺细胞切片; B. EHP孢子横切; C. EHP孢子纵切. Fig.5 Observation of EHP spores by transmission electron microscopy A. hepatopancreas cell slice; B. EHP spores transverse slice; C. EHP spores longitudinal slice. |
通过不连续蔗糖密度梯度离心, 将不同密度层面收集的物质进行EHP基因检测, 结果发现35%~40%的蔗糖层面分离物中检测到EHP强阳性, 在其他层面检测到EHP微弱阳性, 由此表明EHP孢子主要分布在35%~40%的蔗糖层面, 可推测EHP的孢子密度为1.15~1.17g/mL。分离纯化对微孢子虫的诊断、形态学观察、药物筛选和其他相关研究有重要意义, 目前关于微孢子虫分离纯化方面有较多研究, 但关于EHP的分离纯化鲜见报道, 仅有印度学者Rajendran等[16]利用乙醚洗涤法从寄生EHP的南美白对虾粪便分离纯化EHP孢子。孢子密度是微孢子虫分类学中的一项重要依据, 目前关于EHP的孢子密度没有相关报道, 姜义仁等[20]分离柞蚕(Antheraea pernyi)微孢子虫时发现该孢子主要集中在75%和100%的Percoll层面, 其密度为1.09~1.13 g/mL, 与EHP孢子密度存在较大差异。EHP为细胞内寄生虫, 本研究以南美白对虾肝胰腺组织为分离材料, 相比Rajendran等选用粪便, 其干扰物质较多, 分离难度相对较大, 但是获得的孢子更有利掌握其感染时期的相关信息, 也是药物筛选等的良好材料, 有利于进一步深入研究。
本研究利用EHP孢子壁内壁富含几丁质成分, 而Fluorescent Brightener 28为二苯乙烯类化合物荧光染料, 能够与几丁质β-1, 4糖苷键结合着色, 在发散光和激发光下散发明亮的蓝色荧光这一特性, 建立了一种EHP荧光染色方法, 在荧光显微镜下可见EHP孢子形状规则, 圆形或椭圆, 轮廓清晰, 大小基本一致(直径约为1 μm)。Fluorescent Brightener 28染色在微孢子虫鉴别时能够很好地与宿主细胞、细菌、病毒区分, 目前被推崇为微孢子虫鉴别的重要荧光染色剂[21-23]。刘吉平等[24]利用Fluorescent Brightener 28建立了快速鉴别家蚕微孢子虫(Nosema bombycis)的方法, 秦浩然等[25]结合Fluorescent Brightener 28和Sytox Green双重染色建立了一种有效区分东方蜜蜂微孢子虫(Nosema ceranae)孢子存活状态的方法。虾类微孢子虫已有报道十多种[26], 多为专性寄生, 寄生肌肉组织最为常见, 常引起“棉花虾”或“白背虾”[27]。对虾匹里虫(Pleistaphra panaei)、对虾八孢虫(Agmasoma penaei)、奈氏微粒子虫(Ameson nelsoni)和对虾肝肠胞虫(Enterocytozoon hepatopenaei)有寄生南美白对虾肝胰腺组织的报道。本研究中观察到的EHP与国外学者Rajendran等[16]、Tourtip等[6]和Tangprasittipap等[7]发现的孢子大小非常接近。本研究建立的荧光染色法与微孢子虫常见的吉姆萨染色、KMnO4-甲基紫染色、抗酸三色染色和韦伯氏染色等相比, 具有染色时间短, 操作简单, 孢子明晰易辨, 对阅片人的要求较低等优点。
扫描电镜下EHP孢子椭圆, 约为1.7 μm× 0.9 μm, 高倍镜下可见孢子壁表面有大量白色突起, 疑似胞壁蛋白, 这与印度学者Rajendran分离到的EHP孢子高度吻合[16]。微孢子虫细胞外壁的刺突状外层分布大量表面蛋白, 该蛋白在微孢子虫的侵染过程中扮演重要角色[28-30], 与孢子壁的通透性相关, 很可能是控制孢子与外界物质交换的通道。首次采用原子力显微镜对EHP孢子进行观察, 发现EHP孢子梨形, 表面部分区域有凹陷且布满细小的褶皱, Rajendran等[16]通过扫描电镜观察, 也发现了类似的凹陷和脊状隆起。目前有研究发现变形孢虫属孢子存在2种或3种形态[31], 关于EHP孢子形态是否存在多样性未见相关报道, 研究中孢子形态出现差异的原因还需做进一步分析。微孢子虫细胞核数目、核糖体的排列方式可作为微孢子虫属间的划分依据, 极膜、极丝圈数与倾斜角可作为微孢子虫种间的划分依据[32]。本研究分离的EHP孢子透射电镜下呈椭圆形, 孢子约为1.1 μm×0.8 μm, 具有1个细胞核, 极丝4~6圈, 一个后位空泡, 极丝上附着1个锚盘, 细胞壁由一相对薄的电子透亮的孢子内壁(约10 nm)和电子致密的孢子外壁(约2 nm)构成, 这与Tourtip等[5-6]和Sritunyalucksana等[4]观察到的EHP形态结构非常相似。
本研究初步建立了EHP的分离纯化方法, 结合荧光染色技术可以为EHP的快速诊断、离体培养和药物筛选提供理论支持。通过形态学比较发现, 江苏地区南美白对虾分离的EHP形态上与国外的报道基本一致, 推测江苏地区与国外报道的EHP极有可能为同一株系, 本实验结果可为EHP流行病学研究提供参考。
| [1] |
Flegel T W, Nelson L, Thamavit V, et al. Presence of multiple viruses in non-diseased, cultivated shrimp at harvest[J]. Aquaculture, 2004, 240: 55-68. DOI:10.1016/j.aquaculture.2004.06.032 |
| [2] |
Chayaburakul K, Nash G, Pratanpipat P, et al. Multiple pathogens found in growth-retarded black tiger shrimp Penaeus monodon cultivated in Thailand[J]. Diseases of Aquatic Organisms, 2004, 60(2): 89-96. |
| [3] |
Anantasomboon G, Sriurairatana S, Flegel T W, et al. Unique lesions and viral-like particles found in growth retarded black tiger shrimp Penaeus monodon from East Africa[J]. Aquaculture, 2006, 253: 197-203. DOI:10.1016/j.aquaculture.2005.08.021 |
| [4] |
Sritunyalucksana K, Apisawetakan S, Boon-nat A, et al. A new RNA virus found in black tiger shrimp Penaeus monodon from Thailand[J]. Virus Research, 2006, 118(1-2): 31-38. DOI:10.1016/j.virusres.2005.11.005 |
| [5] |
Tourtip S. Histology, ultrastructure and molecular biology of a new microsporidium infecting the black tiger shrimp Penaeus monodon[R]. Department of Anatomy, Faculty of Science. Bangkok: Mahidol University, 2005.
|
| [6] |
Tourtip S, Wongtripop S, Stentiford G D, et al. Enterocytozoon hepatopenaei sp. nov. (Microsporida Enterocytozoonidae), a parasite of the black tiger shrimp Penaeus monodon (Decapoda: Penaeidae): Fine structure and phylogenetic relationships[J]. Journal of Invertebrate Pathology, 2009, 102(1): 21-29. |
| [7] |
Tangprasittipap A, Srisala J, Chouwdee S, et al. The microsporidian Enterocytozoon hepatopenaei is not the cause of white feces syndrome in whiteleg shrimp Penaeus (Litopenaeus) vannamei[J]. BMC Veterinary Research, 2013, 9: 139-148. DOI:10.1186/1746-6148-9-139 |
| [8] |
Liu Y M, Qiu L, Cheng D Y, et al. The relationship of body length and weight in the Litopenaeus vannamei populations detected Enterocytozoon hepatopenaei[J]. Progress in Fishery Sciences, 2017, 38(4): 96-103. [刘雅梅, 邱亮, 程东远, 等. 检出虾肝肠胞虫(Enterocytozoon hepatopenaei)的凡纳滨对虾(Litopenaeus vannamei)群体的体长和体重关系[J]. 渔业科学进展, 2017, 38(4): 96-103.] |
| [9] |
Chen L Z, Yu X Y, Hu Y C, et al. Preliminary investigation of Enterocytozoon hepatopenaei (EHP) and infectious hypodermal and hematopoietic necrosis virus (IHHNV) from Litopenaeus vannamei in west Guangdong Province[J]. Journal of Fisheries Research, 2016, 38(4): 273-280. [陈禄芝, 余霞艳, 胡一丞, 等. 粤西地区凡纳滨对虾虾肝肠胞虫、传染性皮下和造血组织坏死病毒感染情况的初步调查[J]. 渔业研究, 2016, 38(4): 273-280.] |
| [10] |
Biju N, Sathiyaraj G, Raj M, et al. High prevalence of Enterocytozoon hepatopenaei in shrimps Penaeus monodon and Litopenaeus vannamei sampled from slow growth ponds in India[J]. Diseases of Aquatic Organisms, 2016, 120(3): 225-230. DOI:10.3354/dao03036 |
| [11] |
Tang K F J, Pantoja C R, Redman R M, et al. Development of in situ hybridization and PCR assays for the detection of Enterocytozoon hepatopenaei (EHP) a microsporidian parasite infecting penaeid shrimp[J]. Journal of Invertebrate Pathology, 2015, 130: 37-41. DOI:10.1016/j.jip.2015.06.009 |
| [12] |
Tang K F J, Han J E, Aranguren L F, et al. Dense populations of the microsporidian Enterocytozoon hepatopenaei (EHP) in feces of Penaeus vannamei exhibiting white feces syndrome and pathways of their transmission to healthy shrimp[J]. Journal of Invertebrate Pathology, 2016, 140: 1-7. DOI:10.1016/j.jip.2016.08.004 |
| [13] |
Aranguren L F, Han J E, Tang K F J. Enterocytozoon hepatopenaei (EHP) is a risk factor for acute hepatopancreatic necrosis disease (AHPND) and septic hepatopancreatic necrosis (SHPN) in the Pacific white shrimp Penaeus vannamei[J]. Aquaculture, 2017, 471: 37-42. DOI:10.1016/j.aquaculture.2016.12.038 |
| [14] |
Hà N T, Hà D T, Thùy N T, et al. Enterocytozoon hepatopenaei parasitizing on tiger shrimp (Penaeus monodon) infected by white feces culture in Vietnam, has been detected[J]. Journal of Agricultural Science and Technology, 2010, 12: 45-50. |
| [15] |
Flegel T W. Historic emergence, impact and current status of shrimp pathogens in Asia[J]. Journal of Invertebrate Pathology, 2012, 110(2): 166-173. DOI:10.1016/j.jip.2012.03.004 |
| [16] |
Rajendran K V, Shivam S, Praveena P E, et al. Emergence of Enterocytozoon hepatopenaei(EHP) in farmed penaeus (Litopenaeus) vannamei in India[J]. Aquaculture, 2016, 454: 272-280. DOI:10.1016/j.aquaculture.2015.12.034 |
| [17] |
Suebsing R, Prombun P, Srisala J, et al. Loop-mediated isothermal amplification combined with colorimetric nanogold for detection of the microsporidian Enterocytozoon hepatopenaei in penaeid shrimp[J]. Journal of Applied Microbiology, 2013, 114(5): 1254-1263. DOI:10.1111/jam.2013.114.issue-5 |
| [18] |
Liu Z, Zhang Q L, Wan X Y, et al. Development of Real-Time PCR assay for detecting microsporidian Enterocytozoon hepatopenaei and the application in shrimp samples with different growth rates[J]. Progress In Fishery Sciences, 2016, 37(2): 119-126. [刘珍, 张庆利, 万晓媛, 等. 虾肝肠胞虫(Enterocytozoon hepatopenaei)实时荧光定量PCR检测方法的建立及对虾样品的检测[J]. 渔业科学进展, 2016, 37(2): 119-126.] |
| [19] |
Luo Y H, Shi J, Fang L, et al. Development and application of a TaqMan real-time PCR assay for the detection of Enterocytozoon hepatopenaei[J]. Chinese Veterinary Science, 2016, 46(7): 847-852. [骆云慧, 石坚, 方磊, 等. 虾肝肠胞虫TaqMan实时荧光定量PCR检测方法的建立及应用[J]. 中国兽医科学, 2016, 46(7): 847-852.] |
| [20] |
Jiang Y R, Deng Z H, Wang B Y, et al. Study on the method of separation and purification in Nosema pernyi[J]. Chinese Journal of Applied Entomology, 2011, 48(2): 452-456. [姜义仁, 邓真华, 王伯阳, 等. 柞蚕微孢子虫孢子分离纯化方法[J]. 应用昆虫学报, 2011, 48(2): 452-456.] |
| [21] |
Harrington B J, Haneage G J. Calcofluor white: A review of its uses and application in clinical mycology and parasitology[J]. Laboratory Medicine, 2003, 34: 361-367. DOI:10.1309/EPH2TDT8335GH0R3 |
| [22] |
Rasconi S, Jobard M, Jouve L, et al. Use of Calcofluor white for detection, identification and quantification of phytoplanktonic fungal parasites[J]. Applied and Environmental Microbiology, 2009, 75: 2545-2553. DOI:10.1128/AEM.02211-08 |
| [23] |
Yang T, He L T, Chen T, et al. Application of calcofluor white method for detection of fungi in biopsy tissues[J]. Journal of Molecular Diagnosis and Therapy, 2014, 6(5): 307-311. [杨通, 何炼图, 陈涛, 等. 荧光染色剂Calcofluor White在活检组织中真菌染色的应用[J]. 分子诊断与治疗杂志, 2014, 6(5): 307-311. DOI:10.3969/j.issn.1674-6929.2014.05.004] |
| [24] |
Liu J P, Zeng L. Staining and discrimination of Nosema bombycis spores with Calcofluor White M2R[J]. Acta Entomologica Sinica, 2007, 50(11): 1185-1186. [刘吉平, 曾玲. Calcofluor White M2R荧光染色法识别家蚕微孢子虫[J]. 昆虫学报, 2007, 50(11): 1185-1186. DOI:10.3321/j.issn:0454-6296.2007.11.015] |
| [25] |
Qin H R, Li J L, He S Y, et al. Detection and identification of Nosema ceranae by dual fluorescent staining with Calcofluor White M2R and Sytox Green[J]. Chinese Journal of Applied Entomology, 2012, 49(5): 1392-1396. [秦浩然, 李继莲, 和绍禹, 等. Calcofluor White M2R与Sytox Green双重染色法鉴别蜜蜂微孢子虫[J]. 应用昆虫学报, 2012, 49(5): 1392-1396.] |
| [26] |
Wang T C, Nai Y S, Wang C Y, et al. A new microsporidium, Triwangia caridinae gen. nov., parasitizing fresh water shrimp, Cariding formosae (Decapoda: Atyidae) in Taiwan[J]. Journal of Invertebrate Pathology, 2013, 112(3): 281-293. DOI:10.1016/j.jip.2012.12.014 |
| [27] |
Ramasamy P, Jayakumar R, Brennan G P. Muscle degeneration associated with cotton shrimp disease of Penaeus indicus[J]. Journal of Fish diseases, 2000, 23(1): 77-81. |
| [28] |
Li Z, Pan G, Li T, et al. SWP5, a spore wall protein, interacts with polar tube proteins in the parasitic microsporidian Nosema bombycis[J]. Eukaryot Cell, 2011, 11(2): 229-237. |
| [29] |
Wu Z, Li Y, Pan G, et al. Proteomic analysis of spore wall proteins and identification of two spore wall proteins from Nosema bombycis (Microsporidia)[J]. Proteomics, 2008, 8(12): 2447-2461. DOI:10.1002/pmic.200700584 |
| [30] |
Yan Y D, Dang X, Peng P, et al. NbHSWP11, a microsporidia Nosema bombycis protein, localizing in the spore wall and membranes, reduces spore adherence to host cell BME[J]. Journal of Parasitology, 2014, 100(5): 623-632. DOI:10.1645/13-286.1 |
| [31] |
Liu R H, Wan Y J, Liu Q B, et al. Infectious experiment of microsporidium, Vairimorpha ceracessp. nov. from Cerace stipatana to silkworm (Bombyxmori) and fish (Red Carp: Cyprinus carpio L. red Var.)[J]. Science of Sericulture, 2006, 32(1): 58-62. [刘仁华, 万永继, 刘强波, 等. 裳卷蛾变形孢虫(Vairimorpha ceraces sp. nov.)对家蚕、鱼类的感染性试验[J]. 蚕业科学, 2006, 32(1): 58-62. DOI:10.3969/j.issn.0257-4799.2006.01.010] |
| [32] |
Burges H D, Canning E U, Hulls I K. Ultrastructure of Nosema oryzaephili and the taxonomic value of the polar filament[J]. Journal of Invertebrate Pathology, 1974, 23(2): 135-139. DOI:10.1016/0022-2011(74)90176-1 |
 2018, Vol. 25
2018, Vol. 25

