瓦氏眶灯鱼(Diaphus watasei)隶属于灯笼鱼科, 眶灯鱼属, 是大洋性中、底层巡游鱼类, 分布于中国东海和南海, 印度洋中的东非桑给巴尔和莫桑比克海峡一带, 太平洋的日本海、骏河湾等海域[1]。瓦氏眶灯鱼主要作为深海虾拖网的副渔获物被捕获, 是副渔获物的重要种类组成之一。过去, 由于调查采样方法受限, 使得人们对瓦氏眶灯鱼的有关记录及研究较少[2-3]。近几年, 随着研究方法和科学技术的不断提升, 科学家发现中层鱼广泛分布于全球各海域, 储存量巨大, 具有重要的生态地位, 这一发现引起了不少学者对中层鱼的广泛关注。在中层鱼里, 灯笼鱼种类多数量大, 是深海虾拖网副渔获物的主要组成部分, 其中瓦氏眶灯鱼是最优势的种类[2-3], 对维持深海生态系统的稳定性和多样性起到了重要作用。关于瓦氏眶灯鱼的研究陆续报道, 研究内容包括生物学特性和营养价值等方面, 认为瓦氏眶灯鱼含有大量必需氨基酸[4]及高含量的二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)[5], 是良好的脂溶性维生素来源[6], 研究海域主要包括印度西南沿岸[2-3, 6-7]、阿拉伯海[4]、日本沿岸海域[5]及中国东海陆架斜坡区[8]等。
目前, 中国对中层鱼类的研究尚在起步阶段, 以渔业资源调查为主, 对七星底灯鱼(Benthosema pterotum)[9]、金鼻眶灯鱼(Diaphus chrysorhynchus)[10]、长钻光鱼(Gonostoma elongatum)[11]和尾明角灯鱼(Ceratoscopelus warmingii)[12]等中层鱼的摄食、生长、性腺成熟度等生物学特征已作过相关研究, 但国内对瓦氏眶灯鱼的研究仅限于形态分类学[1, 13-14], 缺乏该鱼种渔业生物学方面的基础信息。本研究根据2015年6、8月及2017年3月在南海北部陆坡海域的中层拖网和底层虾拖网调查数据, 对瓦氏眶灯鱼体长及体重组成、性比、性腺成熟度及摄食等级等生物学特性进行了初步研究, 旨在为探讨南海瓦氏眶灯鱼的生长规律及生态习性提供依据, 及为进一步了解该种群及其资源评估提供基础资料。
1 材料和方法 1.1 样品采集样品数据来自于2015年6、8月及2017年3月在南海北部陆坡海域(18°54′N~20°23.71′N, 112°52′E~ 116°34.54′E)进行的渔业资源调查(图 1)。调查船为中国水产科学研究院南海水产研究所“南锋”号海洋渔业资源专业调查船, 船总长66.66 m, 宽12.40 m, 总吨位1537 t, 满载排水量1980 t, 主机功率1920 kW, 副机功率450 kW×2。采集方法分底层虾拖网和中层拖网, 底层虾拖网主尺寸为110.00 m×87.16 m, 网囊网目尺寸为50 mm, 在陆坡区300 m以深的6个站点进行了作业, 平均拖速为3.4~4.1 m/s, 拖曳时长为60~115 min; 中层拖网主尺寸为136.10 m×50.85 m, 网囊网目尺寸为10 mm, 主要在陆坡区的表层水域进行拖网, 平均拖速为3.4~4.5 m/s, 拖曳时长为55~80 min(表 1)。

|
图 1 南海北部陆坡海域渔业资源调查范围 Fig.1 The area of fishery resource survey in the continental slope of northern South China Sea |
|
|
表 1 南海北部陆坡海域瓦氏眶灯鱼采样数据 Tab.1 The sample data of Diaphus watasei in the continental slope of northern South China Sea |
将样本分类鉴定后带回实验室进行渔业生物学测定, 测定指标包括体长、体重、性腺成熟度和摄食等级。由于瓦氏眶灯鱼鳞片极易脱落, 拖网捕捞上来后基本已掉光, 因此文章使用的体重均为没有鳞片重量的鱼体重。体长用量鱼尺测定(精度为1 mm); 体重用天平测定(精度为0.1 g); 采用Ⅰ~Ⅵ期性腺成熟度划分标准对瓦氏眶灯鱼进行性腺成熟度划分; 采用0~4级划分标准对瓦氏眶灯鱼进行摄食等级划分[15]。
生物学测定后,取胃并用滤纸吸干食物团表面水分,在精度为0.001 g的电子分析天平称量食物团总质量,并在体视显微镜(Olympus SZ61)和光学显微镜(Olympus CX22)下鉴别饵料生物种类并分别计数和称重,依据形态特征尽可能精确分到最低分类阶元。此外,使用95%酒精对部分瓦氏眶灯鱼胃含物残存肌肉组织进行浸泡保存,之后用超纯水复水后剪取部分组织进行基因组DNA提取处理,利用COI基因通用引物扩增目的片段,进行COI基因序列分析,从分子生物学角度进一步鉴定胃含物种类。
1.3 数据处理 1.3.1 体长和体重分布根据频率分布法, 以10 mm和10.00 g为组距, 分别对瓦氏眶灯鱼体长和体重进行分析, 采用单因素方差分析雌、雄个体体长和体重是否存在显著性差异, 同时用非参数检验分析瓦氏眶灯鱼体长分布是否有显著性差异。
1.3.2 体长和体重关系瓦氏眶灯鱼体长和体重呈现幂函数关系, 采用下式对两者进行拟合:
| $ W = a{L^b} $ |
式中, W表示体重(g), L为体长(mm), a为肥满度, b为幂指数, a、b均为常数[15-16]。
1.3.3 性比统计瓦氏眶灯鱼雌、雄个体的数量, 采用非参数检验分析雌、雄性比与1 : 1是否一致, 不同月份、体长组性比是否存在显著性差异。
1.3.4 性腺成熟度统计瓦氏眶灯鱼不同月份性腺成熟度百分比, 采用非参数检验分析不同体长组性腺成熟度是否存在显著性差异。
1.3.5 初次性成熟体长(L50%)利用雌性不同体长组性成熟个体百分比拟合Logistic曲线推算瓦氏眶灯鱼雌性初次性成熟体长[12]:
| $ {P_i} = \frac{1}{{1 + {e^{ - (c + b{L_i})}}}};{L_{50\% }} = - \frac{a}{b} $ |
式中, Pi为雌性成熟个体占组内样本的百分比; Li为各雌性体长组(mm), L50%为雌性初次性成熟体长(mm)。
1.3.6 摄食等级统计瓦氏眶灯鱼不同月份、体长组摄食等级, 并用非参数检验分析其是否存在显著性差异。
2 结果与分析 2.1 群体组成本研究共采集瓦氏眶灯鱼879尾, 体长范围为71~172 mm, 优势体长组为101~130 mm, 占总数的77.82%, 平均体长为118 mm; 体重范围为5.25~ 66.20 g, 优势体重组为15.01~35.00 g, 占总数的81.11%, 平均体重为26.05 g(表 1)。不同月份体长、体重分布特征见表 2, 不同月份体长组和体重组分布频率见图 2。单因素方差分析得出, 雌、雄个体规格(体长和体重)存在极显著性差异(ANOVA, P < 0.01);非参数检验分析得出, 不同月份瓦氏眶灯鱼体长、体重分布均存在极显著差异(Kruskal- wallis H, P < 0.01);但各月份的雌、雄体长分布均不存在显著性差异(Kolmogorov-Smirnov Z, P > 0.05)。

|
图 2 南海北部陆坡海域瓦氏眶灯鱼体长和体重分布 Fig.2 Distribution of body length and body weight of Diaphus watasei in the continental slope of northern South China Sea |
|
|
表 2 南海北部陆坡海域瓦氏眶灯鱼不同月份体长、体重分布特征 Tab.2 Characteristics of body length and weight distribution of Diaphus watasei in different months in the continental slope of northern South China Sea |
经回归分析, 瓦氏眶灯鱼体长(L)和体重(W)之间存在显著的相关性指数关系(图 3), 其相关性符合幂函数关系式。

|
图 3 南海北部陆坡海域瓦氏眶灯鱼体长和体重关系 Fig.3 Relationship between body length and body weight of Diaphus watasei in the continental slope of northern South China Sea |
共测定瓦氏眶灯鱼879尾, 其中雌性317尾, 雄性558尾, 未能鉴定雌雄4尾, 雌雄比例为1 : 1.76;其中6月和8月也以雄性居多, 雌、雄比例分别为1 : 2.02和1 : 1.91, 而3月雌雄比例为1.58 : 1, 雌性个体多于雄性。非参数检验分析表明, 样本总体雌、雄性比与1 : 1存在极显著差异(P < 0.01)。不同月份雌、雄性比的非参数检验分析表明, 6月、8月和3月雌、雄性比均与1 : 1存在极显著差异(P < 0.01)。6月、8月和3月各体长组的雌、雄性比也存在较大差异, 且雌性个体在各月份的最大体长组中均占有很大比重(图 4)。
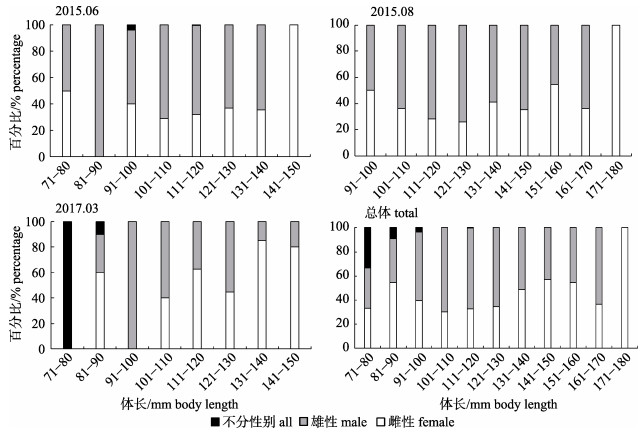
|
图 4 南海北部陆坡海域瓦氏眶灯鱼性比与体长关系 Fig.4 Relationship between sex ratio and body length of Diaphus watasei in the continental slope of northern South China Sea |
瓦氏眶灯鱼的性腺成熟度范围为Ⅱ~Ⅳ期, 以Ⅱ期为主。6月、8月和3月均有性腺成熟个体(Ⅲ~Ⅳ期), 所占比例分别为13.28%、24.00%和21.84%。不同月份性腺成熟度百分比见图 5。经统计分析, 6月不同体长组性腺成熟度存在显著差异(P < 0.05), 性腺成熟度随体长增大而增高; 8月和3月不同体长组性腺成熟度不存在显著差异(P > 0.05, 图 6)。
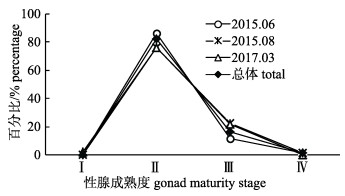
|
图 5 南海北部陆坡海域瓦氏眶灯鱼不同月份性腺成熟度百分比组成 Fig.5 Percentage of different gonad maturity stages of Diaphus watasei in different months in the continental slope of northern South China Sea |
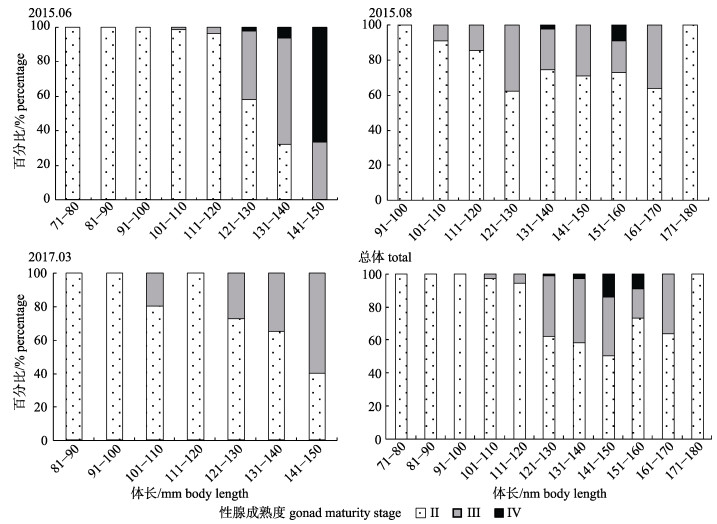
|
图 6 南海北部陆坡海域瓦氏眶灯鱼不同体长组性腺成熟度百分比组成 Fig.6 Percentage of different gonad maturity stages of Diaphus watasei with different body length in the continental slope of northern South China Sea |
根据雌性样品中不同体长组的性成熟个体百分比(图 7), 拟合推算出瓦氏眶灯鱼雌性个体初次性成熟体长(L50%)为145.0 mm。
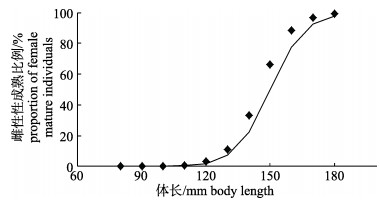
|
图 7 南海北部陆坡海域瓦氏眶灯鱼雌性个体初次性成熟体长 Fig.7 Body length at the first maturity of female Diaphus watasei individuals in the continental slope of northern South China Sea |
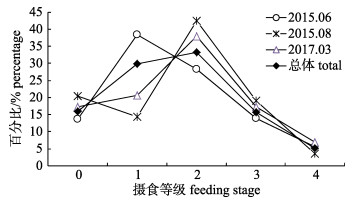
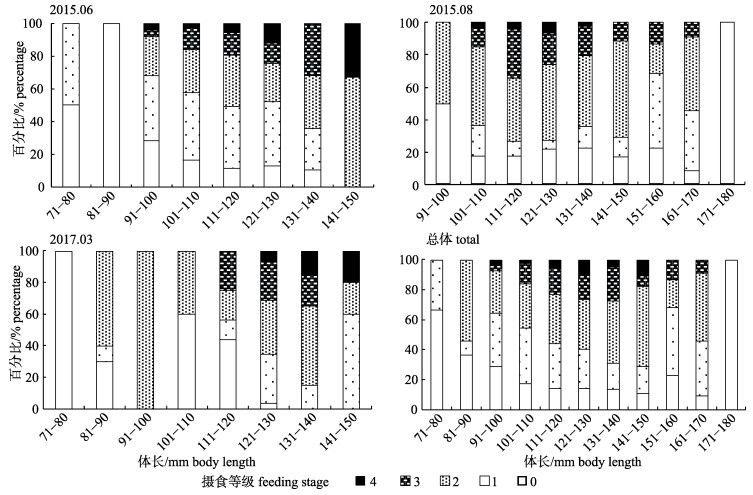
瓦氏眶灯鱼的摄食等级0~4级所占比例分别为15.93%、29.81%、33.33%、15.81%和5.12%, 摄食等级主要以1、2级为主。6月份瓦氏眶灯鱼摄食等级以1、2级为主, 占总数的66.79%; 8月份瓦氏眶灯鱼摄食等级以2级居多, 占总数的42.20%; 3月份瓦氏眶灯鱼摄食等级以1、2级为主, 占总数的58.62%。经非参数检验分析, 不同月份摄食等级存在显著差异(P < 0.01, 图 8)。6月和3月不同体长组的摄食等级存在差异, 摄食等级随着体长组增大而呈现递增趋势(图 9)。
|
图 8 南海北部陆坡海域瓦氏眶灯鱼不同月份摄食等级百分比组成 Fig.8 Percentage of different feeding stages of Diaphus watasei in different months in the continental slope of northern South China Sea |
|
图 9 南海北部陆坡海域瓦氏眶灯鱼不同体长组摄食等级百分比组成 Fig.9 Percentage of different feeding stage of Diaphus watasei with different body length in the continental slope of northern South China Sea |
通过传统解剖观察及分子测序分析表明, 瓦氏眶灯鱼主要摄食头足类、鱼类和甲壳类, 其中以头足类最多, 有安达曼钩腕乌贼(Abralia andamanica)、线小钩腕乌贼(Abraliopsis lineata)及其他武装乌贼(Enoploteuthidae)等; 鱼类主要为中层鱼, 包括七星底灯鱼、尾明角灯鱼、喀氏眶灯鱼(Diaphus garmani)、史氏眶灯鱼(Diaphus schmidti)等, 有时也会摄食同类; 甲壳类种类较多, 包括磷虾(Euphausiidae)、樱虾(Sergestidae)和拟须虾(Aristaeomorpha foliacea)等各种虾类, 端足类, 介形类以及桡足类的剑乳点水蚤(Pleuromamma xiphias)、粗乳点水蚤(P. robusta)、角锚哲水蚤(Rhincalanus cornutus)等。
3 讨论 3.1 生长特性体长和体重关系(W=aLb)通常用于描述鱼类个体的生长规律, 是生物学研究的基本内容, 可为鱼类资源评估模型的应用提供重要基础参数, 其中以幂指数b值是否等于3来评估该鱼是否处于等速生长, 即鱼体体长和体重的增加是否等速[17]。该研究中, 瓦氏眶灯鱼的b值为2.7472, 属负异速生长, 其中6月和3月的b值分别为2.9413和3.1098, 接近等速生长, 而8月的b值为2.5937, 属负异速生长。Baby等[7]研究Kerala沿岸海域瓦氏眶灯鱼的种群特性时, 发现b值为3.02, 属于等速生长。Vipin等[3]的研究也表明, 印度西南海域瓦氏眶灯鱼的雌性个体属于等速生长, 雄性属于正异速生长。该研究6月份的瓦氏眶灯鱼雌性个体也属于等速生长, 雄性属于正异速生长; 3月份的雌性个体属等速生长, 雄性个体属负异速生长; 而8月份的雌雄性均属负异速生长。以上研究表明, 不同海域、月份, 瓦氏眶灯鱼的生长速度会出现一些差异, 而即使生活在同一海域同一时间被捕获的瓦氏眶灯鱼, 性别不同, 其生长速度也可能不同。这也说明, 瓦氏眶灯鱼的生长速度受空间、时间和性别的影响。此外, 摄食、性腺发育程度、产卵状况、疾病及寄生虫量等因素的不同也能引起鱼类体长和体重关系中幂指数b的变化[12, 18]。
3.2 性比和性腺发育灯笼鱼在世界各大洋的性比大部分表现为雌性多于雄性[19-23], 这种性比模式有利于增大雌性的生物量并使产卵量最大化[19-20]。然而也有一些灯笼鱼的性比表现为雄性多于雌性[24], 如瓦氏眶灯鱼等。Vipin等[3]捕获的瓦氏眶灯鱼样品中, 雌雄比为163 : 266。Sassa等[5]研究发现, 中国东海陆坡区瓦氏眶灯鱼的雌雄性比为0.77 : 1, 体长在50~125 mm时雌性略多于雄性(♀ : ♂=1.08 : 1), 125~145 mm时雄性远多于雌性(♀ : ♂=0.3 : 1), 然后随体长增大雌性个体逐渐增多, 直至体长大于等于160 mm时, 所有个体均为雌性。该研究的瓦氏眶灯鱼雌雄性比为1 : 1.76, 总体表现为雄性多于雌性, 雌雄性比没有随体长的增大而表现出明显的变化规律, 但各月份捕获的最大个体均为雌性。以往调查发现, 七星底灯鱼[23]、戴氏眶灯鱼(Diaphus danae)[24]和腺眶灯鱼(Diaphus adenomus)[25]等被捕获的中层鱼样本的最大个体也均为雌性。鱼类性比除受自身行为影响外, 还可能与各水层采样的不均衡、拖网时鱼类逃逸能力的性别差异有关[22]。此外, Clarke[19]认为中层鱼雌性个体大于雄性可能与雌性个体生长速度更快及生命周期更长有关。
本研究的瓦氏眶灯鱼的性腺成熟度以Ⅱ期为主, 但Ⅲ期及以上个体在6月、8月和3月均有出现, 说明瓦氏眶灯鱼是全年多次产卵鱼类, 产卵期略长于中国东海, 与阿拉伯海接近, 产卵期的长短可能与水温的高低有关[7-8]。根据Logistic曲线推算出瓦氏眶灯鱼雌性个体的初次性成熟体长为145.0 mm, 比印度西南沿海[7](101.2 mm)和中国东海[5](雌性120 mm)的研究结果都大, 这可能与该次调查获取的样本较大有关, 具体原因有待以后进一步研究。
3.3 摄食习性国内外对金鼻眶灯鱼、七星底灯鱼、喀氏眶灯鱼、穆氏暗光鱼(Maurolicus mueller)等小型中层鱼的摄食[9-10, 26-29]已作过不少研究, 发现它们主要以浮游动物为食, 极少摄食头足类和鱼类等较大个体饵料生物。而在该研究中, 瓦氏眶灯鱼主要摄食安达曼钩腕乌贼和线小钩腕乌贼等头足类, 其次为七星底灯鱼、尾明角灯鱼、喀氏眶灯鱼和史氏眶灯鱼等中层鱼类, 以及各种甲壳动物等, 偶尔也摄食同类, 是一种比较凶猛的肉食性中层鱼。Sebastine等[4]在研究Kerala沿岸海域瓦氏眶灯鱼时也发现, 瓦氏眶灯鱼为肉食性鱼类, 食物包括深海虾、深海鱿鱼、小型中层鱼及有孔虫, 其中甲壳类最多, 占68%;其次是头足类(占21%), 鱼类(占5%)及其他各种生物(占6%)。以上研究结果表明, 瓦氏眶灯鱼与小型中层鱼存在较大的摄食差异, 其摄食的范围更宽, 更偏好摄食大个体饵料生物, 这也说明瓦氏眶灯鱼较小型中层鱼具有更强的捕食竞争力。大部分中层鱼具有昼夜垂直迁移现象, 一般白天潜到深处以躲避捕食, 夜晚则浮至具有丰富浮游动物的表层进行摄食[30-33]。因此推测, 金鼻眶灯鱼、尾明角灯鱼、七星底灯鱼等小型中层鱼夜晚上浮至表层并不仅仅是为了捕食, 也可能是躲避瓦氏眶灯鱼等底层捕食者的捕食。
该研究除在3月份的中层拖网偶尔见有瓦氏眶灯鱼的未成熟个体(BL < 100 mm)外, 其余样品均来自底层虾拖网。从2014年至今对南海北部陆坡区的调查(包括72 h定点连续观测)发现, 瓦氏眶灯鱼极少出现在中层拖网, 基本由底层虾拖网所捕获。而在其他海域如印度西南沿岸[2-3, 6-7]、阿拉伯海[4]及中国东海[5]等, 无论白天或夜晚均能在200 m以深的底层拖网中捕获瓦氏眶灯鱼。因此认为, 瓦氏眶灯鱼主要生活在底层海域, 基本不进行昼夜垂直迁移。瓦氏眶灯鱼的摄食习性也支持这一结论。瓦氏眶灯鱼主要摄食深海头足类和虾类, 小型中层鱼和浮游动物仅是其食物中的一小部分, 它们在夜晚的上浮对其摄食影响不大, 因此, 从摄食方面考虑, 瓦氏眶灯鱼没有必要进行昼夜垂直迁移。对于出现少量瓦氏眶灯鱼未成熟个体上浮至表层的现象, 很可能因为这些未成熟个体的捕食竞争能力弱, 夜间浮游动物和小型中层鱼迁移至表层后周围食物匮乏, 因此在捕食的过程中随迁移的饵料生物上浮至表层。中国东海等海域同样也发现有部分瓦氏眶灯鱼未成熟个体夜间上浮至表层[8]。
近年来, 随着近海传统渔业资源的衰退, 巨大的中层鱼资源引起世界的广泛关注, 已成为美国和欧洲近期海洋生物资源开发的重点。瓦氏眶灯鱼不仅个体规格大, 还是灯笼鱼中少数基本不进行垂直迁移的种类, 很有必要进一步深入研究其独特的生态习性及其对生态系统能量流动的影响, 为该种类的开发、利用和科学管理提供有效的基础信息参考。
| [1] |
Chen S Z. Fauna Sinica (Ostichthyes Myctophiformes Cetomimiformes Osteoglossiformes)[M]. Beijing: Science Press, 2002: 212-214. [陈素芝. 中国动物志(硬骨鱼纲灯笼鱼目鲸口鱼目骨舌鱼目)[M]. 北京: 科学出版社, 2002: 212-214.]
|
| [2] |
Pillai N G K, Bineesh K K, Sebastine M, et al. Lanternfishes (Myctophids):by-catch of deepsea shrimp trawlers operated off Kollam, south-west coast of India[J]. Marine Fisheries Information Service T & E Ser, 2009, 202: 1-4. |
| [3] |
Vipin P M, Fernandez T J, Vettiyattil M R, et al. First estimate of the length-weight relationship of Diaphus watasei Jordan and Starks, 1904 caught off the southwest coast of India[J]. Asian Fisheries Society, 2011, 24: 453-455. |
| [4] |
Sebastine M, Bineesh K K, Abdussamad E M, et al. Myctophid fishery along the Kerala coast with emphasis on population characteristics and biology of the headlight fish, Diaphus watasei Jordan & Starks, 1904[J]. Indian Journal of Fisheries, 2013, 60(4): 7-11. |
| [5] |
Sassa C, Tanaka H, Ohshimo S. Comparative reproductive biology of three dominant myctophids of the genus Diaphus on the slope region of the East China Sea[J]. Deep-Sea Research Part Ⅰ:Oceanographic Research Papers, 2016, 115: 145-158. DOI:10.1016/j.dsr.2016.06.005 |
| [6] |
Rajamoorthy K, Pradeep K, Anandan R, et al. Biochemical composition of Myctophid species Diaphus watasei and Myctophum obtusirostre caught from Arabian Sea[J]. Fishery Technology, 2013, 50: 41-44. |
| [7] |
Baby L, Sankar T V, Anandan R. Comparison of lipid profile in three species of Myctophids from the south west coast of Kerala, India[J]. National Academy Science Letters, 2014, 37(1): 33-37. DOI:10.1007/s40009-013-0185-4 |
| [8] |
Koizumi K, Hiratsuka S, Saito H. Lipid and fatty acids of three edible myctophids, Diaphus watasei, Diaphus suborbitalis, and Benthosema pterotum:high levels of lcosapentaenoic and docosahexaenoic acids[J]. Journal of Oleo Science, 2014, 63(5): 461-470. DOI:10.5650/jos.ess13224 |
| [9] |
Jin H W, Xue L J, Pan G L, et al. Feeding habits of Benthosema pterotum in the East China Sea and southern part of Yellow Sea[J]. Marine Fisheries, 2011, 33(4): 368-377. [金海卫, 薛利建, 潘国良, 等. 东海和黄海南部七星底灯鱼摄食习性的研究[J]. 海洋渔业, 2011, 33(4): 368-377. DOI:10.3969/j.issn.1004-2490.2011.04.002] |
| [10] |
Gong Y Y, Chen Z Z, Zhang J, et al. Feeding habits of Diaphus chrysorhynchus from continental slope region in northern South China Sea in autumn[J]. South China Fisheries Science, 2015, 11(5): 90-99. [龚玉艳, 陈作志, 张俊, 等. 南海北部陆坡海域秋季金鼻眶灯鱼的摄食习性[J]. 南方水产科学, 2015, 11(5): 90-99. DOI:10.3969/j.issn.2095-0780.2015.05.011] |
| [11] |
Zhang J, Chen G B, Jiang Y E, et al. A preliminary study on fishery biology of elongata poatholefish Gonostoma elongatum in the central-southern part of the South China Sea[J]. Journal of Tropical Oceanography, 2015, 34(3): 62-67. [张俊, 陈国宝, 江艳娥, 等. 南海中南部长钻光鱼渔业生物学初步研究[J]. 热带海洋学报, 2015, 34(3): 62-67. DOI:10.3969/j.issn.1009-5470.2015.03.008] |
| [12] |
Kong X L, Jiang Y E, Gong Y Y, et al. A preliminary study on fishery biology of Ceratoscopelus warmingii in the central and northern South China Sea[J]. South China Fisheries Science, 2016, 12(4): 117-124. [孔啸兰, 江艳娥, 龚玉艳, 等. 南海中北部尾明角灯鱼渔业生物学特性的初步研究[J]. 南方水产科学, 2016, 12(4): 117-124. DOI:10.3969/j.issn.2095-0780.2016.04.015] |
| [13] |
East China Sea Fisheries Research Institute. The Deep Water Fishes of the East China Sea[M]. Shanghai: Xue Lin Publishing House, 1988: 126-127. [东海水产研究所. 东海深海鱼类[M]. 上海: 学林出版社, 1988: 126-127.]
|
| [14] |
Yang J J, Huang Z Y, Chen S Z, et al. The Deep-Water Pelagic Fishes in the Area from Nansha Islands to the Northeast Part of South China Sea[M]. Beijing: Science Press, 1996: 100-101. [杨家驹, 黄增岳, 陈素之, 等. 南沙群岛至南海东北部海域大洋性深海鱼类[M]. 北京: 科学出版社, 1996: 100-101.]
|
| [15] |
Fei H N, Zhang S Q. Aquatic Resources[M]. Beijing: Science and Technology of China Press, 1990: 114-285. [费鸿年, 张诗全. 水产资源学[M]. 北京: 中国科学技术出版社, 1990: 114-285.]
|
| [16] |
Ricker W E. Computation and Interpretation of Biological Statistics of Fish Population[M]. Ottawa: Bulletin of Fisheries Research Board of Canada, 1975: 191-382.
|
| [17] |
Zhan B Y. Fish Stock Assessment[M]. Beijing: China Agriculture Press, 1995: 18-40. [詹秉义. 渔业资源评估[M]. 北京: 中国农业出版社, 1995: 18-40.]
|
| [18] |
Zhang G Z, Li X S, Zhu J C, et al. The growth characteristics of small yellow croaker Larimichthys polyactis under yearling in the central and southern Yellow Sea[J]. Progress in Fishery Science, 2010, 31(3): 16-22. [张国政, 李显森, 朱建成, 等. 黄海中南部小黄鱼当年幼鱼生长特征的研究[J]. 渔业科学进展, 2010, 31(3): 16-22.] |
| [19] |
Clarke T A. Sex ratios and sexual differences in size among mesopelagic fishes from the central Pacific Ocean[J]. Marine Biology, 1983, 73(2): 203-209. DOI:10.1007/BF00406889 |
| [20] |
Young J W, Blaber S J M, Rose R. Reproductive biology of three species of midwater fishes associated with the continental slope of eastern Tasmania, Australia[J]. Marine Biology, 1987, 95(3): 323-332. DOI:10.1007/BF00409562 |
| [21] |
Prosch R M. Reproductive biology and spawning of the myctophid Lampanyctodes hectoris and the sternoptychid Maurolicus muelleri in the southern Benguela Ecosystem[J]. South African Journal of Marine Science, 1991, 10(1): 241-252. DOI:10.2989/02577619109504635 |
| [22] |
Gartner Jr J V. Patterns of reproduction in the dominant lanternfish species (Pisces:Myctophidae) of the eastern Gulf of Mexico, with a review of reproduction among tropical-subtropical Myctophidae[J]. Bulletin of Marine Science, 1993, 52(2): 721-750. |
| [23] |
Sassa C, Tanaka H, Tsukammoto Y, et al. Reproductive biology of Benthosema pterotum (Teleostei:Myctophidae) in the shelf region of the East China Sea[J]. Journal of the Marine Biological Association of the United Kingdom, 2014, 94(2): 423-433. DOI:10.1017/S0025315413001318 |
| [24] |
Flynn A J, Paxton J R. Spawning aggregation of the lanternfish Diaphus danae (family Myctophidae) in the north-western Coral Sea and associations with tuna aggregations[J]. Marine and Freshwater Research, 2012, 63(12): 1255-1271. DOI:10.1071/MF12185 |
| [25] |
Braga A C, Costa P A S, Nunan G W. First record of the firebrow lanternfish Diaphus adenomus (Myctophiformes:Myctophidae) from the South Atlantic[J]. Journal of Fish Biology, 2008, 73(1): 296-301. DOI:10.1111/jfb.2008.73.issue-1 |
| [26] |
Young J W, Blaber S J M. Feeding ecology of three species of midwater fishes associated with the continental slope of eastern Tasmania, Australia[J]. Marine Biology, 1986, 93(1): 147-156. DOI:10.1007/BF00428663 |
| [27] |
Grañal L R, Castro L, Loureiro M, et al. Feeding ecology of dominant larval myctophids in an upwelling area of the Humboldt Current[J]. Marine Ecology Progress, 2005, 290(1): 119-134. |
| [28] |
Shreeve R S, Collins M A, Tarling G A, et al. Feeding ecology of myctophid fishes in the northern Scotia Sea[J]. Marine Ecology Progress, 2009, 386(12): 221-236. |
| [29] |
Tanaka H, Sassa C, Ohshimo S, et al. Feeding ecology of two lanternfishes Diaphus garmani and Diaphus chrysorhynchus[J]. Journal of Fish Biology, 2013, 82(3): 1011-1031. DOI:10.1111/jfb.2013.82.issue-3 |
| [30] |
Marshall N B. Swimbladder structure of deep-sea fishes in relation to their systematics and biology[J]. Discovery Report, 1960, 31: 1-122. |
| [31] |
Clarke T A. Diel feeding patterns of 16 species of mesopelagic fishes from Hawaiian waters[J]. Fishery Bulletin, 1978, 76(3): 495-513. |
| [32] |
Kozlov A N. A review of the trophic role of mesopelagic fish of the family Myctophidae in the southern ocean ecosystem[J]. CCAMLR Science, 1995, 2: 71-77. |
| [33] |
Luo J G, Ortner P B, Forcucci D, et al. Diel vertical migration of zooplankton and mesopelagic fish in the Arabian Sea[J]. Deep-Sea Research Part Ⅱ:Topical Studies in Oceanography, 2000, 47(7-8): 1451-1473. DOI:10.1016/S0967-0645(99)00150-2 |
 2018, Vol. 25
2018, Vol. 25

