2. 中国水产科学研究院淡水渔业研究中心, 中美淡水贝类种质资源保护及利用国际联合实验室, 江苏 无锡 214128;
3. 南京农业大学无锡渔业学院, 江苏 无锡 214128
2. Sino-US Cooperative Laboratory for Germplasm Conservation and Utilization of Freshwater Mollusks, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214128, China;
3. Wuxi Fisheries College, Nanjing Agricultural University, Wuxi 214128, China
目前, 世界上报道的石首鱼类有67属275种, 分类上隶属于石首鱼科(Sciaenidae), 是鲈形目中种属最多的科之一。由于大多数石首鱼类肉味鲜美、经济价值高, 成为世界海洋渔业和海水养殖的重要对象[1]。石首鱼类大多为海水鱼类, 仅有极少数的种类生活在淡水水域, 其中包括北美洲的淡水石首鱼(Aplodinotus grunniens)和东南亚的小鳞波曼石首鱼(Boesemania microlepis)。中国石首鱼科共有16属30种, 全部为海水鱼类[2], 是中国海洋经济鱼类中产量最大的群类, 其中包括中国“四大海洋渔业”的大黄鱼和小黄鱼; 而大黄鱼(Larimichthys crocea)、日本黄姑鱼(Nibea japonica)、褐毛鲿(Megalonibea fusca)、双棘黄姑鱼(N. diacanthus)和从美国引进的眼斑拟石首鱼(Sciaenops ocellatus)[3]是中国目前重要的海水养殖石首鱼类。
目前中国尚无适宜淡水养殖的石首鱼种类。淡水石首鱼, 也称淡水黄花鱼, 隶属石首鱼科(Sciaenidae), 为淡水温水性鱼类, 是北美洲分布最为广泛的淡水鱼类[4-5], 也是北美洲唯一终生生活在淡水中石首鱼类, 是研究石首鱼类系统发育和进化, 尤其是海淡水区域性生物地理格局的优良材料。淡水石首鱼在美国为非垂钓性鱼类, 是内陆渔业捕捞的重要渔获物种类之一, 目前尚未开展人工养殖, 其养殖基础生物学研究薄弱。淡水石首鱼具有适应性广、杂食性偏肉食性[6]、营养丰富、肉味鲜美、无肌间刺等优点, 适宜在淡水及咸淡水中养殖[7], 且可摄食配合饲料, 具有良好的人工养殖前景。另一方面, 淡水石首鱼是中国引进培育紫黑珍珠的育珠蚌—紫黑翼蚌(Potamilus alatus)人工繁育所需的唯一天然寄主鱼[8-10]。由于中国没有淡水石首鱼的天然分布, 极大地制约了紫黑翼蚌苗种的规模化寄生繁育[11]。为此, 中国水产科学研究院淡水渔业研究中心2016年从美国引进一批淡水石首鱼鱼苗开展人工驯养, 取得了良好进展, 旨在为中国紫黑翼蚌苗种规模化寄生繁育提供新的技术途径。
外部形态和内部解剖学特征是鱼类养殖基础生物学研究的重要组成部分, 不仅是鱼类系统发育和分类的重要指标, 也是开展鱼类人工驯养和繁育的理论依据。国际上,关于淡水石首鱼的研究主要集中在年龄与生长[12-14]、繁殖特性与胚胎及早期发育[15]、雌雄形态与生长差异[16-17]、捕捞特征[18]、食性差异分析[19-20]及出血病毒抗体检测[21]等研究。目前, 国内仅见淡水石首鱼肌肉营养成分的报道[7]。本研究对淡水石首鱼幼鱼的外部形态特征作了比较系统的描述, 对内部器官结构和矢耳石形态学特征进行了观察, 分别从外部形态、内部解剖学和矢耳石形态特征3个方面阐述生物学特性, 并以此探讨其分类进化地位, 补充其养殖基础生物学资料, 为进一步开展淡水石首鱼的人工驯养提供理论参考和依据。
1 材料与方法 1.1 实验鱼来源淡水石首鱼为2016年中国水产科学研究院淡水渔业研究中心从美国引进的一批苗种, 全长6~11 cm; 经过近10个月的人工驯养, 成活率达到80%, 平均体重360 g。分别在2016年11月、2017年7月、11月各随机取10尾淡水石首鱼幼鱼, 共计30尾用于形态学观察和可量可数性状测量。其中3种规格的鱼体全长范围分别为8~11 cm、15~18 cm和26~34 cm, 在测量后进行解剖学观察。
1.2 形态学观察和测量按文献[22]测量鱼体体重(0.1 g)、全长、体长、体高、吻长、眼径、头长、尾柄长、尾柄高等形态指标, 计算相应比例, 其中长度指标准确测量至0.1 cm; 对外部形态学、不同部位的鳞片形态、分布特征进行描述和摄像, 对背鳍、胸鳍、腹鳍、臀鳍和尾鳍的组成和数量及侧线鳞等进行定量统计。鳞片在SZX16(OLYMPUS)解剖镜下观察, 采用DP(OLYMPUS)摄像头和CellSens Standard软件拍照。
1.3 内部器官结构观察将鲜活鱼体用5 mg/mL的MS222麻醉处理后, 按文献孟庆闻等[23]方法进行口腔和体腔解剖。依次对口、舌、上下咽齿、食道、胃、幽门盲囊、肠道、肝胰脏、胆囊、脾、鳔、鳃等内部器官位置及形态特征进行观察和拍照; 测定肠道长度, 按赵峰等[24]方法计算肠道系数。
1.4 扫描电镜观察取鱼的上下颌、上下咽齿及鳃, 用磷酸缓冲液(0.02 mol/L, pH7.2)清洗后, 用2.5%戊二醛浸泡处理用于表面超微结构观察。将上述固定样品按闻海波等[25]方法依次进行梯度脱水置换、冷冻干燥(ES2030型冷冻干燥仪)、喷金(E-1010/E离子溅射仪), 采用S-3000N(Hitachi)扫描电镜观察表面微结构和摄像。
1.5 耳石形态特征描述取出左右矢耳石, 用乙醇清洗干净自然晾干, 在解剖镜下观察其背面、腹面及边缘结构特征。耳石形态相关术语参考朱元鼎等[26]、张国华[27]及区又君等[28]。
1.6 数据统计处理采用SPSS 21.0软件对形态学数据进行统计分析, 各形态可量性比例均以平均值±标准差(x±SE)表示。
2 结果与分析 2.1 外部形态基本特征淡水石首鱼体型似纺锤形, 背缘较腹缘弧度大, 以背鳍起点最高, 体表呈淡黄色(图 1A)。外部形态主要可量性比例指标如表 1。当体重达50 g左右, 鱼体高明显增加, 头至背部的弧度增大。头中大, 似羊头, 故英文名为sheepshead。吻长与眼径相当。眼中大, 上侧位, 吻端至眼后缘的距离小于眼后头长。口中等, 下位, 上颌略长于下颌, 中等口裂。无须。鼻孔位于眼前方, 每侧2个, 前鼻孔小, 后鼻孔较大(图 1B), 两鼻孔内部相通。吻部未发现明显的黏液孔分布, 吻褶不发达; 颐部具有5个黏液孔, 大小相似, 左右对称分布, 为五孔型(图 1C)。
|
|
表 1 淡水石首鱼外部形态比例指标及变化范围 Tab.1 Index and variation range of external morphological ratio of juvenile Aplodinotus grunniens |

|
图 1 淡水石首鱼幼鱼外部形态特征 A:淡水石首鱼幼鱼, 示外部形态特征; B:头部, 示前鼻孔和后鼻孔; C:颐部, 示5个黏液孔; D:胸鳍, 示延长的鳍丝. Fig.1 External morphological characteristic of juvenile Aplodinotus grunniens A: juvenile of freshwater drum, showing external morphological characteristics; B: head, showing anterior naris and posterior naris; C: chin, showing 5 mental pores; D: pectoral fin, showing the prolonged fin wire. |
背鳍2个, 中间有一深凹刻, 其中第一背鳍均由硬棘组成, 起于鳃盖膜突后端的上方, 第1根鳍棘最短, 第3根鳍棘最长; 第二背鳍由1根鳍棘和若干分枝鳍条(两分枝)组成, 后方鳍条延伸不到尾鳍基部, 鳍式D.IX, I-30~31。胸鳍侧位, 位于鳃盖正后方, 由分枝(两分枝)鳍条组成, 起点与第一背鳍相似, 淡黄色, 鳍式P.14~15。腹鳍胸位, 由1根硬棘和若干分枝鳍条(多分枝)组成(图 1D), 颜色为黄色, 一般深于胸鳍的颜色; 在胸鳍外侧端有白色特化延长的“鳍丝”, 略长于其他鳍条(图 1D), 鳍式V.I-5。臀鳍起点于位于第二背鳍近第11鳍条的下方, 由2根硬棘和若干分枝鳍条组成, 呈淡黄色, 第2硬棘明显长于第1硬棘, 鳍式A.II-7~8。尾鳍为截形, 呈楔状, 后端平直形, 由分枝鳍条组成, 鳍式C.16~20。
2.1.2 鳞片分布特征除吻端、峡部无鳞分布, 头部两侧包括鳃盖、眼睛周边表面覆盖小圆鳞, 鳞片表面具有同心圆排列的鳞嵴, 鳞焦位于近中心位置, 在眼睛周围区域的鳞片在基区一般无鳞沟(图 2A), 而鳃盖边缘的鳞片具有辐射状鳞沟(图 2B)。身体两侧的侧线上鳞、侧线下鳞均为栉鳞, 鳞片顶区具有一排数目不等的细齿, 为辐射型; 鳞焦顶位, 表面具有同心圆隆起的鳞嵴; 仅基区具有从鳞焦发出的辐射状鳞沟, 在基区形成许多“小枕”(图 2C)。在头顶部(除眼眶前部外)、头与背部的交接处存在圆鳞与栉鳞的过渡类型, 部分鳞焦仍位于中心, 但基区鳞沟不完全, 顶区边缘出现少量细齿(图 2D); 部分鳞焦趋于顶位, 但基区的鳞沟不明显, 顶区边缘细齿分为两簇(图 2E)。
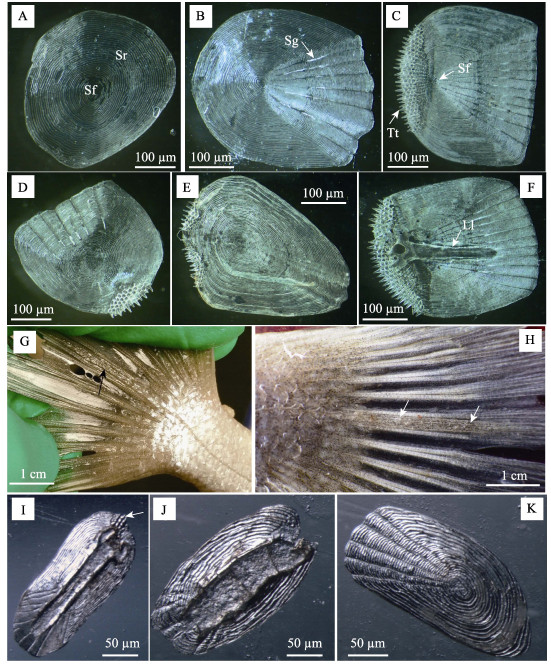
|
图 2 淡水石首鱼幼鱼的鳞片形态特征 A:眼睛周围的圆鳞; B:鳃盖周围的圆鳞, 示鳞沟; C:侧线上鳞和侧线下鳞, 示鳞焦和细齿; D:圆鳞与栉鳞的过渡类型I; E:圆鳞与栉鳞的过渡类型II; F:侧线鳞; G-H:尾鳍侧线鳞, 示其分布; I:尾鳍侧线栉鳞, 示细齿; J:尾鳍侧线鳞-过渡类型; K:尾鳍侧线圆鳞. Sf-鳞焦, Sr-鳞嵴, Sg-鳞沟, Tt-细齿, Ll-侧线. Fig.2 Morphological characteristic of scale in juvenile Aplodinotus grunniens A: cycloid scale around eye; B: cycloid scale around operculum, showing scale grooves; C: scale in lateral line, showing scale focus and tiny teeth; D: intermediate phenotype I between cycloid scale and ctenoid scale; E: intermediate phenotype II between cycloid scale and ctenoid scale; F: lateral line scale; G-H: lateral line scale on the caudal fin, showing its distribution; I: lateral line ctenoid scale at caudal fin, showing tiny teeth; J: intermediate phenotype of lateral line scale at caudal fin; K: lateral line cycloid scale at caudal fin. Sf-scale focus, Sr-scale ridges, Sg-scale grooves, Tt-tiny teeth, Ll-lateral line. |
侧线鳞从头后部一直延长至尾鳍约1/2处(图 2G, 图 2H)。其中躯干上的侧线鳞为栉鳞, 表面有侧线从鳞焦穿过(图 2F), 数量49~54个; 尾鳍基部的侧线鳞为长圆形的小栉鳞(图 2I), 但栉鳞顶区的细齿数量逐步减少、消失, 并过渡为圆鳞(图 2J), 数量5~7。侧线鳞总数为56~61, 侧线上鳞7~10, 侧线下鳞(臀鳍起点至侧线)10~12。第二背鳍、胸鳍及尾鳍鳍膜基部1/5~1/3处有长圆形的小圆鳞分布(图 2K), 而第一背鳍、腹鳍、臀鳍鳍条膜未见鳞片分布。
2.2 内部解剖学特征 2.2.1 消化管消化系统起至口, 经口咽腔、食道、胃、幽门盲囊、肠道至肛门。
上下颌边缘具有细小的犬牙状颌齿, 下颌中央区无颌齿分布(图 3A), 左右两侧颌齿对称分布, 中央内侧数量最多, 有6~7排, 但数量由中央内侧向左右两侧递减(图 3B); 颌齿尖均向口腔内方向弯曲, 颌齿的直径由外侧向内侧逐渐变小, 但弯曲程度逐步增加(图 3C), 颌齿表面均有明显的同心圆生长纹(图 3D, 图 3E)。与下颌齿不同, 上颌齿成连续分布, 且上颌外侧第一排颌齿直径最大, 与内侧相邻颌齿差异尤为显著(图 3F)。梨骨及腭骨均无牙齿分布。

|
图 3 淡水石首鱼幼鱼颌齿形态学特征 A:下颌中央区; B:下颌左侧区颌齿分布; C:下颌齿内外分布; D:外侧下颌齿; E:内侧下颌齿; F:上颌齿分布.图中白色箭头所指方向为口腔内部方向. Fig.3 Morphological characteristic of jaw teeth of juvenile Aplodinotus grunniens A: central area of lower jaw; B: distribution of jaw teeth in left side of lower jaw; C: internal and external distribution of mandibular teeth; D: mandibular teeth located margin; E: mandibular teeth located inside; F: distribution of maxillary teeth. The direction of the white arrow in figure 3 indicates the internal direction of oral cavity. |
口腔下侧有基舌骨突出形成的舌, 前端游离, 扁平状, 前端钝圆, 表面光滑无齿(图 4A), 基部与鳃弓相连(图 4B)。在左右两侧第四鳃弓之间形成近三角形的下咽齿盘(图 4C), 咽齿与颌齿形态相似, 但直径明显较大, 且中央区咽齿最大, 从中央向左右两侧, 咽齿直径逐步变小(图 4D), 但游离端更加尖锐(图 4E), 与颌齿形态相似; 与下咽齿盘相对应, 口腔上部有2个相连而独立的上咽齿盘(图 4C), 均小于下咽齿盘, 似椭圆形, 内侧区咽齿直径较大, 而外侧区咽齿逐步变小而尖锐(图 4F)。所有咽齿末端均向食道方向弯曲。
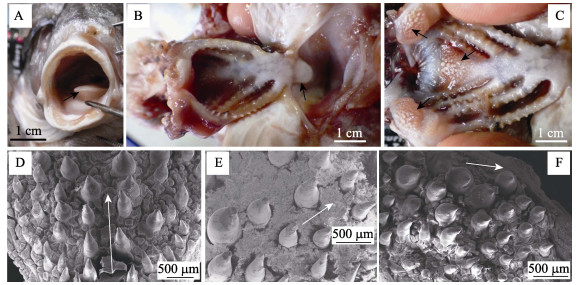
|
图 4 淡水石首鱼幼鱼口咽腔形态特征 A:口腔, 示舌的游离端; B:口咽腔, 示舌的外形; C:口咽腔, 示上咽齿和下咽齿; D-E:下咽齿扫描电镜观察; F:上咽齿扫描电镜观察.图中白色箭头所指方向为口腔内部方向. Fig.4 Morphological characteristic of pharyngo-oral cavity of juvenile Aplodinotus grunniens A: oral cavity, showing free end of tongue; B: pharyngo-oral cavity, showing external form; C: pharyngo-oral cavity, showing upper pharyngeal teeth and hypopharyngeal teeth; D-E: SEM of hypopharyngeal teeth; F: SEM of upper pharyngeal teeth. The direction of the white arrow in Figure 4 indicates the internal direction of oral cavity. |
食道短, 胃为卜形(图 5A), 容量大, 喷门部直径粗于幽门部, 而盲囊部特别发达; 在胃肠连接处具有7个环形排列的幽门盲囊, 呈指状(图 5A); 肠道具有2个180°回旋, 迂回形成3段(图 5B), 及至肛门, 肠道系数约为0.68。
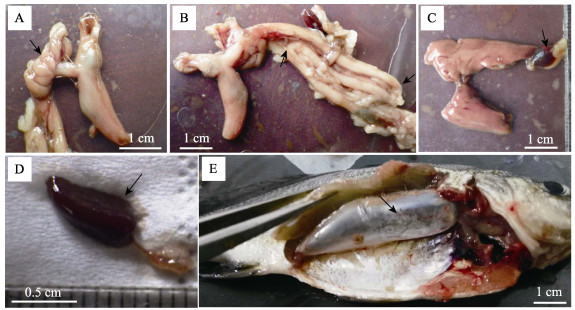
|
图 5 淡水石首鱼幼鱼内脏器官解剖学观察 A:消化管, 示幽门盲囊; B:消化管, 示回旋肠道; C:消化腺, 示胆囊; D:脾; E:鳔, 示红腺. Fig.5 Anatomical observation on the visceral organs of juvenile Aplodinotus grunniens A: digestive tube, showing pyloric caeca; B: digestive tube, showing convoluted intestine; C: digestive gland, showing gall bladder; D: spleen; E: air bladder, showing red gland. |
肝胰脏分为两叶, 左侧肝叶较大, 右侧略小; 胆囊呈卵圆形, 深绿色, 内部胆汁半透明(图 5C); 脾深红色, 体积小, 呈长锥形(图 5D)。
2.2.3 鳔与鳃鳔一室, 为闭鳔类, 无侧囊, 无侧管, 体积大, 从头部后端一直延伸至体腔末端, 前端钝圆, 后端逐步紧缩成圆锥形, 背部及两侧与体壁通过薄膜紧密相连, 下腹部前端具有树枝状的红腺(图 5E)。
具有4对全鳃, 鳃盖两侧有一对较小的假鳃。扫描电镜下:鳃丝在鳃弓上紧密排列(图 6A), 鳃丝两侧有成行排列的鳃小片(图 6B); 鳃丝表皮细胞呈近圆形, 表面形成螺旋状突起(图 6C); 每一鳃弓内侧具有两行鳃耙(图 4C), 第一鳃弓外鳃耙数为16, 鳃耙间隔较大, 一般每7~8个鳃丝间隔出现一个鳃耙(图 6D); 鳃耙为明显的突起, 在突起表面分布大小不等的锥形小刺, 内侧的刺较大, 侧面的刺较小(图 6E); 鳃弓中间的鳃耙较突出, 两侧逐渐减低; 在小刺表面有类似鳃丝表皮细胞覆盖(图 6F)。

|
图 6 淡水石首鱼幼鱼鳃组织表面微结构 A:鳃丝; B:鳃小片; C:鳃丝表皮细胞; D:鳃弓; E:鳃耙; F:鳃弓表皮细胞. Fig.6 Surface microstructure of gill tissue of juvenile Aplodinotus grunniens A: branchial filaments; B: brabchial lamellae; C: branchial epidermic cells; D: branchial arch; E: branchial raker; F: epidermic cells of branchial arch. |
矢耳石位于球囊内, 内缘位置较高, 外缘向腹侧倾斜。在幼鱼体长小于11 cm阶段, 耳石似椭圆形, 前缘略宽于后缘; 背面内凹, 表面粗糙, 中央区明显突出, 与边缘区分界清晰, 近外缘有一排2~6个嵴突, 边缘区较薄, 具一圈均匀分布的辐射状隆起(图 7A); 内缘略内凹, 前缘、外缘及后缘形成较大的弧形, 翼叶、基叶、后基叶及副基叶均不明显, 无中央突。腹面中央凸起, 表面较光滑, 在近内缘具有蝌蚪状印迹, 头区位于前缘, 尾区成J字形, 尾端尖细, 并延伸至外缘(图 7B)。当幼鱼生长至15 cm以上, 耳石似耳形, 前缘明显宽于后缘, 背面嵴突的数量增加, 突起更加明显, 在内缘的中部出现2个明显的缺刻(图 7C); 腹面蝌蚪印迹更加明显(图 7D)。矢耳石长为鱼体长的5.9%, 矢耳石高为鱼体长的4.7%。
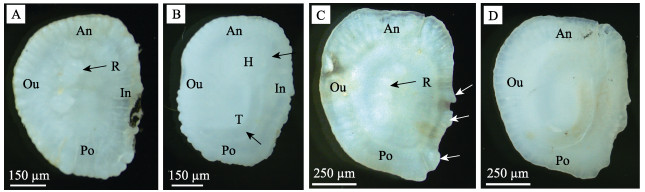
|
图 7 淡水石首鱼幼鱼矢耳石形态特征 A:小规格幼鱼矢耳石背面, 示嵴突; B:小规格幼鱼矢耳石腹面, 示蝌蚪状印迹的头区和尾区; C:大规格幼鱼矢耳石背面, 示内缘突起; D:大规格幼鱼矢耳石腹面. An-前缘, Po-后缘, Ou-外缘, In-内缘, H-头区, T-尾区, R-嵴突. Fig.7 Morphological characteristic of sagittal otoliths of juvenile Aplodinotus grunniens A: back of sagittal otolith of juvenile with small size, showing ridge; B: abdomen of sagittal otolith of juvenile with small size, showing head and tail area of tadpole imprinting; C: back of sagittal otolith of juvenile with large size, showing internal protuberance; D: abdomen of sagittal otolith of juvenile with large size. An-anterior, Po-posterior, Ou-outer, In-inner, H-head area, T-tail area, R-ridge. |
本研究表明淡水石首鱼在鳞片、鳍条形态、黏液孔分布等方面具有明显种的特征, 与其他石首鱼类存在明显差异。一般认为鱼类的圆鳞较为原始, 栉鳞较高级。中国石首鱼类的鳞片分布特征大致可有三大类型:第一类均为圆鳞, 如梅童鱼属(Collichthys); 第二类均为栉鳞, 如双棘黄姑鱼; 第三类最为普遍, 一般吻部、鳃盖或峡部被小圆鳞, 体被栉鳞[26]。本研究表明:淡水石首鱼头部两侧为小圆鳞, 体被栉鳞, 而头部顶区和背部交界处存在圆鳞和栉鳞的过渡类型, 且侧线鳞一直延伸至尾鳍的1/2处。这一特征对淡水石首鱼进化和分类地位的探讨可能具有重要价值。此外, 本研究发现在淡水石首鱼眼睛周围的圆鳞一般无鳞沟, 而鳃盖和鳍条的圆鳞具有数量不等的鳞沟。由于鳞沟可降低鳞片表面骨质层的坚硬性, 增加鳞片的柔软程度[22], 这种圆鳞的形态特征差异分布可能更利于鳃盖、鳍条的运动。
淡水石首鱼的腹鳍外侧第一鳍条稍延长形成特征性的鳍丝, 这与中国的石首鱼属(Sciaena)、叫姑鱼属(Johnius)的物种十分相似, 尾鳍也同为截形[26], 表明其游泳速度不快。但有标记研究表明:密苏里河的淡水石首鱼在不到一年时间可上游至几百公里[29], 这表明淡水石首鱼具有一定的迁移能力。一般来说, 石首鱼类的游泳能力不太强, 除做地方性移动外, 不作远程洄游, 因此属种的地理分布局限性很显著[26]。淡水石首鱼是北美洲分布最为广泛的鱼类[4-5], 其主要原因可能跟其较强的生态适应能力和摄食多样性[20]更为相关。
对于黏液孔的类型, 朱元鼎等[26]认为:底栖的石首鱼种类, 一般吻上孔均明显; 而中下层游泳的种类, 吻上孔不显著, 呈退化或消失。淡水石首鱼仅在颐部有5个黏液孔分布, 以此推测淡水石首鱼可能具有底栖鱼类和中下层鱼类的综合特征, 或者进化上处于两类鱼的中间类型。淡水石首鱼的黏液孔分布特征很可能与在不同生长发育阶段的摄食特性相适应。
由于成鱼矢耳石具有比较稳定的形态特征, 在丽鱼科(Cichaidae)[30]、中国石首鱼类[26]、鲤科[31]及鲚属[32]在亚科、属、种类鉴定和判别上均取得较好的应用。与其他石首鱼类一样, 淡水石首鱼具有一对特大的矢耳石。本研究表明:在幼鱼阶段, 随着淡水石首鱼的生长, 矢耳石的形态发生一定程度的变化, 但基本形态和特征相似。参照朱元鼎等[26]关于中国石首鱼类的耳石类型, 淡水石首鱼矢耳石形态属于石首鱼型, 与中国黄唇鱼(Bahaba flavolabiata)的矢耳石表面形态特征最为接近, 而与大黄鱼、丁氏蜮和棘头梅童鱼(C. niveatus)的外部形态和表面特征差异较大[28]。
在《北美鱼类志》中, Jordan等[33]根据脊椎骨和第一、第二背鳍是否连续等特征, 把北美的石首鱼类划分为石首鱼亚科、牙(
鱼类在长期演化过程中, 形成了一系列适应各自食性类型和摄食方式的形态学特征[34]。本研究发现:淡水石首鱼具有中等大小的口裂, 口咽腔内具有比较锋利的颌齿和发达的咽齿, 两种牙齿形态均似犬牙状, 且分布表现出一定的规律性, 但牙齿基部的直径和游离端的尖锐程度具有较大差异。咽齿直径大小明显大于颌齿, 而颌齿更加尖锐, 这种差异可能与两者的主要功能相适应。另一方面, 颌齿与咽齿弯曲方向均指向口腔内部, 这可能有利于捕食时防止食物逃脱和撕咬, 并将食物推送至消化道内消化, 这与鳜(Siniperca chuatsi)的口腔齿尖细且齿尖向后是一致的[35]。
早期的研究表明:密西西比河下游的淡水石首鱼主要摄食蜉蝣目、双翅目等水生昆虫、鱼类, 甚至包括一些植物碎屑[6]。Jacquemin等[20]研究表明: Wabash河的淡水石首鱼食性与鱼体大小、性别有一定相关性, 而与河流所处的纬度关系不大; 当鱼体全长小于50 cm阶段主要摄食底栖的双翅目、毛翅目、蜉蝣目和环节动物等, 而大于50 cm才倾向摄食小龙虾和河蚬等底栖动物。这表明淡水石首鱼与中国的白姑鱼(Argyrosomus argentatus)、叫姑鱼(J. fasciatus)相似, 为典型的底栖生物食性, 同属于低级肉食性鱼类[36-38]。淡水石首鱼上颌略长于下颌, 可能更利于摄食底栖生物。一般来说, 摄食软体动物和甲壳类的鱼类具有数量较多和坚硬的臼状咽齿, 如青鱼(Mylopharyngodon piceus)、真鲷(Pagrosomus major)、黑鲷(Acanthopagrus schlegelii)等[22]。Essner等[17]对淡水石首鱼的肠道食物分析表明:小规格个体主要摄食较柔软的食物, 如桡足类、摇蚊幼虫等; 而大规格个体主要摄食鱼类等较硬的食物。本文研究表明淡水石首鱼幼鱼的咽齿呈犬牙状, 其咽齿的形态是否随着鱼体生长和摄食食物种类而变化有待进一步的研究。
淡水石首鱼的胃为卜形, 表明其消化功能主要在胃部; 它具有环形排列的7个幽门盲囊, 这与进化关系较近的叫姑鱼亚科的皮氏叫姑鱼(J. belengerii)相同, 与黄唇鱼(8个)、眼斑拟石首鱼(9个)和双棘黄姑鱼(9个)相近, 而与中国的勒氏短须石首鱼Umbrina russelli(5个)、大黄鱼(14个)、小黄鱼(L. polyaclis)(12~16个)、黑鳃梅童鱼(C. lucidus)(10~14个)、棘头梅童鱼(16~18个)数目差异较大[26]。此外, 淡水石首鱼的胆囊呈卵圆形, 与大黄鱼细长管状的胆囊不同[23]。一般来讲, 凶猛的肉食性鱼类, 如鲈(Perca fluviatilis)、鳜(Siniperca chuatsi)和乌鳢(Channa argus)等肠道很短, 肠道与体长的比例在0.25~0.33之间, 多呈直管状或有1个弯曲[22]。淡水石首鱼的肠体比约为0.68, 且具有2个弯曲, 这与中国石首鱼类的肠道形态特征是一致的[26]。综合分析表明:淡水石首鱼与凶猛的肉食性鱼类具有明显的差异, 这也与其主要摄食底栖无脊椎动物的特性相符。
淡水石首鱼幼鱼具有不同于中国石首鱼类的鳞片分布、特化鳍条丝、黏液孔类型、耳石形态及内部器官构造, 与中国石首鱼亚科的物种更为接近, 具有低级底栖肉食性鱼类的特征, 这与其特定的生态习性和摄食特性等相适应。本研究不仅为中国淡水石首鱼人工驯养提供了重要理论依据, 为中国紫黑翼蚌的规模化寄生繁育奠定重要基础, 也为探讨石首鱼类在海淡水区域地理格局演化提供了基础材料。
| [1] |
Chen Q M. Molecular phylogeny of the Sciaenidae in China[D]. Guangzhou: Jinan University, 2007. [陈泉梅.中国石首鱼科鱼类分子系统学研究[D].广州: 暨南大学, 2007.]
|
| [2] |
Cheng Q T, Zheng B S. Systematic Synopsis of Chinese Fishes[M]. Beijing: Science Press, 1987. [成庆泰, 郑葆珊. 中国鱼类系统检索[M]. 北京: 科学出版社, 1987.]
|
| [3] |
Liu Y J, Liu D H, Tian L X, et al. Effect of dietary protein and lipid levels on growth and body composition of juvenile Sciaenops ocellatus[J]. Journal of Fisheries of China, 2002, 26(3): 242-246. [刘永坚, 刘栋辉, 田丽霞, 等. 饲料蛋白质和能量水平对红姑鱼生长和鱼体组成的影响[J]. 水产学报, 2002, 26(3): 242-246.] |
| [4] |
Barney R L. The distribution of the freshwater sheepshead, Aplodinotus grunniens Rafinesque, in respect to the glacial history of North America[J]. Ecology, 1926, 7(3): 351-364. DOI:10.2307/1929317 |
| [5] |
Boschung H T, Mayden R L. Fishes of Alabama[M]. Washington: Smithsonian Books, 2004.
|
| [6] |
Berner L M. Limnology of the Lower Missouri River[J]. Ecology, 1951, 32(1): 1-12. DOI:10.2307/1930968 |
| [7] |
Zhou L B. Approximate composition of muscles and dressed fish in Aplodinotus grnniens[J]. Fisheries Science, 2005, 24(4): 18-20. [周立斌. 淡水石首鱼的含肉率和肌肉营养成分分析[J]. 水产科学, 2005, 24(4): 24-20.] |
| [8] |
Brady T, Hove M, Nelson C, et al. Suitable host fish species determined for hickorynut and pink heelsplitter[J]. Ellipsaria, 2004, 6(1): 15-16. |
| [9] |
Hua D. Biology, captive propagation, and feasibility of pearl culture in the pink heelsplitter (Potamilus alatus) (Say, 1817) (Bivalvia: Unionidae)[D]. Blacksburg: Virginia Polytechnic Institute and State University, 2005.
|
| [10] |
Sietman B E, Bloodsworth K, Bosman B, et al. Freshwater drum confirmed as a suitable host for Leptodea, Potamilus, and Truncilla species[J]. Ellipsaria, 2009, 11(3): 18-19. |
| [11] |
Wen H B. Fundamental biology characteristics of pink heelsplitter (Potamilus alatus) under artificial breeding condition and its glochidia metamorphosis development[D]. Nanjing: Nanjing Agricultural University, 2016. [闻海波.紫黑翼蚌养殖基础生物学与钩介幼虫变态发育研究[D].南京: 南京农业大学, 2016.]
|
| [12] |
Butler R L, Smith Jr L L. The age and rate ofgrowth of the sheepshead, Aplodinotus Grunniens Rafinesque, in the upper Mississippi River Navigation Pools[J]. Transaction of American Fisheries Society, 1950, 79(1): 43-54. DOI:10.1577/1548-8659(1949)79[43:TAAROG]2.0.CO;2 |
| [13] |
Davis-Foust H L, Bruch R M, Campana S E, et al. Age validation of freshwater drum using bomb radiocarbon[J]. Transaction of American Fisheries Society, 2009, 138: 2385-2396. |
| [14] |
Rypel A L, Bayne D R, Mitchell J B. Growth of freshwater drum from lotic and lentic habits in Alabama[J]. Transaction of American Fisheries Society, 2006, 135(4): 987-997. DOI:10.1577/T05-126.1 |
| [15] |
Swedberg D V, Walburg C H. Spawning and early life history of the freshwater drum in Lewis and Clark Lake, Missouri River[J]. Transaction of American Fisheries Society, 1970, 99(3): 560-570. DOI:10.1577/1548-8659(1970)99<560:SAELHO>2.0.CO;2 |
| [16] |
Rypel A L. Sexual dimorphism in growth of freshwater drum[J]. Southeast Naturalist, 2007, 6(2): 333-342. DOI:10.1656/1528-7092(2007)6[333:SDIGOF]2.0.CO;2 |
| [17] |
Essner R L, Patel R, Reilly S M. Ontogeny of body shape and diet in freshwater drum (Aplodinotus grunniens)[J]. Transaction of Illinois State Academic Science, 2014, 107: 27-30. |
| [18] |
Rypel A L, Mitchell J B. Summer nocturnal patterns in freshwater drum[J]. American Midland Naturalist, 2007, 157(1): 230-234. DOI:10.1674/0003-0031(2007)157[230:SNPIFD]2.0.CO;2 |
| [19] |
Daiber F C. The food and feeding relationships of the freshwater drum Aplodinotus grunniens Rafinesque in western Lake Erie[J]. Ohio Journal of Science, 1952, 52: 43-47. |
| [20] |
Jacquemin S J, Pyron M, Allen M, et al. Wabash River freshwater drum Aplodinotus grunniens diet:effects of body size, sex, and river gradient[J]. Journal of Fish and Wildlife Management, 2014, 5(1): 133-140. DOI:10.3996/032013-JFWM-027R |
| [21] |
Wilson-Rothering A, Marcquenski S, Koenigs R, et al. Temporal variation in viral hemorrhagic septicemia virus antibodies in freshwater drum (Aplodinotus grunniens) indicates cyclic transmission in Lake Winnebago, Wisconsin[J]. Journal of Clinical Microbiology, 2015, 53(9): 2889-2894. DOI:10.1128/JCM.00010-15 |
| [22] |
Su J X. Ichthyology and Marine Fish Culture (the secondary editor)[M]. Beijing: Chinese Agriculture Press, 1993. [苏锦祥. 鱼类学与海水鱼类养殖(第2版)[M]. 北京: 中国农业出版社, 1993.]
|
| [23] |
Meng Q W, Su J X, Li W D. Fish Comparative Anatomy[M]. Beijing: Science Press, 1987. [孟庆闻, 苏锦祥, 李婉端. 鱼类比较解剖学[M]. 北京: 科学出版社, 1987.]
|
| [24] |
Zhao F, Zhang L Z, Zhuang P, et al. Configurational character and morphological structure of digestive system of Siganus canaliculatus[J]. Marine Fisheries, 2008, 30(3): 202-206. [赵峰, 章龙珍, 庄平, 等. 长鳍篮子鱼的外形特征与消化系统结构[J]. 海洋渔业, 2008, 30(3): 202-206. DOI:10.3969/j.issn.1004-2490.2008.03.002] |
| [25] |
Wen H B, Xu H H, Cao Z M, et al. Effects of propagation on filtration rate and variation of gill microstructure in wrinkle comb pearl mussel Cristaria plicata[J]. Chinese Journal of Zoology, 2011, 46(4): 84-91. [闻海波, 许洪洪, 曹哲明, 等. 孕育对褶纹冠蚌滤食率的影响及鳃微结构变化[J]. 动物学杂志, 2011, 46(4): 84-91.] |
| [26] |
Zhu Y D, Luo Y L, Wu H L. A Study on the Classification of the Sciaenoid Fishes of China, with Description of New Genera and Species[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1963. [朱元鼎, 罗云林, 伍汉霖. 中国石首鱼类分类系统的研究和新属新种的叙述[M]. 上海: 上海科学技术出版社, 1963.]
|
| [27] |
Zhang G H. Otolith morphology and elemental composition with the application in stock discrimination of fish[D]. Wuhan: Institute of Hydrobiology, Chinese Academy of Sciences, 2000. [张国华.耳石形态和元素组成及其与鱼类群体识别的研究[D].武汉: 中国科学院水生生物研究所, 2000.]
|
| [28] |
Ou Y J, Liao R, Li J E, et al. Comparing of morphological charateristics of otolith in four Sciaenid fishes[J]. Journal of South China Agricultural University, 2012, 33(2): 203-210. [区又君, 廖锐, 李加儿, 等. 4种石首鱼耳石形态特征的比较[J]. 华南农业大学学报, 2012, 33(2): 203-210. DOI:10.3969/j.issn.1001-411X.2012.02.018] |
| [29] |
Funk J L. Movements of stream fishes in Missouri[J]. Transaction of American Fisheries Society, 1957, 85(1): 39-57. DOI:10.1577/1548-8659(1955)85[39:MOSFIM]2.0.CO;2 |
| [30] |
Gaemer P A M. Taxonomic position of Cichlidae (Pisces, Perciformes) as demonstrated by the morphology of their otoliths[J]. Netherlands Journal of Zoology, 1984, 34(4): 566-595. |
| [31] |
Zhang G H, Dan S G, Miao Z G, et al. Otolith morphology of six cyprinid species with the use in species and stock discriminations[J]. Acta Hydrobiologica Sinica, 1999, 23(6): 683-688. [张国华, 但胜国, 苗志国, 等. 六种鲤科鱼类耳石形态以及在种类和种群识别中的应用[J]. 水生生物学报, 1999, 23(6): 683-688.] |
| [32] |
Gou H Y, Tang W Q, Wei K, et al. Morphological characters of the sagittal otoliths of the fishes of the genus Coilia from China[J]. Chinese Journal of Zoology, 2007, 42(1): 39-47. [郭弘艺, 唐文乔, 魏凯, 等. 中国鲚属鱼类的矢耳石形态特征[J]. 动物学杂志, 2007, 42(1): 39-47.] |
| [33] |
Jordan D S, Gilbert C H. Synopsis of the fishes of North America[J]. Bulletin of the United States National Museum, 1883, 3(16): 566-582. |
| [34] |
Xue Y, Jin X S, Zhang B, et al. Feeding habits of three sciaenid fishes in the southern Yellow Sea[J]. Journal of Fisheries of China, 2005, 29(2): 178-187. [薛莹, 金显仕, 张波, 等. 南黄海三种石首鱼类的食性[J]. 水产学报, 2005, 29(2): 178-187.] |
| [35] |
Li M F. Research progress on biology of mandarin fish[J]. Modern Fisheries Information, 2010, 25(7): 16-21. [李明锋. 鳜鱼生物学研究进展[J]. 现代渔业信息, 2010, 25(7): 16-21. DOI:10.3969/j.issn.1004-8340.2010.07.005] |
| [36] |
Wang J, Su Y Q, Liu J Y, et al. The feeding habits of five Sciaenids fishes in Luoyuan Bay[J]. Journal of Xiamen Fisheries College, 1994, 16(2): 34-39. [王军, 苏永全, 柳建英, 等. 罗源湾五种石首鱼类的食性研究[J]. 厦门水产学院学报, 1994, 16(2): 34-39.] |
| [37] |
Zhang B, Tang Q S. Study of trophic level of important resources species at high trophic levels in the Bohai Sea, Yellow Sea and East China Sea[J]. Advances in Marine Science, 2004, 22(4): 393-404. [张波, 唐启升. 渤、黄、东海高营养层次重要生物资源种类的营养级研究[J]. 海洋科学进展, 2004, 22(4): 393-404. DOI:10.3969/j.issn.1671-6647.2004.04.001] |
| [38] |
Zhang B, Jin X S, Dai F Q. Feeding habits of the two sciaenid fishes near the Changjiang estuary[J]. Acta Zoologica Sinica, 2008, 54(2): 209-217. [张波, 金显仕, 戴芳群. 长江口两种重要石首鱼类的摄食习性[J]. 动物学报, 2008, 54(2): 209-217.] |
 2018, Vol. 25
2018, Vol. 25


