鳃是鱼类的主要呼吸器官, 除了承担鱼类的呼吸主要功能外, 还兼具氨氮排泄、离子平衡以及渗透压调节等多种生理功能[1-3]。为了实现这些复杂的生理功能, 鱼鳃进化出了复杂而又精细的形态结构, 而且这些结构会随着水环境中水流、温度、离子浓度以及盐度等条件的改变发生响应的变化[4-6]。鱼鳃的形态结构特征与复杂生理功能之间的关系, 及其对环境变化的适应性受到国内外广泛的关注[1, 7-10]。一方面, 由于鱼类物种的多样性及其生活环境的复杂性, 鱼鳃的结构和功能的研究仍是一项长期、复杂而艰巨的任务; 另一方面, 鱼鳃精细结构对环境变化极为敏感, 通过探索鱼鳃结构的改变和相应生理功能调整与鱼类生存环境变化之间的关系已经成为一个重要的研究领域[1, 11]。例如, 鱼类鳃表面扁平上皮细胞表面的微嵴[12]和线粒体密集细胞亚型的功能特性与水环境的适应性变化就是这一领域研究的热点[13-14]。
怒江裂腹鱼(Schizothorax nukiangensis), 隶属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、裂腹鱼亚科(Schizothoracinae)、裂腹鱼属(Schizothorax), 仅分布于中国怒江中上游(萨尔温江水系), 是怒江特有鱼类和珍稀鱼类[15]。目前, 有关怒江裂腹鱼研究报道较少, 仅涉及怒江裂腹鱼营养级、基因与适应性相关分析[16]、遗传结构变化[15, 17]、线粒体基因表达的差异性[18]等少量研究。怒江裂腹鱼喜栖息于江河急流处, 以刮食水底石头上的藻类及有机碎屑为生。随着怒江上游未来梯级水电开发, 怒江裂腹鱼栖息地的水温、急流等环境因子将发生剧烈变化, 可能导致未来怒江裂腹鱼的灭绝, 亟须加强对怒江裂腹鱼保护的基础生物学的研究。目前, 尚未见关于怒江裂腹鱼鳃的结构及其与环境适应性结构特征的报道。本文通过光镜、扫描电镜以及透射电镜, 研究了怒江裂腹鱼鳃的显微及超微结构, 以期丰富怒江裂腹鱼的基础生物学资料, 并为阐明鱼类鳃的结构特征与其生活习性之间的关系提供参考。
1 材料与方法 1.1 实验鱼怒江裂腹鱼于2017年5月, 采自怒江丙中洛江段, 共10尾, 体长为(6.04±1.99) cm, 体重为(4.97±4.40) g。
1.2 组织切片活体取左侧第二对鳃弓鳃小块, 用波恩氏液固定24 h后用70%乙醇冲洗, 然后经70%、80%、90%、95%、100%乙醇逐级脱水, 二甲苯透明, 石蜡包埋, 组织切片厚度为6 μm, 经苏木精–伊红染色, 中性树胶封片, 在Olympus-BX51生物显微镜下观察, DP-72数码CCD拍照。
1.3 扫面电镜制样将活体怒江裂腹鱼取出完整的第二对鳃, 将其平分为1~2 cm3的小块, 用2.5%戊二醛(pH 7.4)在4℃下对鳃固定12 h。固定好的鳃样品用磷酸缓冲溶液冲洗3次, 经1%锇酸固定1 h, 再用磷酸缓冲溶液冲洗3次, 各级乙醇脱水, 醋酸异戊酯置换, 常规临界点干燥, 真空离子镀膜, 在Hitachi S-4800型扫描电镜下观察、拍照。
1.4 透射电镜样品制备从活体怒江裂腹鱼取出完整的第二对鳃, 经2.5%戊二醛固定, 0.1 mol/L磷酸缓冲液(pH 7.4)冲洗, 经1%的锇酸固定后, 再用0.1 mol/L磷酸缓冲溶液(pH 7.4)冲洗, 然后再经梯度酒精(30%、50%、70%、85%、95%、100%)脱水, 包埋、定位、超薄切片, 以柠檬酸铅和醋酸铀双重染色, 在Phillips TECNAI10型透射电子显微镜下观察、拍照。
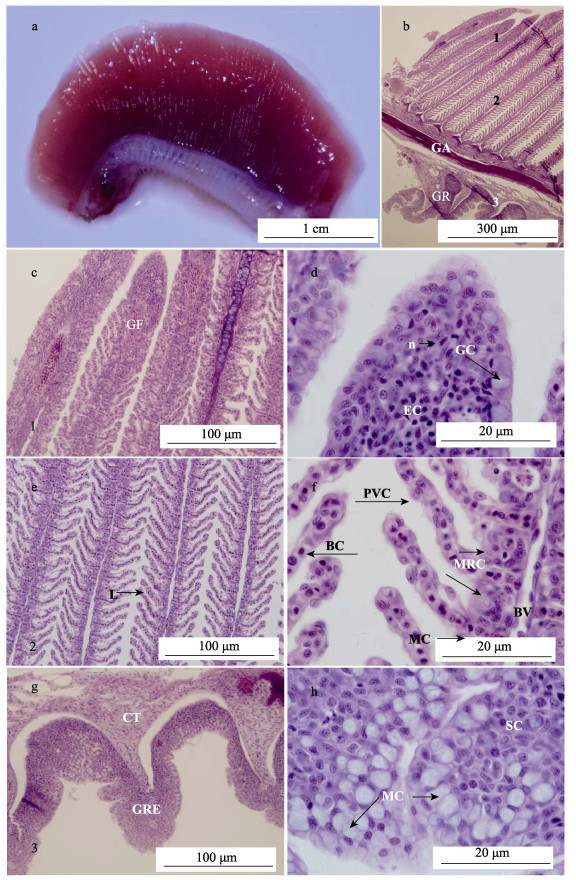
2 结果与分析 2.1 显微组织结构怒江裂腹鱼鳃的结构与其他硬骨鱼相似, 具有4对完整的鳃裂(gill cleft, GC)分别位于咽部后端两侧。鳃主要由鳃丝(gill filament, GF)、鳃弓(gill arch, GA)和鳃耙(gill raker, GR)三部分构成。活体怒江裂腹鱼的鳃丝呈鲜红色、长丝状, 整齐地排列于鳃弓的外侧。鳃耙和鳃弓呈乳白色, 鳃耙位于鳃弓的内侧, 相邻鳃耙之间的间隙清晰(图 1a)。
|
图 1 怒江裂腹鱼鳃的光学显微镜图 a:活体鳃的整体; b:切片鳃整体; c:鳃丝顶端(图 1b中1位置); d:鳃丝顶端局部放大; e:鳃丝中部(图 1b中2位置); f:鳃丝中部局部放大; g:鳃耙顶端(图 1b中3位置); h:鳃耙上皮局部放大. BC:血细胞; BV:血管道; CT:结缔组织; GA:鳃弓; GC:杯状细胞; GF:鳃丝; GR:鳃耙; GRE:鳃耙上皮组织; L:鳃小片; MC:黏液细胞; MRC:线粒体密集细胞; PVC:扁平上皮细胞; SC:表层细胞. Fig.1 Optical microscope images of the gill in Schizothorax nukiangensis a: gill; b: gill; c: the top part of gill filament; d: the top part of gill filament; e: the middle part of gill filament; f: the middle part of gill filament; g: the top part of gill raker; h: gill raker epithelium. BC: blood cells; BV: blood vessels; CT: connective tissue; GA: gill arch; GC: goblet cell; GF: gill filament; GR: gill raker; GRE: gill raker epithelium; L: lamellae; MC: mucus cell; MRC: mitochondrial rich cell; PVC: pavement cell; SC: surface cell. |
经组织切片观察发现, 鳃丝、鳃弓和鳃耙具有不同的组织结构和细胞类型。鳃丝的顶端呈柳叶状, 无鳃小片分页, 主要由杯状细胞(goblet cell, GC)和上皮细胞(epithelium cell, EC)组成(图 1c, 图 1d)。杯状细胞主要分布于鳃丝顶部上皮组织表层, 外形呈高脚杯状, 细胞质着色浅, 呈淡蓝色。杯状细胞的上部为原生质薄壁, 其中含有分泌的颗粒, 基部为细胞核。上皮细胞在鳃丝顶端的内外均有分布, 外形多样, 主要呈扁平、圆形或椭圆形, 细胞核较大, 位于细胞中央(图 1d)。
鳃丝中部的主要细胞类型有扁平上皮细胞(pavement cell, PVC)、线粒体密集细胞(mitochondrial rich cell, MRC)、黏液细胞(mucus cell, MC)以及红细胞(red blood cell, RBC)(图 1e, 图 1f)。扁平上皮细胞呈扁平状, 具有较大的细胞核, 细胞直径范围为5.50~12.76 μm, 直径为(9.76± 1.32) μm, 广泛分布于鳃丝上皮表面。线粒体密集细胞呈圆形或卵圆形, 细胞核体积较大, 直径范围为7.63~12.65 μm, 直径为(10.16±1.44) μm, 主要分布在鳃小片基部。黏液细胞呈圆形或椭圆形, 细胞直径范围为5.32~10.66 μm, 直径为(7.76± 1.34) μm, 在鳃丝上皮均有分布。血细胞呈椭圆形和圆形, 细胞核靠近细胞中央, 细胞直径范围为3.33~4.55 μm, 直径为(3.97±0.44) μm, 位于基底膜内侧血管道中(图 1f)。
鳃弓位于鳃丝和鳃耙中间。鳃弓内骨骼呈圆弧形, 其位置靠近鳃弓背面(图 1a, 图 1b)。鳃耙位于鳃弓内缘, 呈锯齿状, 排列整齐(图 1a, 图 1b)。从图 1g中看出鳃耙主要由上皮组织和结缔组织(connective tissue, CT)组成。上皮组织主要存在上皮细胞和黏液细胞两种类型细胞。鳃耙上皮细胞和黏液细胞的细胞形态与鳃丝上皮基本一致, 不同之处在于鳃耙上皮细胞与黏液细胞的更加密集(图 1h)。
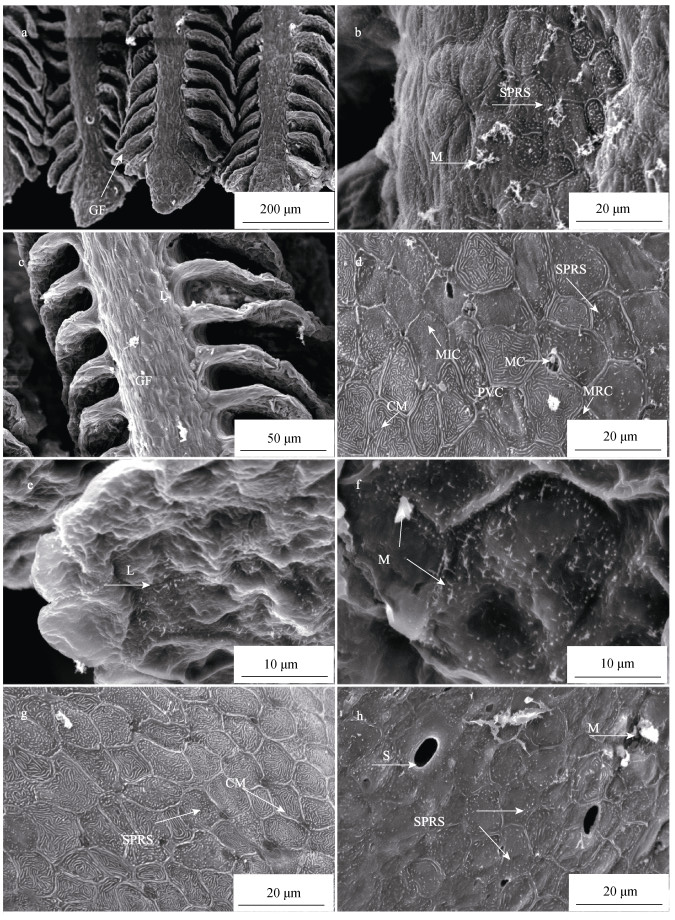
2.2 超微结构 2.2.1 鱼鳃表面超微结构扫描电镜成像表明, 怒江裂腹鱼鳃丝表面被大量的扁平上皮细胞、线粒体密集细胞以及黏液细胞所覆盖(图 2a, 图 2b, 图 2c, 图 2d)。其中扁平上皮细胞占整个鳃丝表皮的90%以上, 而线粒体密集细胞和黏液细胞占比不到10%。在鳃丝、鳃耙以及鳃弓的表面均有孔洞的出现, 而且孔洞主要呈椭圆形, 直径范围在4.35~9.33 μm, 孔径为(6.35±1.71) μm。在鳃表面相邻上皮细胞之间存在凹陷的坑。其中鳃耙表面的坑比鳃丝和鳃弓表面的坑深(图 2d, 图 2g, 图 2h)。
|
图 2 怒江裂腹鱼鳃的扫描电镜图 a:鳃丝顶端; b:鳃丝顶端局部表面放大; c:鳃丝中部; d:鳃丝中部局部表面放大e:鳃小片; f:鳃小片局部表面放大; g:鳃耙表面; h:鳃弓表面. CM:环形微嵴; EC:表皮细胞; M:黏液; MC:黏液细胞; MIC:微绒毛; S:气孔; SPRS:星点棒状. Fig.2 Scanning electron microscope images of the gill in Schizothorax nukiangensis a: the top part of gill filaments; b: surface ultrastructure of the top part of gill filaments; c: the middle part of gill filaments; d: surface architecture of the middle part of gill filaments; e: inside of lamellae; f: inside of lamellae; g: surface ultrastructure of gill raker; h: surface ultrastructure of gill arch. CM: circulars microridged; EC: epithelium; M: mucus; MC: mucus cell; MIC: microvilli; S: stomata; SPRS: star point rod-shaped. |
鳃丝表面的扁平上皮细胞的纹路形态主要有3种类型, 分别是:环形微嵴(circulars microridged)、星点棒状(star point rod-shaped)和微绒毛(microvilli)。扁平上皮细胞的环形微嵴形成类似迷宫的纹路, 具有较深的沟。扁平上皮细胞轮廓形状各异以多边形为主, 环形微嵴细胞轮廓直径范围为5.11~9.38 μm、星点棒状细胞轮廓直径范围为6.25~10.57 μm、微绒毛细胞轮廓直径范围为6.89~9.57 μm。线粒体密集细胞顶端膜表面具有短的微绒毛, 细胞表面凹陷形成小窝, 周围被扁平上皮细胞所环绕。黏液细胞开口于相邻扁平上皮细胞之间的界线处, 在黏液细胞表面能观察到分泌的黏液(图 2b, 图 2d)。
鳃小片表面被大量的上皮细胞所覆盖, 表面有大量黏液附着(图 2c, 图 2e)鳃小片表面的上皮细胞表面有可见微绒毛, 上皮细胞表面凹陷, 形成了类似丘陵的小山, 增加了鳃小片的表面积, 细胞轮廓直径范围: 6.03~15.03 μm (图 2e, 图 2f)。
鳃弓表面比较平滑, 被大量的具有星点棒状的扁平上皮细胞所覆盖。带有星点棒状的上皮细胞的棒状较短而且稀疏, 细胞轮廓清晰可见, 但不规则, 主要呈椭圆形、四边形以及五边形等多样形状, 星点棒状细胞轮廓直径范围: 4.93~11.96 μm (图 2h)。
鳃耙的表面主要被两类表面纹路不同的扁平上皮细胞所覆盖, 即环形微嵴和星点棒状。环形微嵴的扁平上皮细胞轮廓清楚, 呈圆形、椭圆形以及多样多边形, 轮廓直径范围为3.85~13.46 μm, 与鳃丝表面具有环形微嵴的扁平上皮细胞相比微嵴较密。星点棒状的扁平上皮细胞轮廓清晰, 呈圆形、三角形以及不规则的多边形, 轮廓直径范围为4.66~15.49 μm, 与鳃丝表面具有星点棒状的表皮上皮细胞相比棒状较粗, 而相对鳃弓表面的扁平上皮细胞的棒状较为密集(图 2g)。
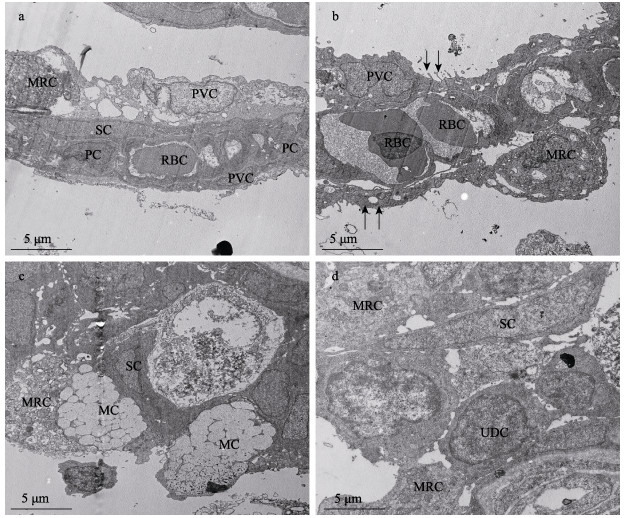
2.2.2 鳃小片内部的超微结构透射电镜成像表明, 怒江裂腹鱼鳃小片由扁平上皮细胞、线粒体密集细胞、支持细胞(support cell, SC)、柱细胞(pillar cell, PC)、黏液细胞、未分化细胞(undifferentiated cell, UDC)、血管内壁细胞(vascular wall cell, VWC)以及血红细胞等多种细胞构成。
扁平上皮细胞覆盖于整个鳃小片的表面, 细胞呈扁平状, 具有较大的细胞核, 细胞质内有高尔基体、内质网和少量线粒体和溶酶体。分布于鳃小片内外两侧的扁平上皮细胞的形态结构略有不同, 主要区别在于细胞表面的指状凸起和细胞核的形态(图 3a, 图 3b)。内侧扁平上皮细胞表面微嵴的数量较少、凸起较长, 细胞核较大、不规则; 外侧扁平上皮细胞表面的微嵴数量多、凸起较短, 细胞核较小, 呈长椭圆形。
|
图 3 怒江裂腹鱼鳃小片内部的超微结构 a:鳃小片顶端; b:鳃小片中部; c:鳃小片基部; d:鳃小片基部. PVC:扁平上皮细胞; MRC:线粒体密集细胞; SC:支持细胞; PC:柱细胞; MC:黏液细胞; UDC:未分化细胞; RBC:红细胞. Fig.3 Ultrastructure of the gill lamellae in Schizothorax nukiangensis a: the top part of lamellae; b: the middle part of lamellae; c: the base of lamellae; d: the base of lamellae. PVC: pavement cell; MRC: mitochondrial rich cell; SC: support cell; PC: pillar cell; MC: mucus cell; UDC: undifferentiated cell; RBC: red blood cell. |
线粒体密集细胞主要分布于鳃小片基部, 细胞质内有大量的线粒体和内质网。细胞内的线粒体呈现多种形状, 包括圆形、长条形和弯曲的条形, 但圆形的线粒体是主要的类型。细胞的细胞核较小, 呈圆形或不规则圆形, 分布于细胞的一端。线粒体密集细胞与外界环境接触的表面可见少量的微绒毛, 但绒毛较短, 顶端膜开口直径为2~5 μm (图 3a, 图 3b, 图 3c)。
鳃小片的黏液细胞主要分布于鳃小片的基部, 周围一般有线粒体密集细胞相伴。细胞呈椭圆形, 内部充满了许多电子密度很低的黏液泡(图 3c)。细胞核较小, 细胞器少, 主要有少量内质网和线粒体, 均被大量黏液泡挤到了细胞的基部。成熟的黏液细胞顶端有开口, 分泌出大量的黏液状分泌物。
鳃小片中间大量分布有微血管(毛细血管)系统, 主要由血管内皮细胞、血红细胞、血管壁以及外部的柱细胞和支持细胞构成(图 3a, 图 3b)。鳃小片顶端的微血管腔小, 血管壁薄, 只能容纳单个红血细胞通过。鳃小片中部和基部的微血管腔逐渐增大, 血管壁增厚, 可容纳多个血红细胞同时通过。微血管腔周围分布有柱细胞和长条状的支持细胞, 对血管系统起支撑作用。柱细胞呈圆柱形, 细胞核较大, 细胞质电子密度较大, 间隔分布在血管腔之间。支持细胞呈长条形或三角形, 广泛分布于鳃小片的血管腔、基膜和软骨的周围。支持细胞的细胞核很大, 呈长条形或三角形, 占据整个细胞体积的80%以上(图 3a, 图 3c, 图 3d)。
3 讨论 3.1 怒江裂腹鱼鳃扁平上皮细胞形态结构与其生活习性关系扁平上皮细胞是鳃上皮组织重要的细胞类型之一, 覆盖鱼鳃表面90%的面积, 具有保护、离子吸收、气体交换以及酸碱平衡调节等功能[3, 26]。鱼鳃的扁平上皮细胞的形态和结构在不同鱼类种类和生活环境一般差异较大, 即使在同一尾鱼鳃部的不同位置也可能存在较大差异[27]。怒江裂腹鱼鳃丝、鳃弓和鳃耙表面的扁平上皮细胞的形态、大小以及其表面的纹路形状、密集程度等有明显不同, 此结果与齐口裂腹鱼(Schizothorax prenanti)[19]、黄颡鱼(Pelteobagrus fulvidraco)[19]的鳃上皮扁平细胞的研究结果基本一致(表 1)。已有学者研究表明, 鳃上皮细胞形态的差异与鱼类生活的习性密切相关[28]。怒江裂腹鱼鳃丝表面的扁平上皮细胞有较深的微嵴以及较长的微绒毛。一方面, 细胞表面较深的微嵴可以缓冲和分散湍急水流对鳃的冲击力, 可能是为保护鳃免受急流的机械损伤; 另一方面, 扁平上皮细胞表面的微嵴极大地增加了鱼鳃的表面积, 增强了怒江裂腹鱼对外界环境变化的敏感度[22]。鳃小片扁平上皮细胞形成凹凸的丘陵表面以及细胞表面的纤维状的绒毛大大增加鳃小片的呼吸表面积, 促进水分子的机械附着力, 提高了鱼鳃在急流中气体交换率[3]。同时, 鳃耙上的扁平上皮细胞密集的微嵴以及粗壮的棒状特征, 增加阻碍水的能力, 有利于在湍急水流中摄食时反转水流方向, 将食物送至咽腔[29-30]。扁平上皮细胞在怒江裂腹鱼鳃丝、鳃耙以及鳃小片上, 具有明显不同的形态结构, 验证了怒江裂腹鱼鳃上皮细胞的形态结构变化与其生活在急流中的生活习性相适应。
|
|
表 1 几种鱼类鳃的扁平上皮细胞形态结构的比较 Tab.1 Morphological structure comparison of pavement cells (PVC) in the gill of different fish species |
电子显微镜成像技术对鱼鳃超微结构的研究表明, 鱼鳃的线粒体密集细胞存在多种类[24-25, 31]。Pisam等[25]依据线粒体密集细胞在鳃中的分布和细胞质的电子密度, 将虹鳉鱼鳃的线粒体密集细胞分为α和β两种亚型。罗芬等[23]根据黄颡鱼鳃线粒体密集细胞的电子密度和线粒体形态等特征将其分为Ⅰ和Ⅱ两个亚型。但由于Ⅰ型和α型线粒体密集细胞在电子密度及线粒体形态结构特征基本一致(表 2), 因此可将Ⅰ型和α型归为同一类型, 而Ⅱ型和β型归为另一类型。此外, Lee等[24]根据线粒体密集细胞顶端膜开口形态, 将尼罗罗非鱼鳃线粒体密集细胞顶端膜开口分为深孔型(deep-hole)、浅滩型(shallow-basin)、波纹型(wavy-convex) 3个亚型。研究已证实, 鱼类鳃中α型顶端膜开口既有浅滩型, 又有突起型, 甚至广盐性鱼类从淡水环境进入海水α型顶端膜开口出现深孔型[25, 32]。由于水环境以及鱼类种类间的差异, 目前, 针对α型(Ⅰ型)、β型(Ⅱ型)线粒体密集细胞与线粒体细胞膜开口形态之间的对应关系还没有明确[33]。本研究中怒江裂腹鱼鳃内的线粒体密集细胞的电子密度和线粒体结构没有明显的分化和区别, 其细胞的形态呈卵圆形, 体积较大, 顶端膜表面凹陷形成小窝, 主要分布于鳃小片基部, 这与虹鳉(Lebistes reticulatus)鱼鳃中β或Ⅱ型线粒体密集细胞以及尼罗罗非鱼(Oreochromis niloticus)鳃中浅滩型线粒体密集细胞的研究结果一致(表 2)。在怒江裂腹鱼鳃中没有明显观察到α型、Ⅰ型以及深孔型线粒体密集细胞, 这可能是由于不同亚型的线粒体密集细胞在鱼鳃不同的部位和不同的水环境中执行不同的生理功能所致。
|
|
表 2 几种鱼类鳃的线粒体密集细胞的形态结构特征的比较 Tab.2 Morphological structure comparison of mitochondrial rich cells (MRC) in the gill of different fish species |
线粒体密集细胞不仅作为离子交换的主要场所, 而且在渗透压调节和能量代谢方面发挥着重要功能[3, 12]。已有研究表明, α型(Ⅰ型)顶端膜口呈突起型和深孔型的线粒体密集细胞, 在淡水鱼鳃中主要负责Na+离子转运, 而在海水鱼鳃中主要负责Cl–的吸收和外排[26, 32, 34]。在淡水鱼鳃中β型(Ⅱ型)顶端膜口呈浅滩型的线粒体密集细胞主要负责吸收Ca2+[6, 34], 而在海水中广盐性鱼类鳃中β型线粒体密集细胞会随盐度的升高逐渐退化消失[25]。本研究发现, 怒江裂腹鱼鳃线粒体密集细胞主要属于β型(Ⅱ型), 且顶端膜口呈浅滩型的细胞, 表明其主要功能可能是吸收Ca2+, 这与怒江裂腹鱼在淡水河流中长期生活相适应。此外, 我们发现怒江裂腹鱼鳃线粒体密集细胞与中华鲟和尼罗罗非鱼主要不同之处在于后面两者线粒体密集细胞顶端膜口除了浅滩型外, 还有深孔型和突起型(表 2), 这可能与怒江裂腹鱼属于纯淡水鱼类, 而后两者属于广盐性鱼类有关。线粒体是线粒体密集细胞能正常进行离子交换和能量代谢的重要保障, 线粒体的大小、数量决定了离子交换和能量代谢的强弱[23, 35]。本研究发现, 怒江裂腹鱼鳃中大量圆形的线粒体, 与黄颡鱼的Ⅱ型线粒体密集细胞研究基本一致(表 2), 提示该细胞具有高的离子转运和能量代谢能力。怒江裂腹鱼属于冷水性淡水鱼, 喜好在急流中活动和摄食, 鳃中大量的线粒体可为其在淡水中进行离子交换以及摄食活动过程中大量耗能提供保障。
| [1] |
Schnell S, Stott L C, Hogstrand C, et al. Procedures for the reconstruction, primary culture and experimental use of rainbow trout gill epithelia[J]. Nature Protocols, 2016, 11(3): 490-498. DOI:10.1038/nprot.2016.029 |
| [2] |
Maina J N. Structure, function and evolution of the gas exchangers:comparative perspectives[J]. Journal of Anatomy, 2002, 201(4): 281-304. DOI:10.1046/j.1469-7580.2002.00099.x |
| [3] |
Evans D H, Piermarini P M, Choe K P. The multifunctional fish gill:dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous waste[J]. Physiological Reviews, 2005, 85(1): 97-177. DOI:10.1152/physrev.00050.2003 |
| [4] |
Hofer R, Kühnl M, Psenner R. Seasonal changes of the gill epithelia of Arctic char (Salvelinus alpinus) from a high mountain lake[J]. Aquatic Sciences, 2000, 62(4): 297-307. DOI:10.1007/PL00001336 |
| [5] |
Uchida K, Kaneko T, Miyazaki H, et al. Excellent salinity tolerance of Mozambique Tilapia (Oreochromis mossambicus):elevated chloride cell activity in the branchial and opercular epithelia of the fish adapted to concentrated seawater[J]. Zoological Science, 2000, 17(2): 149-160. DOI:10.2108/zsj.17.149 |
| [6] |
Tsai J C, Hwang P P. Effects of wheat germ agglutinin and colchicine on microtubules of the mitochondria-rich cells and Ca2+ uptake in tilapia (Oreochromis mossambicus) larvae[J]. Journal of Experimental Biology, 1998, 201(15): 2263-2271. |
| [7] |
Zydlewski J, Mccormick S D. Developmental and environmental regulation of chloride cells in young American shad, Alosa sapidissima[J]. Journal of Experimental Zoology, 2010, 290(2): 73-87. |
| [8] |
Fernandes M N, Perna S A, Moron S E. Chloride cell apical surface changes in gill epithelia of the armoured catfish Hypostomus plecostomus during exposure to distilled water[J]. Journal of Fish Biology, 2010, 52(4): 844-849. |
| [9] |
Li J E, Xu X J, Qu Y J, et al. Study on the gill structure and the respiratory area of chu's croaker Nibea coibor[J]. South China Fisheries Science, 2008, 4(1): 22-27. [李加儿, 许晓娟, 区又君, 等. 浅色黄姑鱼鳃结构及其呼吸面积的研究[J]. 南方水产科学, 2008, 4(1): 22-27. DOI:10.3969/j.issn.2095-0780.2008.01.004] |
| [10] |
Zhao F, Yang G, Zhang T, et al. Characters of morphology, distribution and quantity of branchial chloride cells of juvenile Acipenser sinensis acclimated in freshwater and brackish water[J]. Marine Fisheries, 2016, 38(1): 35-41. [赵峰, 杨刚, 张涛, 等. 淡水和半咸水条件下中华鲟幼鱼鳃上皮泌氯细胞的形态特征与数量分布[J]. 海洋渔业, 2016, 38(1): 35-41. DOI:10.3969/j.issn.1004-2490.2016.01.005] |
| [11] |
Bury N R, Grosell M. Waterborne iron acquisition by a freshwater teleost fish, zebrafish Danio rerio[J]. Journal of Experimental Biology, 2003, 206(19): 3529-3535. DOI:10.1242/jeb.00584 |
| [12] |
Goss G G, Perry S F, Fryer J N, et al. Gill morphology and acid-base regulation in freshwater fishes[J]. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 1998, 119(1): 107-115. DOI:10.1016/S1095-6433(97)00401-7 |
| [13] |
Wilson J M, Laurent P. Fish gill morphology:inside out[J]. Journal of Experimental Zoology, 2002, 293(3): 192-213. DOI:10.1002/(ISSN)1097-010X |
| [14] |
Perry S F. The chloride cell:structure and function in the gills of freshwater fishes[J]. Annual Review of Physiology, 1997, 59(59): 325-347. |
| [15] |
Yue X J, Wang D Q, Liu S P, et al. Population genetic structure of three schizothoracins from Nujiang River in southwestern China[J]. Acta Ecologica Sinica, 2010, 30(23): 6418-6429. [岳兴建, 汪登强, 刘绍平, 等. 怒江三种裂腹鱼属鱼类种群遗传结构[J]. 生态学报, 2010, 30(23): 6418-6429.] |
| [16] |
Yu M, Zhang D, Hu P, et al. Divergent adaptation to Qinghai-Tibetan Plateau implicated from transciptome study of Gymnocypris dobula and Schizothorax nukiangensis[J]. Biochemical Systematics and Ecology, 2017, 71(1): 97-105. |
| [17] |
Chen W, Du K, He S. Genetic structure and historical demography of Schizothorax nukiangensis (Cyprinidae) in continuous habitat[J]. Ecology and Evolution, 2015, 5(4): 984-995. DOI:10.1002/ece3.2015.5.issue-4 |
| [18] |
Li W, Liu Y, Xu Q. Complete mitochondrial genome of Schizothorax nukiangensis Tsao (Cyprinidae:Schizothorax)[J]. Mitochondrial DNA Part A, 2016, 27(5): 3549-3550. DOI:10.3109/19401736.2015.1074212 |
| [19] |
Fang J, Pan K C, Deng T H. A scanning electron microscopical observation of the gill of Schizothorax prenanti (Schizothorax)[J]. Journal of Sichuan Agricultural University, 2004, 22(2): 196-198. [方静, 潘康成, 邓天怀. 齐口裂腹鱼鳃表面结构扫描电镜观察[J]. 四川农业大学学报, 2004, 22(2): 196-198. DOI:10.3969/j.issn.1000-2650.2004.02.025] |
| [20] |
Guo S H, Wang L C. A scanning electron microscopical study of the gill surface of the comon carp, Cyprinus carpio[J]. Acta Hydrobiologica Sinica, 1988, 12(1): 54-58. [郭淑华, 王良臣. 鲤鳃表面结构扫描电镜研究[J]. 水生生物学报, 1988, 12(1): 54-58.] |
| [21] |
Luo F, Chen L Q, Kang B. Observation of uitrastructure of the gill filament in Juvenile spinibarbus sinensis with scanning electrominc microscope[J]. Journal of Sichuan Agricultural University, 2011, 29(4): 555-559. [罗芬, 陈礼强, 康斌. 中华倒刺鲃幼鱼鳃的扫描电镜观察[J]. 四川农业大学学报, 2011, 29(4): 555-559. DOI:10.3969/j.issn.1000-2650.2011.04.022] |
| [22] |
Leguen I. Gills of the medaka (Oryzias latipes):a scanning electron microscopy study[J]. Journal of Morphology, 2018, 279(1): 97-108. DOI:10.1002/jmor.v279.1 |
| [23] |
Luo F, Chen L Q, Kang B. Fine structure of gills in teleost (Pelteobagrus fulvidarco)[J]. Oceanologia et Limnologia Sinica, 2011, 42(4): 488-494. [罗芬, 陈礼强, 康斌. 黄颡鱼(Pelteobagrus fulvidraco)鳃的超微结构研究[J]. 海洋与湖沼, 2011, 42(4): 488-494.] |
| [24] |
Lee T H, Hwang P P, Lin H C, et al. Mitochondria-rich cells in the branchial epithelium of the teleost, Oreochromis mossambicus, acclimated to various hypotonic environments[J]. Fish Physiology, 1996, 15(6): 513-523. |
| [25] |
Pisam M, Caroff A, Rambourg A. Two types of chloride cell in the gill epithelium of a freshwater-adapted euryhaline fish, Lebistes reticulatus:their modifications during adaptation to seawater[J]. American Journal of Anatomy, 1987, 179(1): 40-50. DOI:10.1002/(ISSN)1553-0795 |
| [26] |
Wilson J M, Laurent P, Tufts B L, et al. NaCl uptake by the branchial epithelium in freshwater teleost fish:an immunological approach to ion-transport protein localization[J]. Journal of Experimental Biology, 2000, 203(15): 2279-2296. |
| [27] |
Long H, Chen J W, Fu Y S, et al. Microscopic observation in gill of six species of fish[J]. Journal of Hydroecology, 2008, 28(2): 39-40. [龙华, 陈建武, 付元帅, 等. 6种鱼鳃的显微观察[J]. 水生态学杂志, 2008, 28(2): 39-40.] |
| [28] |
Wright D E. Morphology of the gill epithelium of the Lungfish, Lepidosiren paradoxa[J]. Cell and Tissue Research, 1974, 153(3): 365-381. |
| [29] |
Kumari U, Yashpal M, Mittal S, et al. Surface ultrastructure of gill arches and gill rakers in relation to feeding of an Indian major carp, Cirrhinus mrigala[J]. Tissue Cell, 2009, 41(5): 318-325. DOI:10.1016/j.tice.2009.01.003 |
| [30] |
Elsheikh E H. Scanning electron microscopic studies of gill arches and rakers in relation to feeding habits of some fresh water fishes[J]. The Journal of Basic & Applied Zoology, 2013, 66(3): 121-130. |
| [31] |
Goss G G, Adamia S, Galvez F. Peanut lectin binds to a subpopulation of mitochondria-rich cells in the rainbow trout gill epithelium[J]. Ameican Journal of Physiology, 2001, 281(5): 1718-1725. |
| [32] |
Pisam M, Massa F, Jammet C, et al. Chronology of the appearance of β, A, and α mitochondria-rich cells in the gill epithelium during ontogenesis of the brown trout (Salmo trutta)[J]. The Anatomical Record, 2000, 259(3): 301-311. DOI:10.1002/(ISSN)1097-0185 |
| [33] |
Pisam M, Le M C, Auperin B, et al. Apical structures of "mitochondria-rich" alpha and beta cells in euryhaline fish gill:their behaviour in various living conditions[J]. The Anatomical Record, 1995, 241(1): 13. DOI:10.1002/(ISSN)1097-0185 |
| [34] |
Foskett J K, Scheffey C. The chloride cell:definitive identification as the salt-secretory cell in teleosts[J]. Science, 1982, 215(4529): 164-166. DOI:10.1126/science.7053566 |
| [35] |
Carmona R, Garcia-Gallego M, Sanz A, et al. Chloride cells and pavement cells in gill epithelia of Acipenser naccarii:ultrastructural modifications in seawater-acclimated specimens[J]. Journal of Fish Biology, 2004, 64(2): 553-566. DOI:10.1111/jfb.2004.64.issue-2 |
 2018, Vol. 25
2018, Vol. 25

