 胚胎发育观察
胚胎发育观察
2. 西藏自治区拉萨市墨竹工卡县林业局, 西藏 拉萨 850200
 (Glyptosternum maculatum)是中国唯一的原
(Glyptosternum maculatum)是中国唯一的原 属鱼类,仅分布在中国境内的西藏雅鲁藏布江水系。由于过度捕捞、水利工程影响、外来鱼类入侵等原因,其野生种群数量持续下降,分布范围逐年缩小,目前处于极危状态。本研究中黑斑原
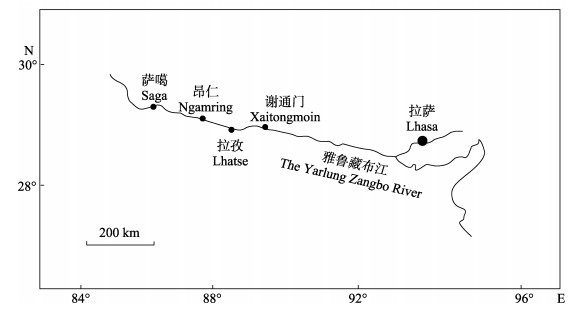
属鱼类,仅分布在中国境内的西藏雅鲁藏布江水系。由于过度捕捞、水利工程影响、外来鱼类入侵等原因,其野生种群数量持续下降,分布范围逐年缩小,目前处于极危状态。本研究中黑斑原 亲鱼捕自西藏日喀则市谢通门县、拉孜县、昂仁县、萨嘎县4个地区的雅鲁藏布江江段,采样地海拔分布范围介于3900~4500 m。2015年5月中旬至6月中旬,人工催产雌鱼79尾,自然排卵7尾,解剖雄鱼15尾进行授精,得到了黑斑原
亲鱼捕自西藏日喀则市谢通门县、拉孜县、昂仁县、萨嘎县4个地区的雅鲁藏布江江段,采样地海拔分布范围介于3900~4500 m。2015年5月中旬至6月中旬,人工催产雌鱼79尾,自然排卵7尾,解剖雄鱼15尾进行授精,得到了黑斑原 受精卵约42208粒。受精卵为圆形的沉性卵,略显淡黄色,黏性较强。将受精卵平铺放在特制筛网上,置于微流水的平列槽内进行孵化。观察从受精卵至仔鱼孵化出膜的胚胎发育过程,统计有效积温。结果显示:黑斑原
受精卵约42208粒。受精卵为圆形的沉性卵,略显淡黄色,黏性较强。将受精卵平铺放在特制筛网上,置于微流水的平列槽内进行孵化。观察从受精卵至仔鱼孵化出膜的胚胎发育过程,统计有效积温。结果显示:黑斑原 胚胎发育时序符合硬骨鱼类胚胎发育的一般规律,分为8个阶段,即受精卵、胚盘形成、卵裂、囊胚、原肠、神经胚、早期器官形成及孵出阶段。胚孔封闭前就形成了肌节和眼囊,进入早期器官形成阶段后依次出现了耳囊、心脏原基、消化道、耳石、眼睛体、胸鳍原基等,心脏搏动后红细胞也有出现。整个胚胎发育期间的平均温度约为13.8℃,有效积温为2963.2~3132.4 h·℃,孵化率约为70%。本研究还发现黑斑原
胚胎发育时序符合硬骨鱼类胚胎发育的一般规律,分为8个阶段,即受精卵、胚盘形成、卵裂、囊胚、原肠、神经胚、早期器官形成及孵出阶段。胚孔封闭前就形成了肌节和眼囊,进入早期器官形成阶段后依次出现了耳囊、心脏原基、消化道、耳石、眼睛体、胸鳍原基等,心脏搏动后红细胞也有出现。整个胚胎发育期间的平均温度约为13.8℃,有效积温为2963.2~3132.4 h·℃,孵化率约为70%。本研究还发现黑斑原 胚胎具有双层卵膜的特殊结构,该结构在成熟卵吸水膨胀后形成,进入神经胚期完全消失,分析推测这种结构可能与对环境的适应有关,外层卵膜在卵的传播和孵化过程中可以起到黏附固定和缓冲保护的作用。本研究旨在深入了解黑斑原
胚胎具有双层卵膜的特殊结构,该结构在成熟卵吸水膨胀后形成,进入神经胚期完全消失,分析推测这种结构可能与对环境的适应有关,外层卵膜在卵的传播和孵化过程中可以起到黏附固定和缓冲保护的作用。本研究旨在深入了解黑斑原 胚胎发育的特点及规律,为黑斑原
胚胎发育的特点及规律,为黑斑原 资源恢复及科学保护提供理论参考。
资源恢复及科学保护提供理论参考。 胚胎发育 形态特征 时序性 双层卵膜 雅鲁藏布江 西藏
胚胎发育 形态特征 时序性 双层卵膜 雅鲁藏布江 西藏 2. Maizhokunggar County Forestry Bureau, Lhasa 850200, China
黑斑原








2004年至今, 国内几所科研单位先后开展了黑斑原



鱼类的胚胎发育在卵膜内进行, 胚胎没有任何主动避敌的能力和行为特性[5-6]。鱼类胚胎发育的研究可为鱼类遗传育种、鱼类学等研究提供参考。本研究观察了黑斑原




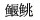

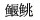
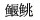



黑斑原
|
图 1 雅鲁藏布江采样点示意图 Fig.1 Sampling locations in the Yarlung Zangbo River |
2015年5月中旬至6月中旬, 挑选体重介于64.70~250.10 g,为(110.64±37.20) g、腹部膨大,以手触摸可明显感觉到卵粒的雌性个体, 适当力度挤压其腹部, 观察卵粒游离情况。卵粒尚未完全分离的雌性个体用促黄体素释放激素A2和鲤鱼脑垂体人工催产、授精。成功催产雌鱼79尾, 自然排卵7尾,产卵总数约为57440粒。雄性黑斑原
在微流水的平列槽内放入特制的筛网,筛网四侧边框为木头,可漂浮于水面上,中间为孔径2.0 mm×2.0 mm的纱网,将受精卵平铺在纱网上进行孵化。
胚胎观察在西藏自治区农牧科学院水产养殖基地(拉萨, 海拔约3600 m)内进行。受精卵和卵裂阶段, 每隔30 min对同一批受精卵进行连续取样、观察、拍照及记录; 卵裂结束后, 每隔1 h采样1次。每次取10枚受精卵,胚胎发育的时序及进入各时期的时间点以镜检50%以上胚胎出现相应特征为准, 各发育时期的划分参考硬骨鱼类的胚胎发育分期方法[9]。当有不足50%的卵出现某时期特征后,进行连续观察,直至一半以上出现相应特征。
用凤凰XTL165系列变倍体式显微镜、普通台式电脑和PHMIAS2008 CS Ver 2.2软件采集图片。
1.4 温度记录及积温计算用杭州凌硕检测仪器有限公司型号为LS-T111的温度记录仪采集温度信息, 记录频率为30 min 1次。
胚胎发育各阶段有效积温按下式计算: K=NT (K, 有效积温, h×℃; N, 某一发育阶段所经历的时间, h; T, 该发育阶段的平均水温, ℃), 即胚胎发育各阶段的有效积温等于本阶段的平均温度与该阶段持续时间的乘积[6]。黑斑原
共获得受精卵42208粒, 受精率约为73.5%, 孵出仔鱼约29546尾, 孵化率约为70.0%。
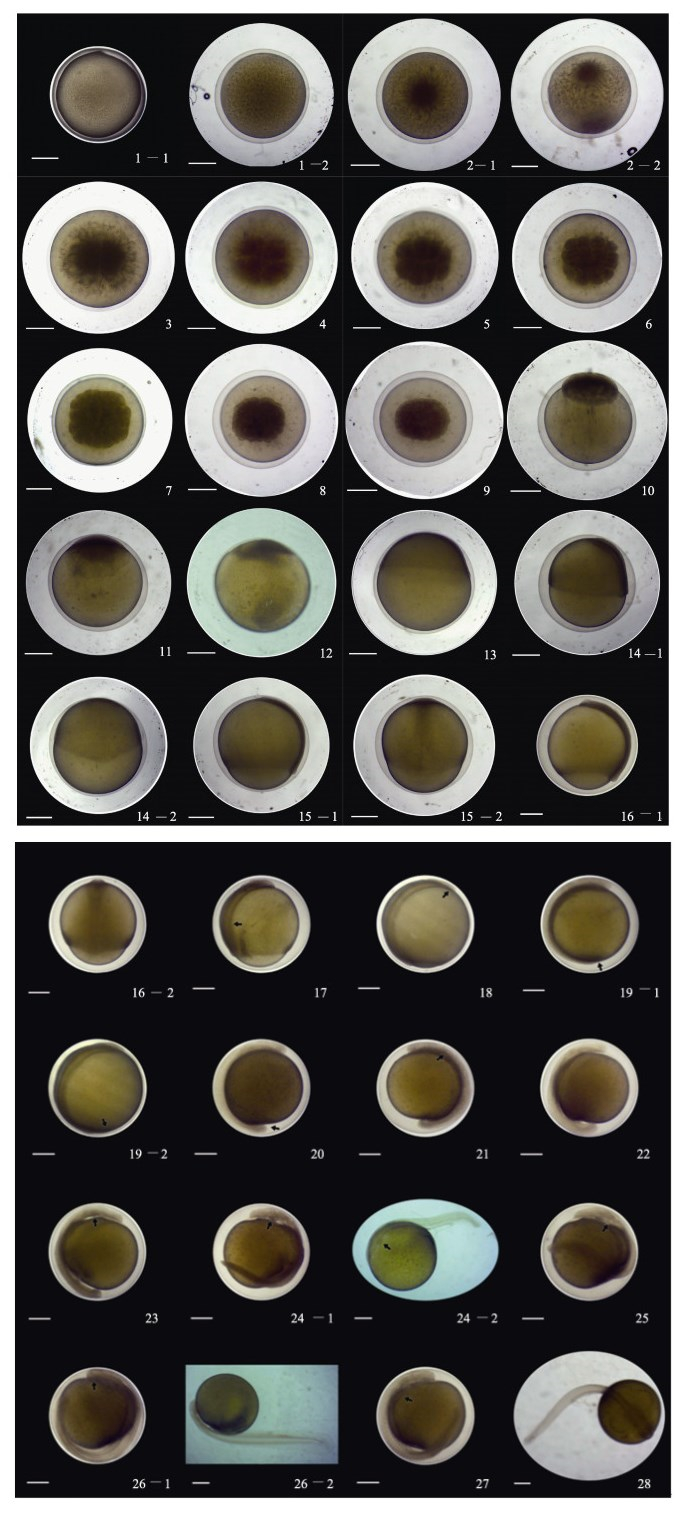
2.2 胚胎发育的时序及形态特征孵化水源为曝气后的地下水, 微流水环境, 水体溶氧量6.0~7.2 mg/L, 水温13.1~15.0℃。受精卵经过216~228 h完成整个胚胎发育, 进入胚后发育。其时序与众多硬骨鱼相同[6, 9-17], 分为8个阶段, 即受精卵、胚盘形成、卵裂、囊胚、原肠、神经胚、器官分化及孵出阶段。根据发育形态特征的变化, 每个阶段又划分为28个时期, 详见表 1及图 2。
|
|
表 1 西藏黑斑原 |
|
图 2 西藏黑斑原 |
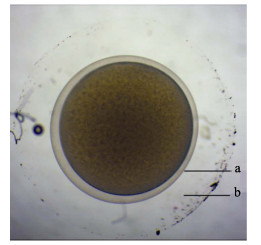
黑斑原
|
图 3 西藏黑斑原 |
细胞质逐渐向动物极集聚, 隆起形成胚胎发育的中心——胚盘, 胚盘呈圆形, 颜色较深[图 2-(2-1, 2-2)]。
2.2.3 卵裂阶段胚盘开始分裂, 细胞数目从2细胞逐渐翻倍增多, 直至无法清晰计数; 随着卵裂次数的增加,分裂出的细胞体积逐渐变小, 细胞间界限较为明显, 细胞层增厚隆起[图 2-(3, 4, 5, 6, 7, 8, 9)]。
2.2.4 囊胚阶段细胞不断分裂, 细胞间界限变得模糊, 细胞层隆起达最高时, 标志着胚胎发育进入囊胚早期。随后, 胚盘细胞沿卵黄朝植物极方向逐渐下包, 细胞层覆盖卵黄的面积逐渐增大, 细胞层逐渐变薄[图 2-(10, 11, 12)]。
2.2.5 原肠阶段当胚盘细胞下包至胚体约1/3处时, 胚胎发育进入了原肠阶段。胚盘下周边缘的胚盘细胞逐渐集中增厚, 内卷形成胚环, 后端形成三角状加厚隆起的胚盾。胚层继续下包达卵黄2/3~3/4, 形成倒梨形的“卵黄栓”, 胚盾前端略微膨大。在原肠晚期即将进入神经胚前, 可见外层卵膜开始消融[图 2-(13, 14-1, 14-2, 15-1, 15-2)。
2.2.6 神经胚阶段进入神经胚发育阶段后,外层卵膜完全消失,胚盘细胞继续向下延伸,未被细胞层包裹的部分越来越小,肌节和眼囊先后出现,且越来越明显[图 2-(16-1, 16-2)]。
2.2.7 早期器官形成阶段胚孔封闭后胚胎进入早期器官形成阶段, 耳囊、心脏原基、消化道、耳石和眼晶体等先后出现。尾芽开始游离, 不断延伸; 心脏开始跳动, 出现红细胞, 胚体活动从肌肉轻微颤动变为扭动、翻转, 且频率逐渐加快[图 2-(17, 18, 19-1, 19-2, 20, 21, 22, 23, 14-1, 24-2, 25, 26-1, 26-2, 27)]。
2.2.8 出膜阶段随着胚体的继续发育, 在216 h进入出膜阶段。在胚体的不断运动及孵化酶的共同作用下, 胚体的尾部最先破膜而出, 尾部不停摆动, 胚体落入平列槽底, 在经过筛网时绝大部分胚体完全脱出卵膜。刚出膜的仔鱼通体淡黄色, 侧躺于平列槽底部, 尾部不停摆动, 卵黄囊较大、近圆形。整个出膜阶段持续12 h左右, 绝大部分胚体完成脱膜(图 2-28)。
2.3 胚胎发育的有效积温整个胚胎发育期间平均水温约为13.8℃, 有效积温为2963.2~3132.4 h·℃(表 2)。
|
|
表 2 黑斑原 |

本研究中, 多批胚胎观察发现, 不管受精与否, 黑斑原



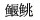



关于



目前关于



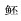
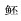
黑斑原

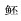




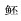
|
|
表 3 黑斑原  |
本研究与谢从新等[1]对黑斑原

胚胎发育时间的长短与物种特性密切相关, 也受环境因子的影响, 而温度是最主要的影响因子[1]。温度影响胚胎发育的速率及成活率[21-24]。在适宜的温度范围内, 胚胎发育速率随水温升高而加快, 低于或超过适宜温度则胚体发育停滞、仔鱼畸形, 时间过长还会造成胚胎死亡, 降低孵化率[20-24]。温度还影响着胚体的活动强度以及胚胎孵化酶的分泌, 影响仔鱼出膜[6]。
雅鲁藏布江常年水温在1~16℃范围内, 每年5—6月水温为11~15℃[1], 为黑斑原

| [1] |
Xie C X, Ma B S, Qin J H. Studies on biodiversity and conservation technology of Glyptosternum maculatum in Yarlung Zangbo River[M]. Beijing: Science Press, 2016. [谢从新, 马宝珊, 覃剑晖. 雅鲁藏布江黑斑原  的生物多样性及养护技术研究[M]. 北京: 科学出版社, 2016.] 的生物多样性及养护技术研究[M]. 北京: 科学出版社, 2016.]
|
| [2] |
Bureau of water production in Tibet autonomous region. Fishes and Fish Resources In Xizang, In China[M]. Beijing: China Agriculture Press, 1995: 134-136. [西藏自治区水产局. 西藏鱼类及其资源[M]. 北京: 中国农业出版社, 1995: 134-136.]
|
| [3] |
Redlist of China's biodiversity-volume of vertebrate[R]. Chinese Academy of Sciences, Ministry of Environmental Protection of the People's Republic of China, 2015(5.20).http://www.mep.gov.cn/gkml eg/hbb/bgg/201505/t20150525_302233.htm. [中国生物多样性红色名录-脊椎动物卷[R].中华人民共和国环境保护部、中国科学院, 2015(5.20). http://www.mep.gov.cn/gkml/hbb/bgg/201505/t20150525_302233.htm.]
|
| [4] |
Zhou J S, Li B H, Pan Y Z, et al. Studies on technique of artificial propagation for Glyptosternum maculatum in Tibet[J]. China Fisheries, 2015, 10: 81-83. [周建设, 李宝海, 潘瑛子, 等. 黑斑原  的人工繁殖技术研究[J]. 中国水产, 2015, 10: 81-83.] 的人工繁殖技术研究[J]. 中国水产, 2015, 10: 81-83.] |
| [5] |
Yin M C. Advances and studies on early life history of fish[J]. Journal of fisheries of China, 1991, 15(4): 348-358. [殷名称. 鱼类早期生活史研究与其进展[J]. 水产学报, 1991, 15(4): 348-358.] |
| [6] |
Xu J. Early development of four Schizothoraeinae fishes in the Yarlung Zangbo River, Tibet[D]. Wuhan: Huazhong Agricultural University, 2011: 4-9. [许静.雅鲁藏布江四种特有鱼类早期发育的研究[D].武汉: 华中农业大学, 2011: 4-9.]
|
| [7] |
Chu X L, Zheng B S, Dai D Y. Fauan Sinica·osteichthyes·Siluriformes[M]. Beijing: Science Press, 1999: 163-172. [褚新洛, 郑葆珊, 戴定远. 中国动物志·硬骨鱼纲·鲇形目[M]. 北京: 科学出版社, 1999: 163-172.]
|
| [8] |
Chu X L. Systematics and evolutionary pedigree of the Glyptosternoid fishes (Family Sisoridae)[J]. Acta Zootaxonomica Sinica, 1979, 4(1): 72-82. [褚新洛. 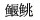 鱼类的系统分类及演化谱系, 包括一新属和一新亚种的描述[J]. 动物分类学报, 1979, 4(1): 72-82.] 鱼类的系统分类及演化谱系, 包括一新属和一新亚种的描述[J]. 动物分类学报, 1979, 4(1): 72-82.] |
| [9] |
Li X. Histology and Embryology of Aquatic Animals[M]. Beijing: China Agriculture Press, 2005: 324-350. [李霞. 水产动物组织胚胎学[M]. 北京: 中国农业出版社, 2005: 324-350.]
|
| [10] |
Wang Z J, Zhang Y G, Li J L, et al. Embryonic development of Glyptothorax fukiensis[J]. Journal of Shanghai Fisheries University, 2000, 9(3): 194-199. [王志坚, 张耀光, 李军林, 等. 福建纹胸  的胚胎发育[J]. 上海水产大学学报, 2000, 9(3): 194-199.] 的胚胎发育[J]. 上海水产大学学报, 2000, 9(3): 194-199.] |
| [11] |
Ding C Z, Chen Y F, He D K, et al. Reproductive biology of Glyptosternum maculatum in Yarlung Zangbo River in Tibet, China[J]. Acta Hydrobiologica Sinica, 2010, 34(4): 762-768. [丁城志, 陈毅峰, 何德奎, 等. 雅鲁藏布江黑班原  繁殖生物学研究[J]. 水生生物学报, 2010, 34(4): 762-768.] 繁殖生物学研究[J]. 水生生物学报, 2010, 34(4): 762-768.] |
| [12] |
Xue C J, Zhang Z X, Ma J Y, et al. Preliminary studies on artificial propagation and embryonic development of Bagarius yarrelli[J]. Journal of Hydroecology, 2012, 33(5): 54-56. [薛晨江, 张正雄, 马建颜, 等. 巨 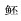 人工繁殖初报与胚胎发育观察[J]. 水生态学杂志, 2012, 33(5): 54-56.] 人工繁殖初报与胚胎发育观察[J]. 水生态学杂志, 2012, 33(5): 54-56.] |
| [13] |
Hua Z L, Chen J, Shi Y L, et al. Artificial propagation and embryonic development of Acrossocheilus yunanensis[J]. Fisheries Science & Technology Information, 2017, 44(2): 69-72. [华泽祥, 陈俊, 石永伦, 等. 云南光唇鱼的人工繁殖和胚胎发育观察[J]. 水产科技情报, 2017, 44(2): 69-72.] |
| [14] |
Yan Y L, Shi Y H, Deng P P, et al. Artificial propagation and embryonic development of Acrossocheilus yunanensis[J]. Journal of Dalian Ocean University, 2016, 31(1): 24-29. [严银龙, 施永海, 邓平平, 等. 舌 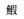 虎鱼的人工繁殖及其胚胎发育[J]. 大连海洋学报, 2016, 31(1): 24-29.] 虎鱼的人工繁殖及其胚胎发育[J]. 大连海洋学报, 2016, 31(1): 24-29.] |
| [15] |
Yang H C, Yang X G, Wu J M, et al. Early development of Hucho bleekeri Kimura[J]. Journal of Fishery Sciences of China, 2016, 23(4): 759-770. [杨焕超, 杨晓鸽, 吴金明, 等. 川陕哲罗鲑个体的早期发育观察[J]. 中国水产科学, 2016, 23(4): 759-770.] |
| [16] |
Gan W X, Wang H M, Deng L J, et al. The morphological development of embryos and yolk-sac larvae of Yalong river wangchiachii's schizothoracin(Schizothorax wangchiachii)[J]. Chinese Journal of Zoology, 2016, 51(2): 253-260. [甘维熊, 王红梅, 邓龙君, 等. 雅砻江短须裂腹鱼胚胎和卵黄囊仔鱼的形态发育[J]. 动物学杂志, 2016, 51(2): 253-260.] |
| [17] |
Shen Y C, Huang M Z, Su Q S. A preliminary observation on the embryonic development of Pangasius sutchi[J]. Journal of Guangdong Ocean University, 2008, 28(4): 41-44. [申玉春, 黄木珍, 苏秋生. 苏氏圆腹鱼芒胚胎发育的初步观察[J]. 广东海洋大学学报, 2008, 28(4): 41-44. DOI:10.3969/j.issn.1673-9159.2008.04.009] |
| [18] |
Qiao D L, Fu L X. Studies on the development of embryo and yolk-sac stage larval channel catfish (Ictalurus punctatus)[J]. Journal of Hydroecology, 2009, 2(1): 58-62. [乔德亮, 付立霞. 斑点叉尾鮰胚胎及卵黄囊仔鱼发育研究[J]. 水生态学杂志, 2009, 2(1): 58-62.] |
| [19] |
Kang S K, Qin Q, Wang M H. Observation on the embryonic and yolk-sac stage larval development of Ictalurus punctatus[J]. Journal of Aquaculture, 2011, 32(1): 1-4. [康晟凯, 秦钦, 王明华. 斑点叉尾鮰胚胎及卵黄囊仔鱼发育的观察[J]. 水产养殖, 2011, 32(1): 1-4. DOI:10.3969/j.issn.1004-2091.2011.01.001] |
| [20] |
Bermudes M, Ritar A J. Effects of temperature on the embryonic development of the striped trumpeter Latris lineate (Bloch and Schneider, 1801)[J]. Aquaculture, 1999, 176: 245-255. DOI:10.1016/S0044-8486(99)00117-9 |
| [21] |
Ingo S W, Gastón A L. Effects of temperature on the embryonic development and hatchling size of Betaeus emarginatus (Decapoda:Caridea:Alpheidae)[J]. Journal of natural history, 2003, 37(18): 2165-2178. DOI:10.1080/00222930210133291 |
| [22] |
Klimogianni A, Koumoundouros G, Kaspiris P, et al. Effects of temperature on the egg and yolk-sac larval development of common pandora, Pagellus erythrinus[J]. Marine Biology, 2004, 145: 1015-1022. DOI:10.1007/s00227-004-1382-y |
| [23] |
Zhang T T, Chen C, Shi Z H, et al. Effects of temperature on the embryonic development and yolk-sac larval development of Epinephelus moara[J]. Progress in Fishery Sciences, 2016, 37(3): 28-32. [张廷廷, 陈超, 施兆鸿, 等. 温度对云纹石斑鱼胚胎发育和仔鱼活力的影响[J]. 渔业科学进展, 2016, 37(3): 28-32.] |
| [24] |
Mu L L, Xu C H, Xu A Y, et al. Effects of temperature on the embryonic development of Oxyeleotris marmorata and its morphology observation on post-embryonic development[J]. Guangdong Agricultural Science, 2015, 42(14): 94-99. [木亮亮, 徐慈浩, 许爱娱, 等. 温度对云斑尖塘鳢胚胎发育的影响及其胚后发育的形态学观察[J]. 广东农业科学, 2015, 42(14): 94-99. DOI:10.3969/j.issn.1004-874X.2015.14.019] |
 2018, Vol. 25
2018, Vol. 25

