2. 上海海洋大学水产与生命学院, 上海 201306
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
中华绒螯蟹(Eriocheir sinensis)属于长距离洄游的甲壳类, 在中国主要分布于长江中下游水域[1], 其早期生活史阶段需经历索饵洄游过程, 即每年6月大眼幼体在长江口逐渐转变为仔蟹, 并借助潮汐作用从河口逆江而上。耿智等[2]和张烈士等[3]对长江口中华绒螯蟹早期资源分布研究表明:中华绒螯蟹蚤状幼体主要分布在长江口北支盐度13~26水域附近; 大眼幼体开始向河口低盐区洄游, 主要分布在长江南支北港盐度8~15水域; 仔蟹主要分布在咸淡水交界盐度0~10的滩涂水域。仔蟹阶段是中华绒螯蟹营浮游生活转为营底栖生活的关键时期, 对生境条件的改变极为敏感, 盐度会影响仔蟹摄食、生长、蜕壳、发育等过程[4]。长江口内引外连, 海陆交互, 各水域盐度范围有所不同。因此, 仔蟹在长江口洄游时需要调节其生理机能, 以便适应不同盐度的栖息环境。
有关盐度对蟹类渗透压调节影响的研究主要集中在三疣梭子蟹(Callinectes sapidus)[5]、滨蟹(Carcinus maenas)[6]、锯缘青蟹(Scylla serrata)[7]、中华绒螯蟹等。而目前关于中华绒螯蟹渗透压调节的研究主要集中在成蟹, 赵磊等[8]研究了盐度对中华绒螯蟹成体雄蟹渗透压调节的影响, 发现其血淋巴渗透压、Na+、Mg2+和Cl–浓度随水体盐度上升而增加, 冯广朋等[9]对雌性亲蟹渗透压调节研究得到相似结果。盐度改变亦会引起蟹类体内发生一系列的生理调节反应, 引起其Na+-K+- ATPase活性、渗透压调节、超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、酚氧化酶(PO)等非特异性免疫酶活性的变化[10-11]。王瑞芳等[12]研究了盐度对中华绒螯蟹亲蟹非特异性免疫因子的影响, 发现随着盐度升高, AKP、SOD和PO活性先降低, 然后逐渐上升, 最后趋于稳定。
目前有关中华绒螯蟹仔蟹的研究主要集中在饵料营养[13]、亚硝酸盐[14]、钙镁离子[15]、饥饿胁迫[16]等因子对其成活、生长以及变态发育影响的研究, 而关于盐度对其渗透压和非特异性免疫影响的研究较少。通过中华绒螯蟹仔蟹渗透压和非特异性免疫系统对盐度响应的研究, 旨在揭示仔蟹在不同盐度水域索饵洄游过程中的生理变化特征, 从而为中华绒螯蟹资源保护、科学利用以及环境影响评估提供科学依据。
1 材料与方法 1.1 实验材料实验所用中华绒螯蟹仔蟹由2017年长江口大眼幼体捕捞运回实验室后培养而成。参考耿智等[2]对长江口中华绒螯蟹早期幼体的研究, 培育期间将大眼幼体放入温度(20.0±0.5)℃、盐度(15.0±0.7)的人工水池中, 早晚各投喂1次丰年虫, 每天充氧、吸污、换水, 维持适宜的养殖条件, 经培养1周后变态为中华绒螯蟹Ⅰ期仔蟹。
1.2 实验方法选取规格一致(体重0.025 g±0.008 g)、附肢完整的Ⅰ期仔蟹转移至直径1 m的圆形玻璃纤维池, 保持水深15 cm。根据长江口中华绒螯蟹早期生活史的盐度范围和仔蟹标准代谢的研究设计确定实验盐度梯度[17], 分别设为盐度0、4、8、12、16、20和24, 用逐步增盐法将各池水体调整至实验盐度值, 每个盐度梯度设置3个平行, 每个平行组放入100只仔蟹, 每天记录各组死亡数。
实验用水为净水设备(Paragon 263/740F, USA)处理后曝气3 d的自来水, 使用海水晶(深圳金创兴公司)调节各实验组盐度, 并用YSI便携式水质分析仪进行校准。实验过程中自然光照(12L:12D), 水温(23~24)℃, 并持续充氧, 维持水中溶氧 > 5 mg/L, 总氨氮 < 0.2 mg/L, pH 7.2~7.8。
1.3 实验取样将实验仔蟹在设定盐度下培养3 d, 然后从每个平行组中随机选取健康且腹肢完整的Ⅰ期仔蟹50只。将仔蟹置于冰盒中麻醉15~20 min, 用蒸馏水漂洗2次, 用精度为0.001 g的电子天平称量各平行组仔蟹重量。按照质量(g)︰体积(mL)比=1︰9的比例, 加入9倍体积的无离子水, 经组织匀浆机12000 r/min、4℃研磨制成10%的匀浆液[18]。随后将制好的匀浆液放入10 mL Eppendorf离心管中, 经冷冻离心机(CF16R Ⅱ, 日立) 3000 r/min、4℃条件下离心15 min, 吸取上清液置入10 mL Eppendorf离心管中, 将所得上清液在上述条件下再离心1次, 吸出上清液转入10 mL Eppendorf离心管中, 置于–80℃冰箱中备用。
1.4 样品分析将冰冻仔蟹组织匀浆上清液在碎冰上进行解冻, 随后在3000 r/min、4℃条件下离心15 min, 取上清液用于各指标的测定。利用电解质分析仪(DSI-905, 上海迅达)测定Na+、Cl–和K+浓度, 采用紫外分光光度法测定氧合血蓝蛋白含量[19], 采用南京建成生化工程研究所试剂盒测定Na+-K+- ATPase活性、AKP、SOD和PO活性。酶活力单位定义如下:每小时每毫克组织蛋白中ATP酶分解ATP产生1 μmol无机磷的量为1个Na+-K+- ATPase活力单位[μmolPi/(mgprot·h)]; 每克组织蛋白在37℃与基质作用15 min产生1 mg酚为1个AKP金氏单位; 每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位(U); 每克组织蛋白在1 mL反应液中PO的含量为1个PO活力单位。
1.5 数据处理采用SPSS 22.0软件进行单因素方差分析(ANOVA), 检测各实验组间仔蟹成活率、仔蟹组织匀浆上清液Na+、Cl–、K+浓度、氧合血蓝蛋白含量以及Na+-K+-ATPase活性、AKP、SOD和PO活性的差异。采用Duncan法对不同盐度组测定指标进行多重比较, 差异显著性以P < 0.05为标准, 实验数据均采用平均值±标准差(x±SD)表示。
2 结果与分析 2.1 盐度对中华绒螯仔蟹成活率的影响不同盐度下中华绒螯蟹仔蟹成活率呈现先上升后下降的趋势(表 1)。盐度0~8时仔蟹成活率随着盐度增加显著上升(P < 0.05), 盐度8实验组成活率最高, 且显著高于其他实验组(P < 0.05)。盐度4和12实验组的仔蟹成活率次之, 均高于盐度0、16、20和24实验组(P < 0.05)。盐度0、20和24实验组仔蟹成活率差异不显著(P > 0.05)。盐度16组显著高于盐度24组(P < 0.05)。
|
|
表 1 不同盐度下中华绒螯蟹仔蟹成活率 Tab.1 Survival rate of juvenile Eriocheir sinensis under different salinities |
随着实验盐度增加, 仔蟹组织匀浆上清液的Na+、Cl–和K+浓度呈现先降低后上升最后保持平稳的趋势(表 2)。Na+和Cl–浓度在盐度8实验组显著低于其他盐度组(P < 0.05), 淡水组浓度最高, 盐度12、16、20和24实验组无显著性差异(P > 0.05)。K+浓度在盐度8实验组最低、淡水组最高, 各盐度组无显著性差异(P > 0.05)。
|
|
表 2 不同盐度下中华绒螯蟹仔蟹组织匀浆上清液Na+、Cl–和K+浓度 Tab.2 Concentrations of Na+, Cl– and K + in supernate of juvenile Eriocheir sinensis under different salinities |
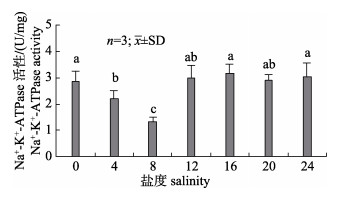
组织匀浆上清液Na+-K+-ATPase活性随盐度增加表现出先下降后上升最后趋于平稳的趋势(图 1)。盐度0~8实验组Na+-K+-ATPase活性逐渐下降, 盐度8实验组显著低于其他盐度组(P < 0.05)。盐度8~24范围内Na+-K+-ATPase活性先上升, 而后逐渐趋于稳定。盐度4实验组显著低于盐度0、16和24实验组(P < 0.05), 但与盐度12和20实验组差异不显著(P > 0.05)。盐度0、12、16、20和24实验组之间差异不显著(P > 0.05)。
|
图 1 盐度对中华绒螯蟹仔蟹Na+-K+-ATPase活性的影响 不同小写字母代表不同盐度下中华绒螯蟹仔蟹体内Na+-K+-ATPase活性差异显著(P < 0.05). Fig.1 Effects of salinity on Na+-K+-ATPase activity in juvenile Eriocheir sinensis Different lowercase letters indicates significant difference on Na+-K+-ATPase activity in juvenile Eriocheir sinensis under different salinities (P < 0.05) |
随着实验盐度升高, 仔蟹组织匀浆上清液的氧合血蓝蛋白含量从(0.152±0.020) mg/mL逐步升高到(0.253±0.023) mg/mL, 盐度8实验组含量最高, 显著高于其他盐度组(P < 0.05), 然后逐渐下降到(0.150±0.024) mg/mL后保持稳定。盐度4实验组显著高于盐度0、12、20和24实验组(P < 0.05), 与盐度16实验组差异不显著(P > 0.05)。当盐度高于12后, 各实验组随着盐度的升高差异不显著(P > 0.05)。
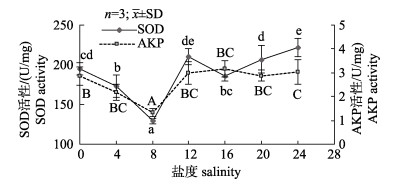
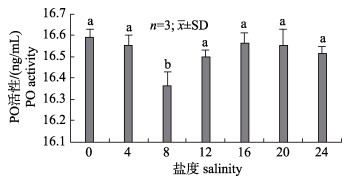
随着盐度增加, 仔蟹组织匀浆上清液SOD、AKP和PO的活性水平总体呈现先下降后上升, 最后维持稳定的趋势(图 2、3)。盐度组8最低, SOD、AKP和PO的活性均显著低于其他实验组(P < 0.05)。
|
图 2 盐度对中华绒螯蟹仔蟹SOD和AKP活性的影响 不同的小写字母代表不同盐度下中华绒螯蟹仔蟹体内SOD活性显著差异(P < 0.05), 不同的大写字母代表不同盐度组下中华绒螯蟹仔蟹体内AKP活性差异显著(P < 0.05). Fig.2 Effects of salinity on SOD and AKP activities in juvenile Eriocheir sinensis Different lowercase letters indicates significant difference on SOD activity in juvenile E. sinensis under different salinities (P < 0.05); Different capital letters indicates significant difference on AKP activity in juvenile E. sinensis under different salinities (P < 0.05) |
|
图 3 盐度对中华绒螯蟹仔蟹PO活性的影响 不同的小写字母代表不同盐度下中华绒螯蟹仔蟹体内PO活性显著差异(P < 0.05). Fig.3 Effects of salinity on PO activity in juvenile Eriocheir sinensis Different lowercase letters indicates significant difference on PO activity in juvenile Eriocheir sinensis under different salinities (P < 0.05) |
中华绒螯蟹早期生活史包括Z1~Z5蚤状幼体、大眼幼体、Ⅰ~Ⅲ期仔蟹、幼蟹等变态过程, 大眼幼体到Ⅲ期仔蟹的过程是中华绒螯蟹从河口半咸水区转入淡水区进行索饵洄游的关键阶段, 为适应河口盐度变化, 其机体需要具备一定的渗透压调节能力。通常在仔蟹的高渗调节范围内, 盐度越高成活率越高, 赵亮等[20]研究表明早期仔蟹的耐受盐度上限为20, Minagawa等[21]研究了盐度对甲壳动物中蛙形蟹(Ranina ranuna)仔蟹的影响, 得到相似研究结果。
本实验表明仔蟹的成活率在淡水组最低, 随着盐度增加仔蟹的成活率逐步增高, 但是当盐度升高到8以后, 仔蟹成活率随着盐度的增高反而逐渐降低。从表 1可以得出仔蟹的较适盐度范围是4~8, 这与成永旭等[15]、翁忠惠[22]关于早期仔蟹适宜培养盐度范围为5~7的研究结果相近。
3.2 盐度对中华绒螯蟹仔蟹离子浓度和Na+-K+- ATPase活性的影响中华绒螯蟹与红螯相手蟹(Sesarma curacaoense)[23]、张口蟹(Chasmagnathus granulata)[24]、滨蟹(Carcinus maenas)[25]等蟹类的早期渗透压功能发育过程类似。其过程通常可分为三阶段, 第一阶段: Ⅰ~Ⅴ期蚤状幼体属于高渗调节, 只能在河口或者沿海水域等高盐环境下生活; 第二阶段:蚤状幼体蜕壳成为大眼幼体后, 具有了中等强度的高低渗调节, 可以在咸淡水中生活; 第三阶段:大眼幼体蜕壳变为Ⅰ期仔蟹后, 具有了较强的高低渗透压调节能力, 可以较好地在淡水、咸淡水和海水中生活。渗透调节主要通过机体的离子调节实现, Na+和Cl–是其调节过程中最重要的贡献者[26]。本实验中, Na+和Cl–浓度在盐度0~8范围内随着盐度的降低而升高, 盐度8实验组最低, 显著低于其他盐度组(P < 0.05)。这种变化趋势主要与环境离子被动进入仔蟹、机体水分流失、以及鳃主动吸收离子等密切相关。相比Na+和Cl–浓度, K+浓度受盐度影响较小, 各盐度组间无显著性差异, 这一结果与赵峰等[27]对中华鲟盐度适应性研究一致, 造成这一结果的原因可能是盐度胁迫下甲壳动物通过触角腺和鳃及时将血淋巴中多余的K+排出体外[28], 从而维持体内K+浓度的稳定。
广盐性蟹类从高盐度海水转移至低盐度海水时, Na+-K+-ATPase以主动运输方式转运Na+和Cl–, 补偿机体离子流失, 从而适应环境盐度变化。本实验中随着盐度的变化, 仔蟹体内Na+-K+-ATPase活性变化趋势与Na+、Cl–浓度变化一致, 出现先下降后上升最后保持稳定的趋势。在淡水中仔蟹体内Na+-K+-ATPase活性较高, 原因是淡水中仔蟹体外渗透压低于体内, 无机离子通过触角腺、鳃和肠等向外流失, 为维持机体较高的离子浓度和渗透压, 后鳃Na+-K+-ATPase活性增加, 主动从环境中吸收电解质, 提高体内渗透压。当进入盐度4~8水域后, 外界渗透压升高, 仔蟹体内离子和水分流失减弱, 此时后鳃Na+-K+-ATPase活性下降, 盐度8时达到最低。当盐度大于8时Na+-K+-ATPase活性又开始升高, 此阶段中华绒螯蟹仔蟹虽已具备一定的低渗调节能力, 但其调节能力较弱, 在高盐环境中外界渗透压高于仔蟹体内, 机体需将多余离子排出体外, 故后鳃Na+-K+-ATPase活性升高。本实验结果与赵磊等[8]和王顺昌等[29]对河蟹短期盐度适应的研究结果相一致。本实验研究表明, 仔蟹在盐度8水体中具有较好的生理适应性, 机体分配用于渗透调节的能量最低, 从而可以调配更多的能量用于生长和蜕壳。因此, 人工养殖蟹苗时一般需要在微咸水中进行。
3.3 盐度对中华绒螯蟹仔蟹氧合血蓝蛋白和非特异性酶的影响氧合血蓝蛋白是一种呼吸蛋白, 对动物的健康起着指示作用。研究表明氧合血蓝蛋白不仅具有运输氧气、储存蛋白、调节渗透压、调节蜕皮等功能, 还具有酚氧化酶、抗菌肽、凝集活性等免疫活性[30]。本实验表明, 在盐度0~8时, 仔蟹氧合血蓝蛋白含量随着盐度的增加逐渐增高; 在盐度8~24时, 随着盐度的增加逐渐下降。淡水和盐度大于8时血蓝蛋白含量降低的原因可能是盐度胁迫下仔蟹体内血蓝蛋白部分分解为游离氨基酸, 从而调节机体渗透压, 另有部分血蓝蛋白转变为酚氧化酶, 并降解产生抗菌肽, 从而发挥其免疫学功能, 应对外界盐度的胁迫。
超氧化物酶是生物体内一种重要的抗氧化酶, 作用是清除体内超氧阴离子(O2–)和-OH自由基, 防御甲壳类动物产生生物毒素, 同时还具有抗菌、抗病毒等作用。研究发现, 超氧化物歧化酶活性与生物的免疫水平密切相关, 常被用作判断生物非特异性免疫的能力指标[31]。本实验结果表明盐度8实验组中SOD活性最低, 当盐度高于12时SOD活性趋于稳定。这一变化趋势的原因可能是仔蟹在盐度胁迫下体内细胞的线粒体、微粒体以及胞浆的酶系统与非酶系统反应, 产生较多的氧自由基, 破坏机体活性氧代谢平衡, 导致机体SOD活性增高[32], 这与陈宇锋等[33]研究锯缘青蟹SOD活性随盐度变化先降后升的实验结论一致。
碱性磷酸酶是生物体内一种代谢调控酶, 可以形成水解体系促进吞噬细胞消除生物体内异物, 同时转移磷酸基团, 加速体内钙磷吸收和物质代谢[34]。本研究实验中, 盐度4和8实验组仔蟹体内AKP活性显著低于0、12、16、20和24实验组, 这表明淡水及盐度大于8时, 仔蟹体内AKP活性增加, 促使机体物质代谢加快, 能源消耗增多, 仔蟹生长和蜕壳受到抑制, 这与亓磊[35]对拟穴青蟹(Scylla paramamosain)幼体的研究结果一致。
酚氧化酶是动物体内酚氧化酶原激活系统产物, 具有识别异物, 增强血细胞功能, 产生凝集素和溶菌酶等免疫功能[36]。本实验不同盐度下仔蟹体内PO活性无显著性差异(P > 0.05), 原因可能是盐度变化引起的酚氧化酶原激活系统反应速度很快, 在第3天时已恢复至正常水平, 导致此时仔蟹体内检测不到PO变化。罗日祥等[37]对中国明对虾(Fenneropenaeus chinensis) PO活力研究表明, 在1~13 min内PO活力随时间变化呈上升趋势。Luna [38]和马贵华等[36]发现甲壳动物PO活力在第5分钟时达到最大值, 随后开始下降。综合仔蟹体内3种免疫酶活性变化规律, 发现当盐度低于4和高于8均会对仔蟹非特异性免疫造成显著影响, 本实验结果与王瑞芳等[12]对中华绒螯蟹亲蟹的研究结论一致。
4 结语长江口是中华绒螯蟹最重要的产卵场, 海淡水在此交汇, 盐度变化较大。本实验表明, 盐度对中华绒螯蟹仔蟹的渗透压和非特异性免疫酶活性具有一定影响, 中华绒螯蟹仔蟹在盐度4~8水体中有较强的适应性, 淡水和高盐度水体会降低其渗透压调节和免疫防御功能。因此, 长江口中华绒螯蟹仔蟹在发育和洄游过程中, 若栖息水域的盐度变化幅度较大, 会对其生长成活和生理代谢产生较大影响, 这可能是导致长江口蟹苗资源数量在有些年份波动较大的原因之一, 今后还需要结合长江口生态环境和中华绒螯蟹资源变动趋势开展深入系统的研究。
| [1] |
Li C H, Li S F. Phylogenesis of populations of mitten crabs (Eriocheir sinensis, Eriocheir japonicus) in six river systems of mainland China:morphology discriminant analysis[J]. Journal of Fisheries of China, 1999, 23(4): 325-330. [李晨虹, 李思发. 中国大陆沿海六水系绒螯蟹(中华绒螯蟹和日本绒螯蟹)群体亲缘关系:形态判别分析[J]. 水产学报, 1999, 23(4): 325-330.] |
| [2] |
Geng Z, Feng G P, Zhao F, et al. Distribution of larval crabs (Eriocheir sinensis) and relationship with oceanographic features in the Yangtze Estuary[J]. Ecoscience, 2018, 25(2): 125-134. DOI:10.1080/11956860.2018.1430881 |
| [3] |
Zhang L S, Zhu X C, Gong L X. The life history and fishing of Eniocheir sinensis[J]. Fishery Science and Technology Information, 1973, 11(2): 5-21. [张烈士, 朱选才, 宫伦祥. 河蟹生活史的研究及蟹苗的捕捞[J]. 水产科技情报, 1973, 11(2): 5-21.] |
| [4] |
Zang W L, Jiang M, Dai X L, et al. Effects of salinity on larval development of Eriocheir sinensis[J]. Journal of Shanghai Fisheries University, 1999, 8(2): 174-178. [臧维玲, 江敏, 戴习林, 等. 盐度对中华绒螯蟹幼体发育的影响[J]. 上海水产大学学报, 1999, 8(2): 174-178.] |
| [5] |
Neufeld G J, Holliday C W, Pritchard J B. Salinity adaption of gill Na+/K+-ATP in the blue crab, Callinectes sapidus[J]. Journal of Experimental Zoology Part A:Ecological Genetics & Physiology, 1980, 211(2): 215-224. |
| [6] |
Siebers D, Leweck K, Markus H, et al. Sodium regulation in the shore crab Carcinus maenas as related to ambient salinity[J]. Marine Biology, 1982, 69(1): 37-43. DOI:10.1007/BF00396958 |
| [7] |
Romano N, Wu X, Zeng C, et al. Growth, osmoregulatory responses and changes to the lipid and fatty acid composition of organs from the mud crab, Scylla serrata, over a broad salinity range[J]. Marine Biology Research, 2014, 10(5): 460-471. DOI:10.1080/17451000.2013.819981 |
| [8] |
Zhao L, Long X W, Wu X G, et al. Effects of water salinity on osmoregulation and physiological metabolism of adult male Chinese mitten crab Eriocheir sinensis[J]. Acta Hydrobiologica Sinica, 2016, 40(1): 27-34. [赵磊, 龙晓文, 吴旭干, 等. 水体盐度对中华绒螯蟹成体雄蟹渗透压调节和生理代谢的影响[J]. 水生生物学报, 2016, 40(1): 27-34.] |
| [9] |
Feng G P, Lu J, Zhuang P, et al. Effects of salinity on osmo-ionic regulation and enzyme activities in mature female Eriocheir sinensis[J]. Marine Fisheries, 2013, 35(4): 468-473. [冯广朋, 卢俊, 庄平, 等. 盐度对中华绒螯蟹雌性亲蟹渗透压调节和酶活性的影响[J]. 海洋渔业, 2013, 35(4): 468-473. DOI:10.3969/j.issn.1004-2490.2013.04.013] |
| [10] |
Castilho P C, Martins I A, Bianchini A. Gill Na+, K+-ATPase and osmoregulation in the estuarine crab, Chasmagnathus granulata Dana, 1851 (Decapoda, Grapsidae)[J]. Journal of Experimental Marine Biology and Ecology, 2001, 256: 215-227. DOI:10.1016/S0022-0981(00)00315-4 |
| [11] |
Zheng P P, Wang C L, Song W W, et al. Effect of salinity stress on serum non-specific immune factors in swimming crab Portunus trituberculatus[J]. Fisheries Science, 2010, 29(11): 634-638. [郑萍萍, 王春琳, 宋微微, 等. 盐度胁迫对三疣梭子蟹血清非特异性免疫因子的影响[J]. 水产科学, 2010, 29(11): 634-638. DOI:10.3969/j.issn.1003-1111.2010.11.002] |
| [12] |
Wang R F, Zhang P, Feng G P, et al. Changes in non-specific immune parameters of mature Chinese mitten crab (Eriocheir sinensis) in response to elevated salinities[J]. Journal of Fisheries of China, 2012, 36(4): 546-552. [王瑞芳, 庄平, 冯广朋, 等. 盐度升高对中华绒螯蟹几种非特异性免疫因子的影响[J]. 水产学报, 2012, 36(4): 546-552.] |
| [13] |
Jiang H B, Chen L Q, Wang Q, et al. Effects of dietary protein on activities of digestive enzyme and trypsin mRNA abundance in Eriocheir sinensis juveniles[J]. Journal of Fisheries of China, 2005, 29(2): 216-221. [江洪波, 陈立侨, 王群, 等. 饵料蛋白质对中华绒螯蟹仔蟹消化酶活性及胰蛋白酶mRNA丰度的影响[J]. 水产学报, 2005, 29(2): 216-221.] |
| [14] |
Hong M L. The toxicity effect of nitrite and ammonia nitrogen in Eriocheir sinensis juvenile and the nutrition regulation of vitamin E[D]. Shanghai: East China Normal University, 2007: 5-10. [洪美玲.水中亚硝酸盐和氨氮对中华绒螯蟹幼体的毒性效应及维生素E的营养调节[D].上海: 华东师范大学, 2007: 5-10.]
|
| [15] |
Cheng Y X, Wang W, Tan Y J, et al. Effects of the ambient salinity and the ambient Ca2+, Mg2+ concentration on the survival and growth of Eriocheir sinensis, from the megalopa to the juvenile[J]. Journal of Fisheries of China, 1997, 21(1): 85-89. [成永旭, 王武, 谭玉钧, 等. 盐度及钙镁离子对中华绒螯蟹大眼幼体育成Ⅲ仔蟹的成活率和生长的影响[J]. 水产学报, 1997, 21(1): 85-89.] |
| [16] |
He J, Wang C, Shao L C, et al. Impacts of starvation on the juveniles of Chinese mitten crab Eriocheir sinensis[J]. Chinese Journal of Ecology, 2013, 32(8): 2077-2084. [何杰, 王春, 邵路畅, 等. 饥饿胁迫对中华绒螯蟹(Eriocheir sinensis)仔蟹的影响[J]. 生态学杂志, 2013, 32(8): 2077-2084.] |
| [17] |
Huang X F, Zhao F, Wang Y, et al. Effect of salinity on standard metabolism of juvenile Chinese mitten crab, Eriocheir sinensis[J]. Journal of Fishery Sciences of China, 2016, 23(5): 1157-1163. [黄孝锋, 赵峰, 王妤, 等. 盐度对中华绒螯蟹仔蟹标准代谢的影响[J]. 中国水产科学, 2016, 23(5): 1157-1163.] |
| [18] |
Qi L, Jiang K J, Gu X L, et al. Growth, survival and Na+/K+-ATPase activity of early juvenile mud crabs (Scylla paramamosain) in low salinities[J]. Modern Fisheries Information, 2011, 26(11): 20-23. [亓磊, 蒋科技, 顾孝连, 等. 盐度突降对拟穴青蟹仔蟹生长发育和Na+/K+-ATP酶活性的影响[J]. 现代渔业信息, 2011, 26(11): 20-23. DOI:10.3969/j.issn.1004-8340.2011.11.005] |
| [19] |
Chen J C, Cheng S Y. Hemolymph oxygen content, oxyhemocyanin, protein levels and ammonia excretion in the shrimp Penaeus monodon exposed to ambient nitrite[J]. Journal of Comparative Physiology B, 1995, 164(7): 530-535. |
| [20] |
Zhao L, Cheng H L, Sun D X, et al. The influence of salinity on the cultivation of the juvenile Eniocheir sinensis[J]. Freshwater Fishery, 2004, 34(4): 33-35. [赵亮, 陈红玲, 孙德祥. 盐度对河蟹仔蟹培育的影响[J]. 淡水渔业, 2004, 34(4): 33-35. DOI:10.3969/j.issn.1000-6907.2004.04.011] |
| [21] |
Minagawa M. Effects of salinity on survival, feeding, and development of larvae of the red frog crab Ranina ranina[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1992, 58(10): 1855-1860. DOI:10.2331/suisan.58.1855 |
| [22] |
Weng Z H. The effects of different salinities and feed additives on the survival rates of young crab (Eriocheir sinensis)[J]. Journal of Shanghai Fisheries University, 1996, 5(3): 189-192. [翁忠惠. 盐度和饲料添加剂对中华绒螯蟹仔蟹成活率的影响[J]. 上海水产大学学报, 1996, 5(3): 189-192.] |
| [23] |
Anger K, Charmantier G. Ontogeny of osmoregulation and salinity tolerance in a mangrove crab, Sesarma curacaoense (Decapoda:Grapsidae)[J]. Journal of Experimental Marine Biology and Ecology, 2000, 251(2): 265-274. DOI:10.1016/S0022-0981(00)00223-9 |
| [24] |
Charmantier G, Gimenez L, Charmantier M, et al. Ontogeny of osmoregulation, physiological plasticity, and larval export strategy in the grapsid crab Chasmagnathus granulata (Crustacea, Decapoda)[J]. Marine Ecology Progress, 2002, 229(1): 185-194. |
| [25] |
Cieluch U, Anger K, Aujoulat F, et al. Ontogeny of osmoregulatory structures and functions in the green crab Carcinus maenas (Crustacea, Decapoda)[J]. Journal of Experimental Biology, 2004, 207(2): 325-336. DOI:10.1242/jeb.00759 |
| [26] |
Chen J C, Chia P G. Osmotic and ionic concentrations of Scylla serrata (Forskal) subjected to different salinity levels[J]. Comparative Biochemistry & Physiology Part A:Physiology, 1997, 117(2): 239-244. |
| [27] |
Zhao F, Zhuang P, Zhang L Z, et al. The influence of salinity acclimation on activity of Na+/K+-ATPase in branchial epithelium, concentration of ions and osmolarity in serum of Acipenser schrenckii[J]. Journal of Fisheries of China, 2006, 30(4): 444-449. [赵峰, 庄平, 章龙珍, 等. 盐度驯化对史氏鲟鳃Na+/K+-ATPase酶活力、血清渗透压及离子浓度的影响[J]. 水产学报, 2006, 30(4): 444-449.] |
| [28] |
Lin S C, Liou C H, Cheng J H. The role of the antennal glands in ion and body volume regulation of cannulated Penaeus monodon reared in various salinity conditions[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2000, 127(2): 121-129. |
| [29] |
Wang S C, Yu M. Gill Na+/K+-ATPase and ALP activities of Chinese mitten crab, Eriocheir sinensis, adapting to different water salinity[J]. Journal of Anhui Technical Teachers College, 2003, 17(2): 117-120. [王顺昌, 于敏. 中华绒螯蟹在不同盐度下鳃Na+/K+-ATPase和ALP活性的变化[J]. 安徽科技学院学报, 2003, 17(2): 117-120. DOI:10.3969/j.issn.1673-8772.2003.02.007] |
| [30] |
Liu C B, Xiao M, Feng Y H, et al. Effects of Water Dissolved Oxygen Level on Physiological Responses in Portunus trituberculatus (Miers, 1876)[J]. Chinese Journal of Animal Nutrition, 2011, 23(3): 506-513. [刘重斌, 肖敏, 冯彦红, 等. 水溶氧对三疣梭子蟹(crab Portunus trituberculatus, Miers, 1876)生理应答的影响[J]. 动物营养学报, 2011, 23(3): 506-513. DOI:10.3969/j.issn.1006-267x.2011.03.023] |
| [31] |
Lin L, Ding M L, Sun J J, et al. Organic pollution enhance susceptibilites of Penaeus chinensis to pathogenic bacteria[J]. Acta Oceanologica Sinica, 1998, 20(1): 90-93. [林林, 丁美丽, 孙舰军, 等. 有机污染提高对虾对病原菌易感性研究[J]. 海洋学报, 1998, 20(1): 90-93.] |
| [32] |
Lu J, Zhuang P, Feng G P, et al. Response of osmoregulation and antioxidation system to water salinity in parent Chinese mitten crab (Eriocheir sinensis)[J]. Marine Fisheries, 2011, 33(1): 39-45. [卢俊, 庄平, 冯广朋, 等. 中华绒螯蟹亲蟹渗透压调节和抗氧化系统对盐度的响应[J]. 海洋渔业, 2011, 33(1): 39-45. DOI:10.3969/j.issn.1004-2490.2011.01.007] |
| [33] |
Chen Y F, Ai C X, Lin Q W, et al. Effect of salinity stress on the activities of phenoloxidase and superoxide dismutase of the serum, tissue and organ of mud crab, Scylla serrata[J]. Journal of Oceanography in Taiwan Strait, 2007, 26(4): 569-575. [陈宇锋, 艾春香, 林琼武, 等. 盐度胁迫对锯缘青蟹血清及组织、器官中PO和SOD活性的影响[J]. 台湾海峡, 2007, 26(4): 569-575. DOI:10.3969/j.issn.1000-8160.2007.04.017] |
| [34] |
Feng G P, Zhuang P, Zhang L Z, et al. Changes of enzyme activity in blood and liver of juvenile Chinese sturgeon (Acipenser sinensis) during starvation[J]. Marine Fisheries, 2011, 33(2): 165-171. [冯广朋, 庄平, 章龙珍, 等. 饥饿期间中华鲟幼鱼血液与肝脏酶活力的变化[J]. 海洋渔业, 2011, 33(2): 165-171. DOI:10.3969/j.issn.1004-2490.2011.02.007] |
| [35] |
Qi L, Gu X L, Jiang K J, et al. Effect of salinity on the survival, growth and Na+/K+-ATPase activity of early juvenile mud crabs, Scylla paramamosain[J]. Marine Sciences, 2013, 37(2): 56-60. [亓磊, 顾孝连, 蒋科技, 等. 盐度对拟穴青蟹幼蟹存活、生长和Na+/K+-ATPase酶活性的影响[J]. 海洋科学, 2013, 37(2): 56-60.] |
| [36] |
Ma G H, Zhong Q, Cao Y H, et al. Preliminary study on phenol oxidase of Eriocher sinensis[J]. Acta Agriculturae Jiangxi, 2006, 18(1): 41-44. [马贵华, 钟青, 曹义虎, 等. 中华绒螯蟹酚氧化酶的初步研究[J]. 江西农业学报, 2006, 18(1): 41-44. DOI:10.3969/j.issn.1001-8581.2006.01.011] |
| [37] |
Luo R X, Jiang Y X, Li G Y. Studies on the phenoloxidase activities in hemocytes of the shrimp[J]. Marine Sciences, 1996, 20(6): 1-3. [罗日祥, 姜玉香, 李光友. 中国对虾血细胞中酚氧化酶活力研究[J]. 海洋科学, 1996, 20(6): 1-3.] |
| [38] |
Luna G A, Maeda M A N, Vargas A F, et al. Phenoloxidase activity in larval and juvenile homogenates and adult plasma and hemocytes of Bivalve molluscs[J]. Fish & Shellfish Immunology, 2003, 15(4): 275-282. |
 2018, Vol. 25
2018, Vol. 25

