2. 山东省淡水水产遗传育种重点实验室, 山东 济南 250013
2. Key Laboratory of Freshwater Fisheries of Genetics and Breeding of Shandong Province, Jinan 250013, China
近年来, 中国水产养殖业逐渐向高密度、集约化发展, 人工配合饲料的大量投喂、药物和激素的不规范化使用、养殖水体环境的日益恶化、饲料中存在有害物质以及饲料营养成分缺失与失衡等不利因素越来越多, 对鱼体本身造成巨大胁迫, 使其代谢系统失衡特别是对肝功能的损害尤为巨大, 最终导致鱼类肝胆综合征的大规模暴发, 使水产养殖业的发展受限[1]。肝胆综合征若不对症用药, 鱼体可迅速大量死亡。因此, 了解鱼类肝胆综合征的发病机制并在发病时及时对症下药, 对鱼体肝胆综合征的防治具有重要意义。
目前许多研究表明, 部分化学物质如乙醇、四氯化碳(CCl4)、铬化物等[2]均能导致肝损伤, 其中, CCl4是经典的肝毒物, 可损害肝细胞膜、细胞器膜, 致使膜发生脂质过氧化, 最终导致肝功能下降, 肝细胞坏死等[3]。在哺乳动物中, CCl4作为一种模式毒物被广泛用于构建肝(细胞)损伤模型以筛选保肝药物和研究肝机理等[4]。与哺乳动物类似, 鱼类的肝细胞对CCl4较为敏感[5], 近年来CCl4被广泛用于构建鱼体肝损伤模型[6]。
对于鱼类肝胆综合征的治疗, 尚未发现特效药物, 目前还是多以抗生素为主。然而, 许多研究[7-8]发现鱼类内服抗生素不但会引起鱼体本身消化道功能降低, 还会对机体肝胆、脾肾等脏器造成损伤。此外, 抗生素在机体内大量残留会致使病原菌对药物产生一定耐药性, 最终给人类健康造成危害。因此, 开发一种绿色的无毒副作用的对鱼体肝脏损伤具有保护和治疗作用的中成渔药已变得至关重要。姜黄素(curcumin)是一种从姜科植物中提取的分子量较小的多酚类植物。大量研究显示, 姜黄素具有抗氧化[9]、杀菌消炎[10-11]、清除自由基[9]及抗癌[12]等作用, 并且在临床中发现姜黄素也可作为一种特效药广泛应用于心血管系统和消化系统疾病的治疗。目前, 有关姜黄素抗氧化和防护肝损伤方面的研究多见于小鼠(Mus musculus)[13-14]和畜禽类[15], 研究结果均表明姜黄素对小鼠或肉鸡(Gallus gallus)等动物肝损伤具有保护作用, 而鱼类在此方面的研究却很少见, 仅有喻运珍等[16]对草鱼(Ctenopharynodon idellus)急性肝损伤保护作用的研究, 然而此研究中姜黄素是采用灌胃给药的方法, 较难操作, 对鱼体消化道功能具一定的损伤, 不适用于大规模的养殖过程。而本研究以CCl4诱导尼罗罗非鱼肝急性损伤模型为基础, 姜黄素以添加剂的形式添加于饲料中, 研究饲料中姜黄素对鱼体生长和对急性肝损伤的保护作用, 以期为鱼类保肝药物的进一步开发提供理论依据。
1 材料与方法 1.1 试验设计本试验分为7组, P1组为对照组, P2组为空白对照组, 以基础饲料(不添加姜黄素)投喂; P3、P4、P5、P6、P7为试验组, 饲喂试验饲料(姜黄素的添加水平分别为15 mg/kg、30 mg/kg、60 mg/kg、120 mg/kg和240 mg/kg)。姜黄素(纯度 > 95%)和CCl4分别由西安飞达生物技术有限公司和德州润昕实验仪器有限公司提供。
试验一:连续饲养8周后, 对P1、P3、P4、P5、P6和P7组进行采样, 分析不同添加量的姜黄素对尼罗罗非鱼(Oreochromis niloticus)幼鱼生长性能的影响。试验二:连续饲养8周后, 以0.5 mL/100 g体重的比例, 分别对P1、P3、P4、P5、P6和P7组鱼体腹腔注射30%的CCl4溶液(溶于橄榄油); P2 (空白对照)组的罗非鱼幼鱼在连续饲养8周后, 不进行CCl4溶液注射, 而是按照相同的比例(0.5 mL/100 g体重)注射橄榄油, 72 h后分别采样, 以探究姜黄素对四氯化碳诱导鱼体肝损伤的影响。
1.2 试验饲料试验饲料在山东省淡水渔业研究院营养与饲料加工研究室制备, 先将饲料原料粉碎并过40目筛, 随后采用逐级混匀的方法使原料充分混匀, 加水后用小型颗粒机(SLP-45, 购自中国水产科学研究院渔业机械研究所)制成直径为2 mm的颗粒备用, 基础饲料见表 1。
|
|
表 1 试验饲料配方与营养水平 Tab.1 Formulation and nutrient contents of the experimental diets |
尼罗罗非鱼鱼苗由山东省淡水渔业研究院罗非鱼良种场提供。试验开始前, 使用通威饲料公司提供的沉性饲料暂养, 21 d后, 随机将630尾规格、体重基本一致的鱼苗分为7个组(表 2), 每组3个平行, 每个平行30尾鱼, 分别放入21个网箱(60 cm×60 cm×120 cm)中, 网箱悬挂于室内养殖池中。
|
|
表 2 饲料中姜黄素的添加量对尼罗罗非鱼生长性能和形体指标的影响 Tab.2 Growth performance of Oreochromis niloticus fed diets containing different curcumin levels |
每组试验所用网箱在空间位置上随机分散排布, 减少试验组之间因光线等因素造成的误差。每天投喂3次(分别于8:30、12:30和4:30), 近饱食投喂, 每次投喂持续30 min以上。每天除污确保水质, 日夜连续充气增氧[17]。整个试验期间水质条件为:水温24.5~27.5℃、溶解氧在6 mg/L以上、氨氮在0.1 mg/L以下、亚硝酸盐在0.1 mg/L以下、pH 6.8~7.0。
1.4 采样与处理采样前禁食24 h, 每个网箱随机取3尾鱼, 用质量浓度为100 mg/L的MS-222作快速深度麻醉, 尾静脉采血, 将血样收集在抗凝管中, 以4℃ 6000 r/min转速离心10 min制备血浆, -80℃冻存备用。迅速分离肝和肠道, 并称重[18]。同时, 每条鱼采集肝, 存于波恩氏液中以备作切片用。
1.4.1 生长与形体指标试验结束后, 停喂24 h, 对每缸分别进行称重, 测定每缸鱼的总体重和尾数, 计算特定生长率、增重率、饲料系数及蛋白质效率等。随后每个网箱随机抽取3尾鱼测定体重、体长、内脏重、肝重, 用于肥满度、内脏比、肝体比的测定[19]。
鱼体生长及饲料利用率等指标的计算方法如下:
增重率(weight gain, WG, %)=(Wt–W0)× 100%/W0
特定生长率(specific growth rate, SGR, %/d)= (lnWt−lnW0)×100%/t
脏体比(viserosomatic index, VSI, %)=内脏重× 100%/Wt
肝体比(hepatosomatic index, HIS, %)=肝脏重× 100%/Wt
肥满度(condition factor, CF, %)= Wt×100%/L3
饵料系数(feed conversion ratio, FCR)=F/ (Wt–W0)
式中, W0为实验开始时鱼的体重(g); Wt为实验结束时鱼的体重(g); L为实验结束时鱼的体长(cm); t为鱼的养殖天数(d); F为摄食的饲料量(g)。
1.4.2 血浆肝功能指标测定总蛋白(TP)、白蛋白(ALB)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)和总抗氧化能力(T-AOC)试剂盒均购自南京建成生物工程研究所科技有限公司。
1.4.3 肝抗氧化指标测定采样所取得的肝脏, 在4℃冰箱化冻, 用生理盐水冲洗去掉血液并用滤纸吸干, 以生理盐水为介质按照1 : 9的比例制成匀浆液, 随后离心10 min (转速3000 r/min), 取上清液用于谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)和丙二醛(MDA)的测定, 试剂盒购自南京建成生物工程研究所科技有限公司。
1.4.4 肝组织切片分析养殖试验结束后, 每个网箱中随机取3尾鱼麻醉, 在冰盘上解剖取出肝, 放入预先配制好的波恩氏固定液(配制比例: 1.22%的饱和苦味酸75 mL, 40%的福尔马林溶液25 mL, 冰醋酸5 mL)中进行组织固定[20]。然后按照操作规范对固定好的肝脏组织进行水洗、脱水、透明、浸蜡、包埋和切片(所用切片机型号为Leica RM-2255, 德国)。蜡片制作完成后, 将其附贴于用蛋白甘油处理过的载玻片上进行HE染色, 然后用中性树胶封片。封片结束后, 将组织切片置于光学显微镜(NIKON DS-Fi1)(油镜×1000)下观察。
1.5 数据统计与分析试验数据采用SPSS 17.0软件进行单因素方差分析, 数据差异显著时, 采用Duncan’s检验法进行多重比较, 差异水平定为P < 0.05。试验结果以平均值±标准误(x±SE)表示。
2 结果与分析 2.1 不同添加水平的姜黄素对尼罗罗非鱼生长性能和形体指标的影响由表 2可知, 饲料中添加不同水平的姜黄素可显著影响尼罗罗非鱼的增重率和特定生长率(P < 0.05), 与对照组(P1)和15 mg/kg姜黄素组(P3)相比, 60 mg/kg (P5)和120 mg/kg (P6)姜黄素组的增重率和特定生长率显著升高, 而与30 mg/kg (P4)和240 mg/kg(P7)组无显著差异(P > 0.05);添加不同水平的姜黄素对肝体比、脏体比、饵料系数和肥满度等均无显著影响(P > 0.05)。
2.2 姜黄素对CCl4诱导尼罗罗非鱼肝损伤后血液肝功指标的影响表 3显示, 鱼体未经过CCl4诱导致肝损伤时, 姜黄素在饲料中的添加水平对血浆中GPT和GOT活力影响不显著(P > 0.05);血浆中总蛋白含量和白蛋白含量随着姜黄素添加量的升高而先升高后降低, 姜黄素添加水平对白蛋白无显著影响(P > 0.05), 但却显著影响总蛋白含量(P < 0.05), 由结果可知, 当饲料中姜黄素的添加量为60 mg/kg和120 mg/kg时, 血液中总蛋白含量显著高于对照组(P1和P2) (P < 0.05), 但与其他各姜黄素组均无显著差异(P > 0.05);血浆中总抗氧化能力受饲料中姜黄素的添加水平影响显著(P < 0.05), 与对照组(P1和P2)相比, P4 (30 mg/kg)、P5 (60 mg/kg)和P6 (120 mg/kg)组的T-AOC显著升高(P < 0.05), P6组的T-AOC显著高于P4组(P < 0.05), 其他各组之间差异不显著(P > 0.05)。
|
|
表 3 CCl4诱导前姜黄素对尼罗罗非鱼血浆肝功指标的影响 Tab.3 Effects of curcumin on the plasma liver function of Oreochromis niloticus before CCl4-induced |
表 4显示, 罗非鱼经CCl4诱导处理后, 对照组血液中的GPT和GOT活力明显上升, 而TP和ALB含量以及T-AOC则显著降低(P < 0.05), 与空白对照组(P2)相比, 差异极显著(P < 0.05)。随着饲料中姜黄素添加量的逐渐增大, GPT和GOT活力均先降低后升高, 当添加量为120 mg/kg (P6)时, 血液中GPT活力显著低于(P < 0.05)对照组(P1)和15 mg/kg组(P3), 与其他各组无显著差异; P5、P6和P7组的GOT活力均显著低于(P < 0.05)P1组, 而当姜黄素添加水平为120 mg/kg时, 其效果最佳。与P1组相比, 饲料中添加一定水平的姜黄素均可使鱼体在一定程度上抵抗CCl4侵害, 其TP、ALB和T-AOC的表现为升高, 且以120 mg/kg的姜黄素效果最佳。
|
|
表 4 CCl4诱导后72 h姜黄素对尼罗罗非鱼血浆肝功指标的影响 Tab.4 Effects of curcumin on the plasma liver function of Oreochromis niloticus after 72 h CCl4-induced |
由图 1可知, 在饲料中添加姜黄素在一定程度上可提高肝SOD活力并降低MDA含量, 而鱼体经CCl4诱导处理后, 与空白对照组相比, P1组的肝SOD活力明显降低, MDA含量则显著升高(P < 0.05);但随着饲料中姜黄素添加水平的逐渐增大, SOD活力呈先升高后降低的趋势, 且以60 mg/kg和120 mg/kg姜黄素组的效果最佳(P < 0.05)(图 1A); MDA含量则呈相反趋势, 当姜黄素添加量为30 mg/kg、60 mg/kg和120 mg/kg时, 其MDA均显著低于(P < 0.05) P1组(图 1B)。
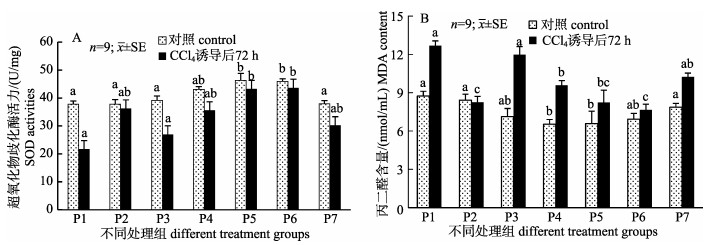
|
图 1 姜黄素对CCl4诱导尼罗罗非鱼肝超氧化物歧化酶活力(A)和丙二醛含量(B)的影响 Fig.1 Effects of curcumin on the activity of SOD (A) and MDA content (B) in CCl4-induced Oreochromis niloticus liver homogenate supernatant |
由图 2可知, CCl4诱导前, 鱼肝中GSH-Px和GSH活力均随着饲料中姜黄素添加量的增加呈先升高后降低的趋势, 但各组之间的GSH-Px活力无显著差异, 当姜黄素添加量为120 mg/kg时, 其肝脏GSH显著高于对照组(P1)和高剂量组(240 mg/kg, P7);当CCl4诱导72 h后, 对照组的GSH-Px和GSH活力均显著降低(P < 0.05), 而二者在姜黄素组的活力均有所升高, 其中, P5 (60 mg/kg)、P6 (120 mg/kg)和P7 (240 mg/kg)组的GSH-Px活力显著高于对照组, 且以120 mg/kg组的GSH活力最高。
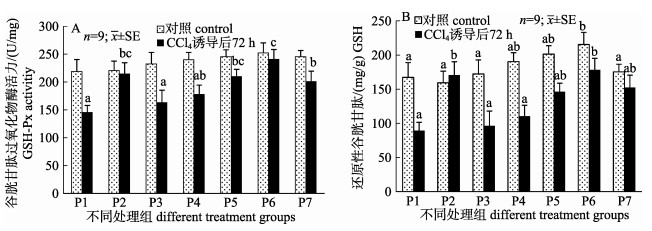
|
图 2 姜黄素对CCl4诱导尼罗罗非鱼肝谷胱甘肽过氧化物酶活力(A)和谷胱甘肽含量(B)的影响 Fig.2 Effects of curcumin on the activity of GPx (A) and GSH content (B) in CCl4-induced Oreochromis niloticus liver homogenate supernatant |
罗非鱼经CCl4诱导后肝组织病理切片如图 3所示。诱导后72 h, 样品在油镜(×1000)下观察, 结果表明, 与空白对照组(P2)相比, CCl4可引起鱼体肝严重损伤, 肝细胞出现严重空泡现象及细胞膨大现象, 大部分肝细胞的细胞核出现偏移。随着姜黄素添加量的增加, 与P1组相比各试验组肝细胞空泡化和膨大现象均出现不同程度的减轻, 其中, P6 (120 mg/kg)和P7 (240 mg/kg)组的肝细胞形状较为正常, 没有表现出细胞膨大现象, 也无明显的脂肪空泡, 细胞核大小适中, 分布于细胞中间。

|
图 3 CCl4诱导72 h后姜黄素对尼罗罗非鱼肝脏组织结构的影响 a代表脂肪空泡; b代表细胞核. Fig.3 Effects of curcumin on liver histology in Oreochromis niloticus in 72 h of CCl4-induced a indicated adipose hollow space; b indicated cell nucleus. |
生长和抗病是广大水产养殖户最关心的两大问题。目前, 在陆生动物的养殖过程中, 存在广泛使用抗生素和其他抗寄生虫药物来达到促生长和提高免疫力的现象[21]。然而, 抗生素存在耐药性, 最终将危害人类的健康。中草药资源丰富且无毒副作用, 目前已被广泛应用于水产动物的养殖过程中[22]。本试验中, 基础饲料里添加60 mg/kg和120 mg/kg的姜黄素可显著促进尼罗罗非鱼的增重率(WG)和特定生长率(SGR), 这一结论与俞军等[23]和胡忠泽等[24]分别在大黄鱼(Larimichthys crocea) (300 mg/kg)和草鱼(Ctenopharyngodon idellus) (0.06%)的研究中得出的最适添加量略有不同, 这可能与姜黄素的纯度和养殖对象及其大小有关。
3.2 CCl4诱导后姜黄素对尼罗罗非鱼血液肝功指标的影响鱼类血液中具有很多生理指标能够很好地体现机体代谢及营养状况。当血浆生理指标发生变化时, 这代表机体可能受到外界因子的影响而发生生理病变。因此, 鱼类的营养和健康状况以及对环境的适应情况大多可以根据血液生理指标的高低来判断。GPT和GOT是鱼类最重要的转氨酶, 具有分布广、活力强的特点, 是反映肝生理状态的重要指标[25]。在肝细胞受损时, GPT和GOT会被释放到血液中, 在一定程度上血浆GOT和GPT活力的相对增加能反映肝功能的障碍, 被认为是肝功能损害最具有特异性和最广泛应用的一个指标[26]。本试验中, 当尼罗罗非鱼未经CCl4诱导时, 血液中GPT和GOT活力无显著差异, 这说明一定范围内添加姜黄素不会导致肝功能损伤, 鱼体肝代谢功能正常, 且肝无肿大、萎缩等现象, 这与肝体比等形体指标无显著差异这一结论是一致的; 而当CCl4诱导鱼体72 h后, 血浆GOT和GPT活力显著升高, 这说明鱼体肝受到严重损伤, 然而当基础饲料中添加一定水平的姜黄素时, 血液中GPT和GOT活力可显著降低, 且以120 mg/kg的水平添加时, GPT活力与对照组显著差异, 这说明饲料中添加一定水平的姜黄素对尼罗罗非鱼肝脏具有保护作用。
血浆中蛋白浓度是反应机体营养和代谢好坏的重要指标, 也间接反映了机体的抗氧化水平。蛋白质代谢多发生在肝中, 当肝损伤时, 血液中TP和ALB活性会发生骤降, 因此, TP和ALB也可作为检测肝功能的重要指标被用于临床鉴定。本试验中, 当鱼体未受CCl4诱导时, 与对照组相比, 一定添加量的姜黄素组TP和ALB含量明显升高; 而当CCl 4诱导72 h后, 对照组的TP和ALB与空白对照组相比明显降低, 然而姜黄素组的TP和ALB含量却逐渐有所回升, 这说明饲料中添加一定含量的姜黄素可促进鱼体蛋白质的合成, 保护鱼肝不受损伤。刘红柏等[27]的研究表明多种中草药不仅可以提高施氏鲟(Acipenser schrenckii)的抗氧化功能, 也能显著提高鱼体TP含量, 与本实验结论一致。原因可能有以下几个方面:首先, 姜黄素本身具有一定的免疫功能, 可通过增加自身免疫力而抵抗外来病源的损伤, 从而促进机体的生长和蛋白质代谢; 其次, 姜黄素作为Nrf2重要的诱导剂, 可通过诱导Nrf2的活力来激活抗氧化通路中相关抗氧化酶的基因表达, 最终达到提高肝脏抗氧化功能的目的[28]。
3.3 CCl4诱导后姜黄素对尼罗罗非鱼肝抗氧化指标的影响在生物体正常的代谢活动中, 活性氧(超氧化物阴离子(O2–)、羟基阴离子(•OH)和过氧化氢(H2O2)等的产生和代谢维持着机体的动态平衡。SOD可将O2–歧化为H2O2, 而谷胱甘肽过氧化物酶(GSH-Px)又可通过还原性谷胱甘肽(GSH)将H2O2催化生成水, 以达到抵抗体内自由基的目的。MDA是脂质过氧化的产物, 是由羟基阴离子攻击细胞膜所产生的, 具有很强的生物毒性, 并会破坏细胞的结构和功能。本试验中, 60 mg/kg和120 mg/kg姜黄素组的SOD活力和GSH含量显著高于对照组和240 mg/kg姜黄素组, 而MDA含量的趋势正好相反, 这说明姜黄素在一定范围内可提高鱼体的抗氧化功能, 同样的结论也见于Malar和Charles的研究[29]。而当尼罗罗非鱼经CCl4诱导72 h后, 对照组的SOD、GPx活力和GSH含量出现了明显降低, MDA含量也明显升高, 但当饲料中添加一定含量的姜黄素时, 鱼体肝脏中抗氧化物活力得到明显改善, 且以120 mg/kg添加水平的效果最佳。这说明, 120 mg/kg的姜黄素在一定程度上提高了鱼体抗氧化功能, 保护肝脏不受损伤。这可能是因为姜黄素可以通过抑制CCl4引起的NF-κB/c-Rel、IL-1β、TNF-α mRNA表达量和NF-κB/c-Rel蛋白水平上调, 来调控部分抗氧化酶的活力, 最终保护肝脏不受损伤[30]。
3.4 四氯化碳诱导后姜黄素对尼罗罗非鱼肝组织结构的影响机体中抗氧化机制可以被许多因素所调节, 而最终抗氧化功能的提高是各种抗氧化因子共同作用的结果。因此, 在一个试验中, 一个单纯的抗氧化指标的上升或下降并不能说其抗氧化功能是被增强还是抑制了, 这与各个抗氧化指标之间的相互作用并不同步。所以关于姜黄素可以提高罗非鱼抗氧化功能以保护肝不受损伤, 需要进一步的更加可信的指标来证明。CCl4是一种最常见的肝损伤诱导剂, 被广泛应用于畜禽、小鼠及临床等试验中, 所以通过观察经CCl4诱导后机体的肝脏组织切片是一个用来确定姜黄素是否具有肝脏保护作用的最直接、最客观的方法。本试验中, 鱼体经CCl4诱导后, 与空白对照组相比, 对照组肝细胞的空泡化及细胞核偏移等现象严重, 然而, 姜黄素组的空泡化有所缓解, 其中30 mg/k、60 mg/k、240 mg/kg组有轻微空泡化, 120 mg/kg组的细胞基本无空泡化, 这说明姜黄素对鱼体具有保护肝脏不受损伤的功能, 且以120 mg/kg的添加水平效果最佳。类似的结论在人[31]和小鼠[32]中均有报道。这可能是因为姜黄素可以诱导机体产生ROS, 其可使受损细胞的DNA分子损伤, 通过调节细胞凋亡相关基因的表达以期修复肝功能[33], 但剂量不足或者过量均不能达到最佳效果。
4 结论饲料中添加60 mg/kg和120 mg/kg姜黄素可提高尼罗罗非鱼幼鱼的生长性能; 姜黄素对尼罗罗非鱼的抗氧化功能有一定促进作用, 当姜黄素的添加水平为120 mg/kg时, 可最大程度降低其幼鱼脂质过氧化, 保护肝脏不受损伤, 机体的抗氧化功能最强。
| [1] |
Hu B L. Research on the prevention of fish liver and gall syndrome[J]. Journal of Aquaculture, 2006, 27(2): 335. [胡宝林. 鱼类肝胆综合症的防治[J]. 水产养殖, 2006, 27(2): 335.] |
| [2] |
Arnold H, Pluta H J, Braunbeck T. Sublethal effects of prolonged exposure to disulfoton in rainbow trout (Oncorhynchus mykiss):cytological alterations in the liver by a potent acetylcholine esterase inhibitor[J]. Ecotoxicology and Environmental Safety, 1996, 34(1): 43-55. DOI:10.1006/eesa.1996.0043 |
| [3] |
Adzet T, Camarasa J, Laguna J C. Hepatoprotective activity of polyphenolic compounds from Cynara scolymus against CCl4 toxicity in isolated rat hepatocytes[J]. Journal of Natural Products, 1987, 50(4): 612-617. DOI:10.1021/np50052a004 |
| [4] |
Koneri R, Balaraman R, Firdous K M V, et al. Hepatoprotective effects of Momordica Cymbalaria Fenzl. against carbon tetrachloride induced hepatic injury in rats[J]. Pharmacologyonline, 2008, 1: 365-374. |
| [5] |
Statham C N, Croft W A, Lech J J. Uptake, distribution, and effects of carbon tetrachloride in rainbow trout (Salmo gairdneri)[J]. Toxicology and Applied Pharmacology, 1978, 45(1): 131-140. DOI:10.1016/0041-008X(78)90034-0 |
| [6] |
Koskinen H, Pehkonen P, Vehniäinen E, et al. Response of rainbow trout transcriptome to model chemical contaminants[J]. Biochemical and Biophysical Research Communications, 2004, 320(3): 745-753. DOI:10.1016/j.bbrc.2004.06.024 |
| [7] |
Liu H C, Cai L H, Wang S Y. Progress on antitumor mechanisms of Polyporus polysaccharide[J]. Journal of Henan University of Science and Technology:Medical Edition, 2011, 29(3): 236-238. [刘洪超, 蔡林衡, 王淑英. 猪苓多糖抗肿瘤机制研究进展[J]. 河南科技大学学报:医学版, 2011, 29(3): 236-238.] |
| [8] |
Zhang M Y, Wang J X. The pathogenesis and treatment of fish liver and gall syndrome[J]. Journal of China Aquatic, 2009(10): 61-62. [张忙友, 王菊肖. 鱼类肝胆综合症的发病规律及治疗措施[J]. 中国水产, 2009(10): 61-62. DOI:10.3969/j.issn.1002-6681.2009.10.027] |
| [9] |
Yang K Y, Gu J L, Yin D M, et al. Effect of curcumin on iNOS expression in LPS-activated microglia cells and anti-oxidation[J]. Chinese Journal of Biochemistry and Molecular Biology, 2007, 23(11): 938-945. [杨开艳, 顾建兰, 殷冬梅, 等. 姜黄素对脂多糖激活的小胶质细胞iNOS表达的抑制及抗氧化作用[J]. 中国生物化学与分子生物学报, 2007, 23(11): 938-945. DOI:10.3969/j.issn.1007-7626.2007.11.011] |
| [10] |
Bengmark S. Curcumin, an atoxic antioxidant and natural NFκB, cyclooxygenase-2, lipooxygenase, and inducible nitric oxide synthase inhibitor:a shield against acute and chronic diseases[J]. Journal of Parenteral and Enteral Nutrition, 2006, 30(1): 45-51. DOI:10.1177/014860710603000145 |
| [11] |
Maczurek A, Hager K, Kenklies M, et al. Lipoic acid as an anti-inflammatory and neuroprotective treatment for Alzheimer's disease[J]. Advanced Drug Delivery Reviews, 2008, 60(13): 1463-1470. |
| [12] |
Kuttan G, Hari Kumar K B, Guruvayoorappan C, et al. Antitumor, anti-invasion, and antimetastatic effects of curcumin[J]. The Molecular Targets and Therapeutic Uses of Curcumin in Health and Disease, 2007, 173-184. |
| [13] |
Ma X L, Li X M, Chu F, et al. Protective effect of curcumin on liver injury induced by endoplasmic reticulum stress in mice[J]. Acta Universitatis Medicinalis Anhui, 2014, 49(11): 1629-1633. [马晓磊, 李晓明, 储菲, 等. 姜黄素对内质网应激诱导小鼠肝损伤的保护作用[J]. 安徽医科大学学报, 2014, 49(11): 1629-1633.] |
| [14] |
Han G, Wan H, Zhai G Y, et al. Protective effect of curcumin solid dispersionon acute liver injury induced by carbon tetrachloride in mice[J]. Lishizhen Medicine and Materia Medica Research, 2009, 20(6): 1321-1322. [韩刚, 万红, 翟冠钰, 等. 姜黄素固体分散体对四氯化碳致小鼠急性肝损伤的保护作用[J]. 时珍国医国药, 2009, 20(6): 1321-1322. DOI:10.3969/j.issn.1008-0805.2009.06.012] |
| [15] |
Zhang J F. The protective effects of curcumin on mitochondrial oxidant damages in animals and the potential antioxidant mechanism[D]. Nanjing: Nanjing Agricultural University, 2015. [张婧菲.姜黄素对动物线粒体氧化损伤的保护作用及其抗氧化机制研究[D].南京: 南京农业大学, 2015.] http://cdmd.cnki.com.cn/Article/CDMD-10307-1017042049.htm
|
| [16] |
Yu Y Z, Yu S M, Xiong W J, et al. The protective effect of curcumin in acute hepatic injuried Ctenopharyngodon idellus[J]. Hubei Agricultural Sciences, 2016, 55(6): 1514-1517. [喻运珍, 余少梅, 熊文静, 等. 姜黄素对草鱼急性肝损伤的保护作用研究[J]. 湖北农业科学, 2016, 55(6): 1514-1517.] |
| [17] |
Zhang C N, Wang A M, Liu W B, et al. Effects of dietary lipid levels on fat deposition, lipid metabolize enzyme and antioxidantic activities of Chelon haematocheilus[J]. Journal of Fishery Sciences of China, 2013, 20(1): 108-115. [张春暖, 王爱民, 刘文斌, 等. 饲料脂肪水平对梭鱼脂肪沉积、脂肪代谢酶及抗氧化酶活性的影响[J]. 中国水产科学, 2013, 20(1): 108-115.] |
| [18] |
Liao Y J, Liu B, Ren M C, et al. Effects of dietary arginine level on growth performance, free essential amino acids, hematological characteristics, and immune response in juvenile blunt snout bream (Megalobrama amblycephala)[J]. Journal of Fishery Sciences of China, 2014, 21(3): 549-559. [廖英杰, 刘波, 任鸣春, 等. 精氨酸对团头鲂生长、血清游离精氨酸和赖氨酸、血液生化及免疫指标的影响[J]. 中国水产科学, 2014, 21(3): 549-559.] |
| [19] |
Wu F, Wen H, Jiang M, et al. Effect of dietary vitamin C on growth performance, flesh quality and antioxidant function in genetically improved farmed tilapia[J]. Journal of Fishery Sciences of China, 2015, 22(1): 79-87. [吴凡, 文华, 蒋明, 等. 饲料维生素C水平对吉富罗非鱼生长性能、肌肉品质和抗氧化功能的影响[J]. 中国水产科学, 2015, 22(1): 79-87.] |
| [20] |
Du J L, Jia R, Cao L P, et al. Protective effects of Polyporus umbellatus polysaccharide on liver injury induced by carbon tetrachloride in Cyprinus carpio var. Jian[J]. Journal of Southern Agriculture, 2013, 44(9): 1564-1570. [杜金梁, 贾睿, 曹丽萍, 等. 猪苓多糖对四氯化碳诱导建鲤肝损伤的保护作用[J]. 南方农业学报, 2013, 44(9): 1564-1570. DOI:10.3969/j:issn.2095-1191.2013.9.1564] |
| [21] |
Turnidge J. Antibiotic use in animals-prejudices, perceptions and realities[J]. Journal of Antimicrobial Chemotherapy, 2004, 53(1): 26-27. |
| [22] |
Yin G, Jeney G, Racz T, et al. Effect of two Chinese herbs (Astragalus radix and Scutellaria radix) on non-specific immune response of tilapia, Oreochromis niloticus[J]. Aquaculture, 2006, 253(1): 39-47. |
| [23] |
Yu J, Chen Q T, Li S Y, et al. Effects of curcumin on growth and non-specific immunity of Pseudosciaena crocea[J]. Journal of Southern Agriculture, 2015, 46(7): 1315-1321. [俞军, 陈庆堂, 李宋钰, 等. 姜黄素对大黄鱼生长及非特异性免疫功能的影响[J]. 南方农业学报, 2015, 46(7): 1315-1321. DOI:10.3969/j:issn.2095-1191.2015.7.1315] |
| [24] |
Hu Z Z, Yang J F, Tan Z J, et al. Effects of curcumin on the production performance and immune function of broiler chickens[J]. Cereal and Feed Industry, 2003(11): 29-30. [胡忠泽, 杨九峰, 谭志静, 等. 姜黄素对草鱼生长和肠道酶活力的影响[J]. 粮食与饲料工业, 2003(11): 29-30. DOI:10.3969/j.issn.1003-6202.2003.11.020] |
| [25] |
Hemre G I, Waagbø R, Hjeltnes B, et al. Effect of gelatinized wheat and maize in diets for large Atlantic salmon (Salmo salar L.) on glycogen retention, plasma glucose and fish health[J]. Aquaculture Nutrition, 1996, 2(1): 33-39. DOI:10.1111/anu.1996.2.issue-1 |
| [26] |
Sheikhzadeh N, Tayefi-Nasrabadi H, Oushani A K, et al. Effects of Haematococcus pluvialis supplementation on antioxidant system and metabolism in rainbow trout (Oncorhynchus mykiss)[J]. Fish Physiology and Biochemistry, 2012, 38(2): 413-419. DOI:10.1007/s10695-011-9519-7 |
| [27] |
Liu H B, Huang J, Ma A Z, et al. Effects of the Chinese medicinal herb compound additives on growth and blood biochemical indicator of Amur sturgeon (Acipenser schrencki Brandt)[J]. Chinese Journal Fisheries, 2009, 22(3): 14-18. [刘红柏, 黄江, 马爱枝, 等. 中草药复方添加剂对施氏鲟生长及血液生化指标的影响[J]. 水产学杂志, 2009, 22(3): 14-18.] |
| [28] |
Charoensuk L, Pinlaor P, Prakobwong S, et al. Curcumin induces a nuclear factor-erythroid 2-related factor 2-driven response against oxidative and nitrative stress after praziquantel treatment in liver fluke-infected hamsters[J]. International Journal for Parasitology, 2011, 41(6): 615-626. DOI:10.1016/j.ijpara.2010.12.011 |
| [29] |
Malar H L V, Charles P M. Effect of turmeric Curcuma longa Linn. extract on immunity and resistance to Vibrio harveyi in black tiger shrimp Penaeus monodon[J]. International Journal of Research in Zoology, 2013, 3(2): 21-26. |
| [30] |
Cao L, Ding W, Du J, et al. Effects of curcumin on antioxidative activities and cytokine production in Jian carp (Cyprinus carpio var. jian) with CCl4-induced liver damage[J]. Fish and Shellfish Immunology, 2015, 43(1): 150-157. DOI:10.1016/j.fsi.2014.12.025 |
| [31] |
Jing X, Ueki N, Cheng J, et al. Induction of apoptosis in hepatocellular carcinoma cell lines by emodin[J]. Cancer Science, 2002, 93(8): 874-882. |
| [32] |
Hemeida R A, Mohafez O M. Curcumin attenuates methotraxate-induced hepatic oxidative damage in rats[J]. Journal of the Egyptian National Cancer Institute, 2008, 20(2): 141-148. |
| [33] |
Jiang S, Song M J, Shin E C, et al. Apoptosis in human hepatoma cell lines by chemotherapeutic drugs via fas-dependent and fas-independent pathways[J]. Hepatology, 1999, 29(1): 101-110. DOI:10.1002/(ISSN)1527-3350 |
 2018, Vol. 25
2018, Vol. 25


