增殖放流是海洋生物资源养护的重要方式[1]。标志重捕是研究放流对象扩散、洄游、生长[2], 评价增殖放流效果[3], 优化增殖群体利用方式的重要手段[4]。为开展相关研究, 国内外学者研发了包括生物标记、化学标记、分子标记、外部标志在内的多种形式标志标记方法[5], 其中外部标志技术中的挂牌标志因其易操作、易识别等特点成为常用的标志方法之一[6-7]。国内外学者已对金头鲷(Sparus aurata)[8]、欧洲无须鳕(Merluccius merluccius)[9]、大黄鱼(Pseudosciaena crocea)[10]、褐牙鲆(Paralichthys olivaceus)[5]等海水鱼类开展了挂牌标志技术研究。
大亚湾是中国南海区典型半封闭海湾之一[11], 海域内生物资源丰富、生境多样, 曾经是许多鱼类的产卵、索饵、育肥海域之一, 同时是省级水产资源自然保护区[12]。近年来, 随着过度捕捞、海洋生态环境破坏等的加剧, 该海域鱼类种类不断减少, 生境扰动和破坏严重, 鲷科鱼类等优质经济鱼类生物量明显降低, 以真鲷(Pagrosomus major)为主的鲷科鱼类已不能成为该海域优势种类[13-14]。林金錶等[2]已在该海域初步开展了黑鲷(Acanthopagrus schlegelii)标志放流技术研究,而其后十数年未见其他有关报道。本研究对2014—2016年大亚湾海域放流的标志黑鲷进行回捕跟踪, 对回捕数据进行整理分析, 以期为今后制定该海域的鲷科鱼类增殖放流策略提供技术支撑与理论指导。
1 材料与方法 1.1 黑鲷幼鱼标志保持率与生长实验对黑鲷幼鱼以下4个不同部位刺挂塑料椭圆标志牌(plastic oval tags): (1)标志鱼背鳍鳍棘膜DS; (2)标志鱼背鳍前部基部肌肉组织DF; (3)标志鱼背鳍后部基部肌肉组织DB; (4)标志鱼臀鳍基部肌肉组织A; (5)对照C。统计10 d后不同标志位置POTs保持率与死亡率。
待标志幼鱼标志前24 h饥饿处理。标志时, 配备30~50 mg/L质量浓度MS-222海水麻醉液, 放入黑鲷幼鱼持续麻醉时间不超过5 min。将POTs刺挂于黑鲷幼鱼鳍棘基部第4~6鳍棘下方5 mm处背部肌肉中, 利用标枪打出“工”形挂针, 穿过标牌上的圆孔、穿刺固定到鱼体(图 1)。

|
图 1 POTs对黑鲷幼鱼的标志效果 POTs规格: 0.1 mm×8 mm×15 mm; “工”字形刺挂针规格:长8 mm. Fig.1 Marking effect of POTs tagged on juvenile Acanthopagrus schlegelii POTs size: 0.1 mm × 8 mm × 15 mm. The size of the "工" type prickle: 8 mm long. |
分试验组和对照组, 每组设置3个平行, 每个平行500尾黑鲷幼鱼, 平均体长(68.60±6.21) mm, 平均体重(8.05±2.33) g。将每个平行置于3 m× 3 m×2 m的网箱中进行为期90 d的养殖试验, 养殖45 d时每个平行随机抽取50尾测量体长、体重, 90 d后全部捞取测量体长、体重, 统计存活率、标志保持率。
1.2 放流苗种放流黑鲷苗种为汕头市南海渔业公司与深圳市高氏水产种鱼繁养殖场繁育, 标粗至50~100 mm的黑鲷幼鱼, 放流前10 d左右逐步调节盐度至放流海区盐度, 标志前提前1 d禁食。采用1.1所述方式标志黑鲷幼鱼。
1.3 标志放流与标志鱼回收2014—2016年在大亚湾海域放流标志黑鲷幼鱼3批次, 分别在2014年11月(201411), 2015年6月(201506)和2016年7月(201607)。标志黑鲷幼鱼共计60115尾, 不同批次选择不同颜色POTs标牌以作区分。放流点选择在深圳杨梅坑人工鱼礁区附近海域、珍珠湾港口附近海域与鹅公湾附近海域(表 1)。放流时间选择禁渔期间的6—7月, 大规格苗种放流选择在11月。制作回捕宣传海报并设置“有奖回收”点, 对捕获标志鱼进行回收, 获得回捕样品, 收集回捕日期、回捕地点、回捕方式等信息。对回捕标志鱼逐尾进行体长、体重等基础生物学测定。
|
|
表 1 2014—2016年标志放流黑鲷幼鱼的部分信息 Tab.1 Tagging-release information on released Acanthopagrus schlegelii from 2014 to 2016 in Daya Bay |
回捕黑鲷体长测量精确到0.1 cm, 体重精确到0.1 g。根据放流时间与回捕时间确定回捕月龄(month)[5]:月龄=(回捕日期-放流日期)/30。参照Schmalenbach等[15], 通过月平均生长速率评估放流标志鱼生长情况:体长平均生长速率=(回捕时体长-放流时体长)/月龄; 体重平均生长速率=(回捕时体重-放流时体重)/月龄。
2 结果与分析 2.1 POTs不同标志部位效果及其对黑鲷幼鱼生长的影响比较不同标志位置保持效果, 其中DF位置标志效果最好(99%), DB与A位置次之(94%, 87%), DS位置效果最差(23%), 死亡率各组均为0%。
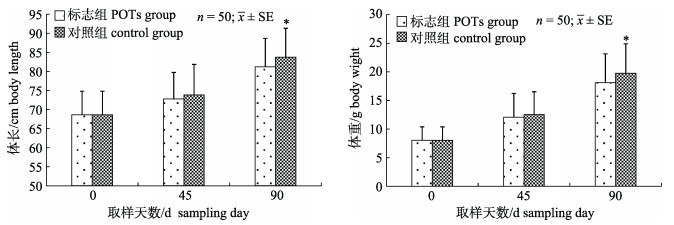
标志组与对照组黑鲷幼鱼45 d之内生长无显著性差异(P > 0.05), 90 d后两者体长与体重均有显著性差异(P < 0.05, 图 2); 标志黑鲷存活率平均为87.53%, 对照组平均为88.20%。统计POTs保持状况, 90 d后各试验组标志保持率平均为81.76%。
|
图 2 POTs标志黑鲷0 d、45 d、90 d的体长与体重 *表示与对照组差异显著(P < 0.05). Fig.2 Mean body length and weight mass of Acanthopagrus schlegelii following POTs tagging on the 0, 45th and 90th day during the growth experiment *indicates significant difference between POT group and control group (P < 0.05). |
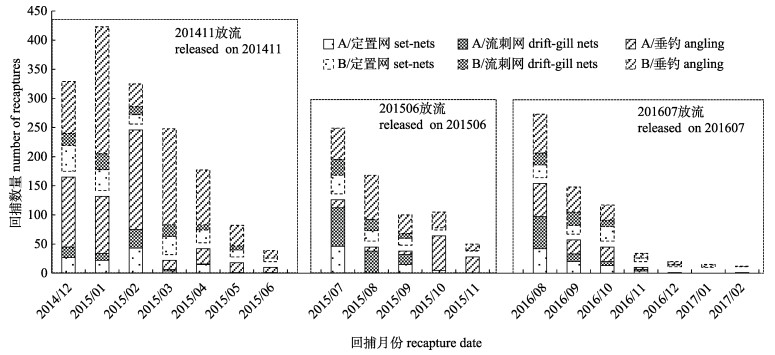
3个批次共计放流POTs标志黑鲷幼鱼60115尾, 确认回捕2758尾, 平均回捕率4.59%;实际收回到实验室“实体鱼”1204尾, 其余为“信息鱼”; 其中2014年批次回捕1563尾(回捕率7.76%), 2015年批次回捕622尾(回捕率3.66%), 2016年批次回捕573尾(回捕率2.49%)。回捕数量随时间推移显著降低, 大部分回捕标志鱼出现在放流后的3~5个月内, 放流7个月后少有回捕。回捕标志鱼被定置网、流刺网、垂钓3种方式捕获, 以垂钓回捕数量最多, 定置网其次。
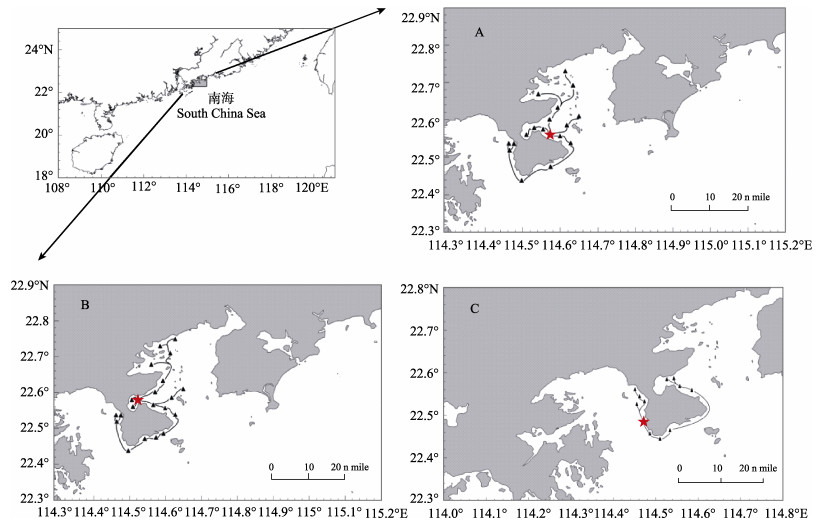
2.3 标志鱼的迁移扩散2014年批次: POTs标志黑鲷幼鱼被放流至大亚湾西岸珍珠岛码头附近海区后, 经过短暂适应停留, 沿不同方向进行扩散。根据回捕信息, 标志黑鲷幼鱼分4个方向进行扩散:其中两支向湾内进行迁移, 一支游向水头附近并在河涌咸淡水区域作停留, 一支越过水头沿着海岸线向惠州方向扩散, 一支穿过杨梅坑人工鱼礁区向大亚湾中心部位迁移, 最后一支迁移最远, 沿着大鹏半岛洄游迁移至南澳附近海域, 迁移距离达70余km。绘制放流后黑鲷的迁移路线(图 4A), 显示放流标志黑鲷呈近岸辐射状迁移扩散。
|
图 3 2014—2016年标志黑鲷幼鱼回捕数量 A:被送回实验室的标志黑鲷, 为实体鱼; B:仅送回标牌或回捕信息的标志黑鲷, 为信息鱼. Fig.3 The number of Acanthopagrus schlegelii recaptured from 2014 to 2016 A: tagged A. schlegelii, which had been returned to the laboratory. B: only tag or information (no fish) collected. |
|
图 4 放流标志黑鲷迁移路线 A. 2014年11月放流, B. 2015年6月放流, C. 2016年7月放流; ★代表放流地点; ▲代表回捕地点, 黑线为推测出的迁移路线. Fig.4 The migratory paths of tagged Acanthopagrus schlegelii after being released A. Released in November 2014; B. Released in June 2015; C. Released in July 2016. ★ shows the releasing location. ▲ shows the recaptured location. Black lines represent migratory paths of released A. schlegelii, which were surmised. |
2015年批次:该批次标志鱼被放流至大亚湾杨梅坑近岸人工鱼礁区, 放流后1~3个月, 标志黑鲷多在邻近礁区附近被流刺网和地笼网获得, 之后标志黑鲷幼鱼分两个方向扩散。绘制放流后黑鲷的迁移路线(图 4B), 同样呈近岸辐射状迁移扩散。
2016年批次:该批次标志鱼被放流至近大鹏湾口鹅公湾海域附近。放流后的5个月时间内, 一部分标志黑鲷被流刺网、地笼网捕获, 一部分被钓鱼爱好者钓获。整理回捕信息, 标志黑鲷分为两支进行扩散, 一支游向大鹏湾内, 另一支绕过大鹏半岛游向大亚湾, 沿着海岸线向大亚湾扩散(图 4C)。
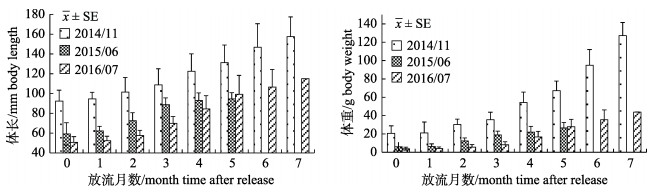
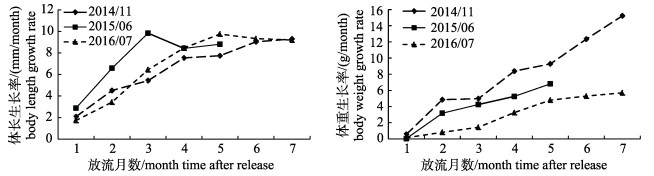
2.4 生长情况将回捕到的黑鲷实体鱼全部带回测量体长、体重, 逐月计算平均生长率。标志鱼生长情况如图 5、图 6所示。201411批次放流标志鱼规格较201506、201607批次大(表 1), 放流7个月后, 体长自(92.44±10.99) mm增加至(157.52±0.00) mm, 体重自(20.81±8.02) g增加至(127.36±0.00) g, 体长、体重增长70.40%和512.01%; 201506批次放流5个月后, 体长、体重增长59.51%和322.75%; 201607批次放流7个月后, 体长、体重增长127.20%和989.83%。体长、体重绝对增加量以放流规格最大的201411批次最大; 增长百分比则以201607批次最大。放流后的1~2个月, 标志鱼体长、体重增长较缓慢, 随后大规格放流标志鱼在体重增长方面表现出更高的生长速率(图 6)。
|
图 5 标回捕志黑鲷体长和体重的生长 Fig.5 Body length and body weight growth of tagged Acanthopagrus schlegelii from recaptured |
|
图 6 标回捕志黑鲷体长生长率和体重生长率变化 Fig.6 Body length growth rates and body weight growth rates of tagged Acanthopagrus schlegelii from recaptured |
按标志牌固定类型可将其分为刺穿固定[16]与内锚固定[7]两种, 本研究使用的POTs为刺穿固定。实验结果显示, 标志牌刺挂位置能显著影响POTs的保持效果, 背鳍基部肌肉组织位置(背鳍基部向下约0.5 cm)为刺挂POTs合适位置, 这与刘家富等[17]对大黄鱼、徐开达等[18]对黑鲷挂牌标志位置与方法类似。在被标志的初始阶段(10 d内), 黑鲷幼鱼100%存活, POTs的刺挂操作与携带并非其致死的直接原因, Lv等[16]对褐牙鲆的研究结果也支持了这一推测; 根据实验观察推断, 后期的死亡率较高可能与标志黑鲷摩擦网箱网衣导致标志牌脱落引发的伤口感染有关[19]。幼鱼在被刺挂POTs 90 d后, 其体长、体重指标与对照组呈现显著性差异(P > 0.05);标志牌的携带, 可能会使被标志黑鲷产生更多的能量消耗[20], 从而影响其生长。早期的标志牌脱落, 与标志操作及创伤感染有关, 之后的脱落推测与创口再次感染、捕食等有关。王茂元等[21]对鲢(Hypophthalmichthys molitrix)体外标志90 d后保持率为70%, 稍低于本研究; 另有报道显示, 在野外, 标志牌可在标志鱼体保持16个月以上[16], 在贝类[22]、甲壳类[23]上可保持更久。
3.2 标志黑鲷的回捕效率中国黑鲷标志试验最早见于林金錶等[2], 其回捕率为8.0%, 较本研究高, 分析原因可能是宣传力度不足以及经济奖励刺激较弱所致[24]; 同时, 标志死亡与标志脱落也是影响回捕率不可忽略的因素之一[21]。不同规格的标志黑鲷, 标志回捕率大规格(201411批次, 回捕率7.76%)高于小规格(201506、201607批次, 回捕率3.66%、2.49%), 这与褐牙鲆不同规格的标志回捕率相当[25]。研究表明, 人工放流苗种因饵料获得与捕食逃避等原因, 在自然水域的生态适应能力明显弱于野生对象[26]。
分析3种不同类型的方式回捕, 垂钓回捕数量占据了总回捕数的62.08%, 而占大亚湾渔业产量相当比例的拖网从未收到回捕信息。分析原因, 黑鲷作为典型的恋礁性鱼类[27], 其大多分布在礁石周围, 而礁石区域通常则是拖网作业避开区域, 这就限制了该渔具渔法对黑鲷的捕获, 而海底地形复杂的区域通常是垂钓爱好者中意的钓点选择之一。值得注意的是, 大规格放流黑鲷回捕率的71.47%是由垂钓贡献, 可以出这样一个假设:大规格黑鲷苗种回捕率更高的原因可能是因其更易被捕获, 而并非其在自然水域的适应能力更强于小规格苗种?因此, 开展放流苗种放流前的野外驯化研究, 同时对放流群体在自然水域中生存规律进行研究, 或可解开此问, 同时可提升放流群体在自然水域中的适应存活能力。放流规格对于回捕率的影响较大, 但不是唯一因素:放流对象的生态习性以及放流时间的选择等同样会影响回捕率。
3.3 标志黑鲷的扩散分布及生长情况黑鲷具有集群行为, 但其仍呈现出分散辐射的扩散, 可能与海区捕食者的存在以及食物密度的非均匀分布有关[28]。最初1~3个月回捕的黑鲷大多出现在人工鱼礁区, 可能是因为礁区为其提供了适应自然环境、躲避敌害的屏障, 且礁区的食物更加丰富。不同季节放流的黑鲷表现出类似的扩散方式和较弱的迁移能力, 这种现象更多与其恋礁习性有关[28], 且在较小规格标志鱼上表现更为明显。不同季节放流的标志鱼同样表现出不同特点, 冬季放流黑鲷更多会向湾内进行扩散, 这与黑鲷冬季进行近岸入湾的洄游习性相符[27]。
放流后1~2个月的标志黑鲷生长较慢, 随后相对加快, 与徐开达等[18]研究结果一致; 大规格的放流黑鲷表现出更高的生长速率。有关研究结果表明, 食物、水温和盐度是影响鲷科鱼类生长的主要因素[29]。黑鲷杂食性, 幼鱼自然水域以藻类、多毛类、甲壳类、贝类为主要食物[30], 在苗种的人工培育阶段, 主要投喂人工配合饲料, 放流后的苗种需在自然水域中主动觅食, 摄食难度和因摄食而产生的能量消耗增加是导致其放流后初期生长缓慢的主要原因。
| [1] |
Cheng J H, Jiang Y Z. Marine stock enhancement:Review and prospect[J]. Journal of Fishery Sciences of China, 2010, 17(3): 610-617. [程家骅, 姜亚洲. 海洋生物资源增殖放流回顾与展望[J]. 中国水产科学, 2010, 17(3): 610-617.] |
| [2] |
Lin J B, Chen T, Chen L, et al. The techniques of Sparus marocephalus tagged and released in Daya Bay[J]. Journal of Fisheries of China, 2001, 25(1): 79-83. [林金錶, 陈涛, 陈琳, 等. 大亚湾黑鲷标志放流技术[J]. 水产学报, 2001, 25(1): 79-83.] |
| [3] |
Liang J, Wang W D, Lin G Z, et al. Effect and assessment of enhancement release of Nibea japonica and Sparus macrocephalus in artificial reef habitat waters of Zhoushan, Zhejiang[J]. Journal of Fishery Sciences of China, 2010, 17(5): 1075-1084. [梁君, 王伟定, 林桂装, 等. 浙江舟山人工生境水域日本黄姑鱼和黑鲷的增殖放流效果及评估[J]. 中国水产科学, 2010, 17(5): 1075-1084.] |
| [4] |
Jiang Y Z, Lin N, Liu Z L, et al. Effectiveness of Nibea albiflora stock enhancement in Xiangshan Bay and prioriti-zation of fishing strategy for the released stock[J]. Journal of Fishery Sciences of China, 2016, 23(3): 641-647. [姜亚洲, 林楠, 刘尊雷, 等. 象山港黄姑鱼增殖放流效果评估及增殖群体利用方式优化[J]. 中国水产科学, 2016, 23(3): 641-647.] |
| [5] |
Lv H J. Experimental studies of marking techniques and mark-recapture for juvenile black rockfish (Sebastes schlegelii) and Japanese flounder (Paralichthys oliva-ceus)[D]. Qingdao: Ocean University of China, 2013: 67-83. [吕红健.许氏平鲉和褐牙鲆标志技术与标志放流追踪评价[D].青岛: 中国海洋大学, 2013: 67-83.]
|
| [6] |
Liu Y, Sun D R, Geng Q, et al. Comparative study on im-mersion marking with alizarin red S and calcein for black porgy Acanthopagrus schlegelii of different sizes[J]. South China Fisheries Science, 2016, 12(6): 17-24. [刘岩, 孙典荣, 耿倩, 等. 茜素红与钙黄绿素标记不同规格黑鲷幼鱼的比较研究[J]. 南方水产科学, 2016, 12(6): 17-24. DOI:10.3969/j.issn.2095-0780.2016.06.003] |
| [7] |
Liu X Z, Xu Y J, Zhou X Z, et al. Study on tagging of the Tongue sole using T-bar tags[J]. Advances in Marine Sci-ence, 2013, 31(2): 273-280. [柳学周, 徐永江, 陈学周, 等. 半滑舌鳎苗种体外挂牌标志技术研究[J]. 海洋科学进展, 2013, 31(2): 273-280. DOI:10.3969/j.issn.1671-6647.2013.02.014] |
| [8] |
Sánchez-Lamadrid A. Effectiveness of four methods for tagging juveniles of farm-reared gilthead sea bream, Sparus aurata, L[J]. Fisheries Management and Ecology, 2001, 8(3): 271-278. DOI:10.1046/j.1365-2400.2001.00249.x |
| [9] |
Jolivet A, de Pontual H, Garren F, et al. Effects of T-bar and DST tagging on survival and growth of European hake[M]. Dordrecht: Springer, 2009: 181-193.
|
| [10] |
Ma X L, Zhou Y D, Xu K D, et al. The tagging release of great yellow croaker, Pseudosciaena crocea in Zhejiang coastal waters[J]. Journal of Zhejiang Ocean University (Natural Science), 2016, 35(1): 24-29. [马晓林, 周永东, 徐开达, 等. 浙江沿岸大黄鱼标志放流及回捕率调查研究[J]. 浙江海洋学院学报(自然科学版), 2016, 35(1): 24-29. DOI:10.3969/j.issn.1008-830X.2016.01.005] |
| [11] |
Chen P M, Yuan H R, Jia X P, et al. Changes in fishery resources of Yangmeikeng artificial reef area in Daya Bay[J]. South China Fisheries Science, 2013, 9(5): 100-108. [陈丕茂, 袁华荣, 贾晓平, 等. 大亚湾杨梅坑人工鱼礁区渔业资源变动初步研究[J]. 南方水产科学, 2013, 9(5): 100-108. DOI:10.3969/j.issn.2095-0780.2013.05.016] |
| [12] |
Wang Y S, Wang Z D, Huang L M. Environment changes and trends in Daya Bay in recent 20 years[J]. Journal of Tropical Oceanography, 2004, 23(5): 85-95. [王友绍, 王肇鼎, 黄良民. 近20年来大亚湾生态环境的变化及其发展趋势[J]. 热带海洋学报, 2004, 23(5): 85-95. DOI:10.3969/j.issn.1009-5470.2004.05.012] |
| [13] |
Wang X H, Du F Y, Qiu Y S, et al. Variations of fish species diversity, faunal assemblage, and abundances in Daya Bay in 1980-2007[J]. Chinese Journal of Applied Ecology, 2010, 21(9): 2403-2410. [王雪辉, 杜飞雁, 邱永松, 等. 1980-2007年大亚湾鱼类物种多样性、区系特征和数量变化[J]. 应用生态学报, 2010, 21(9): 2403-2410.] |
| [14] |
Guo J Z, Chen Z Z, Xu Y W, et al. The effects of anthropo-genic activities on the diversity and succession of fish community in Daya Bay[J]. Journal of Fishery Sciences of China, 2018, 25(3): 595-607. [郭建忠, 陈作志, 许友伟, 等. 人类活动对大亚湾海域鱼类群落多样性及其演替的影响[J]. 中国水产科学, 2018, 25(3): 595-607.] |
| [15] |
Schmalenbach I, Mehrtens F, Janke M, et al. A mark-recapture study of hatchery-reared juvenile European lobsters, Homarus gammarus, released at the rocky island of Helgoland (German Bight, North Sea) from 2000 to 2009[J]. Fisheries Research, 2011, 108(1): 22-30. DOI:10.1016/j.fishres.2010.11.016 |
| [16] |
Lv H, Zhang X, Zhang P, et al. The implement of plastic oval tags for mark-recapture in juvenile japanese flounder (Paralichthys olivaceus) on the northeast coast of shandong province, China[J]. African Journal of Biotechnology, 2011, 10(61): 13263-13277. |
| [17] |
Liu J F, Weng Z C, Tang X G, et al. Tagging techniques of Pseudosciaena crocea (Richardson) in Guanjingyang Sea area and a preliminary study on ecological habites and characteristics of early tagged fish[J]. Marine Sciences, 1994, 18(5): 53-58. [刘家富, 翁忠钗, 唐晓刚, 等. 官井洋大黄鱼标志放流技术与放流标志鱼早期生态习性的初步研究[J]. 海洋科学, 1994, 18(5): 53-58.] |
| [18] |
Xu K D, Zhou Y D, Wang W D, et al. The tagging and re-leasing experiment of Sparus macrocephalus (Basilewsky) in the Zhoushan sea area[J]. Journal of Shanghai Ocean University, 2008, 17(1): 93-97. [徐开达, 周永东, 王伟定, 等. 舟山海域黑鲷标志放流试验[J]. 上海海洋大学学报, 2008, 17(1): 93-97.] |
| [19] |
Astorga N, Afonso J M, Zamorano M J, et al. Evaluation of visible implant elastomer tags for tagging juvenile gilthead seabream (Sparus auratus L.):effects on growth, mortality, handling time and tag loss[J]. Aquaculture Research, 2005, 36(8): 733-738. DOI:10.1111/are.2005.36.issue-8 |
| [20] |
Luo X, Zhang Q Z, Cui M. Tagging techniques applied to Ctenopharyngodon idellus[J]. Journal of Hydroecology, 2011, 32(6): 135-140. [罗新, 张其中, 崔淼. 草鱼标志技术的初步研究[J]. 水生态学杂志, 2011, 32(6): 135-140.] |
| [21] |
Wang M Y, Huang H G, Lai M Y, et al. Study on the tagging techniques for the release and enhancement of Hypophthalmichthys molitrix[J]. Jiangsu Agricultural Sciences, 2015, 43(9): 261-263. [王茂元, 黄洪贵, 赖铭勇, 等. 鲢鱼增殖放流标志技术研究[J]. 江苏农业科学, 2015, 43(9): 261-263.] |
| [22] |
Leaf R T, Rogers-Bennett L, Haaker P L. Spatial, temporal, and size-specific variation in mortality estimates of red aba-lone, Haliotis rufescens, from mark-recapture data in Cali-fornia[J]. Fisheries Research, 2007, 83(2-3): 341-350. DOI:10.1016/j.fishres.2006.10.017 |
| [23] |
Stewart J. Long-term recaptures of tagged Scyllarid lobsters (Ibacus peronii) from the east coast of Australia[J]. Fisheries Research, 2003, 63(2): 261-264. DOI:10.1016/S0165-7836(03)00078-X |
| [24] |
Piñeiro C, Rey J, Pontual H D, et al. Tag and recapture of European hake (Merluccius merluccius, L.) off the North-west Iberian Peninsula:First results support fast growth hy-pothesis[J]. Fisheries Research, 2007, 88(1-3): 150-154. DOI:10.1016/j.fishres.2007.08.015 |
| [25] |
Fujita T, Mizuno T, Nemoto Y. Stocking effectiveness of Japanese flounder Paralichthys olivaceus fingerlings re-leased in the coast of Fukushima prefecture[J]. Saibai Gyogyo Gijutsu Kaihatsu Kenkyu, 1993(22): 67-73. |
| [26] |
Kallio-Nyberg I, Romakkaniemi A, Jokikokko E, et al. Differences between wild and reared Salmo salar, stocks of two northern Baltic Sea rivers[J]. Fisheries Research, 2015, 165: 85-95. DOI:10.1016/j.fishres.2014.12.022 |
| [27] |
Gonzalez E B, Umino T, Nagasawa K. Stock enhancement programme for black sea bream, Acanthopagrus schlegelii (Bleeker), in Hiroshima Bay, Japan:a review[J]. Aquaculture Research, 2010, 39(12): 1307-1315. |
| [28] |
Tsuyuki A, Umino T. Spatial movement of black sea bream Acanthopagrus schlegelii, around the oyster farming area in Hiroshima Bay, Japan[J]. Fisheries Science, 2017, 83(2): 1-10. |
| [29] |
Fujita T, Umino T, Saito H, et al. Seasonal variations in dorsal muscle constituents of wild black sea bream Acanthopagrus schlegelii in Hiroshima Bay, Western Japan[J]. Nippon Suisan Gakkaishi, 2011, 77(6): 1034-1042. DOI:10.2331/suisan.77.1034 |
| [30] |
Bai H P. Food habit of black pargy (Sparus macrocephalus) in Xiangshan Port[J]. Journal of Ningbo University (NSEE), 1999, 12(4): 42-47. [柏怀萍. 象山港黑鲷的摄食习性[J]. 宁波大学学报(理工版), 1999, 12(4): 42-47.] |
 2019, Vol. 26
2019, Vol. 26

