2. 青岛海洋科学与技术国家实验室, 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071;
3. 上海海洋大学水产与生命学院, 上海 201306;
4. 大连富谷水产有限公司 辽宁 大连 116400
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
4. Dalian Fugu Fishery Co. Ltd., Dalian 116400, China
目前, 中国海洋渔业已进入转型升级发展的新时期, 发展深远海养殖成为新的产业增长点, 而筛选和培育适宜的养殖品种则是推动深远海养殖事业快速发展的关键。黄条鰤(Seriola aureovittata)属鲈形目(Perciformes)、鲹科(Carangidae)、鰤属, 又称黄尾鰤, 是一种在全球海洋中上水层广泛分布的大洋性经济鱼类, 在中国沿海均有分布[1-2]。黄条鰤具有形体大、生长快、肉质鲜美、营养丰富等特点, 深受消费者喜爱。养殖实践证明, 黄条鰤非常适宜于深水抗风浪网箱养殖生产方式, 是开发前景广阔的一种深远海养殖优良鱼种。
20世纪90年代以来, 日本等国家相继开展了黄条鰤人工繁育与养殖技术研究, 学者们观察和描述了不同水域黄条鰤亲鱼产卵、胚胎和仔稚幼鱼阶段的形态及生理生态特征, 但由于地理群体、培育条件、遗传背景等的差异, 不同水域黄条鰤的早期生长发育特性差异较大[3-8]。另外, 目前国际上黄条鰤苗种培育过程中尚存在畸形率高、成活率低等问题[3], 表明对其早期生活史的生命现象及规律的认识尚不够深入, 从而导致人工繁育技术不稳定, 养殖业多依赖野生苗种[9]。因此, 有必要针对不同地理种群的黄条鰤早期生活史特性进行详尽研究, 获得特定海洋环境下的早期生长发育第一手资料, 支撑建立稳定的苗种培育技术。近年来, 受海洋环境衰退和过度捕捞等因素的影响, 中国黄条鰤的自然资源不断下降, 有必要尽快开展黄条鰤人工繁育技术研究, 加强自然资源修复和科学保护, 也为中国发展深远海养殖提供优良品种支撑。2013年以来, 本团队开始对黄条鰤进行人工繁育技术研究, 2017年突破了亲鱼自然产卵技术, 开展了苗种培育试验, 培育出大规格苗种。此期间, 笔者对黄条鰤胚胎和仔稚幼鱼发育的形态特征和数量性状进行了观察和测量, 揭示了其器官发育和生长的基本规律, 为建立中国黄条鰤苗种培育技术提供了重要的早期生活史资料支撑。
1 材料与方法 1.1 亲鱼培育与产卵调控实验于2017年4—6月在大连富谷水产有限公司进行。黄条鰤亲鱼年龄为4龄, 来自黄海野生亲鱼群体, 经驯化培育后用于人工繁殖。亲鱼在室内水泥池内(10 m×10 m×2 m)充气流水培育, 培育条件:水温20~23℃, 盐度29~32, pH 8.0~8.6, 日换水率200%~300%。饵料为鲜杂鱼虾肉, 日投喂两次, 投喂量为鱼体重的2%~3%, 定期清理亲鱼培育池保持水质清洁。通过水温和光周期调控, 亲鱼性腺发育成熟, 在培育池内自然产卵。
1.2 胚胎发育观察每日检测亲鱼产卵情况, 当发现亲鱼在培育池内产卵时, 立刻取样观察。收集受精卵置于60 L固定于方形钢质框架上的筛绢网内孵化, 连续充气, 流水孵化, 控制水温20~22℃。期间, 胚胎发育至原肠期前每15~30 min取样1次, 胚体形成后每30 min~1 h观察1次。胚胎发育观察利用NIKON(MSZ800)解剖镜, 记录胚胎发育时序及其形态特征, 用NIKON coolpix 4500数码相机进行显微拍照。
1.3 胚后发育观察利用室内方形抹角水泥池(体积20 m3)开展苗种培育, 初孵仔鱼布池密度为10000尾/m2。培育条件:水温22~24℃, 盐度30~32, DO≥6 mg/L, pH 8.0~8.6, 光照周期12L:12D。饵料系列:褶皱臂尾轮虫(Brachionus plicatilis), 卤虫无节幼体(Artemia salina), 卤虫成体, 鱼肉糜。苗种胚后发育时间以日龄计算, 初孵仔鱼为0日龄(0 DAH, 0 days after hatching), 以此类推。3~17 DAH仔鱼投喂褶皱臂尾轮虫, 日投喂2次, 投喂密度为8~ 10 ind/mL, 投喂轮虫时添加小球藻(Chlorella sp.), 密度为5×105 cell/mL, 18 DAH停止添加小球藻和轮虫; 12 DAH开始增加投喂卤虫无节幼体, 密度1~2 ind/mL, 日投喂2次; 30 DAH开始投喂卤虫成体, 50 DAH后转换投喂鱼肉糜。自4 DAH开始换水, 换水率逐渐达100%~200%, 定期清理培育池底部, 保证水质清洁。
自仔鱼布池开始, 20 DAH前每天从培育池中随机取样40~50尾, 20 DAH后每2天取样30~40尾苗种, 60 DAH后每5天取样1次, 每次取样20~30尾。测量时先用MS222将鱼苗麻醉, 在NIKON(MSZ 800)解剖镜下观察仔稚幼鱼的形态特征、器官发育、摄食和开鳔情况, 拍照记录。测量苗种全长、卵黄囊长短径和油球径等可量性状, 计算卵黄囊和油球体积, 数据以平均值±标准差
黄条鰤受精卵为浮性卵、圆球形, 卵黄透明, 单油球。卵径(1.48±0.04) mm (n=55), 油球径(0.37±0.02) mm (n=55), 克重卵粒数约为533粒。受精卵在水温(21.5±0.5)℃、盐度32条件下经73 h 40 min完全孵化出膜(表 1)。
|
|
表 1 孵化水温(21.5±0.5)℃下黄条鰤胚胎发育时序 Tab.1 Embryonic development timing of Seriola aureovittata at water temperature of (21.0±0.5)℃ |
未受精成熟卵子原生质表层分布有复杂的网纹结构(图 1A)。受精后0 h 35 min, 受精膜一侧局部升高, 动物极形成, 卵周隙扩大(图 1B)。
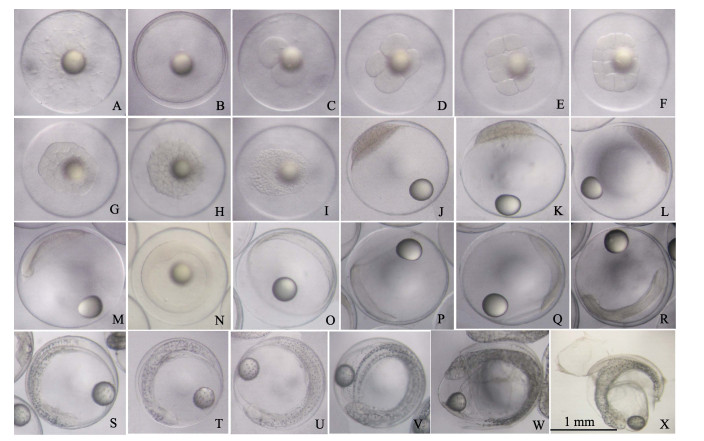
|
图 1 黄条鰤胚胎发育形态特征 A.未受精卵; B.受精卵动物极形成; C. 2细胞; D.细胞; E. 8细胞; F. 16细胞; G. 32细胞; H. 64细胞; I.多细胞; J.桑葚配; K.高囊胚; L.低囊胚; M.原肠早期; N.原肠早期正面观; O.原肠中期; P.原肠后期; Q.原口关闭期; R.神经胚(示克氏泡); S.胚体包卵黄囊1/2; T.胚体包卵黄囊2/3; U.胚体包卵黄囊4/5; V.胚体全部包被卵黄囊; W.破膜孵化; X.孵化出膜. Fig.1 Morphological characteristics of embryonic development of Seriola aureovittata A. Unfertilized egg; B. Fertilized egg; C. 2-cell stage; D. 4-cell stage; E. 8-cell stage; F. 16-cell stage; G. 32-cell stage; H. 64-cell stage; I. Multicellular stage; J. Morula stage; K. High Blastula stage; L. Low blastula stage; M. Early gastrula stage; N. Early gastrula stage (show embryonic shield); O. Mid-Gastrula stage; P. Ana-phase of gastrula stage; Q. Telo-phase of gastrula stage; R. Neurula stage; S. Embryo encircling 1/2 of yolk sac; T. Embryo encircling 2/3 of yolk sac; U. Embryo encircling 4/5 of yolk sac; V. Embryo encircling the whole yolk sac; W. Hatching; X. Larva hatched out. |
受精后1 h 10 min, 受精卵胚盘发生经裂, 将胚盘分成2个大小均等的细胞; 此后, 至受精后2 h 25 min, 受精卵胚盘陆续发生第二次、第三次和第四次经裂, 每一次经裂的卵裂沟均与前1次卵裂沟垂直, 胚盘分化为4细胞、8细胞和16细胞; 受精后2 h 50 min, 发生第五次经裂, 胚盘分化为32个大小不一的细胞; 受精后3 h 20 min, 第一次纬裂发生, 胚盘分化成排列不均的2层细胞, 此后细胞不断分裂, 在动物极处排成多层; 至4 h 20 min, 胚盘动物极一侧形成表面粗糙的高帽状细胞群, 进入桑葚期(图 1 C, 图 1D, 图 1E, 图 1F, 图 1G, 图 1H, 图 1I, 图 1J)。
2.1.3 囊胚期受精后5 h 30 min, 高帽状细胞群粗糙表面变得光滑, 高度增加, 形成高囊胚; 8 h 40 min, 细胞持续分裂, 囊胚层边缘开始变薄并向扁平发展, 进入低囊胚期(图 1K, 图 1L)。
2.1.4 原肠期受精后11 h 30 min, 囊胚边缘细胞下包形成原肠腔, 胚盾出现, 之后历经原肠中期、原肠后期, 至19 h, 原口即将关闭, 胚体雏形形成(图 1M, 图 1N, 图 1O, 图 1P, 图 1Q)。
2.1.5 神经胚期受精后21 h 20 min, 原口完全关闭, 进入神经胚期, 此时神经胚两侧加厚隆起向内卷曲后在中间结合凸起, 形成神经脊。胚体头部呈三角形, 胚体体节3~4对。部分胚体在尾部出现克氏泡。胚体上出现黄褐色的点状色素分布(图 1R)。
2.1.6 器官发生期受精后24 h 20 min, 胚体包卵黄囊1/2, 视囊形成, 胚体两侧有零星点状色素分布, 体节9对, 心脏原基形成; 受精后39 h 40 min, 胚体包卵黄囊2/3, 尾芽形成, 心跳出现(跳动频率62~81次/min), 胚体两侧分布较多星状黑色素, 卵黄囊和油球上分布有零星枝状黑色素, 脑分化为3部分, 晶体形成, 体节22~24对, 胚体偶尔出现间歇性收缩, 频次为2~3次/min(图 1S, 图 1T)。
2.1.7 肌肉效应期受精后57 h 10 min, 胚胎包卵黄囊4/5, 头部分化为5部分, 尾部明显歪向一侧, 随后整个胚体头尾相接盘在卵黄囊一侧, 胚体两侧边缘色素细胞明显增多, 形成两条细的黑色素带, 胚体扭动明显(肌肉效应), 心跳达16~ 220次/min(图 1U, 图 1V)。
2.1.8 破膜孵化受精后69 h 30 min, 胚胎肌肉效应幅度和频率加大(10~18次/min), 头部先将卵膜顶破, 成功脱膜而出。至73 h 40 min, 全部胚胎孵化完毕, 初孵仔鱼身体蜷曲围绕住卵黄囊(图 1W, 图 1X)。
2.2 仔稚幼鱼生长发育特征 2.2.1 卵黄囊仔鱼期(yolk sac larva stage)初孵仔鱼(0 DAH):全长(4.23±0.39) mm(n=45), 卵黄囊呈椭圆形, 长径(1.27±0.03) mm, 短径(0.73± 0.032) mm。油球径(0.33±0.02) mm。头长占全长的10.55%, 肛前距占全长的55.97%, 眼径为头长的54.85%。初孵仔鱼初始出膜时身体弯曲, 在水中处于静止状态, 1~2 h后身体展直。背鳍膜与尾鳍膜连接处有一凹陷作为分界线。背鳍膜和臀鳍膜边缘分布浅黄色枝状色素带。躯干、头部与油球上散布枝状的淡黑色素。心跳频率200次/min以上。肠道为细线状, 紧贴躯干腹部(图 2A)。

|
图 2 黄条鰤胚后发育形态特征 A.初孵仔鱼; B. 1 DAH仔鱼; C. 2 DAH仔鱼; D. 3 DAH仔鱼; E. 5 DAH仔鱼; F. 7 DAH仔鱼; G. 10 DAH仔鱼; H. 15 DAH仔鱼; I. 20 DAH仔鱼; J. 25 DAH仔鱼; K. 35 DAH稚鱼; L. 45 DAH幼鱼; M. 60 DAH幼鱼; N. 80 DAH幼鱼. Fig.2 Morphological characteristics of post-embryonic development of Seriola aureovittata A. Newly hatched larvae; B. Larvae of 1 DAH; C. Larvae of 2 DAH; D. Larvae of 3 DAH; E. Larvae of 5 DAH; F. Larvae of 7 DAH; G. Larvae of 10 DAH; H. Larvae of 15 DAH; I. Larvae of 20 DAH; J. Larvae of 25 DAH; K. Post-larvae of 35 DAH; L. Juvenile of 45 DAH; M. Juvenile of 60 DAH; N. Juvenile of 80 DAH. |
1 DAH仔鱼:全长(4.34±0.22) mm (n=45), 卵黄囊体积减少约33%, 油球径(0.32±0.04) mm。头长占全长的10.67%, 肛前距占全长的59.1%, 眼径为头长的55.49%。仔鱼在水体中倒立静止悬浮。心脏呈L形, 心跳160~185次/min。肠道未充气, 上有一条细小的凹痕。躯干两侧枝状色素细胞分布密集, 但近尾端部为透明。背鳍和臀鳍膜边缘枝状色素细胞密度增加, 呈现相对明显的色素带(图 2B)。
2 DAH仔鱼:全长(4.58±0.25) mm (n=45), 卵黄囊体积减少约80%, 油球径(0.31±0.03) mm。头长占全长的10.78%, 肛前距占全长的59.32%, 眼径为头长的57.30%。仔鱼在水体中相对均匀分布, 多在水体中上层悬浮, 开始平游, 靠尾部的摆动可变换水层分布。仔鱼瞬时游动速度快。肠道开始变粗, 肠道中间腔扩大。眼囊与头部上开始分布淡黄色的点状色素, 呈淡黄色。尾鳍膜呈扇形(图 2C)。
3 DAH仔鱼:全长(4.61±0.43) mm (n=45), 卵黄囊体积减少95%, 油球径(0.26±0.03) mm。头长占全长的13.19%, 肛前距占全长的59.61%, 眼径为头长的52.41%。仔鱼开口, 眼囊因密集分布黑色素而呈黑色, 下颌骨凸显。肠道变粗, 腔明显。膀胱膨大。肛门尚未与外界联通。胸鳍小叶状, 扇动能力不强。仔鱼多数时间在水体中静止, 游动时靠躯干后部和尾部摆动前进。躯干上下两侧边缘密布点状、枝状和星状黑色素细胞, 但中轴部位无色素分布, 呈透明状。头部散布零星枝状和星状色素细胞。背鳍膜和臀鳍膜边缘色素带变宽, 背鳍膜色素带前有一个高度下降。尾鳍膜上开始分布点状或细线状黑色素细胞。鳔原基形成, 未充气(图 2D)。
5 DAH仔鱼:全长(4.68±0.25) mm (n=45), 卵黄囊消耗殆尽, 油球径(0.19±0.03) mm。头长占全长的16.83%, 肛前距占全长的58.81%, 眼径为头长的43.64%。仔鱼肠道变为管状。鳃盖上着生2根长的和1根短的鳃棘。鳔开始充气。心脏中有血液流动。躯干中部呈淡黄色。背鳍膜和臀鳍膜上的色素聚集成为色素斑, 尾鳍膜上的色素增多。背鳍膜与尾鳍膜交界处无色素分布。仔鱼游泳和躲避能力增强, 主要在中上水层游动, 开始表现出聚群和趋光的特性(图 2E)。
2.2.2 脊索弯曲前仔鱼期(preflexion larva stage)7 DAH仔鱼:全长(4.79±0.36) mm (n=40), 油球仍有残留。头长占全长的19.21%, 肛前距占全长的58.92%, 眼径为头长的42.82%。除眼睛黑色外, 仔鱼躯干、腹部和头部都覆盖黄褐色素, 通体呈淡黄色。胸鳍条3~4根, 鳃盖上着生3根长的和2根短的鳃棘。肩带骨凸显。鳔充气成为椭圆形亮泡, 仔鱼开鳔率约60%。仔鱼摄食积极, 口部张合速率达130~160次/min。仔鱼游动积极, 白天聚群趋光, 夜晚多分散在水体中上层。背鳍膜边缘黄褐色素斑数量12~17个, 臀鳍膜边缘色素斑4~7个(图 2F)。
10 DAH仔鱼:全长(5.19±0.37) mm(n=40), 油球消耗完毕。头长占全长的20.32%, 肛前距占全长的58.73%, 眼径为头长的40.94%。仔鱼体表密集覆盖黑色和黄色素, 通体黑色透金黄色, 躯干两侧、头部、腹部覆盖雪花状、星状黑色素, 下颌分布点状黑色素。胸鳍鳍条6~7根, 尾鳍鳍条褶皱5根。鳃弓1对。仔鱼开鳔率达80%以上。仔鱼摄食轮虫良好, 摄食率达95%以上。背鳍膜前端高度下降, 分为明显的两部分, 边缘色素斑8~10个。臀鳍膜在肛门处高度降低, 边缘分布色素斑3~5个。尾鳍膜上点状和枝状色素增多。肠道前端、胃后方形成第一个生理弯曲(图 2G)。
2.2.3 脊索弯曲仔鱼期(flexion larva stage)15 DAH仔鱼: (全长5.71±0.50) mm (n=40)。头长占全长的23.45%, 肛前距占全长的61.51%, 眼径为头长的38.27%。身体明显变宽。上颌边缘着生牙齿5~6个。仔鱼脊索末端开始向上弯曲, 脊索末端下方尾扇形成, 鳍条10根, 上覆盖黄褐色色素。背鳍分为前后两部分, 鳍条数为15根, 臀鳍条12根, 胸鳍条10根。体表覆盖数量较多的斑点色素, 呈淡黑透黄色。眼囊变为蓝绿色, 晶体黑色。背鳍膜和臀鳍膜上色素斑数量减少。背鳍膜边缘分布枝状和星状黑色素带。肠道形成两个生理弯曲(图 2H)。
20 DAH仔鱼:全长(6.97±0.42) mm (n=40)。头长占全长的27.81%, 肛前距占全长的61.83%, 眼径为头长的39.04%。仔鱼脊索尾端弯曲完成。上颌齿10~11个。鳃盖上鳃棘消褪。第一背鳍条3根, 第二背鳍条20~22根; 臀鳍条15根, 胸鳍条13根, 尾鳍条15根。背鳍条和尾鳍条上密布黑色素。仔鱼整体呈黑黄色, 个体生长差异加剧(图 2I)。
2.2.4 脊索弯曲后稚鱼期(post-flexion larvae stage)25 DAH稚鱼:全长(8.66±1.06) mm (n=30)。头长占全长的29.69%, 肛前距占全长的60.82%, 眼径为头长的37.36%。脊索末端退化为尾鳍条, 尾叉明显。通体除尾鳍外呈现黑色, 眼囊在灯光下呈现亮蓝绿色。第一背鳍条7根, 第二背鳍条30~32根, 臀鳍条22根, 胸鳍条13根, 尾鳍条17根, 腹鳍条5根。鱼苗顺流而动, 白天多在水体中上层集群游动, 见光等刺激可迅速逃逸(图 2J)。
35 DAH稚鱼:全长(20.04±1.56) mm (n=30)。鱼苗在灯光下呈黑金黄色, 眼囊为黑黄色。鳍条数量与成鱼一致。鱼苗可逆流游动, 生长速度加快, 个体差异加大, 鱼苗之间有攻击和残食行为, 其主要特征为个体较大苗种不断通过接触、撕咬、吞食的方式攻击个体较小的苗种, 导致小个体苗种收到惊吓到处窜逃甚至死亡, 这种攻击行为多发生在早上, 攻击频率可达7~10次/min, 造成了苗种死亡率较高。开始摄食卤虫成体(图 2K)。
2.2.5 幼鱼期(juvenile stage)45 DAH幼鱼:全长(30.92±2.95) mm (n=30)。体表鳞片开始生成。鱼苗呈梭形, 体色发生巨大变化, 整体呈浅金黄色, 体表分布9条横向黄褐色的色素带。第二背鳍、腹鳍、臀鳍、尾鳍两个尾叉均密布黄色素(图 2L)。
60 DAH幼鱼:全长(65.06±1.94) mm (n=20)。体表鳞片形态同成体。苗种体色再次发生变化, 体表 9条色素带颜色加深, 体表背部呈黄褐色, 腹部为白色。尾鳍整体、背鳍和臀鳍边缘为黄色。苗种在水中集群顶流快速游动, 遇有惊扰快速散开逃逸。撕咬摄食鱼糜(图 2M)。
80 DAH幼鱼:全长(134.05±3.25) mm (n=20)。苗种外观与成体一致, 体表横向分布的色素带消失, 出现一条纵向横贯眼睛和尾椎末端的浅黄色色素带。背部为淡青色, 腹部为白色。尾鳍黄色。背鳍、臀鳍和腹鳍为淡黄色。眼囊为黄色(图 2N)。
2.3 摄食与生长黄条鰤早期仔鱼的营养主要依靠卵黄囊, 在3 DAH开口后转入混合营养期, 在5 DAH卵黄囊消耗殆尽后仔鱼完全依赖外源营养(图 3)。油球吸收速度要慢于卵黄囊, 至8 DAH才完全吸收完毕。4 DAH仔鱼全长(4.57±0.88) mm, 初次摄食轮虫, 5 DAH仔鱼摄食率约为40%, 7 DAH仔鱼摄食率为70%~80%, 肠道中充满轮虫。12 DAH仔鱼开始摄食卤虫无节幼体, 15 DAH仔鱼摄食卤虫个体比例可达40%, 20 DAH仔鱼均已摄食卤虫无节幼体。40 DAH稚鱼可在较短时间内适应并摄食卤虫成体, 45 DAH幼鱼摄食卤虫成体良好。60 DAH幼鱼可积极摄食鱼肉糜。
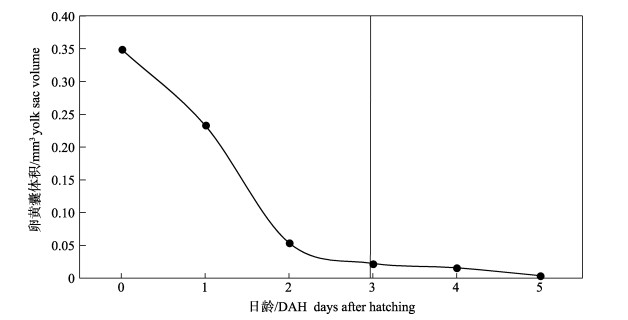
|
图 3 黄条鰤卵黄囊的吸收过程 Fig.3 Exhaustion of yolk sac of Seriola aureovittata |
黄条鰤早期生活史阶段(0~60 DAH)的生长特性符合公式: TL=0.0226D2-0.4448D+6.4118 (R= 0.9917), 其中TL为全长, D为日龄。仔鱼在25 DAH前生长缓慢, 日生长速率仅为0.14 mm/d, 但在25 DAH后仔鱼生长速度明显加快, 日生长速率达1.24 mm/d (26~40 DAH)。随着苗种摄食卤虫成体和肉糜后, 鱼苗日生长速率达到2.63 mm/d (41~80 DAH)。自初孵仔鱼至80 DAH, 黄条鰤早期生长发育阶段的日生长速率为1.62 mm/d(图 4), 表现出典型的异速生长模式。
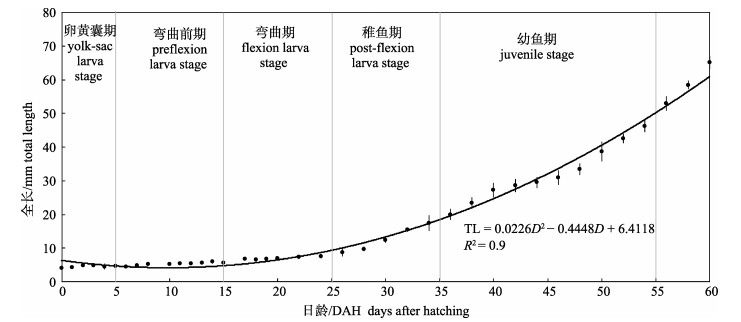
|
图 4 黄条鰤早期生长曲线(0–60日龄) Fig.4 The early growth curve of Seriola aureovittata (0–60 DAH) |
本研究详细观察和记录了中国黄海海域黄条鰤胚胎及仔稚幼鱼生长发育的数量形态特征, 参照Shiogaki等[11]的分类方法, 将黄条鰤早期生长发育划分为卵黄囊仔鱼、脊索弯曲前仔鱼、脊索弯曲期仔鱼、脊索弯曲后稚鱼期和幼鱼期5个典型的发育阶段。
黄条鰤受精卵为单油球的圆球形浮性卵, 卵径比同为鰤属鱼类的高体鰤(Seriola dumili)[12-14]、五条鰤(Seriola quinqueradiata)[16]大(表 2)。另外, 本研究结果大于美国、韩国水域以及中国福建海区黄条鰤受精卵径[4-6, 17], 而与新西兰水域的黄条鰤受精卵径相近[7](表 2), 这种受精卵径的差异主要是与地理种群、亲鱼规格大小、亲鱼营养、环境因子、激素催产、世代差异等因素有关, 在其他鱼类中也有类似发现[6]。黄条鰤胚胎发育过程中会在胚体包卵黄囊1/2时出现克氏泡, 但不是所有胚胎发育过程中都出现克氏泡, 表明这种结构可能不是生长发育所必需的, 与其他鱼类的研究结果一致[14-15], 可能只是一种早期生长阶段器官发育的始祖重演现象。本研究发现, 当黄条鰤胚体包卵黄囊2/3时, 心跳频率达62~81次/min, 其后在胚胎期心跳频率可达200次/min以上。这一特征出现时间较其他低温鱼类为早且心跳频率高[22-23], 但与高体鰤基本一致[16], 推测与鰤属鱼类早期快速发育的代谢需求相关。另外, 黄条鰤胚胎孵化出膜时, 头部先破膜而出, 这与钟建兴等[17]对中国福建海区黄条鰤的胚胎发育观察结果一致, 而与高体鰤不同[14-15], 这种破膜孵化方式的差异取决于不同种的早期生活史习性, 其与仔鱼发育和存活的关系尚不明确。这些结果表明鰤属鱼类不同种之间在早期生活史的器官发育时序及不同生长阶段的生理特征存在明显差异。
|
|
表 2  |
比较了几种鰤属鱼类胚胎和早期仔鱼发育特征(表 2), 结果发现本研究黄条鰤初孵仔鱼全长(4.23±0.39) mm[(21.0±0.5)℃], 较高体鰤[14, 18]、五条鰤[16]等鰤属鱼类长(表 2), 但短于条斑星鲽(Verasper moseri)[19]、圆斑星鲽(Verasper variegatus)[20]等受精卵径较大的鱼类, 可见初孵仔鱼的大小与受精卵大小有密切关系。对新西兰种群的黄条鰤早期生长发育研究表明, 初孵仔鱼大小与受精卵孵化温度相关, 低温下初孵仔鱼个体大于高温下初孵仔鱼, 但油球大小相反, 这种初孵仔鱼大小的差异取决于温度对卵黄物质转化效率的影响[7], 但过高或过低的温度会造成卵黄和油球等内源性营养过快或过缓吸收利用, 容易造成仔鱼开口期对外源营养的适应障碍, 从而导致早期生长发育阶段高的死亡率[21-22], 因此应采用适宜的温度进行苗种早期培育。另外, 本研究还发现, 美国、日本、新西兰海域黄条鰤初孵仔鱼个体相对较大[5, 7-8], 而韩国海域黄条鰤初孵仔鱼全长相对小[4], 这种初孵仔鱼大小的差异与地理水域、亲鱼营养状态、孵化温度、生活史等因素都有密切的关系, 可能会为黄条鰤地理种群划分、亲体培育及苗种培育等提供有益的借鉴, 值得下一步开展国际联合研究确证。在本研究条件下, 黄条鰤卵黄囊在孵化后5 d完全消耗殆尽, 而同为鰤属鱼类的五条鰤、高体鰤的仔鱼多在3~4 DAH卵黄囊才能完全消耗完[14, 16]。与之相比, 冷温性鱼类太平洋鳕(Gadus macrocephalus)、条斑星鲽、圆斑星鲽等仔鱼卵黄囊分别在孵化后8 DAH、7 DAH和11 DAH才完全消耗完毕[19-20, 23], 长时间卵黄吸收过程可能是鱼类适应低温和洄游生活的一种种群繁衍策略, 以满足生活环境变化适应引发的新陈代谢能量需求的差异, 获得最大后代存活率, 对于自然群体资源的早期补充具有重要意义。与其他水域黄条鰤相比, 美国、智利、新西兰、韩国、日本等海域的黄条鰤仔鱼卵黄囊分别在2 DAH、3 DAH、5.4 DAH、5 DAH和4 DAH [4-5, 7-8] (表 2), 这种差异与培育温度、亲体状态和地理种群差异有关, 可能为不同地理水域黄条鰤群体的早期判别提供有益的营养指标借鉴。本研究还发现, 同样作为内源性营养来源的油球吸收速度较慢, 在孵化后8 DAH才完全吸收完毕, 这与Sang等[4]报道结果基本一致, 油球吸收耗时较长, 在一些鱼类中油球是一种重要的能量存储方式, 可有效保障洄游性鱼类仔鱼由内源性营养向外源性营养阶段过渡期的成活与生长[24]。
本研究发现, 黄条鰤早期生长发育阶段存在早期生长速度慢、后期生长速度快的现象, 在25 DAH前生长速率仅为0.14 mm/d, 但在25 DAH后生长速率达到1.24 mm/d (26~40 DAH), 而在摄食卤虫成体和肉糜后, 生长速率达2.63 mm/d (41~80 DAH), 这是一种异速生长模式, 在其他硬骨鱼类早期生活史阶段中也存在类似的生长发育特点[19, 26]。国外学者对智利、韩国、日本海域黄条鰤早期生长研究也表明其具有典型的异速生长模式, 与本研究结果基本一致[4, 8, 25], 这种早期阶段的异速生长特性与其早期生活史的生态习性是相适应的, 推测也是早期生长发育阶段适应环境变化和提高后代成活率的一种生存策略。本研究还发现, 黄条鰤苗种在20 DAH后个体生长差异明显, 同时30 DAH后开始出现攻击与残食行为, 个体较大的苗种不断通过接触、撕咬、吞食的方式攻击个体较小的苗种, 导致小个体苗种受到惊吓到处窜逃甚至死亡, 造成了苗种培育损失较大。有关学者开展了黄条鰤早期生长阶段攻击行为的相关研究[27-28], 基本认识了其发生时期及特征, 但尚未建立较为有效的防除技术。今后苗种培育过程中, 应及时对个体差异大的苗种进行分筛, 同时加强黄条鰤苗种攻击行为的发生机理及防除技术研究, 提高苗种培育成活率。
| [1] |
Zhang C L. Survey Report on Fishes of the Bohai Sea and Yellow Sea[M]. Beijing: Science Press, 1955: 116-119. [张春霖. 黄渤海鱼类调查报告[M]. 北京: 科学出版社, 1955: 116-119.]
|
| [2] |
Liu J, Chen Y X, Ma L. Fishes of the Bohai Sea and Yellow Sea[M]. Beijing: Science Press, 2015: 172. [刘静, 陈咏霞, 马琳. 黄渤海鱼类图志[M]. 北京: 科学出版社, 2015: 172.]
|
| [3] |
Leyton Y, Sayes C, Mejias C, et al. Increased larval survival of Seriola lalandi using Pseudoalteromonas sp. as probiotics[J]. Revista de Biología Marinay Oceanografía, 2017, 52(1): 95-101. DOI:10.4067/S0718-19572017000100007 |
| [4] |
Sang G Y, Sang W H, Ji S C, et al. Morphological development of embryo, larvae and juvenile in yellowtail kingfish, Seriola lalandi[J]. Development and Reproduction, 2016, 20(2): 131-140. DOI:10.12717/DR.2016.20.2.131 |
| [5] |
Stuart K R, Drawbridge M A. Captive spawning and larval rearing of California yellowtail (Seriola lalandi)[J]. Aquaculture Research, 2013, 44(5): 728-737. DOI:10.1111/are.2013.44.issue-5 |
| [6] |
Yang S G, Ji S C, Gu L S, et al. Management of sexual maturation and natural spawning of captive-reared yellowtail kingfish, Seriola lalandi, in an indoor rearing tank[J]. Development and Reproduction, 2016, 20(2): 141-147. DOI:10.12717/DR.2016.20.2.141 |
| [7] |
Moran D, Smith C K, Gara B, et al. Reproductive behaviour and early development in yellowtail kingfish (Seriola lalandi Valenciennes 1833)[J]. Aquaculture, 2007, 262(1): 95-104. DOI:10.1016/j.aquaculture.2006.10.005 |
| [8] |
Fujita S, Yogata T. Induction of ovarian maturation, embryonic development and larvae and juveniles of the amberjack, Seriola aureovittata[J]. Japanese Journal of Ichthyology, 1984, 30(4): 426-435. |
| [9] |
Sicuro B, Luzzana U. The state of Seriola spp. other than yellowtail (S. quinqueradiata) farming in the world[J]. Reviews in Fisheries Science and Aquaculture, 2016, 24(4): 314-325. DOI:10.1080/23308249.2016.1187583 |
| [10] |
Alderdice D F, Rosenthal H, Velsen F P J. Influence of salinity and cadmium on capsule strength in Pacific herring eggs[J]. Helgoland Marine Research, 1979, 32(1-2): 149-162. |
| [11] |
Shiogaki M, Doutsu Y. The spawning of sea culpin, Pseudoblennius cottoides[J]. Bulletin of Fishery of Nagasaki University, 1974, 38: 71-76. |
| [12] |
Mylonas C C, Papandroulakis N, Smboukis A, et al. Induction of spawning of cultured greater amberjack (Seriola dumerili) using GnRHa implants[J]. Aquaculture, 2004, 237(1-4): 141-154. DOI:10.1016/j.aquaculture.2004.04.015 |
| [13] |
Jerez S, Samper M, Santamaría F J, et al. Natural spawning of greater amberjack (Seriola dumerili) kept in captivity in the Canary Islands[J]. Aquaculture, 2006, 252(2-4): 199-207. DOI:10.1016/j.aquaculture.2005.06.031 |
| [14] |
Chen C S, Huang J M, He H W, et al. Morphological studies of the embryos, larvae, juveniles and young fish of Seriola dumerili[J]. Journal of Fishery Sciences of China, 1998, 5(1): 25-29. [陈昌生, 黄佳鸣, 何华武, 等. 高体鰤胚胎及仔稚幼鱼的形态观察[J]. 中国水产科学, 1998, 5(1): 25-29. DOI:10.3321/j.issn:1005-8737.1998.01.005] |
| [15] |
Masuma S, Kanematu M, Teruya K. Embryonic and morphological development of larvae and juveniles of the amberjack, Seriola dumerili[J]. Japanese Journal of Ichthyology, 1990, 37(2): 163-168. |
| [16] |
Fukuhara O, Nakagawa T, Fukunaga T. Larval and juvenile development of yellowtail reared in the laboratoty[J]. Nippon Suisan Gakkaishi, 1986, 52(12): 2091-2098. DOI:10.2331/suisan.52.2091 |
| [17] |
Zhong J X, Cai L H, Zheng H D, et al. Embryonic development in Seriola aureovittata[J]. Journal of Fujian Fisheries, 2010(2): 22-25. [钟建兴, 蔡良候, 郑惠东, 等. 黄条  胚胎发育观察[J]. 福建水产, 2010(2): 22-25. DOI:10.3969/j.issn.1006-5601.2010.02.006] 胚胎发育观察[J]. 福建水产, 2010(2): 22-25. DOI:10.3969/j.issn.1006-5601.2010.02.006] |
| [18] |
Papandroulakis N, Mylonas C C, Maingot E, et al. First results of greater amberjack (Seriola dumerili) larval rearing in mesocosm[J]. Aquaculture, 2005, 250(1-2): 155-161. DOI:10.1016/j.aquaculture.2005.02.036 |
| [19] |
Liu X Z, Xu Y J, Liu X F, et al. Embryonic and postembryonic development of barfin flounder, Verasper moseri[J]. Oceanology et Limnologia Sinica, 2009, 40(6): 699-707. [柳学周, 徐永江, 刘新富, 等. 条斑星鲽(Verasper moseri)的早期生长发育特征[J]. 海洋与湖沼, 2009, 40(6): 699-707. DOI:10.3321/j.issn:0029-814X.2009.06.005] |
| [20] |
Ning X, Liu X Z, Sun Z Z, et al. Morphological development and growth pattern of Verasper variegatus, Temminck et Schlegel in early life stages[J]. Progress in Fishery Sciences, 2011, 32(2): 7-15. [宁鑫, 柳学周, 孙中之, 等. 圆斑星鲽的早期生长发育特征[J]. 渔业科学进展, 2011, 32(2): 7-15. DOI:10.3969/j.issn.1000-7075.2011.02.002] |
| [21] |
Blaxter J H S. The effect of temperature on larval fishes[J]. Netherland Journal of Zoology, 1992, 42: 336-357. |
| [22] |
Martell D J, Kieffer J D, Trippel E A. Effects of temperature during early life history on embryonic and larval development and growth in haddock[J]. Journal of Fish Biology, 2005, 66: 1558-1575. DOI:10.1111/jfb.2005.66.issue-6 |
| [23] |
Xu Y J, Liu X Z, Shi B, et al. Domestication of wild broodstock and early development of pacific cod (Gadus macrocephalus)[J]. Progress in Fishery Sciences, 2017, 38(1): 159-167. [徐永江, 柳学周, 史宝, 等. 太平洋鳕(Gadus macrocephalus)亲鱼驯化培育与早期发育特征[J]. 渔业科学进展, 2017, 38(1): 159-167.] |
| [24] |
R nnestad I, Koven W, Tandler A, et al. Utilisation of yolk fuels in developing eggs and larvae of European sea bass (Dicentrarchus labrax)[J]. Aquaculture, 1998, 162(1-2): 157-170. DOI:10.1016/S0044-8486(98)00203-8 |
| [25] |
Martínez-Montaño E, González-Álvarez K, Lazo J P, et al. Morphological development and allometric growth of yellowtail kingfish Seriola lalandi V. larvae under culture conditions[J]. Aquaculture Research, 2016, 47(4): 1277-1287. DOI:10.1111/are.2016.47.issue-4 |
| [26] |
Liu X Z, Xu Y J, Wang Y Y, et al. Characters of development and growth of early life stages of the rock bream Oplegnathus fasciatus[J]. Acta Zoologica Sinica, 2008, 54(2): 332-341. [柳学周, 徐永江, 王妍妍, 等. 条石鲷的早期生长发育特征[J]. 动物学报, 2008, 54(2): 332-341.] |
| [27] |
Moran D. Size heterogeneity, growth potential and aggression in juvenile yellowtail kingfish (Seriola lalandi Valenciennes)[J]. Aquaculture Research, 2007, 38: 1254-1264. DOI:10.1111/are.2007.38.issue-12 |
| [28] |
Nguyen N H, Whatmore P, Miller A, et al. Quantitative genetic properties of four measures of deformity in yellowtail kingfish Seriola lalandi Valenciennes, 1833[J]. Journal of Fish Diseases, 2016, 39: 217-228. DOI:10.1111/jfd.2016.39.issue-2 |
 2019, Vol. 26
2019, Vol. 26

