2. 农业农村部海水养殖病害防治重点实验室, 青岛海洋科学与技术国家实验室, 海洋渔业科学与食物产出过程功能实验室, 中国水产科学研究院黄海水产研究所, 山东 青岛 266071
2. Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs; Qingdao Na-tional Laboratory for Marine Sciences and Technology, Laboratory for Marine Fisheries and Food Production Processes; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China
金乌贼(Sepia esculenta), 又名乌鱼、墨鱼、乌子等, 属软体动物门(Mollusca)、乌贼目(Sepioidea)、乌贼属, 主要分布于中国沿海、日本列岛和菲律宾群岛海域, 是乌贼科中重要的经济种类之一, 年产量居乌贼科第二位, 也是黄渤海重要的渔业资源, 与大黄鱼(Larimichthys crocea)、小黄鱼(Larimichthys polyactis)、带鱼并称中国传统四大海产之一。近年来, 受海域环境污染和过度捕捞的影响, 资源量明显衰退[1]。21世纪中国金乌贼繁殖技术取得的突破, 金乌贼增养殖业得到快速发展。
目前对于金乌贼的研究主要集中于养殖技术、生物学特性[2]、繁殖和胚胎生物学[3-6]等方面, 病害研究较少。育苗及养殖过程中的病害问题一直是苗种和养殖稳定生产的限制因子, 亟需加强金乌贼病害研究。在乌贼属病害方面,曾报道了线虫(Nematoda)[7]、溶藻弧菌(Vibrio alginolyticus)引起的捕获枪乌贼皮肤溃疡、鳃坏死等[8], 寄生性球虫(Aggregata)引起的人工饲养真蛸(Octopus vulgaris)死亡[9]等, 此外, 自然捕获长腕乌贼(Sepia longipes)、日本无针乌贼(Sepiella japonica)及水蛸(Enteroctopus dofleini)等还在肾内检出二胚虫寄生虫[10-12]。金乌贼育苗技术突破后,苗种规模化培育阶段陆续出现幼体大规模死亡的现象,但对其病害发生原因和机制尚缺少相关研究。本研究对青岛市黄岛区人工繁育金乌贼幼体大规模坏死病进行了病原分离、致病性和组织病理学分析, 对致病病原进行鉴定,并筛选了防控药物, 旨在为中国金乌贼病害防控及增养殖提供理论基础。
1 材料与方法 1.1 实验材料和实验动物实验所用培养基、细菌微量生化鉴定管购自青岛海博生物技术有限公司; 革兰氏染色液试剂盒购自北京索莱宝科技有限公司; DNA提取试剂盒购自北京天根生物; 药敏纸片购自杭州微生物试剂有限公司。
患病金乌贼幼体于2017年7月取自青岛市黄岛区某金乌贼育苗场, 体重为(2.00±0.05) g, 胴长为(2.2±0.2) cm, 选取发病症状明显幼体, 4℃低温水运回实验室; 同时, 采集患病车间进水口水样、育苗池水样和所喂生物饵料——糠虾进行细菌分离和病理相关分析。人工感染用的健康金乌贼幼体取自同一养殖场未患病养殖车间, 体重(2.30± 0.05) g, 胴长为(2.5±0.2) cm。
1.2 实验方法 1.2.1 病样检查与优势菌分离、纯化取典型症状金乌贼幼体, 观察并记录发病幼体的临床症状, 同时取病灶组织制作水浸片, 检查有无寄生虫、霉菌等。
取典型症状金乌贼幼体, 1.5%灭菌NaCl溶液冲洗体表 2次, 剔除内骨骼、剪碎并研磨, 取研磨液涂布1.5%NaCl的TSA和TCBS培养基, 用于分离病原菌, 同时计算幼体细菌总数、弧菌总数及弧菌占比。优势菌单菌落经2次纯化培养, 获纯化优势菌株。
取育苗池进水口水样、育苗池水样和投喂糠虾研磨液梯度稀释, 涂布于TSA和TCBS平板上进行细菌和弧菌的计数及分类统计。
1.2.2 人工感染试验人工感染以浸浴感染方式进行。将分离纯化的3株优势菌扩大培养后用生理盐水制成菌悬液, 采用分光光度法结合平板菌落计数法计算菌液浓度。实验组感染浓度分别设置为104、105、106、107、108 CFU/mL, 对照组使用相同体积的1.5% NaCl溶液。每组使用健康幼体30只, 设置成2个平行。实验期间连续充气, 水温在(19± 1)℃, 每天换水1次, 换水量为1/2 (感染组补充菌悬液, 维持感染浓度)。每日观察并记录金乌贼幼体的体色、摄食、活动、发病症状及死亡情况。从感染发病幼体中进行细菌的分离、培养和纯化, 进行菌落形态观察并与攻毒用细菌进行对比分析, 确定病原菌。
根据寇氏法[13]计算菌株的半致死浓度: lgLD50= XK-d(ΣPi-0.5), 其中XK为最大对数剂量, d为相邻两组对数剂量之差数, Pi为死亡率, i为组号。
1.2.3 病原菌的分类鉴定采用革兰氏染色法对病原菌进行染色镜检; 2.5%戊二醛固定后进行电镜观察; 采用细菌微量生化鉴定管对分离纯化的菌株进行生理生化指标测试, 参照《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》进行初步鉴定[14-15]。采用试剂盒提取细菌DNA, 利用细菌16S rDNA通用引物扩增目标序列, PCR产物送至上海生工生物技术服务有限公司测序。测序的结果进行Blast比对, 用MEGA 6软件构建病原菌的系统发育树。
1.2.4 组织病理学观察取典型患病症状金乌贼幼体, Davidson’s固定24 h, 经酒精梯度脱水、二甲苯透明、石蜡包埋、切片、苏木精-伊红染色法(HE染色)染色后, 进行病理观察并记录结果[16]。
1.2.5 病原菌的药物敏感性实验选择36种药物, 采用药敏纸片扩散法进行药敏测试:配置浓度约为1.00×109 CFU/mL的菌悬液, 取100 μL均匀涂布于TSA培养基平板, 将药敏纸片贴于培养基上, 28℃培养20 h, 测定抑菌圈直径, 根据抑菌圈的大小, 参照说明书进行敏感性判断。
2 结果与分析 2.1 患病幼体症状观察健康金乌贼幼体体色为黄褐色, 受外界刺激后体色可迅速变化(图 1A、D、G), 而患病金乌贼幼体对外界刺激反应迟钝, 摄食减少, 生长缓慢, 体色偏暗发黑(图 1B); 至发病后期, 幼体的体表、肌肉、及内脏团大面积溃烂, 口腕及触腕断裂(图 1C、E、F), 幼体失去游泳能力直至死亡。光学显微镜下可观察到患病幼体背部色素细胞膨大、溃散、破碎后形成的空斑区域(图 1H、I)。对病灶组织的水浸片观察, 未发现霉菌和寄生虫, 但可见水浸片中存在大量细菌。

|
图 1 患弧菌性坏死病金乌贼症状
A.健康金乌贼幼体; B.患病个体; C.濒死个体; D.解剖镜下健康金乌贼; E.解剖镜下患病幼体口腕; F.解剖镜下患病幼体尾部; G.显微镜下正常幼体皮肤的色素细胞; H、I.显微镜下患病幼体皮肤的色素细胞. Fig.1 Symptoms of the Sepia esculenta with disease of necrosis symptoms A. Healthy larva; B. Sick larva; C. Moribund larva; D. A normal larva under a stereo microscope; E. Oral arm of a sick larva under a stereo microscope; F. Tail of a sick larva under a stereo microscope; G. Chromatophores in a normal larva under microscope; H and I. Chromatophores in sick larva under microscope. |
对患病幼体细菌检测结果见表 1。自患病前期和患病末期幼体中均分离出3株优势菌, 分别编号为SE-A、SE-B、SE-C和SE-A2、SE-B2、SE-C2。从菌落形态看出, 各优势菌的种类无变化, 而丰度发生明显变化。由此看出, 随着病程的发展, 菌株SE-B和SE-C无论其绝对浓度还是相对丰度均大幅升高, 提示这2株菌可能为该疾病的病原菌。
|
|
表 1 金乌贼育苗系统中的细菌种类和数量变化分析 Tab.1 Bacterial species and abundance analysis in the breeding system of Sepia esculenta |
育苗系统中细菌培养结果见表 1。在糠虾、进水口水样和育苗池水样中均有优势菌株存在, 且糠虾中分离的3种优势菌与患病幼体分离得到的3株优势菌菌落一致。自育苗池进水口水样和育苗池水样各分离得到1株优势菌, 且其菌落形态与患病幼体中分离的SE-B和糠虾中分离的KX-B一致。从各样品中优势菌的种类和丰度以及其与患病幼体分离的病原菌对比分析, 推测, 糠虾是本次疾病病原菌的主要来源, 幼体摄食含有大量致病原的生物饵料后患病, 由于机体代谢和池内投喂的糠虾饵料, 养殖池水中相应病原菌数量也维持在较高的丰度水平。
2.3 人工感染实验结果人工感染实验结果见表 2。攻毒感染实验期间空白对照组和SE-A组金乌贼幼体均未发生死亡, SE-A仅在高浓度组出现少量幼体运动活力下降的现象, 说明SE-A不是此次疾病的病原菌。而SE-B和SE-C的高浓度浸浴实验组, 在感染12 h后幼体出现持续死亡现象, 到第3天(SE-B)和第2天(SE-C)累计死亡率均为100% (表 2); 低浓度SE-B和SE-C浸浴感染组的幼体对外界刺激反应迟钝, 游动缓慢, 体表色素逐渐加深。感染2~4 d后, 部分幼体口腕及鳍基部肌肉坏死、溃烂, 并逐渐死亡, 内骨骼发生脱落现象, 与自然发病症状一致, 且从人工感染发病的金乌贼幼体中再次分离出的优势菌株(记为SE-1、SE-2)的菌落形态分别与SE-B和SE-C一致, 符合科赫法则, 结果表明, SE-B和SE-C是此次导致金乌贼患病的病原菌。利用寇氏法[21]计算获得SE-B、SE-C对金乌贼幼体的半致死浓度LD50分别为3.98× 106 CFU/mL和8.91×105 CFU/mL。
|
|
表 2 菌株SE-B和SE-C对金乌贼的人工感染实验结果 Tab.2 Results of artificial challenge to Sepia esculenta using SE-B and SE-C |
平板划线培养结果显示, SE-B在TCBS培养基上为圆形、不透明的黄色菌落(图 2A), SE-C在TCBS培养基上形成中间凹陷、边缘半透明的黄色菌落(图 2C)。2株细菌均为革兰氏染色阴性。电镜观察, SE-B呈杆状, 周生鞭毛, 大小约2 μm (图 2B); SE-C为两端钝圆的短杆状、弧形, 端生鞭毛, 大小约1.5 μm (图 2D)。
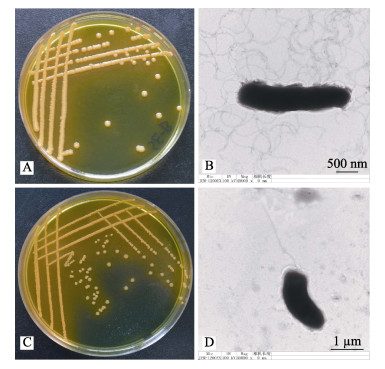
|
图 2 菌株SE-B和SE-C的形态观察 Fig.2 Observation of the morphology of isolated strains SE-B and SE-C |
生理生化测定结果见表 3。两株致病菌均在无盐胰胨水中不生长, 氧化酶阳性, ONPG阴性, 均可利用蔗糖、甘露醇, 不能利用阿拉伯糖、乳糖等。另外, SE-B在3%~10% NaCl胰胨水中生长, 赖氨酸脱羧酶反应阳性, 鸟氨酸脱羧酶、精氨酸双水解酶反应阴性; SE-C在3%~6% NaCl胰胨水中生长, 10% NaCl胰胨水中不生长, 精氨酸双水解酶反应阳性, 赖氨酸、鸟氨酸脱羧酶反应阴性。参照《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》[14-15], 判断SE-B的生理生化特征与溶藻弧菌相符, SE-C的生理生化特征与塔氏弧菌(Vibrio tubiashii)相符。
|
|
表 3 菌株SE-B和SE-C的生理生化特征 Tab.3 Physiological and biochemical characteristics of the strains SE-B and SE-C |
SE-B、SE-C的16S rDNA序列测定结果的可信区读长分别为1391 bp和1393 bp, 通过Blast比对分析发现SE-B与溶藻弧菌同源性最高, 相似性为99.14%, SE-C与塔氏弧菌同源性最高, 相似性为99.28% (图 3)。系统发育树显示, SE-B与溶藻弧菌聚为一支, SE-C与塔氏弧菌聚为一支。由此, 将此次金乌贼幼体坏死病的致病原鉴定为溶藻弧菌和塔氏弧菌。
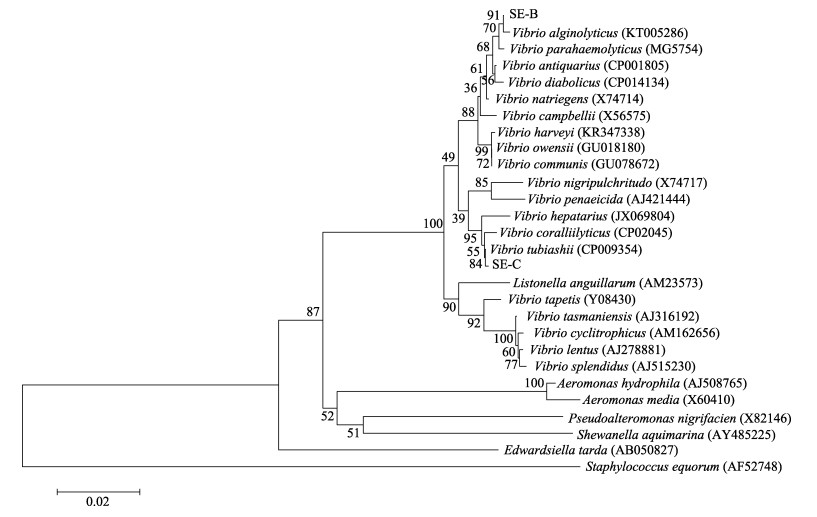
|
图 3 菌株SE-B和SE-C的16S rDNA基因序列聚类分析 菌株后的编号为GenBank中的序列读取号, 标尺表示每个碱基的替换率为0.02. Fig.3 Clustering analysis of bacterial strain SE-B and SE-C based on the gene sequence of 16S rDNA Numbers in parenthesis represented the sequences accession number in GenBank and the scale bar indicated 0.02 substitutions per nucleotide position. |
患病金乌贼幼体的组织病理观察结果见图 4, 患病个体多个器官组织呈现坏死病变特征:皮肤真皮层组织的细胞核固缩, 色素细胞膨大、沉积黑着, 随后崩解, 色素颗粒散布到周围组织中(图 4A)。胴体的肌丝断裂, 肌原纤维结构散乱, 细胞核固缩、深染(图 4B)。鳃小叶水样性病变, 上皮细胞水肿肥大, 细胞核固缩、深染, 鳃丝结构崩解、组织细胞脱落(图 4C)。肝小叶上皮细胞的核固缩、深染, 大量细胞坏死、脱落, 肝小叶坏死后形成空白区域(图 4D、E)。肠道绒毛膜上皮细胞细胞核固缩、深染呈嗜碱性, 微绒毛脱落、消失(图 4F)。
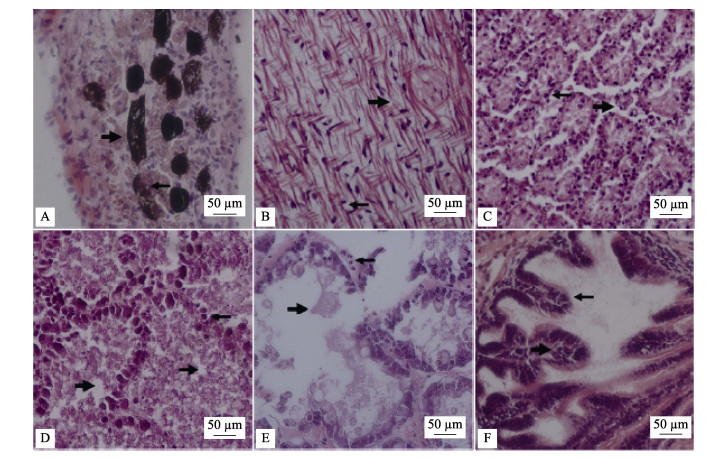
|
图 4 患病金乌贼幼体的组织病理变化 A.真皮层色素细胞膨大, 崩解、扩散; B.肌细胞核固缩、深染, 肌丝断裂; C.鳃上皮细胞水肿, 核固缩、深染, 崩解、脱落; D-E.肝上皮细胞核固缩、深染, 细胞坏死、脱落; F.肠道上皮细胞核固缩、深染, 微绒毛脱落. Fig.4 The pathological changes of Sepia esculenta larva associated with bacterial infection A. The chromatophore in the dermal layer expanded, disintegrated and diffused; B. Myocyte nuclei becoming pyknosis and deep stained, the myofilament being broken; C. Gill epithelial cells becoming edema hypertrophy, nuclear pyknosis, then the gill filament structure disintegrated and shed off; D-E. Nuclear condensation of hepatic lobule epithelial cells, being deep stained, a large number of cells becoming necrosis and dispersion; F. Intestinal epithelial cells nucleus becoming pyknosis and deep stained, and the microvilli shed off. |
对2株病原菌的药敏实验结果见表 4。两株菌均对萘啶酸、氟苯尼考等敏感, 另外, SE-B对链霉素、庆大霉素等耐药, SE-C对新霉素、克拉霉素等耐药。结合药敏试验结果、农业部渔药使用规定及用药成本考虑, 筛选出对2株致病菌均有较好抑菌效果的氟苯尼考作为候选防治药物。
|
|
表 4 菌株SE-B和SE-C对抗生素的敏感性 Tab.4 Sensitivity of strains of SE-B and SE-C to some antibiotics |
近年来, 为了遏制金乌贼资源衰退, 多个地区已将金乌贼增殖放流作为资源恢复的重要手段, 而充足的苗种量是进行增殖放流的基础。金乌贼育苗技术的突破为苗种的规模化供应提供了种质保障, 但育苗及养殖过程中的病害问题一直是苗种和养殖稳定生产的限制因子, 亟需加强金乌贼病害研究。目前, 金乌贼细菌病的研究较少, 本研究从导致金乌贼育苗期幼体大规模死亡的幼体坏死病追踪入手, 开展了病原学、病理学和传播途径分析, 自患病幼体分离得到溶藻弧菌和塔氏弧菌, 通过人工感染实验证实这2株细菌是幼体坏死病的致病原。根据流行病学特征和致病原种类, 笔者将该病命名为“乌贼弧菌性坏死病”(cuttlefish vibrionic necrosis disease, CVND), 这是有关金乌贼细菌性病害研究的首次报道。
从人工感染试验结果来看, 菌株SE-B(溶藻弧菌)和SE-C(塔氏弧菌)浸浴感染均可使健康金乌贼幼体产生与自然发病一致的症状, 对金乌贼幼体的半致死浓度LD50分别为3.98×106 CFU/mL和8.91×105 CFU/mL, 这说明塔氏弧菌比溶藻弧菌的致病力更强。此外, 从幼体感染前、后期比较来看, 溶藻弧菌优势度从患病前期的20%上升到后期的30%, 而塔氏弧菌的优势度从患病前期的10%增长到后期的60%, 且塔氏弧菌总数是溶藻弧菌的两倍, 可以看出塔氏弧菌在金乌贼幼体弧菌性坏死病中的贡献度更大。溶藻弧菌是海水养殖动物中常见的病原之一, 常引起养殖动物疾病和经济损失, 曾在平鲷(Rhabdosargus sarba)、红鳍笛鲷(Sparus macrocephlus)等鱼类养殖病害研究中有报道[17-18], 还有利用溶藻弧菌人工感染加拿大萨斯卡通地区乌贼(Sepia officinalis)发病的报道[8]。塔氏弧菌在中国水产养殖方面的研究较少, 在国外养殖鱼类和美洲牡蛎(Crassostrea virginica)和太平洋牡蛎(Crassostrea gigas)等软体动物种类等方面有少量报道, 并认为是具有威胁性的致病菌[19-22]。在本研究中发现, 金乌贼幼体感染溶藻弧菌和塔氏弧菌后, 均可引起其背部色素细胞加深, 口腕和触腕溃疡断裂, 鳍溃烂等症状, 与早期报道的乌贼感染后表现出相似的症状[8]。由此可见, 在养殖过程中要对这2株细菌的数量进行密切关注。
通过对育苗系统中养殖水源、养殖池水、生物饵料——糠虾进行了细菌学分析, 以期推测病原来源及传播途径。检测结果表明, 水源水中虽然也分离到溶藻弧菌, 但细菌总量相对较低, 养殖池水中的优势菌亦为溶藻弧菌且细菌量相对较高; 糠虾中的优势菌种类与患病金乌贼幼体中优势菌的种类一致, 且其中的溶藻弧菌含量达到107 CFU/g。此外, 第2种致病菌——塔氏弧菌也仅在糠虾和患病幼体中分离发现。结合育苗管理技术工艺并对比育苗系统中各位点、各环节中细菌和弧菌数量以及优势菌株形态特征可以推测, 育苗用生物饵料——糠虾是坏死病致病菌的主要来源, 摄食糠虾是金乌贼幼体坏死病传播的重要途径。有研究表明, 饵料的携菌种类和菌量与养殖动物疾病发生关系密切。例如, 刘朝阳等[23]研究表明摄食携带有大量细菌的小杂鱼可导致大菱鲆(Scophthalmus maximus)腹水病, 逄慧娟等[24]研究表明刺参(Apostichopus japonicus)“肠炎病”是由于摄食沉积到附着基上含有大量病原菌的饵料而导致。本研究结果显示, 糠虾和不清洁水源携带大量有害弧菌导致了金乌贼幼体的感染, 并出现大批死亡。由此, 从切断病原入手, 严格控制饵料的质量是保障苗种健康养殖的基础。
综上, 本研究完成了金乌贼育苗期“乌贼弧菌性坏死病”的病原、病理、防治药物及病原传播途径的初步研究。在此基础上, 还需进行病原致病机理的深入研究; 此外, 为适应绿色养殖和产品质量安全的需要, 针对该疾病仍需进一步开展中草药等绿色药品的研发及疾病防控技术的研究, 为金乌贼的健康养殖提供技术保障。
| [1] |
Qi Z Y. Economic Mollusca of China[M]. Beijing: China Agriculture Press, 1998: 293-294. [齐钟彦. 中国经济软体动物[M]. 北京: 中国农业出版社, 1998: 293-294.]
|
| [2] |
Hao Z L, Zhang X M, Zhang P D. Biological characteristics and propagation of Sepia esculenta[J]. Chinese Journal of Ecology, 2007, 26(4): 601-606. [郝振林, 张秀梅, 张沛东. 金乌贼的生物学特性及增殖技术[J]. 生态学杂志, 2007, 26(4): 601-606. DOI:10.3321/j.issn:1000-4890.2007.04.027] |
| [3] |
Zhao H J, Wei B F, Hu M, et al. Preliminary study on Sepia esculenta oosperm hatching and effects of different adhesion substrates[J]. Transactions of Oceanology and Limnology, 2004, 26(3): 64-68. [赵厚钧, 魏邦福, 胡明, 等. 金乌贼受精卵孵化及不同材料附着基附卵效果的初步研究[J]. 海洋湖沼通报, 2004, 26(3): 64-68. DOI:10.3969/j.issn.1003-6482.2004.03.011] |
| [4] |
Zheng X D, Han S, Lin X Z, et al. Research progress in Cephalopod reproductive behaviors[J]. Journal of Fishery Sciences of China, 2009, 16(3): 459-465. [郑小东, 韩松, 林祥志, 等. 头足类繁殖行为学研究现状与展望[J]. 中国水产科学, 2009, 16(3): 459-465. DOI:10.3321/j.issn:1005-8737.2009.03.020] |
| [5] |
Niu C, Yang C J, Huang Y X, et al. The efficacy of new spawning substrates for Sepia esculenta oosperm adhe-sion[J]. Journal of Fishery Sciences of China, 2017, 24(6): 1234-1244. [牛超, 杨超杰, 黄玉喜, 等. 金乌贼新型产卵附着基的实验研究[J]. 中国水产科学, 2017, 24(6): 1234-1244.] |
| [6] |
Lei S H, Zhang X M, Zhang P D, et al. Early development of golden cuttlefish Sepia esculenta[J]. Journal of Fishery Sciences of China, 2014, 21(1): 37-43. [雷舒涵, 张秀梅, 张沛东, 等. 金乌贼的早期生长发育特征[J]. 中国水产科学, 2014, 21(1): 37-43.] |
| [7] |
Brickle P, Olson P D, Littlewood D T J, et al. Parasites of Loligo gahi from waters off the Falkland Islands, with a phylogenetically based identification of their cestode larvae[J]. Canadian Journal of Zoology, 2001, 79(12): 2289-2296. DOI:10.1139/z01-189 |
| [8] |
Sangster C R, Smolowitz R M. Description of Vibrio algino-lyticus infection in cultured Sepia officinalis, Sepia apama, and Sepia pharaonis[J]. Biological Bulletin, 2003, 205(2): 233-234. DOI:10.2307/1543270 |
| [9] |
Mladineo I, Jozić M. Aggregata infection in the common octopus, Octopus vulgaris (Linnaeus, 1758), Cephalopoda:Octopodidae, reared in a flow-through system[J]. Acta Adriatica, 2005, 46(2): 193-199. |
| [10] |
Furuya H. Two new dicyemids from Sepia longipes (Mol-lUsca:Cephalopoda:Decapoda)[J]. Journal of Parasitology, 2009, 95(3): 681-689. DOI:10.1645/GE-1875.1 |
| [11] |
Furuya H. A new dicyemid from Sepiella japonica (Mollusca:Cephalopoda:Decapoda)[J]. Journal of Parasitology, 2008, 94(1): 223. DOI:10.1645/GE-1173.1 |
| [12] |
Furuya H. Redescription of Dicyemennea nouveli (Phylum:Dicyemida) from Enteroctopus dofleini (Mollusca:Cepha-lopoda:Octopoda)[J]. Journal of Parasitology, 2008, 94(5): 1064-1070. DOI:10.1645/GE-1503.1 |
| [13] |
Yang M C. Veterinary Statistics[M]. Beijing: China Prospect Press, 1990: 232. [杨茂成. 兽医统计学[M]. 北京: 中国展望出版社, 1990: 232.]
|
| [14] |
Holt J G, Krieg N R, Pha S, et al. Bergey's Manual of De-terminative Bacteriology [M]. 9th Edition. Philadelphia: Wil-liams & Wilkins Company, 1994: 482-484.
|
| [15] |
Dong X Z, Cai M Y. Common Bacterial System Identifica-tion Manual[M]. Beijing: Science Press, 2002: 107-116. [东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2002: 107-116.]
|
| [16] |
Hao J G, Wang Y G, Liao M J, et al. The effects of three types of feed supplements on the growth of Apstichopus ja-ponicus cultured in cages[J]. Progress in Fishery Sciences, 2015, 36(5): 102-110. [郝继光, 王印庚, 廖梅杰, 等. 饲料中添加3种不同投入品对筏式浅海网箱刺参(Apstichopus japonicus)养殖生长的影响[J]. 渔业科学进展, 2015, 36(5): 102-110.] |
| [17] |
Li J, Feng J, Liu X, et al. Vibro alginolyticus, a pathogen of Sparus sarba cultured in Hongkong[J]. Journal of Fisheries of China, 1998, 22(3): 275-278. [李军, 冯娟, 刘旭, 等. 香港地区养殖平鲷的病原菌(溶藻胶弧菌)研究[J]. 水产学报, 1998, 22(3): 275-278.] |
| [18] |
Li Y Q, Jian J C, Wu Z H. Pathogen of Vibriosis of Lutjanus sanguineus[J]. Journal of Zhanjiang Ocean University, 2004, 24(6): 1-5. [李永芹, 简纪常, 吴灶和. 红鳍笛鲷弧菌病病原的研究[J]. 湛江海洋大学学报, 2004, 24(6): 1-5. DOI:10.3969/j.issn.1673-9159.2004.06.001] |
| [19] |
Biel F M, Allen F A, Häse C C. Autolysis in Vibrio tubiashii and Vibrio coralliilyticus[J]. Canadian Journal of Microbi-ology, 2014, 60(2): 57-63. DOI:10.1139/cjm-2013-0654 |
| [20] |
Richards G P, Watson M A, Needleman D S, et al. Mortali-ties of Eastern and Pacific oyster larvae caused by the path-ogens Vibrio coralliilyticus and Vibrio tubiashii[J]. Applied & Environmental Microbiology, 2015, 81(1): 292-297. |
| [21] |
Elston R A, Hasegawa H, Humphrey K L, et al. Re-emergence of Vibrio tubiashii in bivalve shellfish aqua-culture:severity, environmental drivers, geographic extent and management[J]. Diseases of Aquatic Organisms, 2008, 82(2): 119. |
| [22] |
Hasegawa H, Lind E J, Boin M A, et al. The extracellular metalloprotease of Vibrio tubiashii is a major virulence fac-tor for Pacific oyster (Crassostrea gigas) larvae[J]. Applied and Environmental Microbiology, 2008, 74(13): 4101-4110. DOI:10.1128/AEM.00061-08 |
| [23] |
Liu Z Y, Wang Y G, Sun X Q. Correlation between bacteria associated with trash fish and diseases of cultured turbot (Scophthalmus maximus)[J]. South China Fisheries Science, 2009, 5(5): 44-51. [刘朝阳, 王印庚, 孙晓庆. 小杂鱼携带细菌与大菱鲆疾病发生的相关性[J]. 南方水产科学, 2009, 5(5): 44-51. DOI:10.3969/j.issn.1673-2227.2009.05.008] |
| [24] |
Pang H J, Liao M J, Li B, et al. Etiology and treatment of enteritis disease in cultured junviles of Apostichopus japonicus[J]. Progress in Fishery Sciences, 2017, 38(3): 188-197. [逄慧娟, 廖梅杰, 李彬, 等. 刺参(Apostichopus japonicus)保苗期"肠炎病"及其治疗方法[J]. 渔业科学进展, 2017, 38(3): 188-197.] |
 2019, Vol. 26
2019, Vol. 26

