2. 浙江海洋大学海洋与渔业研究所, 浙江 舟山 316021
2. Marine and Fisheries Research Institute of Zhejiang Ocean University, Zhoushan 316021, China
大黄鱼(Larimichthys crocea)是中国东部沿海重要的海水经济鱼类之一, 近年大黄鱼人工网箱养殖规模不断扩大, 同时缺乏统一规划和合理布局, 导致大黄鱼养殖网箱发展呈无序、无度、盲目状态, 各种疾病也因此频繁暴发[1-3]。目前报道的危害养殖大黄鱼的常见疾病主要有大黄鱼细菌性溃疡病、大黄鱼内脏白点病、大黄鱼“白鳃病”、大黄鱼虹彩病毒病、淀粉卵甲藻病、刺激隐核虫病等, 每年这些病害都给大黄鱼养殖业造成巨大的经济损失。其中大黄鱼“白鳃病”是近年在养殖大黄鱼中出现的一种新的疾病, 因患病鱼的鱼鳃表现出明显的贫血症状而得名。2007年首次在福建三都澳海域网箱养殖大黄鱼中被发现, 之后相继在福建宁德等地的大黄鱼网箱养殖中发生, 浙江省自2010年发生“白鳃病”以来, 已连续4年在台州、宁波、舟山等大黄鱼海水网箱养殖区暴发该病, 并呈逐年加重的趋势。大黄鱼“白鳃病”持续时间长, 死亡率高, 且以危害大黄鱼成鱼为主, 对大黄鱼养殖业危害极其严重, 但对于该病的传播机制和发病机理至今尚不清楚[4]。已有报道多数认为该病为病毒性疾病, 杨小强[5]运用针对真鲷虹彩病毒(red sea bream iridovirus, RSIV)的引物从患“白鳃病”的病鱼中检测到了RISV; 而龚辉等[6]则从患病鱼上分离到直径15~20 nm的疑似RNA病毒粒子; Xu等[7]在患“白鳃病”病鱼的组织超薄切片中观察到了直径为45~50 nm的病毒粒子。
由于水产动物养殖环境、密度、方法等在各养殖地存在很大差异, 导致不同的病原有时可以引发相同的临床症状, 如鱼类内脏白点病, 据报道, 诺卡氏菌(Nocardia)、迟缓爱德华氏菌(Edwardsiella tarda)、杀香鱼假单胞菌(Pseudomonas aeruginosa)等都可以使发病鱼的内脏器官都出现白色结节[8-10]。2017年8-10月期间, 舟山六横、登步等地网箱养殖的大黄鱼出现了大量死亡, 发病鱼的主要临床症状表现为白鳃, 养殖户也称之为“白鳃病”。据不完全统计, 患病大黄鱼累计死亡率可达30%以上, 严重时可达80%, 且患病大黄鱼均为1龄以上成鱼, 抗菌药物治疗无明显效果。为了查明此次导致养殖大黄鱼暴发性死亡的病因, 本研究通过组织病理切片、透射电镜超薄切片和PCR扩增等方法对采集的表现严重“白鳃”临床症状的大黄鱼进行病原学分析, 旨在为大黄鱼养殖过程中出现的“白鳃”病的诊断与防治提供科学依据。
1 材料与方法 1.1 材料发病大黄鱼于2017年8-9月采集自浙江舟山登步、六横的大黄鱼网箱养殖点, 体长25~ 28 cm, 体重230~270 g, 选取20尾水产养殖中出现特征性鳃丝苍白症状的病鱼, 低温运回实验室。常规TSA和TCBS细菌培养基购自杭州微生物试剂有限公司; 快速瑞姬氏染液购自南京建成生物工程研究所; 高保真Ex Taq DNA聚合酶、dNTPs、DL 2000 Marker、UNIQ-10柱式胶回收试剂盒购自TAKARA公司; 组织DNA提取试剂盒购自Qiagen公司; 其他化学试剂均为国产分析纯级试剂。
实验使用的主要仪器: Leica RM2235切片机、Nikon Eclipse 50 i生物显微镜、Eppendorf 5424 R台式冷冻离心机、Bio-Rad DNA Engine®多槽PCR仪、Bio-Rad GDXI型凝胶成像系统等。
1.2 病理组织切片制备与观察选择临床表现出典型病征的濒死病鱼, 取鳃丝、体表黏液及肠道内容物等制成水浸片, 显微镜下观察。
分别取相同体积病鱼和健康鱼的血液制备血涂片, 瑞姬氏染色后显微镜下观察。
分别取其肝、脾、肾及心脏等组织经10%甲醛中固定, 在24 h后换数次75%乙醇冲洗, 最后保存于75%的乙醇中。固定样品经后续乙醇系列及丙酮脱水过程, 移入二甲苯溶液中透明, 浸蜡包埋后切片, 烤干后展片以苏木精-伊红染色法(H & E染色)染色, 显微镜下观察拍照。
将病鱼肝、脾、肾及心脏等内脏组织切成2 mm×2 mm×2 mm的小块分别固定于2.5%戊二醛磷酸缓冲液(0.1 moL/L, pH 7.4)中, 4℃固定4 h以上。在0.1 moL/L磷酸缓冲液中4℃漂洗过夜后再用1%锇酸溶液固定, 经过一系列浓度的乙醇脱水, 样品块经环氧树脂包埋后制备超薄切片, 透射电镜观察拍照。
1.3 致病菌分离用酒精棉球对濒死病鱼体表进行消毒后解剖鱼, 无菌条件下取出病鱼的肝、肾、脾等内脏组织于离心管中, 剪碎后在常规细菌培养基胰蛋白胨大豆琼脂(TSA)和弧菌选择性培养基(TCBS)上划线接种, 27℃培养24~48 h, 观察细菌生长情况。
1.4 PCR模板制备将病鱼样本的肝、脾、肾等内脏组织碾碎, 分别取20~50 mg内脏组织的匀浆液, 使用DNA抽提试剂盒, 按说明书提取总基因组DNA。
1.5 RISV和SSU DNA的PCR扩增根据中华人民共和国出入境检验检疫行业标准(SN/T 1675-2014), 合成RSIV检测用引物, 以提取的总基因组DNA为模板进行RSIV的PCR扩增检测; 根据已发表的微孢子虫相关文献[11], 合成针对微孢子虫亚单位核糖体核糖核酸基因(SSU rDNA)的1对通用引物:上游引物MF, 5'–CCGGAGAGGGAGCCTGAGA–3'和下游引物MR, 5'–GACGGGCGGTGTGTACAAA–3', 进行PCR扩增。
PCR反应条件为: 94℃预变性5 min; 94℃ 45 s, 55℃ 45 s, 72℃ 1 min, 共35个循环, 最后72℃延伸10 min。PCR反应体系均为25 μL, 其中超纯水19.25 μL, 10×Reaction buffer 2.5 μL, 引物(50 pmol/L) 0.5 μL, dNTP (10 mmol/L) 0.5 μL, 模板2.5 μL, Taq酶0.25 μL。获得的PCR产物用1.2%的琼脂糖凝胶电泳检测, 并送华大基因公司进行序列测定。
1.6 SSU DNA序列分析及分子发育树构建将获取的基因序列运用DNAMAN软件进行排序、比对, 并辅以人工校正, 同时应用NCBI中在线软件BLAST对获取的基因序列进行同源检索。从GenBank中下载相关的黏孢子虫、微孢子虫等基因序列作参考, 使用MEGA 3.1分析软件, Kimura-2法计算遗传距离, 并采用Bootstrap(重复次数1000)检查聚类树各分支置信度, 邻接法构建分子发育树。
1.7 巢式PCR检测方法的建立根据获得的SSU rDNA基因序列, 用Primer premier 5.0软件, 设计了内、外两对引物。
外引物序列为:
WGF1: 5'–GTGACACCGGCAGTTGGATT–3'
WGR1: 5'–CGGCTTTTAAAATCGCACAGT–3'
内引物序列为:
WGF2: 5'–GTCGTTTGAATGCCAGTTG–3'
WGR2: 5'–CAAAGCGATAAATTAGAGATCGT–3'
其中WGF1和WGR1扩增784 bp的片段, WGF2和WGR2扩增536 bp的片段, 引物由上海生工生物工程技术服务有限公司合成。第一轮PCR反应结束后, 取扩增产物1 μL, 用内引物WGF2和WGR2进行第二轮PCR扩增。
PCR反应体系(25 μL)为: 2.5 μL 10 × buffer、2 μL dNTP(2.5 mmol/L)、Primer 1和2 (25 μmol/L)各0.25 μL、Taq DNA聚合酶0.2 μL、模板0.5 μL, 用灭菌去离子水补充反应总体积至25 μL, 将混合物置PCR仪中反应。
PCR循环参数: 94℃预变性5 min后开始循环, 94℃ 45 s, 55℃ 45 s, 72℃ 1 min, 共35个循环, 最后72℃延伸7 min。5 μL PCR产物经琼脂糖凝胶电泳后, 在紫外凝胶成像仪中照相记录。获得的PCR产物用1.5%的琼脂糖凝胶电泳检测, 并送华大基因公司进行序列测定。
采用DNA抽提试剂盒抽提正常大黄鱼、鮟鱇鱼孢子虫以及三疣梭子蟹微孢子虫基因组DNA, 以获得的DNA作模板, 在相同条件进行巢式PCR扩增, 验证巢式PCR方法的特异性。以紫外分光光度计测定提取的含有SSU rDNA的质粒模板, 定量后10倍递进稀释法进行稀释, 分别取各浓度适量作为PCR扩增模板, 对建立的巢式PCR灵敏度进行检测。
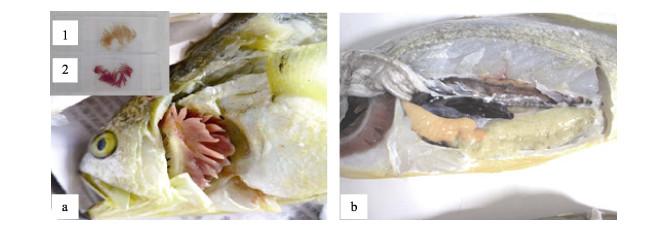
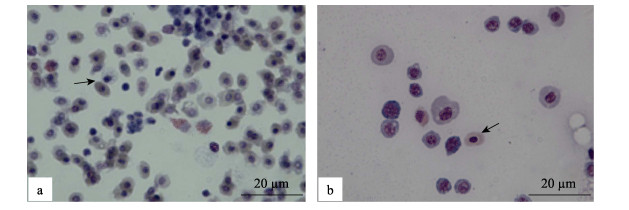
2 结果与分析 2.1 临床症状与解剖观察病鱼临床解剖观察显示, 与以往报道的大黄鱼“白鳃病”病症状相似, 病鱼的鳃丝表现出极度的贫血; 部分鱼有腹水; 脾脏肿大呈暗红色; 肾脏肿大贫血; 心包积液明显(图 1)。显微镜下观察制备的血涂片, 病鱼血液中的红细胞数量急剧减少(图 2)。
|
图 1 患“白鳃病”大黄鱼的临床症状
a.病鱼鳃丝苍白. 1:病鱼鳃丝; 2:正常鱼类鳃丝. b.病鱼脾脏充血呈暗红色, 肾脏贫血肿大.
Fig.1 Clinical symptoms of white-gill diseased Larimichthys crocea
a. Pericardial effusion. 1: gill of sick fish; 2: gill of healthy fish. b. The spleen of sick fish showed obvious hyperaemia and kermesinus, the kidney intumesced and with severe anaemia. |
|
图 2 大黄鱼血涂片
a.正常大黄鱼血涂片, 血液中有大量的红细胞(箭头); b.发病大黄鱼血涂片, 血液中红细胞(箭头)数量急剧减少.
Fig.2 Blood smear of Larimichthys crocea
a. Blood smear of healthy fish, there were a lot of erythrocytes (arrow); b. Blood smear of sick fish, there were little erythrocytes (arrow). |
组织病理切片观察结果显示, 病鱼的肝、脾和肾等内脏组织均发生了严重的病理变化, 有明显的细胞坏死、炎性细胞浸润等现象。肝组织结构松散, 肝内血管管腔狭窄或闭塞, 血管壁的内皮细胞发生变性, 坏死或解体, 血管内多空虚, 或所含的血液多为血浆, 红细胞少见。脾脏组织中出现大量变性、坏死的红细胞; 病变严重的脾脏组织发生大面积坏死, 椭圆体、红髓和白髓等正常结构消失; 脾脏实质出现肉芽肿结构, 中心有坏死的组织碎片, 外围有炎性细胞浸润, 部分退变的红细胞凝聚成一小团, 形成均质体。肾脏组织结构松散, 失去原有结构; 肾小球萎缩或崩解; 肾小管管腔变窄或闭塞, 肾小管上皮细胞肿胀, 界限模糊; 肾脏实质内有炎性细胞浸润, 部分病鱼肾脏实质也出现肉芽肿结构。心肌纤维纹理不清晰, 心肌纤维断裂严重, 心肌细胞变性、坏死, 有少量炎性细胞浸润(图 3)。
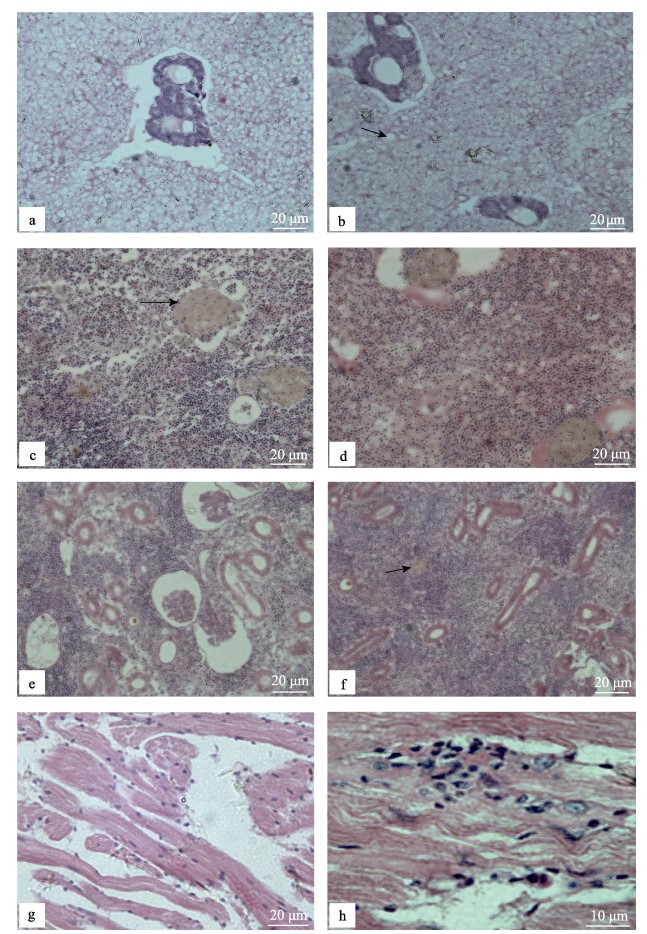
|
图 3 患“白鳃病”大黄鱼的组织病理学分析 a.肝组织血管管腔狭窄, 血管内只有血浆无红细胞; b.肝细胞排列疏松, 空泡明显(箭头); c.脾脏组织肉芽肿(箭头); d.红细胞弥漫于整个脾组织中; e.肾小球萎缩或崩解; f.肾实质有淋巴细胞浸润, 有肉芽肿结构(箭头), 肾小管管腔狭窄; g.心肌纤维纹理不清晰; h.心肌内有炎性细胞浸润. Fig.3 Histopathology of white-gill diseased Larimichthys crocea a. Intrahepatic vasculars were stenosing and there were no red blood cells in blood vessels of the liver; b. Liver cell arranged loosely and the gap is obvious; c. The granuloma in spleen (arrow); d. Erythrocytes diffused throughout the spleen and showed serious degenerative changes; e. Atrophic glomeruli or disintegration; f. Lymphocytes infiltrated in the kidney, renal tubule stenosis, the granuloma in kidney (arrow); g. Myocardial fibrous transverses are not distinct; h. There were a little inflammatory cell infiltration in the myocardium. |
病鱼内脏组织超薄切片法观察结果显示, 在脾脏和肾脏的组织细胞内有一种圆形孢子样结构, 且分布于细胞质中(图 4a)。该结构中间为直径250~400 nm的电子致密层, 在致密层外包裹一圈花边样结构, 最外层为囊膜结构, 但未观察到疑似病毒粒子结构(图 4b)。
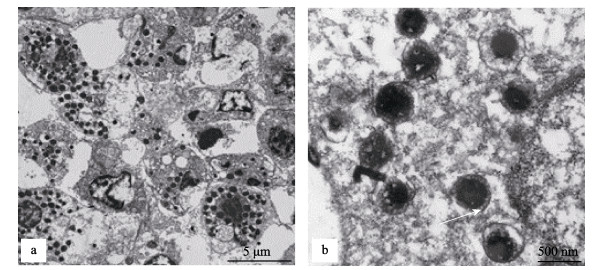
|
图 4 患“白鳃病”大黄鱼的脾和肾组织细胞的电镜图 a.脾细胞的细胞质中充满孢子样结构; b.电子致密层外包裹一圈花边样结构(箭头). Fig.4 Electron micrograph of cells from white-gill diseased Larimichthys crocea a. Spore-like structures filled in the cytoplasm of splenocytes; b. The lace-like structure wrapped around an electron compact layer. |
无菌条件下, 使用细菌常用培养基TSA和TCBS对濒死鱼内脏组织进行细菌分离培养, 结果在病鱼样本的各内脏组织中均未见有明显的优势菌群出现。
2.4 RSIV PCR检测结果RSIV的扩增检测结果:两对针对RSIV的特异性引物均未从病鱼DNA样本中扩增出目的核酸片带; 而RISV阳性对照则可以扩增出目的核酸条带。
2.5 SSU rDNA基因扩增结果PCR产物电泳结果显示, 可从病样中扩增出单一的特异性条带(图 5)。SSU rDNA基因序列比对分析结果显示, 扩增获得的5个SSU rDNA基因的长度同为1471 bp, 而且基因序列之间同源性为100%。将测序结果提交到NCBI获得GenBank登录号为MH 407695。
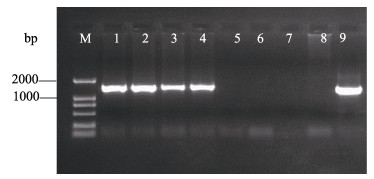
|
图 5 大黄鱼中SSU rDNA PCR扩增结果 M: DL 2000 DNA Marker; 1-9:为临床样本SSU rRNA基因扩增结果. Fig.5 Detected results of SSU rDNA in Larimichthys crocea samples by PCR M: DL2000 DNA marker; Lane1-9: genomic DNA purified from diseased fish. |
在GenBank中进行同源序列检索, 获取的序列与GenBank中黏孢子虫纲(Myxosporidia)双壳目(Bivalvulida)单极亚目(Unipolarina)弯缝虫属(Sinuonea)一种Sinuolinea sp.的序列同源性最高, 达89%。图 6是根据PCR扩增获得的SSU DNA序列与相关属种SSU DNA序列构建的系统发育树。图中可见, 所有基因序列都起源于共同的祖先双壳目, 所有序列分为两大集群, 所获基因序列与单极亚目和变孢亚目的部分系列处于同一集群中, 又与单极亚目弯缝虫属的Sinuolinea sp.的基因序列聚为同一分支, 亲缘关系最密切。
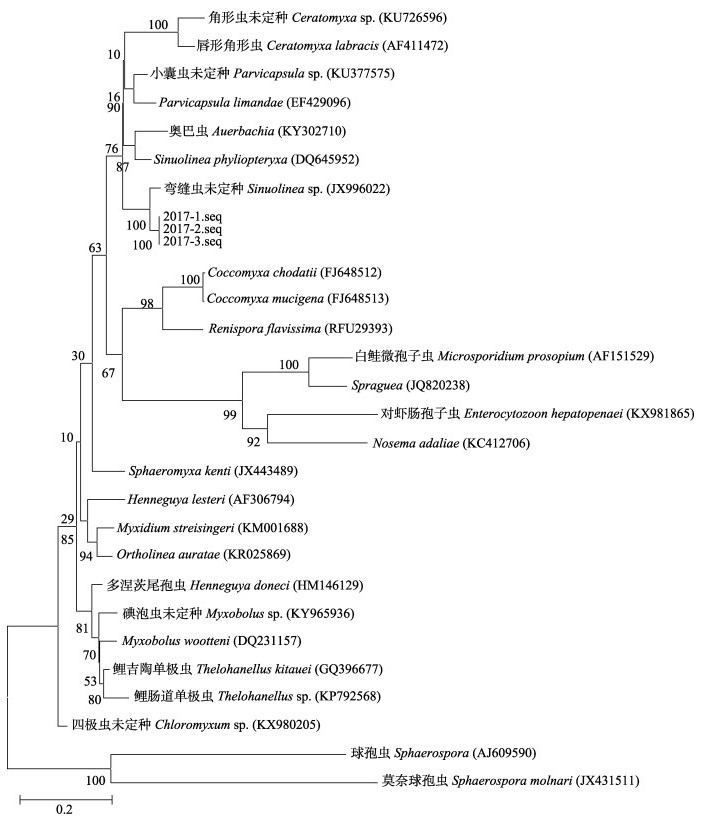
|
图 6 根据黏孢子虫SSU rDNA基因序列构建的系统发育树 分子进化树构建采用邻位归并法, 选择Kimura-2参数模型; 分叉处数值表示1000次重复抽样所得到的置信度百分比; 标尺长度表明代表每个位点发生0.2次置换 Fig.6 The phylogenetic tree of myxosporidia based on partial SSU rDNA gene The phylogenetic tree was generated by neighbor-joining method using 1000 bootstrap and kimura 2-parameter model. The scale bar represents the average number of nucleotide substitutions per site. |
从发病大黄鱼样本中提取总DNA, 进行巢式PCR方法检测, 扩增产物经过1.5%琼脂糖电泳检测, 第一轮和第二轮PCR均扩增出预期的目标带(图 7)。以正常大黄鱼、鮟鱇孢子虫、虾肝肠胞虫以及三疣梭子蟹微孢子虫DNA样本为PCR扩增的模板, 在相同条件进行巢式PCR检测, 结果只在发病大黄鱼样本中扩增出特异性条带, 而其他样本未有条带扩增, 说明设计的引物对有很强的特异性(图 8)。以各稀释倍数质粒为模板, 进行巢式PCR灵敏度检测, 结果显示, 外引物WGF1和WGR1可检测的灵敏度为10-6的稀释度, 而二次PCR可检测的灵敏度比首轮PCR高104倍以上, 最高可达0.5 pg(图 9)。
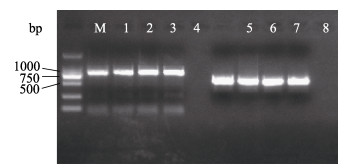
|
图 7 从患“白鳃病”大黄鱼提取的总DNA的巢式PCR扩增图 M: DL 2000 DNA Marker; 1, 2, 3, 4:一次PCR扩增产物; 5, 6, 7, 8:二次PCR扩增产物. Fig.7 Detected results of SSU rRNA of white-gill diseased Larimichthys crocea samples by PCR M: DL 2000 DNA Marker; Lane1-4: first (nest) PCR; Lane5-8: second (nest) PCR. |

|
图 8 巢式PCR特异性检测 M: DL 2000 DNA Marker; 1:鮟鱇微孢子虫; 2:虾肝肠胞虫3:三疣梭子蟹微孢子虫; 4: “白鳃”病鱼样本; 5:健康大黄鱼样本; 6:大黄鱼刺激隐核虫; 7:空白对照; 8:阳性对照. Fig.8 Specificity analysis of the nested PCR amplification M. DL 2000 DNA Marker; 1. Microsporidia from Lophius litulon; 2. Enterocytozoon hepatopenaei; 3. Microsporidia from Portunus trituberculatus; 4. Diseased fish; 5. Healthy fish; 6. Cryptocaryon irritans from LarimIchthys crocea; 7. Negative control; 8. Positive control. |
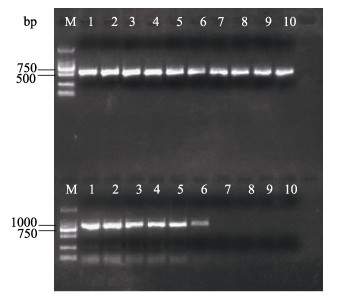
|
图 9 巢式PCR的灵敏度检测 M: DL 2000 DNA Marker; 1-10: 10–1–10–10不同的稀释倍数. Fig.9 Sensitivity analysis of the nested PCR amplification M: DL 2000 DNA Marker; Lane1-10: 10–1–10–10. |
本次临床采集的患病大黄鱼体表完好无溃疡症状, 具有特征性的鳃丝苍白临床表征, 解剖观察病鱼脾脏肿大呈暗红色, 同时肾脏贫血肿大。采集病鱼血液涂片显示嗜酸性粒细胞等淋巴细胞增多, 而红细胞数量显著下降。病鱼内脏组织中未分离到优势致病菌, 患病鱼核酸样本中RSIV PCR检测也均为阴性, 排除了其他病原同时感染的可能。在病鱼的内脏组织超薄切片中观察到一种直径约为300~600 nm的圆形孢子样结构。从病鱼样本中通过PCR扩增获得SSU rDNA基因序列, 经序列比对发现与已报道的黏孢子虫Sinuolinea sp.的基因序列同源性达到了89%, 与其他孢子虫的SSU rDNA同源性较低, 说明此次养殖大黄鱼“白鳃病”是由一种黏孢子虫引起, 大黄鱼造血器官因虫体寄生发生病变, 导致鱼体全身贫血, 引发了临床“白鳃”症状。
黏孢子虫的寄主广泛, 海水鱼和淡水鱼都可寄生, 几乎可以感染鱼的各种器官, 甚至在同一条鱼的同一器官内有数种黏孢子虫寄生[12-13]。但在此次采集的病鱼样本中, 只在病鱼的肾和脾脏组织中观察到了孢子样结构, 而在肌肉、鳃丝、肝脏组织中未有发现。黏孢子主要影响宿主的生长发育, 降低宿主抗病能力, 造成寄生部位病变, 严重时会使水产动物失去商品价值, 甚至引起宿主的死亡。Granath等[14]报道在北美、欧洲和日本流行着一种鲑鳟类打转病, 并使鲑鳟大量死亡, 研究证实脑黏体虫(Myxobolus cerebralis)是导致该病的病原; Elizabeth等[15]2000年在北美银大麻哈鱼(Oncorhynchus keta)肾脏内发现一类新的黏孢子虫, 该虫可引起寄主鱼的慢性肾脏增生病, 并导致鱼类较高的死亡率; Yokoyama等[16]报道由于光滑单极虫(Thelohanellus hovorkae)寄生导致鲤暴发严重的出血性疾病。Sinuolinea属最早于1916年由Davis在犬牙石首鱼的膀胱组织切片中发现, 可以寄生于海水鱼和淡水鱼, 至今报道的有10多个种[17]。2008年Garner等[18]报道一种Sinuolinea可以导致感染鱼的肾小管扩张, 肾小管上皮细胞肥大。Marianna等[19]对患病尼罗罗非鱼(Oreochromis niloticus)的组织病理学研究, 发现病鱼的脾肾组织发生凝固性坏死、出血, 在病鱼肝、肾、脾、肌肉、心脏、肠道等多个组织中还可观察到黑色素巨噬细胞和嗜酸性粒细胞的浸润, 同时在脾肾组织中观察到了一种黏孢子虫, 经18S SSU rDNA序列分析确认为尼罗罗非鱼弯缝虫(新种)(Sinuolinea niloticus n. sp.)。本次患“白鳃病”的大黄鱼体表完好, 未见出血或组织增生等症状; 组织病理学观察显示, 患病鱼内脏组织出现淋巴细胞浸润、肾小管上皮细胞肥大等病理变化, 但未观察到黑色素巨噬细胞。虽然在患病鱼的肝脏和心脏中也观察到病理变化, 但最严重的病变还是在脾脏和肾脏; 超薄电镜切片观察也只有在脾脏和肾脏中找到的孢子样结构, 且虫体结构一致。本研究未对肌肉、肠道组织进行组织病理学观察, 后期的PCR检测未在肠和肌肉组织的DNA样本中检测到虫体的核酸, 所以推测脾脏和肾脏两者可能是该虫的靶器官。
目前报道的患“白鳃病”的大黄鱼均呈极度的贫血状态, 体表黏液及鳃部极少可以观察到肉眼可见的寄生虫, 内脏组织中也分离不到优势致病菌。该病波及面广, 危害程度严重, 发病水温一般为26~28℃, 感染发病的大黄鱼以1龄以上的成鱼为主, 病死亡率在10%~50%, 之前的报道多认为该病是一种病毒性疾病[4-7]。据笔者统计, 这次大黄鱼白鳃病发病的水温也是在26~28℃左右, 患病鱼也都是1龄以上成鱼; 临床主要可见症状为鱼鳃苍白, 体表黏液及鳃丝显微镜检也未观察到致病性寄生虫; 内脏组织中也未分离到致病菌; RSIV PCR核酸检测为阴性, 内脏组织超薄切片没有观察到可疑病毒粒子, 只观察到了孢子样结构, 表明引起此次“白鳃病”的致病原与以往报道的大黄鱼“白鳃病”致病原不同, “白鳃”有可能只是患病鱼表现出的一个相似的临床症状。
由于黏孢子虫个体微小, 虫体结构简单, 且虫体形态在属、种间差异很小, 许多结构特征在显微镜下也无法直接观察, 给黏孢子虫病的临床诊断带来了困难。据现有研究, 黏孢子的种类繁多, 已报道的各种黏孢子虫的生活史阶段存在较大差异, 迄今没有一个统一的生活史模式[20-22]。近年随着分子生物学技术的应用, 黏孢子虫病的检测技术得到了快速发展, 并取得了一些重要进展。Hallett等[23]建立了用于检测感染沙斯塔角形虫(Ceratomy xashasta)病鱼的实时荧光定量PCR法, 并证实该方法极有助于沙斯塔角形虫的生活史研究; 李丹等[24]开发了多重PCR法, 用于异育银鲫养殖中洪湖碘泡虫(Myxobolus honghuensis)、武汉单极虫(Thelohanellus wuhanensis)、吴李碘泡虫(Myxobolus wulii)和丑陋圆形碘泡虫(Myxobolus turpisrotundus)等4种黏孢子虫病的特异性诊断。由于巢式PCR扩增特异性较强, 同时又可以有效排除非特异性扩增的干扰, 因此本研究在获得的SSU rDNA序列基础上, 建立了巢式PCR检测方法, 由于缺少临床样本, 尚未对建立的方法进行临床检测, 但特异性试验表明其对患病大黄鱼中的黏孢子虫有很强的特异性, 且该方法灵敏度最高可达0.5 pg。由于采集的部分大黄鱼样本中黏孢子虫寄生较少, 这样大量病鱼自身的DNA可能会导致PCR非特异扩增, 降低阳性检出率, 而本研究建立的巢式PCR方法的二次PCR扩增可以有效避免此类情况出现, 大大提高检测灵敏度, 有效防止假阴性的出现。
综上所述, 目前网箱养殖大黄鱼的“白鳃病”有可能是临床症状相似但由不同种病原引起的不同种疾病。仅凭“白鳃”等临床症状无法对大黄鱼不同种的“白鳃病”进行区别诊断时, 只有通过PCR扩增或超薄切片观察进行确诊。由于电镜成本高, PCR检测方法更适合于临床快速检测。此次发现的黏孢子虫尚未进行离体培养, 该虫的种属分类地位和致病机理还有待进一步研究。
| [1] |
Xu X J, Sang B H, Qin Y X, et al. Detecting macrophage migration inhibitory factor in tissues of Larimichthys crocea with Cryptocaryon irritans disease[J]. Journal of Fishery Sciences of China, 2015, 22(6): 1227-1233. [徐晓津, 桑本红, 覃映雪, 等. 大黄鱼刺激隐核虫病组织中巨噬细胞移动抑制因子的检测分析[J]. 中国水产科学, 2015, 22(6): 1227-1233.] |
| [2] |
Li Z Q, Zhang K, Lin M, et al. Isolation and identification of pathogenic Aeromonas veronii from Pseudosciaena crocea[J]. Oceanologia et Limnologia Sinica, 2017, 48(1): 139-147. [李忠琴, 张坤, 林茂, 等. 大黄鱼(Pseudosciaena crocea)致病性维氏气单胞菌(Aeromonas veronii)的分离鉴定与药敏特性研究[J]. 海洋与湖沼, 2017, 48(1): 139-147.] |
| [3] |
Zhang D F, An S W, Zhou S M, et al. Histopathology and ultrastructure of visceral white-spots in Pseudosciaena crocea[J]. Progress in Fishery Sciences, 2017, 38(4): 11-16. [张丹枫, 安树伟, 周素明, 等. 大黄鱼(Pseudosciaena crocea)内脏白点病的组织病理和超微病理分析[J]. 渔业科学进展, 2017, 38(4): 11-16.] |
| [4] |
Shi H, Xie J J, Wang W, et al. Preliminary study of a new virus pathogen that caused the white-gill disease in cultured Larimichthys crocea[J]. Journal of Fisheries of China, 2017, 41(9): 1455-1462. [施慧, 谢建军, 汪玮, 等. 养殖大黄鱼"白鳃病"一种新病毒病原的初步研究[J]. 水产学报, 2017, 41(9): 1455-1462.] |
| [5] |
Yang X Q. PCR detection of cage cultured large yellow croaker Iridovirus in the Luoyuan bay, Fujian province[J]. Fujian Journal of Animal Husbandry and Veterinary Medicine, 2013, 35(2): 5-8. [杨小强. 罗源湾养殖大黄鱼虹彩病毒的PCR检测[J]. 福建畜牧兽医, 2013, 35(2): 5-8. DOI:10.3969/j.issn.1003-4331.2013.02.004] |
| [6] |
Gong H, Zheng Z Y, Liu Z Y, et al. Isolation of a virus and its partial physicochemical properties of the yellow fish with white-gill disease[C]//Proceedings of the 2013 Symposium Abstracts of China Society of Fisheries Fish Specialized Committee. Haikou: China Society of Fisheries, 2013: 86. [龚晖, 郑在予, 刘振勇, 等.患"白鳃病"大黄鱼的病毒的分离及部分理化特性分析[C]//2013年中国水产学会鱼病专业委员会学术研讨会论文集.海口: 中国水产学会, 2013: 86.]
|
| [7] |
Xu W J, Qin Z D, Shi H, et al. Mass mortality associated with a viral-induced anaemia in cage-reared large yellow croaker, Larimichthys crocea (Richardson)[J]. Journal of Fish Diseases, 2014, 38(5): 499-502. |
| [8] |
Yuan S P, Wang G L, Jin S. Review of pathogenic Nocardias in cultured fish[J]. Journal of Microbiology of China, 2006, 33(2): 137-141. [袁思平, 王国良, 金珊. 养殖鱼类致病诺卡氏菌研究进展[J]. 微生物学通报, 2006, 33(2): 137-141. DOI:10.3969/j.issn.0253-2654.2006.02.028] |
| [9] |
Xu X Y, Chen J M, Feng J J, et al. Pathological and ultrastructural changes of American eel (Anguilla rostrata) infected by Edwardsiella tarda[J]. Journal of Jimei University (Natural Science), 2017, 22(6): 17-22. [许晓芸, 陈锦民, 冯建军, 等. 迟缓爱德华氏菌感染美洲鳗鲡后的组织与超微病理观察[J]. 集美大学学报(自然科学版), 2017, 22(6): 17-22. DOI:10.3969/j.issn.1007-7405.2017.06.003] |
| [10] |
Zhang J, Mao Z J. Research progress on Pseudomonas plecoglossicida and its virulence factors of Pseudosciaena crocea[J]. Journal of Zhejiang Wanli University, 2015, 28(6): 69-76. [张杰, 毛芝娟. 大黄鱼内脏白点病病原杀香鱼假单胞菌及其毒力因子研究进展[J]. 浙江万里学院学报, 2015, 28(6): 69-76. DOI:10.3969/j.issn.1671-2250.2015.06.013] |
| [11] |
Somjintana T, Somjai W, Grant D, et al. Enterocytozoon hepatopenaei sp. nov. (Microsporida: Enterocytozoonidae), a parasite of the black tiger shrimp Penaeus monodon (Decapoda: Penaeidae): Fine structure and phylogenetic relationships[J]. Journal of Invertebrate Pathology, 2009, 102(1): 21-29. DOI:10.1016/j.jip.2009.06.004 |
| [12] |
Liu Y, Gu Z M, Du N, et al. Progress in the taxonomy of Myxosporean[J]. Chinese Bulletin of Life Sciences, 2010, 22(8): 717-722. [柳阳, 顾泽茂, 杜娜, 等. 粘孢子虫分类学研究进展[J]. 生命科学, 2010, 22(8): 717-722.] |
| [13] |
Lu Y S, Wang J. Progress of studies on Myxosporea (Protozoa: Myxozoa)[J]. Journal of Fishery Sciences of China, 2000, 7(1): 103-106. [鲁义善, 汪建. 粘孢子虫(黏体门:粘孢子纲)的研究现状[J]. 中国水产科学, 2000, 7(1): 103-106. DOI:10.3321/j.issn:1005-8737.2000.01.023] |
| [14] |
Willard O. Granath W O Jr, Effects of habitat alteration on the epizootiology of Myxobolus cerebralis, the causative agent of salmonid whirling disease[J]. Journal of Parasitology, 2014, 100(2): 157-165. |
| [15] |
Elizabeth U C, Alan C, Stephen W F, et al. A new class and order of Myxozoans to accommodate parasites of bryozoans with ultrastructural observations on Tetracapsula bryosalmonae (PKX organism)[J]. Journal of Eukaryotic Microbiology, 2000, 47(5): 456-468. DOI:10.1111/jeu.2000.47.issue-5 |
| [16] |
Yokoyama H, Liyanage Y S, Sugai A, et al. Efficacy of Fumagillin against Haemorrhagic thelohanellosis caused by Thelohanellus hovorkai (Myxosporea: Myxozoa) in coloured carp, Cyprinus Carpio L.[J]. Journal of Fish Diseases, 1999, 22(3): 243-245. DOI:10.1046/j.1365-2761.1999.00165.x |
| [17] |
Dyková I, Kodádková A, de Buron I, et al. Sinuolinea infections in the urinary system of Cynoscion species (Sciaenidae) and phylogenetic position of the type species of Sinuolinea Davis, 1917 (Myxozoa: Myxosporea)[J]. International Journal for Parasitology: Parasites and Wildlife, 2013, 2: 10-17. DOI:10.1016/j.ijppaw.2012.11.004 |
| [18] |
Garner M M, Atkinson S D, Hallett S L, et al. Renal myxozoanosis in weedy sea dragons, Phyllopteryx taeniolatus (Lacepède), caused by Sinuolinea phyllopteryxa n. sp.[J]. Journal of Fish Diseases, 2008, 31(1): 27-35. |
| [19] |
Marianna V R, Claire J F, Germano F B, et al. Sinuolinea niloticus n. sp., a myxozoan parasite that causes disease in Nile tilapia (Oreochromis niloticus)[J]. Parasitology Research, 2016, 115(11): 4307-4316. DOI:10.1007/s00436-016-5214-z |
| [20] |
Bartholomew J L, Atkinson S D, Hallett S L. Involvement of Manayunkia speciosa (Annnelida: Polychaeta: Sabellidae) in the life cycle of Parvicapsula minibicomis, a myxozoan parasite of Pacific salmon[J]. Journal of Parasitology, 2006, 2(4): 742-748. |
| [21] |
K ie M, Karlsbakk E, Nylund A. A new genus Gadimyxa with three new species (Myxozoa, Parvicapsulidae) parasitic in marine fish (Gadidae) and the two-host life cycle of Gadimyxa atlantica n. sp.[J]. Journal of Parasitology, 2007, 93(6): 1459-1467. DOI:10.1645/GE-1256.1 |
| [22] |
K ie M, Karlsbakk E, Einen A C. A Parvicapsulid (Myxozoa) infecting Sprattus sprattus and Clupea harengus (Clupeidae) in the Northeast Atlantic uses Hydroidesnorvegicus (Serpulidae) as invertebrate host[J]. Folia Parasitological, 2013, 60(2): 149-154. DOI:10.14411/fp.2013.016 |
| [23] |
Hallett L S, Bartholomew J L. Application of a real-time PCR assay to detect and quantify the myxozoan parasite Ceratomyxa shasta in river water samples[J]. Diseases of Aquatic Organisms, 2006, 71(2): 109-118. |
| [24] |
Li D, Liu Y, Zhai Y H, et al. Development and preliminary application of PCR method for the detection of Myxobolus honghuensis (Myxosporea:Bivalvulida)[J]. Freshwater Fisheries, 2017, 47(1): 12-16. [李丹, 柳阳, 翟艳花, 等. 洪湖碘泡虫PCR检测方法的建立与初步应用[J]. 淡水渔业, 2017, 47(1): 12-16. DOI:10.3969/j.issn.1000-6907.2017.01.002] |
 2019, Vol. 26
2019, Vol. 26

