鱼类病毒性出血性败血症(viral hemorrhagic septicemia, VHS)是一种以暴发性流行为主的动物疫病, 主要引起养殖虹鳟(Oncorhynchus mykiss)、大菱鲆(Scophthalmus maximus)和牙鲆(Paralichthys olivaceus)等发病, 造成脾肾坏死、变性及全身性出血等症状, 引起大量死亡, 自从1938年最初暴发于丹麦的虹鳟养殖场, 该疾病现已广泛流行于北半球, 给水产养殖业带来了重大的经济损失[1-3]。其病原VHSV属于弹状病毒科(Rhabodiradae), 诺拉弹状病毒属(Novirhabdovirus), 是一种不分节段的单链负义RNA病毒。据报道, VHSV已从80多种淡水或海水鱼类中分离到, 被感染的鱼类广泛分布于北美[4]、欧洲[5]以及亚洲的日本[6]和韩国[7], 在中国[8]和伊朗[9]也各有一例报道。
M蛋白是弹状病毒的结构蛋白, 同时也是一种多功能蛋白, 在病毒的侵染过程中发挥着多种作用, 包括参与病毒的组装和出芽, 抑制宿主基因表达和核质间物质运输, 以及诱导宿主细胞凋亡等[10-13], 这些研究主要集中于两种人畜共患病弹状病毒病原:水泡性口炎病毒(vesicular stomatitis virus, VSV)和狂犬病毒(rabies virus, RABV)。目前对VHSV的研究多集中于病原分离[6-9]、进化分析[14-16]和非结构(non-virion, NV)蛋白的功能研究[17-19], 对其他结构蛋白的功能研究则相对较少, 且至今无有效的商用病毒疫苗。对于M蛋白, Ke等[20]通过实验证明VHSV M蛋白能抑制宿主基因转录, Chiou等[21]在另一种相近的鱼类弹状病毒-传染性造血器官坏死病毒(infectious hematopoietic necrosis virus, IHNV)中证实其M蛋白能抑制宿主基因表达并诱导细胞凋亡。鉴于M蛋白的多功能性, 研究M蛋白的功能及其与细胞的相互作用机制, 将有助于对VHS的有效防控。
为了对VHSV M蛋白功能进行研究, 本实验通过构建原核表达系统对M蛋白进行了原核表达, 将纯化的重组融合蛋白免疫小鼠制备了多克隆抗体, 通过间接ELISA和Western blot对抗体进行检测, 并利用间接免疫荧光对M蛋白的亚细胞定位进行了研究。实验结果将为进一步研究VHSV M蛋白的功能和疾病的免疫学诊断奠定基础。
1 材料和方法 1.1 主要材料VHSV毒株及包含病毒基因的质粒由中国科学院水生生物研究所张奇亚研究员馈赠; 原核表达载体pET-32a、EPC细胞由实验室保存; 大肠杆菌DH5α感受态和Rosetta (DE3)感受态、反转录试剂盒、T4 DNA连接酶、限制性内切酶等均购自北京全式金生物技术有限公司, PAGE胶蛋白微量回收试剂盒购自生工生物工程(上海)股份有限公司。
1.2 引物设计与合成根据GenBank上发表的序列(登录号: KC685626), 利用Primer5.0软件设计了1对M基因的原核表达引物FM-3.1 (5'-ACAGAATTCATGGCTCTATTCAAAAG-3')和RM-3.1 (5'-CTTCTCGAGCTACCGGGGTC-3'), 上下游引物分别引入EcoR I与Xho I两个酶切位点, 送至生工生物工程(上海)股份有限公司合成。
1.3 M基因的克隆以包含VHSV M基因的质粒为模板, 用合成的上下游引物进行PCR扩增, 反应条件为94℃预变性5 min, 然后94℃变性30 s, 51℃退火30 s, 72℃延伸1 min, 32个循环, 再72℃延伸10 min。经1.0%琼脂糖凝胶电泳分离后, 目的片段用胶回收试剂盒回收, 将回收产物与pMD18-T载体连接, 4℃连接过夜, 连接产物转化到大肠杆菌DH5α感受态细胞中, 并涂布于含氨苄青霉素的LB平板, 37℃过夜培养, 筛选阳性克隆后送生工生物工程(上海)股份有限公司进行测序验证。
1.4 原核表达载体的构建将重组质粒pMD18-T-M和pET-32a(+)载体分别用EcoR I和Xho I在37℃进行双酶切, 2 h后, 酶切产物经1%琼脂糖凝胶电泳分离后, 切胶回收目的片段, 用T4 DNA连接酶4℃连接过夜, 转化至Rosetta(DE3)感受态细胞中, PCR筛选阳性克隆, 阳性克隆扩大培养后提取质粒, 经双酶切鉴定后, 送至生工生物工程(上海)股份有限公司测序, 测序无突变后用于诱导原核表达。
1.5 融合蛋白的诱导表达将包含重组原核表达载体的大肠杆菌Rosetta (DE3)接种于含氨苄的LB培养基中, 37℃振荡培养, 菌液OD600值达到0.6时加入终浓度为1 mmol/L的IPTG进行诱导表达, 6 h后离心收集菌体, 菌体用PBS清洗2次后重悬, 在冰上进行超声破碎, 离心后分别收集上清和沉淀, 进行SDS-PAGE电泳分析。诱导的蛋白切胶后通过PAGE胶蛋白微量回收试剂盒按说明书进行回收纯化。
1.6 多克隆抗体制备取纯化的M融合蛋白免疫BALB/c小鼠, 第1次免疫50 μg/只, 以后每隔7 d加强免疫, 1次20 μg/只, 共5次。首次免疫加入与融合蛋白等体积的弗氏完全佐剂, 后4次加入与融合蛋白等体积的弗氏不完全佐剂。最后一次加强免疫3 d后取血, 分离血清。
1.7 间接ELISA检测抗体效价以纯化的重组蛋白为抗原, 用碳酸盐包被液稀释到2 μg/mL后包被96孔板, 待测多克隆抗体为一抗, 按1:12800、1:256000、1:51200、1:102400、1:204800、1:409600、1:819200、1:1638400的比例稀释, 用HRP标记的羊抗鼠IgG为二抗, 经四甲基苯胺(TMB)溶液显色后用酶标仪测定OD450值, 以检测孔OD450值是阴性对照OD450 2倍以上来确定抗体效价。同时设立未免疫小鼠血清做阴性对照, PBS缓冲液为空白对照, 每个样本重复2次取结果平均值。
1.8 Western blot分析取VHSV感染EPC细胞后的细胞悬液和诱导的M融合蛋白, 进行Western blot检测抗体血清的特异性, 同时分别以未感染VHSV的EPC细胞和未诱导的细菌作为对照, 按照如下条件进行实验:样本经SDS-PAGE电泳后转印到PVDF膜上, 用5%脱脂奶粉室温封闭1 h, 用TBST洗膜3次, 将制备的抗体血清经1:1000倍稀释后作为一抗, 室温作用2 h, 接着用HRP标记的羊抗鼠IgG经1:1500稀释后作为二抗, 室温作用2 h, 最后用NBT/BCIP底物显色液进行显色。
1.9 间接免疫荧光检测将VHSV病毒接种于EPC单层细胞上48 h, 观察到细胞病变后, 弃掉细胞培养液, PBS清洗3遍, 经4%多聚甲醛固定和0.2%Triton-X 100透化后, 以制备的多克隆抗体为一抗, 以FITC标记的羊抗鼠IgG抗体为二抗, 用DAPI进行核染后, 用激光共聚焦显微镜进行观察。
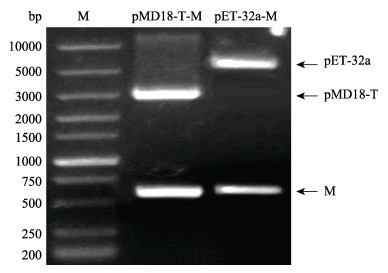
2 结果与分析 2.1 重组载体的构建及鉴定根据设计的引物PCR扩增M基因, 将片段切胶回收后连接到pMD18-T中, 获得重组载体pMD18-T-M。将pMD18-T-M和pET-32a(+)分别用EcoR I和Xho I双酶切后连接, 获得了重组载体pET-32a-M。两个重组载体均通过双酶切和测序来进行验证是否正确。双酶切鉴定结果见图 1, 两个载体均被切割成目的片段和载体片段, 且大小与预计相符。
|
图 1 pMD18-T-M、pET-32a-M重组质粒的双酶切验证 Fig.1 Restriction enzyme double-digestion of recombinant plasmid pMD18-T-M and pET-32a-M M: super 10000 DNA marker. |
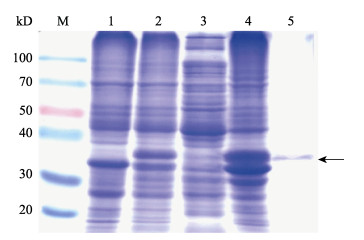
将诱导表达产物进行SDS-PAGE电泳, 结果显示在约36 kD的位置出现了大量表达的蛋白质, 比预计的40 kD略小。超声破碎处理诱导后的菌体, 将上清和沉淀分别进行SDS-PAGE电泳检测, 结果显示, 融合蛋白主要存在于沉淀中, 以不溶性的包涵体形式存在。将包涵体进行切胶回收, 经SDS-PAGE检测后结果显示, 获得了较纯的M融合蛋白(图 2)。
|
图 2 蛋白诱导表达产物的SDS-PAGE分析 M:蛋白分子量标准; 1:未诱导; 2:诱导; 3:诱导上清; 4:诱导沉淀; 5:纯化的M融合蛋白.箭头所示为融合蛋白所在位置. Fig.2 SDS-PAGE analysis of prokaryotic expression products M: protein marker; 1: non-induced bacteria; 2: induced bacteria; 3: induced supernatant; 4: induced precipitation; 5: purified fusion protein. The target protein is indicated by an arrow. |
利用间接ELISA检测获得多克隆抗体的效价, 通过两次重复采样结果的平均值来计算抗体效价, 结果见表 1。其中阴性对照N和空白对照PBS检测数据均小于0.1, 取P/N≥2.0的血清稀释度为待检血清的效价, 如表 1所示, 待检血清效价大于1:102400。
|
|
表 1 ELISA检测多克隆抗体效价 Tab.1 The titer of polyclonal antibody detected by ELISA |
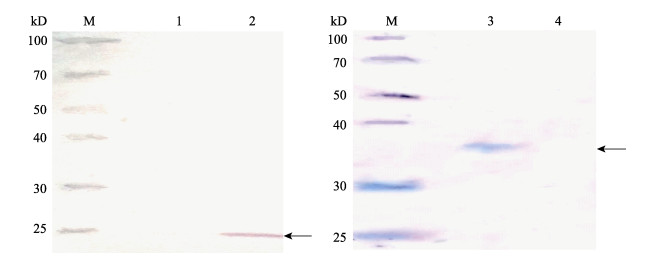
取VHSV感染EPC细胞后的细胞悬液和诱导的M融合蛋白进行Western blot, 检测抗体血清的特异性, 结果显示两者均能检测到单一的条带, 且大小符合预期。其中VHSV感染的EPC细胞中为单一的M蛋白, 预计大小为22 kD(图 3A), 融合蛋白大小为约36 kD, 与诱导结果大小一致(图 3B), Western blot结果表明制备的多克隆抗体能特异性识别M蛋白及其融合蛋白。
|
图 3 Western blot检测多克隆抗体特异性 M:蛋白分子量标准; 1:未感染VHSV的EPC细胞; 2:感染VHSV的EPC细胞; 3:纯化后的融合蛋白4:未诱导细菌. Fig.3 Specificity of polyclonal antibody detected by Western blot M: protein marker; 1: uninfected EPC cells; 2: EPC cells infected by VHSV; 3: purified fusion protein; 4: non-induced bacteria. |

|
图 4 VHSV M蛋白在鲤上皮瘤细胞中的定位 A. DAPI染核; B.间接免疫荧光检测M蛋白; C.叠加效果; 箭头所示为检测的M蛋白的位置. Fig.4 Subcellular localization of M protein in epithelioma papulosum cyprini (EPC) cells A. DAPI-stained nuclei; B. M protein detected by indirect immunofluorescence; C. Merge. M protein is indicated by arrows. |
利用制备的多抗通过间接免疫荧光检测了VHSV感染48 h的EPC细胞中的M蛋白, 并利用共聚焦荧光显微镜观察。结果显示, 制备的多抗可以识别EPC细胞中的M蛋白, 且M蛋白主要定位于细胞质和细胞膜上。
3 讨论弹状病毒是一类宿主范围非常广泛的病毒, 能够感染脊椎动物、节肢动物和植物等, 造成重大危害。根据国际病毒分类委员会(the international committee on taxonomy of viruses, ICTV)第十次报告, 弹状病毒科包含18个属共计131种病毒[22]。其中, 鱼类弹状病毒主要归于水泡性口炎病毒属(Vesiculovirus)和诺拉弹状病毒属, 而VHSV则属于诺拉弹状病毒属[23]。VHSV能感染全球80多种鱼类, 在适宜水温条件下, 对敏感鱼类如虹鳟、大菱鲆和牙鲆等, 特别是鱼苗, 致死率可高达100%, 对水产业危害重大[15]。鉴于该病在水产养殖中的危害性, 世界动物卫生组织(Office International Des Epizooties, OIE)将其列入水生动物疫病名录, 要求各国如有相关疫情需及时上报。因此, 深入了解VHSV病毒的生物学特性和致病机理, 加强对病毒的诊断和防治非常重要。由于M蛋白在病毒侵染过程中的多功能性, 本研究利用大肠杆菌高效表达了M蛋白, 并制备了多克隆抗体, 实验结果显示, 该抗体能特异性识别纯化的融合蛋白和VHSV感染的EPC细胞中的M蛋白, 且效价较高, 表明抗体质量较好。
在间接免疫荧光试验中, 结果显示制备的多抗可以识别VHSV感染的EPC细胞中的M蛋白, 且M蛋白主要定位于细胞质或细胞膜上, 这与病毒感染过程中M蛋白发挥的作用是相关的。在VSV和RABV中, 有多项研究表明M蛋白参与病毒的组装和出芽[10]、抑制宿主基因转录和蛋白质核质运输[11]、诱导细胞凋亡[12-13]等。Larrous等[24]的结果显示狂犬病毒的M蛋白与线粒体共定位, 并通过线粒体途径诱导细胞凋亡。Ameyama等[25]报道狂犬病毒M蛋白会与糖蛋白一起与高尔基体相结合, 推测与病毒的出芽过程相关。本实验中观察到的细胞质中的VHSV M蛋白有可能与线粒体或者高尔基体发生相互作用, 但还需进一步研究。此外, 大量的研究表明, 病毒出芽过程中, M蛋白会与病毒核蛋白复合体结合后再与细胞膜结合, 完成病毒出芽[26-27]。本研究中大量的M蛋白位于细胞膜, 表明病毒感染细胞已处于晚期, 大量组装的病毒处于出芽的阶段。而赵雪超等[28]观察到狂犬病病毒BD-06株的M蛋白定位于细胞核膜, 发挥抑制蛋白质核质运输作用, 这种现象在本研究中没有见到, 可能是取样时间较晚, 病毒感染已处于晚期。
在构建原核表达载体的过程中, 通过设计引物在目的蛋白的N端加上了His标签, 重组融合蛋白可以诱导成功, 但是在利用His标签蛋白纯化试剂盒纯化时, 总有杂蛋白无法去除, 可能是与目的蛋白产生了非特异性结合, 于是利用0.25 mol/L KCl溶液显色后切胶回收的方式进行纯化, SDS- PAGE电泳结果显示纯化效果较好。此外, 在对M蛋白进行原核表达时, 融合蛋白预计大小为40 kD, 而实际只有约36 kD, 比预计的略小。张世宽等[29]和宫苗苗等[30]分别对VSV和RABV的M蛋白进行原核表达时, 得到的融合蛋白均与预计大小一致。推测本研究中, 融合蛋白编码基因不是主要从pET-32a(+)载体的Trx·Tag处的ATG开始转录, 而是从下游第二个ATG起始转录, 如此得到的融合蛋白大小预计值与实际大小则一致。
综上所述, 本研究通过大肠杆菌原核表达系统制备了能特异性识别VHSV的M蛋白且效价较高的多克隆抗体, 该抗体将可用于建立基于M蛋白的VHSV免疫学检测方法或进行病毒与宿主的相互作用机制研究等, 为VHSV的防治和疫苗研发打下基础。
| [1] |
Schaperclaus W. Die Schadigungen der deutschen Fischerei durch Fischparasiten und Fischkrankheiten[J]. Allg Fischztg, 1938, 41: 267-270. |
| [2] |
Studer J, Janies D A. Global spread and evolution of viral haemorrhagic septicaemia virus[J]. Journal of Fish Diseases, 2011, 34(10): 741-747. DOI:10.1111/j.1365-2761.2011.01290.x |
| [3] |
Kim R, Faisal M. Emergence and resurgence of the viral hemorrhagic septicemia virus (Novirhabdovirus, Rhabdoviridae, Mononegavirales)[J]. Journal of Advanced Research, 2011, 2(1): 9-23. DOI:10.1016/j.jare.2010.05.007 |
| [4] |
Faisal M, Shavalier M, Kim R K, et al. Spread of the emerging viral hemorrhagic septicemia virus strain, genotype Ⅳb, in Michigan, USA[J]. Viruses, 2012, 4(5): 734-760. DOI:10.3390/v4050734 |
| [5] |
Duesund H, Nylund S, Watanabe K, et al. Characterization of a VHS virus genotype Ⅲ isolated from rainbow trout (Oncorhychus mykiss) at a marine site on the west coast of Norway[J]. Virology Journal, 2010, 7(1): 19. DOI:10.1186/1743-422X-7-19 |
| [6] |
Ju J B, Takano T, Hirono I, et al. Genome analysis of viral hemorrhagic septicemia virus isolated from Japanese flounder Paralichthys olivaceus, in Japan[J]. Fisheries Science, 2006, 72(4): 906-908. DOI:10.1111/fis.2006.72.issue-4 |
| [7] |
Wisik K, Seokryel K, Duwoon K, et al. An outbreak of VHSV (viral hemorrhagic septicemia virus) infection in farmed olive flounder Paralichthys olivaceus in Korea[J]. Aquaculture, 2009, 296(1-2): 165-168. DOI:10.1016/j.aquaculture.2009.07.019 |
| [8] |
Zhu R L, Zhang Q Y. Determination and analysis of the complete genome sequence of Paralichthys olivaceus rhabdovirus (PORV)[J]. Archives of Virology, 2014, 159(4): 817-820. DOI:10.1007/s00705-013-1716-5 |
| [9] |
Ahmadivand S, Soltani M, Mardani K, et al. Isolation and identification of viral hemorrhagic septicemia virus (VHSV) from farmed rainbow trout (Oncorhynchus mykiss) in Iran[J]. Acta Tropica, 2016, 156: 30-36. DOI:10.1016/j.actatropica.2016.01.005 |
| [10] |
Rajani K R, Kneller E L P, Mckenzie M O, et al. Complexes of vesicular stomatitis virus matrix protein with host rae1 and Nup98 involved in inhibition of host transcription[J]. PLoS Pathogens, 2012, 8(9): e1002929. DOI:10.1371/journal.ppat.1002929 |
| [11] |
Mire C E, Whitt M A. The protease-sensitive loop of the vesicular stomatitis virus matrix protein is involved in virus assembly and protein translation[J]. Virology, 2011, 416(1): 16-25. |
| [12] |
Larrous F, Gholami A, Mouhamad S, et al. Two overlapping domains of a lyssavirus matrix protein that acts on different cell death pathways[J]. Journal of Virology, 2010, 84(19): 9897-9906. DOI:10.1128/JVI.00761-10 |
| [13] |
Cary Z D, Willingham M C, Lyles D S. Oncolytic vesicular stomatitis virus induces apoptosis in U87 glioblastoma cells by a type Ⅱ death receptor mechanism and induces cell death and tumor clearance in vivo[J]. Journal of Virology, 2011, 85(12): 5708-5717. DOI:10.1128/JVI.02393-10 |
| [14] |
Pierce L R, Stepien C A. Evolution and biogeography of an emerging quasispecies: diversity patterns of the fish Viral Hemorrhagic Septicemia virus (VHSv)[J]. Molecular Phylogenetics & Evolution, 2012, 63(2): 327-341. |
| [15] |
He M, Yan X C, Liang Y, et al. Evolution of the viral hemorrhagic septicemia virus: divergence, selection and origin[J]. Molecular Phylogenetics & Evolution, 2014, 77(1): 34-40. |
| [16] |
Getchell R G, Cornwell E R, Bogdanowicz S, et al. Complete sequences of 4 viral hemorrhagic septicemia virus Ⅳb isolates and their virulence in northern pike fry[J]. Diseases of Aquatic Organisms, 2017, 126(3): 211-227. DOI:10.3354/dao03171 |
| [17] |
Biacchesi S, Merour E, Chevret D, et al. NV proteins of fish novirhabdovirus recruit cellular PPM1Bb protein phosphatase and antagonize RIG-I-mediated IFN induction[J]. Scientific Reports, 2017, 7: 44025. DOI:10.1038/srep44025 |
| [18] |
Chinchilla B, Gomez-Casado E. Identification of the functional regions of the viral haemorrhagic septicaemia virus (VHSV) NV protein: Variants that improve function[J]. Fish & Shellfish Immunology, 2017, 70: 343-350. |
| [19] |
Baillon L, Mérour E, Cabon J, et al. A single amino acid change in the non-structural NV protein impacts the virulence phenotype of viral hemorrhagic septicemia virus in trout[J]. Journal of General Virology, 2017, 98(6): 1181-1184. DOI:10.1099/jgv.0.000830 |
| [20] |
Ke Q, Weaver W, Pore A, et al. Role of viral hemorrhagic septicemia virus matrix (M) protein in suppressing host transcription[J]. Journal of Virology, 2017, 91(19): e00279-17. DOI:10.1128/JVI.00279-17 |
| [21] |
Chiou P P, Kim C H, Ormonde P, et al. Infectious hematopoietic necrosis virus matrix protein inhibits host-directed gene expression and induces morphological changes of apoptosis in cell cultures[J]. Journal of Virology, 2000, 74(16): 7619-7627. DOI:10.1128/JVI.74.16.7619-7627.2000 |
| [22] |
Walker P J, Blasdell K R, Calisher C H, et al. ICTV virus taxonomy profile: Rhabdoviridae[J]. Journal of General Virology, 2018, 99: 447-448. DOI:10.1099/jgv.0.001020 |
| [23] |
Mahy B W J, Van Regenmortel M H V. The Encyclopedia of Virology[M]. 3rd ed. Salt Lake: Academic Press, 2008: 221-227.
|
| [24] |
Larrous F, Gholami A, Mouhamad S, et al. Two overlapping domains of a lyssavirus matrix protein that acts on different cell death pathways[J]. Journal of Virology, 2010, 84(19): 9897-9906. DOI:10.1128/JVI.00761-10 |
| [25] |
Ameyama S, Toriumi H, Takahashi T, et al. Monoclonal antibody #3-9-16 recognizes one of the two isoforms of rabies virus matrix protein that exposes its N-terminus on the virion surface[J]. Microbiology and Immunology, 2003, 47(9): 639-651. DOI:10.1111/mim.2003.47.issue-9 |
| [26] |
Solon J, Gareil O, Bassereau P, et al. Membrane deformations induced by the matrix protein of vesicular stomatitis virus in a minimal system[J]. Journal of General Virology, 2005, 86(12): 3357-3363. DOI:10.1099/vir.0.81129-0 |
| [27] |
Dancho B, Mckenzie M O, Connor J H, et al. Vesicular stomatitis virus matrix protein mutations that affect association with host membranes and viral nucleocapsids[J]. Journal of Biological Chemistry, 2009, 284(7): 4500-4509. DOI:10.1074/jbc.M808136200 |
| [28] |
Zhao X C, Zhang X W, Zhang S F, et al. Prokaryotic expression and purification of matrix protein of bd-06 strain rabies virus and preparation of its polyclonal antibody[J]. China Animal Husbandry & Veterinary Medicine, 2013, 40(4): 36-39. [赵雪超, 张学炜, 张守峰, 等. 狂犬病病毒BD-06株基质蛋白的原核表达、纯化及其多克隆抗体的制备[J]. 中国畜牧兽医, 2013, 40(4): 36-39. DOI:10.3969/j.issn.1671-7236.2013.04.008] |
| [29] |
Zhang S K, Chen B J, Xiao X, et al. Preparation of recombinant VSV Matrix protein and establishment of ELISA for antibody detection[J]. Journal of Shanghai Jiaotong University (Agricultural Science), 2014, 32(1): 89-94. [张世宽, 陈备娟, 肖贤, 等. 重组水泡性口炎病毒基质蛋白制备及ELISA检测方法的建立[J]. 上海交通大学学报(农业科学版), 2014, 32(1): 89-94. DOI:10.3969/J.ISSN.1671-9964.2014.01.015] |
| [30] |
Gong M M, Zeng N, Cheng C F, et al. Development of indirect ELISA for detection of antibodies against rabies virus based on prokaryotic expression of matrix protein[J]. Chinese Journal of Zoonoses, 2013, 29(1): 17-22. [宫苗苗, 曾妮, 程朝飞, 等. 狂犬病病毒基质蛋白的原核表达及其间接ELISA方法的建立[J]. 中国人兽共患病学报, 2013, 29(1): 17-22. DOI:10.3969/cjz.j.issn.1002-2694.2013.01.003] |
 2019, Vol. 26
2019, Vol. 26

