2. 中国水产科学研究院黑龙江水产研究所, 黑龙江 哈尔滨 150070
2. Heilongjiang River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin 150070, China
肌间刺(intermuscular bones, Imbs)是硬骨鱼类特有的、位于肌节间的一种骨骼。肌间刺的存在对鱼肉制品的加工和鲜活鱼类的食用带来极大的不便。中国养殖的大宗淡水鱼类如鲤、草鱼、鲢、鳙和团头鲂等普遍含有肌间刺[1-5], 在一定程度上制约着我国淡水水产养殖业的发展。因此, 为了应对产业发展需要, 选育少肌间刺或无肌间刺鱼类新品种便成为研究的热点。
吕耀平等[1]对低等真骨鱼类肌间刺的研究发现, 肌间刺的发生、发育与鱼类的演化密切相关, 自真骨鱼类出现开始, 肌间刺便以较简单的形态存在于鱼体之中, 随着物种的演化, 肌间刺呈现出由简单形态向复杂形态再向简单形态演化的趋势。因此, 推测肌间刺是鱼类演化到一定阶段的产物, 是一种痕迹器官。此外, 解剖学研究认为肌间刺具有支撑肌肉和传导力量的作用, 肌纤维是肌肉组织的主要组成部分, 也是力量传导的主要载体[2, 6]。但是, 针对已有肌间刺的鱼类, 去除肌间刺将对鱼类产生何种影响尚不可知; 肌间刺的发生和发育是否和肌纤维的发育存在相关性, 或者肌间刺的缺失是否影响肌肉的发育和生长亦未可知。
斑马鱼(Danio rerio)骨骼肌是由体节中的生肌节细胞发育而来的, 首先体节中的生肌节细胞分化形成骨骼肌前体细胞, 也称成肌细胞; 多个成肌细胞融合成为合胞肌管, 此时的肌纤维细胞退出细胞周期并开始表达肌肉特异性蛋白, 如肌肉调节因子(myogenic regulatory factors, MRFs), 最终形成成熟的骨骼肌纤维[7-8]。肌肉调节因子包括myod、myf5、myog和MRF4, 在肌细胞的分化过程中不可或缺, 可将纤维原细胞、软骨细胞等转变为成肌细胞[9-10]。研究表明, myod和myf5的表达是早期胚胎肌肉细胞系前体细胞的识别标志, 当myf5和myod基因不能正常行使功能时, 小鼠(Mus musculus)骨骼肌成肌细胞不能正常形成[11]。在斑马鱼早期胚胎研究中也发现, myod和myf5的表达可诱导前体细胞向肌肉细胞的转变[12-13]。myog在肌细胞的分化和成熟中起关键作用, myog首先在斑马鱼发育的体节中表达, 随着体节的发育成熟, 其表达范围由中部体节向后部侧面延伸[14]。此外, 肌肉的发育还受肌肉调节因子的调控, 如mef2 (myocyte enhancer factor 2)基因家族。mef2家族基因可协助MRFs介导肌肉特异性基因的表达, 在所有已知的肌肉细胞系中, myf5/myod的表达均受到mef2基因家族的正向调控, 强化介导肌肉分化基因的表达[15-16]。除此之外, 在小鼠和鱼类的研究中发现转录因子sox6在胚胎发育中能够促进快肌纤维基因的分化, 并抑制慢肌基因的表达[17-18]。
本研究以斑马鱼为研究对象, 采用基因敲除和遗传筛选技术, 在前期获得了1个可稳定遗传的斑马鱼肌间刺完全缺失突变系(图 1), 通过分析肌肉发育特异性基因(myod、myf5、myog、mef2和sox6)表达, 以及受精率、孵化率和仔鱼畸形率与野生型的差异, 评估肌间刺的缺失对胚胎发育及肌肉发育的影响。
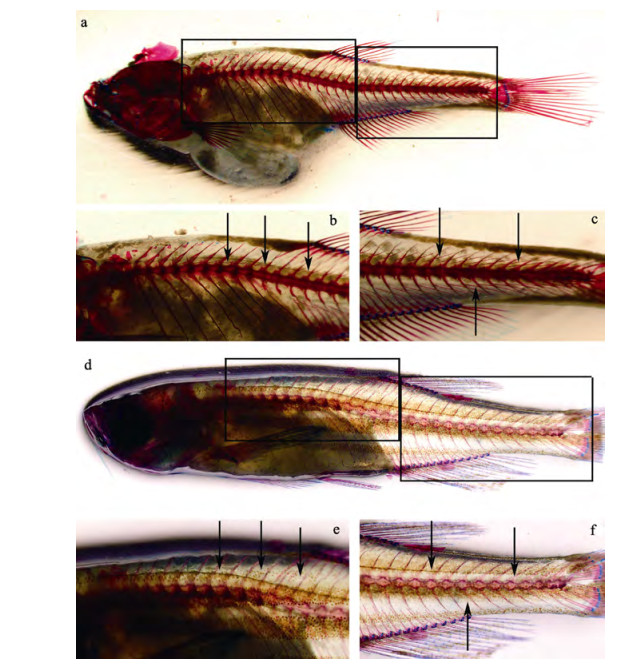
|
图 1 斑马鱼骨骼染色 a、d分别为野生型(45 dph, days post hatch, 全长17.77 mm)和肌间刺完全缺失突变型斑马鱼个体(52 dph, 全长20.13 mm)全鱼骨骼染色; b、e分别为野生型和突变型斑马鱼的背鳍前部骨骼染色; c、f则分别为野生型和突变型斑马鱼的背鳍后部骨骼染色; 与野生型相比, 突变型斑马鱼个体全身肌间刺已全部去除; 箭头指示肌间刺所在位置. Fig.1 Skeleton-stain of zebrafish Danio rerio a, d: skeleton stained images of whole body of WT (wildtype) zebrafish (45 dph; total length, 17.77 mm) and Imbs completely deletion mutant (52 dph; total length, 20.13 mm) respectively; b, e: skeleton stained images of anterior part of dorsal fin of WT and mutant individuals, respectively; c, f: skeleton stained images of posterior part of dorsal fin of WT and mutant individuals, respectively; compared to WT, all Imbs are disappeared in mutants (e, f); arrowheads indicate Imbs. |
为了去除遗传背景带来的影响, 将已获得的肌间刺完全缺失突变型斑马鱼与野生型个体杂交, 构建F2代家系。F2代家系自交可分别获得25%的野生型和突变型纯合个体, 以及50%杂合个体。将筛选出的野生型个体和纯合突变个体分别按雌雄比例为1 : 1配组构建F3家系, 通过基因型和骨骼染色分析, 最终获得14个突变型家系和13个野生型家系, 突变型及野生型斑马鱼骨骼染色结果见图 1。
1.2 实验鱼的饲养与繁殖实验鱼饲养于斑马鱼养殖系统中, 养殖水温27℃±1℃, 光周期14 L : 10 D, 用丰年虫投喂。养殖3个月后达到性成熟, 按雌雄比例为1 : 1配对繁殖。产卵结束后立即统计产卵量、受精卵数。将受精卵置于28℃培养箱中孵化, 每天统计并清理各家系的死卵。孵化完毕后, 计算孵化率和仔鱼畸形率。实验家系每周繁殖1次, 共繁殖4次。其中初产家系和孵化过程中因水霉等原因受精卵死亡超过10%的家系不计入统计结果。
1.3 基因表达检测按照斑马鱼胚胎发育的分期[19], 并结合镜检结果, 在受精后3 hpf(囊胚期)、6 hpf(原肠胚期)、12 hpf(体节期)、24 hpf(咽囊期)和72 hpf(孵化期)5个发育时期采集胚胎用于基因表达分析。突变型与野生型分别随机选择3个家系, 每个家系随机取发育正常的受精卵50粒, 用于总RNA的提取。采用Trizol法提取(Invitrogen, USA)总RNA, 采用High Capacity cDNA Reverse Transcription kits (Roache, USA)合成cDNA。
采用qRT-PCR方法检测5个基因(myod、myf5、myog、mef2 和sox6)的表达水平, 扩增引物采用Primer3 plus设计(表 1)。采用10 µL反应体系进行qRT-PCR实验, 包括: 5 µL 2×Luna Universal qPCR Master Mix(NEB, USA), 0.25 µL 10 µmol/L的正向、反向引物, 1 µL 50 ng/µL cDNA, 3.5 µL nuclease-free水。扩增条件为: 95℃预变性60 s; 之后, 95℃变性15 s, 60℃延伸30 s, 循环40次。内参基因为gapdh。
|
|
表 1 肌肉特异性基因引物设计 Tab.1 Muscle-specific gene primers for qRT-PCR |
采用2-ΔΔCt法来评估[20]5个肌肉特异性基因的表达水平, 采用t检验评估肌间刺缺失突变型个体和野生型个体间5个基因在每个时期中的表达水平和时序表达差异。受精率、孵化率和畸形率采用单因素方差分析, 并结合t检验来评估。受精率、孵化率和畸形率采用95%显著性水平进行分析。
2 结果与分析 2.1 产卵量、受精率、孵化率和畸形率统计共统计野生型16组数据, 肌间刺突变型14组数据(表 2)。其中野生型斑马鱼的平均受精率、平均孵化率和平均仔鱼畸形率分别为0.908± 0.095、0.902±0.072和0.011±0.014;肌间刺完全缺失突变型斑马鱼的平均受精率、平均孵化率和平均仔鱼畸形率分别为0.917±0.055、0.930±0.039、0.017±0.016。在受精率、孵化率和畸形率方面, 肌间刺突变型与野生型斑马鱼无明显差异(P > 0.05)。
|
|
表 2 野生型与肌间刺突变型斑马鱼繁殖数据统计 Tab.2 Summary of spawn data of wildtype zebrafish and intermuscular-bones deficiency mutant |
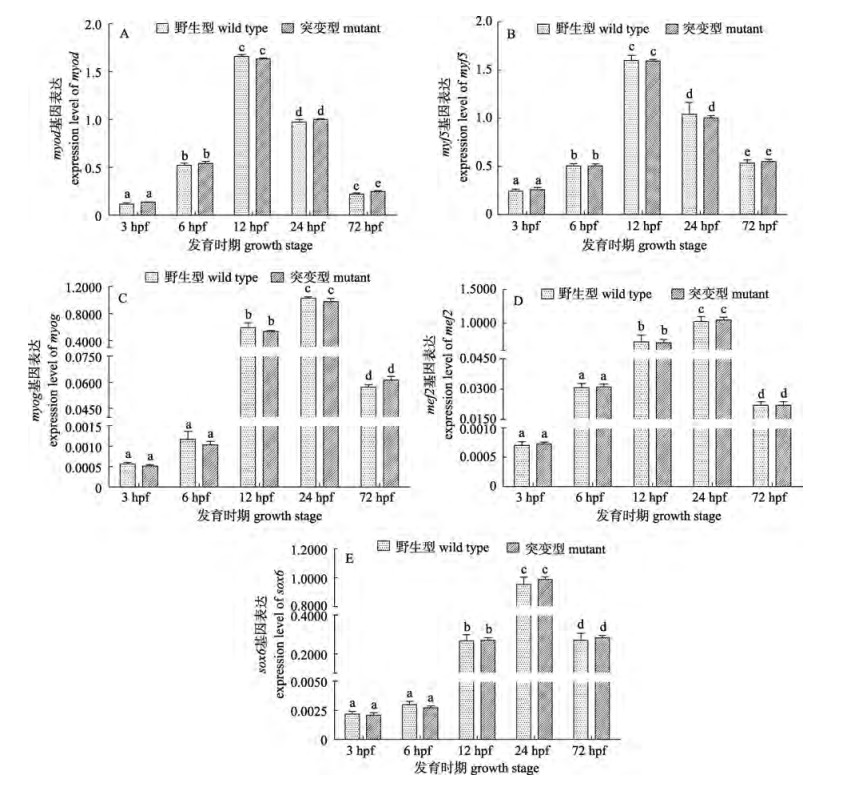
对5个肌肉特异性基因(myod、myf5、myog、mef2和sox6)在斑马鱼胚胎发育不同阶段的表达情况进行了分析, 如图 3所示, 5个基因在各时期的表达情况均呈现出先升后降的趋势, 其中基因myf5和myod的表达水平在12 hpf (体节期)明显高于其他阶段, mef2、myog和sox6在3 hpf (囊胚期)和6 hpf (原肠胚期)表达量很低, 在12 hpf(体节期)和24 hpf(咽囊期)表达量最高, 随后降低。t检验分析结果表明5个基因在突变型与野生型斑马鱼在各发育阶段的表达水平无明显差异(P > 0.05)。

|
图 2 野生型与突变型斑马鱼受精率、孵化率和畸形率的比较 采用x±SD表示野生型和突变型斑马鱼的受精率、孵化率和仔鱼畸形率; 相同小写字母表示无显著差异(P > 0.05). Fig.2 Comparisons of fertility rate, hatching rate and abnormality rate between wildtype zebrafish and Imbs deficiency mutants Rates of fertility, hatching and abnormality were presented as x±SD; the same small letter indicated no significant difference (P > 0.05). |
|
图 3 5个肌肉特异性基因在胚胎发育不同时期的表达 以gadph为内参基因, 采用x±SD表示野生型和突变型斑马鱼5个特异性基因表达水平; 不同小写字母表示差异极显著(P < 0.001). Fig.3 Expression of 5 muscle-specific genes in different embryonic development stages The genes expression were normalized by the expression of reference gene gapdh; data were expressed as x±SD of 2-ΔΔCt (n=3); different small letters indicate extremely significant differences (P < 0.001). |
骨骼肌的系统发生可以分为3个阶段:决定、分化和成熟。中胚层细胞聚集形成体节, 体节中的生肌节细胞转变为肌肉祖先细胞, 并形成增殖的肌肉细胞系, 之后只有表达肌肉特异性因子(如MRFs)才能发育成为肌肉, 这一过程即为分化[21]。分化分为早期分化和晚期分化, myod基因家族在从退出细胞循环到细胞再生的早期和晚期分化中均有参加[22]。其中, myf5和myod在早期阶段表达, 在接近原肠胚形成末期时(70%~80%外包), 慢肌的前体细胞―轴细胞中的myf5和myod被激活; 在体节形成和分化开始后, 两者的表达量降低[13-14], 这与本研究的结论相一致。本研究表明, myf5和myod在囊胚期(3 hpf, 1K细胞期)和原肠中期(6 hpf, 50%外包期)的表达量很低, 在体节期前期(12 hpf, 5-8体节期)表达量跃升, 在体节期末期和咽囊期初期开始下降, 但仍维持在一个较高的水平, 而到孵化期—仔鱼期(72 hpf)则下降至原肠中期左右的水平。而myog则主要在晚期分化中表达。研究发现, myog首先在斑马鱼发育中的体节细胞中表达, 并随着体节的成熟由体节中部向后部侧面延伸。本研究发现, myog基因在体节期初期(12 hpf)到体节期结束(24 hpf)均有较高的表达水平, 与已有文献结论一致[15]。作为肌肉发育重要的调控因子之一, mef2家族基因对myf5/myod基因的表达起着重要的正向调控作用[17]。本研究发现mef2基因的表达时序与myog相近, 在体节期(12 hpf至24 hpf)表达量跃升, 与myod/myf5基因的表达水平变化相吻合。此外, sox6基因在肌纤维后期(30 hpf以后)的分化过程发挥着重要作用, 其主要作用是促进快肌纤维的分化, 并抑制慢肌纤维的分化[18]。本研究中sox6的基因表达结果显示, sox6基因在体节期末期、咽囊期初期(24 hpf)表达量跃升, 在肌纤维发育后期的分化过程中发挥着重要作用。
本研究结果显示, 肌间刺完全缺失突变与野生型斑马鱼的肌肉发育特异性基因在不同发育时期的表达水平并无二致; 此外, 与野生型斑马鱼相比, 突变型斑马鱼在受精率、孵化率和仔鱼畸形率方面的差异亦不显著。因此, 推测肌间刺的缺失不影响斑马鱼正常的胚胎发育及肌肉的发育。
近几年国内外期刊发表的关于肌间刺的研究报道较少, 针对日本鳗鲡(Anguilla japonica)与斑马鱼, 两种具有截然不同游泳方式的鱼类肌间刺发育的报道, 为研究肌间刺的发生、发育提供了新的研究方向[23]; 除此之外, 关于唇䱻(Hemibarbus labeo)肌间刺发育中肌节同源基因C的作用[24], 团头鲂(Megalobrama amblycephala)肌间刺相关microRNA的作用、蛋白质组等[25-26]研究也为肌间刺发育和形成机制的深入研究提供了基础知识。本实验室致力于肌间刺发生发育的分子机制及少肌间刺鱼类分子育种的研究, 通过遗传筛选获得了斑马鱼肌间刺缺失突变系, 本文借助肌间刺缺失突变系探讨了肌间刺缺失对早期胚胎发育及胚胎发育过程中肌肉发育的影响, 证明了肌间刺的缺失不会影响胚胎发育和肌肉发育, 为少肌间刺鱼类分子育种的可行性提供了可靠的数据支撑, 但是肌间刺的缺失是否会对其他生理学功能以及鱼类行为产生影响, 仍需要大量的研究进行论证。
| [1] |
Lv Y P, Bao B L, Jiang Y, et al. Comparative analysis of intermuscular bones in lower teleosts[J]. Journal of Fisheries of China, 2007, 31(5): 661-668. [吕耀平, 鲍宝龙, 蒋燕, 等. 低等真骨鱼类肌间骨的比较分析[J]. 水产学报, 2007, 31(5): 661-668.] |
| [2] |
Dong Z J, Huang D Z, Li L J, et al. Preliminary study on intermuscular bones of several cultured cyprinids[J]. Journal of Shanghai Fisheries University, 2006, 15(4): 425-429. [董在杰, 黄代中, 李丽娟, 等. 几种常见鲤科养殖鱼类肌间刺的初步研究[J]. 上海水产大学学报, 2006, 15(4): 425-429.] |
| [3] |
Bing Z. On the myoseptal spines of the carp (Cyprinus carpio L.)[J]. Acta Zoologica Sinica, 1962, 14(2): 175-178. [秉志. 幼鲤大侧肌隔骨针的观察[J]. 动物学报, 1962, 14(2): 175-178.] |
| [4] |
Gao W J. A study on the morphological and distribution of Os. intermuscular of Ctenopharyngodon idellus[J]. Journal of Agricultural University of Hebei, 1984, 7(4): 178-184. [高维竞. 草鱼的肌间骨(Os. intermuscuIar)形态及其分布的研究[J]. 河北农业大学学报, 1984, 7(4): 178-184.] |
| [5] |
Ke Z H, Zhang W, Jiang Y, et al. Developmental morphology of the intermuscular bone in Hypophthalmichthys molitrix[J]. Chinese Journal of Zoology, 2008, 43(6): 88-96. [柯中和, 张炜, 蒋燕, 等. 鲢肌间小骨发育的形态学观察[J]. 动物学杂志, 2008, 43(6): 88-96. DOI:10.3969/j.issn.0250-3263.2008.06.013] |
| [6] |
Ma L X, Dong Z J, Su S Y, et al. Research progress of fishes intermuscular bones[J]. Jiangsu Agricultural Sciences, 2012, 40(4): 234-235, 240. [马良骁, 董在杰, 苏胜彦, 等. 鱼类肌间刺的研究进展[J]. 江苏农业科学, 2012, 40(4): 234-235, 240. DOI:10.3969/j.issn.1002-1302.2012.04.087] |
| [7] |
Chargé S B P, Rudnicki M A. Cellular and molecular regulation of muscle regeneration[J]. Physiological Reviews, 2004, 84(1): 209-238. DOI:10.1152/physrev.00019.2003 |
| [8] |
Gros J, Scaal M, Marcelle C. A two-step mechanism for myotome formation in chick[J]. Developmental Cell, 2004, 6(6): 875-882. DOI:10.1016/j.devcel.2004.05.006 |
| [9] |
He X, Yan Y L, De Laurier A, et al. Observation of miRNA gene expression in zebrafish embryos by in situ hybridization to microRNA primary transcripts[J]. Zebrafish, 2011, 8(1): 1-8. DOI:10.1089/zeb.2010.0680 |
| [10] |
Choi J, Costa M L, Mermelstein C, et al. MyoD converts primary dermal fibroblasts, chondroblasts, smooth muscle, and retinal pigment epithelial cells into striated, mononucleated myoblasts and multinucleated myotubes[J]. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(20): 7988-7992. DOI:10.1073/pnas.87.20.7988 |
| [11] |
Weintraub H, Dwarki V J, Verma I, et al. Muscle-specific transcriptional activation by MyoD[J]. Genes & Development, 1991, 5: 1377-1386. |
| [12] |
Rudnicki M A, Schnegelsberg P N, Stead R H, et al. MyoD or Myf5 is required for the formation of skeletal muscle[J]. Cell, 1993, 75: 1351-1359. DOI:10.1016/0092-8674(93)90621-V |
| [13] |
Coutelle O, Blagden C S, Hampson R, et al. Hedgehog signaling is required for maintenance of myf5 and myoD expression and timely terminal differentiation in zebrafish adaxial myogenesis[J]. Developmental Biology, 2001, 236(1): 136-150. DOI:10.1006/dbio.2001.0193 |
| [14] |
Weinberg E S, Allende M L, Kelly C S, et al. Developmental regulation of zebrafish MyoD in wild-type, no tail and spadetail embryos[J]. Development, 1996, 122: 271-280. |
| [15] |
Sun W. Cloning, expression and functional analysis of genes regulating muscle development from zebrafish[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2009: 20. [孙威.斑马鱼肌肉发育相关基因的克隆、表达与功能分析[D].青岛: 中国科学院海洋研究所, 2009: 20.] http://cdmd.cnki.com.cn/Article/CDMD-80068-2009138686.htm
|
| [16] |
Molkentin J D, Black B L, Martin J F, et al. Cooperative activation of muscle gene expression by MEF2 and myogenic bHLH proteins[J]. Cell, 1995, 83: 1125-1136. DOI:10.1016/0092-8674(95)90139-6 |
| [17] |
Yun K, Wold B. Skeletal muscle determination and differentiation: story of a core regulatory network and its context[J]. Current Opinions in Cell Biology, 1996, 8: 877-889. DOI:10.1016/S0955-0674(96)80091-3 |
| [18] |
Jackson H E, Ono Y, Wang X G, et al. The role of Sox6 in zebrafish muscle fiber type specification[J]. Skeletal Muscle, 2015, 5(1): 2. DOI:10.1186/s13395-014-0026-2 |
| [19] |
Charlrs B K, William W B, Seth R K, et al. Stages of embryonic development of the zebrafish[J]. Developmental Dynamics, 1995, 203: 253-310. DOI:10.1002/aja.1002030302 |
| [20] |
Kenneth J L, Thomas D S. Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2–ΔΔCt Method[J]. Methods, 2001, 25: 402-408. DOI:10.1006/meth.2001.1262 |
| [21] |
Kubota T, Zhang Q, Wrana J L, et al. Multiple forms of SppI (secreted phosphoprotein, osteopontin) synthesized by normal and transformed rat bone cell populations: Regulation by TGF-β[J]. Biochemical and Biophysical Research Communications, 1989, 162(3): 1453-1459. DOI:10.1016/0006-291X(89)90837-1 |
| [22] |
Tan X G. Muscle development in fish and evolution of myogenic factors[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2003: 20. [谭训刚.鱼类肌肉发育及成肌因子的进化[D].青岛: 中国科学院海洋研究所, 2003: 30] http://cdmd.cnki.com.cn/article/cdmd-80068-2005071891.htm
|
| [23] |
Yao W J, Lv Y P, Gong X L, et al. Different ossification patterns of intermuscular bones in fish with different swimming modes[J]. Biology Open, 2015, 4(12): 1727-1732. DOI:10.1242/bio.012856 |
| [24] |
Lv Y P, Yao W J, Chen J, et al. Newly identified gene muscle segment homeobox C may play a role in intermuscular bone development of Hemibarbus labeo[J]. Genetics and Molecular Research, 2015, 14: 11324-11334. DOI:10.4238/2015.September.22.26 |
| [25] |
Wan S M, Yi S K, Zhong J, et al. Identification of microRNA for intermuscular bone development in blunt snout bream (Megalobrama amblycephala)[J]. International Journal of Molecular Sciences, 2015, 16: 10686-10703. DOI:10.3390/ijms160510686 |
| [26] |
Nie C H, Wan S M, Tomljanovic T, et al. Comparative proteomics analysis of teleost intermuscular bones and ribs provides insight into their development[J]. BMC Genomics, 2017, 18: 147. DOI:10.1186/s12864-017-3530-z |
 2019, Vol. 26
2019, Vol. 26

