2. 鳗鲡现代产业技术教育部工程研究中心, 福建 厦门 361021;
3. 厦门大学海洋与地球学院, 福建 厦门 361102;
4. 厦门出入境检验检疫局检验检疫技术中心, 福建 厦门 361026
2. Engineering Research Center of the Modern Industry Technology for Eel, Ministry of Education, Xiamen 361021, China;
3. College of Ocean and Earth Sciences, Xiamen University, Xiamen 361102, China;
4. Technical Center of Xiamen Entry-Exit Inspection and Quarantine Bureau, Xiamen 361026, China
日本鳗鲡(Anguilla japonica)为降海洄性鱼类, 是中国鳗鲡养殖的主要种类之一。中国鳗鲡养殖始于20世纪70年代初, 现在中国养殖产量约占全球的70%。目前鳗鲡养殖苗种仍依靠采捕自然苗种, 苗种资源是产业发展的最重要瓶颈之一。日本鳗鲡人工繁殖研究自20世纪60年代开始, 经过50多年的努力, 终于2010年在实验室获得子二代的初孵仔鱼[1]。但是, 鳗苗产量低和高昂的柳叶鳗培育成本, 还不能大批量培育白仔鳗苗, 无法达到商业化养殖的要求, 因此还需要进一步研究相关的技术, 如亲鱼的选择、人工催熟催产技术的优化、卵子质量的提高等[2]。
20世纪70年代到90年代早期, 成功诱导性腺成熟的鳗鲡大多为野生下海的日本鳗鲡银鳗亲鱼[3-5]。通常野生银鳗的卵巢发育优于养殖的亲鳗[6], 在外源激素诱导下更容易完成卵黄积累[7]。随着野生亲鳗数量的减少, 目前用于人工繁殖研究的日本鳗鲡多为养殖的菜鳗, 尚未达到自然下海产卵亲鱼的年龄, 大多未经亲鱼培育直接采用注射鱼脑垂体提取液和人绒毛膜促性腺激素(HCG)等外源激素的方法诱导卵巢发育和成熟。在人工诱导过程中, 雌鳗对激素敏感性的个体差异很大, 受精率、孵化率和幼鱼存活率较低, 而外源激素注射前雌鳗的成熟度是决定人工诱导成功的重要因素[2]。在鱼类的繁殖中, 亲鱼的营养状况和卵子质量密切相关[8]。脂类, 特别是高度不饱和脂肪酸, 是卵巢发育和卵子质量的重要决定因素之一[9]。
中草药资源丰富、天然、毒副作用小且功能多样, 常用于提高水产动物生产性能和防治水产动物病害等[10-12]。研究发现, 许多中草药含有类性激素样作用, 甚至有类性激素样双向调节作用, 即同时具有类雄激素样和类雌激素样作用[13]。中草药淫羊藿(Epimedium brevicornum Maxim.)和菟丝子(Cuscuta chinensis Lam.)主要有效成分都是黄酮类[14-15], 其中淫羊藿含淫羊藿苷, 朝藿定A、B、C和宝藿苷Ⅰ等[14]; 菟丝子含山萘酚、槲皮素、金丝桃苷、黄芪苷和木脂素类[16-17]。对雌性哺乳动物的研究发现, 淫羊藿和菟丝子既有雌激素样作用又有刺激雌性动物体内雌二醇合成的促性腺激素作用[18-19]。同时淫羊藿和菟丝子还有雄激素样作用, 均可促进睾酮(T)的分泌[20-21]。中草药淫羊藿和菟丝子在临床上经常用于治疗不育、性功能障碍等疾病[22]和增强生殖功能[23], 在畜牧兽医上也有广泛的应用[24]。然而, 对于提高水产动物生殖功能的研究较少[25-26]。本研究拟在日本鳗鲡亲鱼培育饲料中添加中草药淫羊藿和菟丝子, 以期探索对日本鳗鲡卵巢发育的影响, 为后期成功开展注射外源激素人工催熟催产提供良好的材料和基础。
1 材料与方法 1.1 材料雌亲鱼为取自集美大学水产学院海水试验场淡水循环水养殖的7龄日本鳗鲡, 全长(67.4± 6.1) cm, 体重(592.5±52.5) g, 实验前投喂商品配合饲料。
淫羊藿产自贵州, 菟丝子产自山东, 冷冻粉碎后过160目筛制成超微粉, 按料液质量比1:10加入60%乙醇水溶液, 用高速分散机搅拌1 h后离心取上清液, 重复2次合并药液。置于多样品平行蒸发仪中浓缩, 得到浸膏物即为中药制剂, 膏剂/生药质量比为1:10。置于4℃冰箱中保存备用。
1.2 实验设计120尾亲鱼随机分为对照组和实验组, 放入直径1.5 m、高1 m、容积1000 L的圆形养殖桶中, 水为曝气自来水。各设1个平行组, 每桶30尾鱼。配合饲料饲喂量为2.5 g/kg鱼体重, 待亲鱼摄食稳定后, 实验组分别将淫羊藿和菟丝子浸膏按0.034 g/kg鱼体重加入饲料中进行投喂, 实验组投喂时间为90 d, 对照组继续投喂人工配合饲料, 实验期间控制水温在(21±1)℃, 养殖水体氨氮 < 0.2 mg/L, 亚硝酸盐氮 < 0.05 mg/L, 溶氧 > 5 mg/L。实验结束, 对照组和实验组各随机采鱼样6尾。
1.3 生物学数据采集和组织学观察用浓度0.01%的MS-222 (Sigma-Aldrich, St. Louis, MO, USA)麻醉实验鱼, 测量体重和全长。用注射器尾静脉取血。解剖鱼取卵巢及肝脏, 称重, 按下式计算性腺指数(gonadosomatic index, GSI)和肝体比(hepatosomatic index, HSI):
| $ \begin{array}{*{20}{c}} {性腺指数 = 性腺重/体重 \times 100\% }\\ {肝体比 = 肝重/体重 \times 100\% } \end{array} $ |
取部分卵巢组织用新鲜配制的4%多聚甲醛固定8~12 h, 梯度酒精脱水, 二甲苯透明, 石蜡包埋。连续切片, 切片厚5 μm, H-E染色, Leica DM5500B显微镜观察和拍照。
1.4 ELISA法测定血清中血清雌二醇(E2)和11-酮基睾酮(11-KT)的含量全血标本不加抗凝剂, 于室温放置2 h或4℃过夜后, 1000 g离心15 min, 取上清液得到血清, 置于-20℃保存备用。根据Estradiol ELISA试剂盒和11-Keto Testosterone EIA试剂盒(Cayman Chemical Company, Ann Arbor, Michigan, USA)说明书的操作方法分别检测单尾鱼血清中E2和11-KT的含量。
1.5 卵巢发育相关基因的表达量取部分卵巢和肝样品放入液氮后转-80℃冰箱中保存, 采用TRIzol总RNA试剂盒(TIANGEN)提取总RNA, 用超微量紫外分光光度计检测RNA的浓度和纯度, 用1%琼脂糖凝胶TAE检测RNA完整性。参照Thermo公司First Strand cDNA Kit说明书合成第一条cDNA链。在NCBI网站查找日本鳗鲡内参基因(β-actin)、卵黄蛋白原(vtg)、芳香化酶(cyp19a1)和雌激素受体(erα、erβ) cDNA序列, 利用PrimerPremier 5.0软件分别设计上下游引物(表 1)。将反转录得到的日本鳗鲡肝脏和卵巢第一条cDNA链用灭菌双蒸水稀释10倍后作为模板, 进行PCR扩增, 回收PCR产物并送南京金斯瑞生物科技有限公司测序, 确定是否为目的基因片段。
|
|
表 1 引物序列 Tab.1 Sequences of the primers used in the experiment |
配制好PCR体系进行PCR扩增, 目的基因扩增循环数为34, 内参基因β-actin扩增循环数为28。用凝胶成像分析系统分析PCR产物电泳结果并拍照。比较对照组和实验组肝脏vtg、erα和erβ, 以及卵巢cyp19a1的表达情况。
1.6 肌肉脂肪酸含量测定在每尾鱼躯干的前中后部剪开皮肤, 各部均剪取5 g肌肉, 总共得到新鲜肌肉样品15 g, 在105℃鼓风干燥箱中干燥至恒重。将样品用滤纸包好, 放入索氏提取器的抽提管内, 下部连接接收瓶, 从抽提管上方的冷凝管上端加入无水石油醚至瓶内体积2/3处, 回流提取8 h, 旋转蒸发回收石油醚。旋干残留物转移至(100±5)℃烘箱干燥1 h, 放干燥器内冷却至室温。提取的粗脂肪用正己烷定容至5 mL, 加入5 mL 2 mol/mL氢氧化钾甲醇溶液, 涡旋2 min, 取1 mL上清液, 用正己烷定容至10 mL。将37种脂肪酸甲酯混标标准液定溶于10 mL正己烷中, 配置成2.5 mg/mL的标准液, 上机检测。TR-FAME石英毛细管柱100.0 m× 250 μm×0.20 μm; 进样口温度270℃; 进样量1 μL; 流速1.0 mL/min, 恒定流量, 检测器温度280℃。升温程序:初始温度50℃保持1 min, 以30℃/min升至150℃保持1 min, 以1.5℃/min升至210℃保持5 min, 接着以1℃/min升至240℃, 再以30℃/min升至250℃保持5 min。载气: N2, 纯度≥99.99%;分流比10:1;尾吹45 mL/min。外标法定量测定, 面积归一化法计算各脂肪酸的含量。
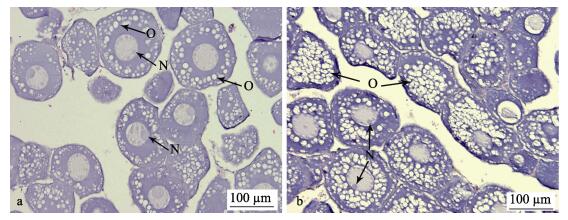
2 结果 2.1 卵巢发育实验组雌鱼的GSI和HSI均显著高于对照组(P < 0.05)(表 2)。解剖后发现, 实验组日本鳗鲡卵巢比对照组粗, 呈乳白色长皱带状。组织切片观察, 对照组和实验组卵巢均处于第Ⅱ期, 大部分卵母细胞属第Ⅱ时相, 未见卵黄颗粒, 细胞核内可见明显的核仁(图 1a, 图 1b)。实验组日本鳗鲡卵母细胞内油球的数量比对照组多, 个体明显增大, 部分卵母细胞胞质已充满油球, 核仁分裂变小增多。
|
|
表 2 日本鳗鲡卵巢发育情况 Tab.2 The ovary development of Japanese eel Anguilla japonica |
|
图 1 日本鳗鲡的卵巢组织切片图 a.对照组; b.实验组; N.核仁; O.脂滴. Fig.1 Photomicrographs of histological sections for Japanese eel Anguilla japonica ovary a. control group; b. treated group; N. nucleolus; O. oil droplet. |
实验组和对照组日本鳗鲡血清E2和11-KT含量均低于1 mg/L, 处于较低水平。实验组血清E2和11-KT含量均显著高于对照组(P < 0.05), 其中实验组11-KT含量约为对照组的4倍(表 3)。
|
|
表 3 日本鳗鲡血清中E2和11-KT的含量 Tab.3 Serum E2 and 11-KT levels of Japanese eel Anguilla japonica |
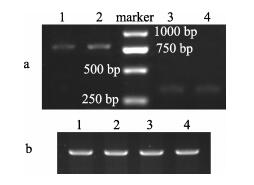
对照组和实验组日本鳗鲡卵巢和肝脏中内参基因β-actin的表达量一致(图 2b)。但是, vtg在实验组日本鳗鲡肝脏中的表达量高于对照组。实验组和对照组卵巢中cyp19a1仅微量表达(图 2a)。对照组和实验组的肝脏均未检测到erα和erβ的表达。
|
图 2 日本鳗鲡肝脏vtg和卵巢cyp19a1表达量 a-1.对照组肝脏vtg; a-2.实验组肝脏vtg; a-3.对照组卵巢cyp19a1; a-4.实验组卵巢cyp19a1; M. marker; b-1.对照组肝脏β-actin; b-2.实验组肝脏β-actin; b-3.对照组卵巢β-actin; b-4.实验组卵巢β-actin. Fig.2 Expression of vtg in the liver and cyp19a1 in the ovary of Japanese eel Anguilla japonica a-1. vtg in liver in the control group; a-2. vtg in liver in the treated group; a-3. cyp19a1 in ovary in the control group; a-4. cyp19a1 in ovary in the treated group; M. marker; b-1. β-actin in liver in the control group; b-2. β-actin in liver in the treated group; b-3. β-actin in ovary in the control group; b-4. β-actin in ovary in the treated group. |
用37种脂肪酸标准样品分析后, 在日本鳗鲡肌肉样品中共检测到42个峰用于定量分析, 其中饱和脂肪酸(SFA) 12个, 单不饱和脂肪酸(MUFA) 9个和多不饱和脂肪酸(MUFA) 11个, 包括花生四烯酸(AA)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)(表 4)。
|
|
表 4 日本鳗鲡肌肉脂肪酸组成 Tab.4 Fatty acid composition of muscle in Japanese eel Anguilla japonica |
实验组雌鱼肌肉总脂肪酸、SFA、MUFA和高度不饱和脂肪酸(HUFA)含量均显著高于对照组(P < 0.05)。最主要的不饱和脂肪酸AA、EPA和DHA含量均显著高于对照组(P < 0.05)。实验组n-3不饱和脂肪酸含量显著高于对照组(P < 0.05)(表 4)。
3 讨论实验结果显示, 饲料中添加中草药淫羊藿和菟丝子后, 日本鳗鲡卵巢仍处于第Ⅱ期, 未出现卵黄颗粒, 但是, GSI和HSI均显著高于对照组, 卵细胞油滴明显增大、增多, 核仁变小增多, 血清性类固醇激素E2和11-KT含量显著升高, 肝脏卵黄蛋白原基因vtg表达量升高, 肌肉总脂肪酸, 高不饱和脂肪酸AA、EPA和DHA含量显著升高, 表明淫羊藿和菟丝子能够促进日本鳗鲡卵巢的发育。
本研究中, 淫羊藿和菟丝子能提高血清11-KT和E2的水平, 特别是11-KT。11-KT是鱼类卵细胞发育中卵黄生成前期最重要的性类固醇激素, 能促进日本鳗鲡卵母细胞中油滴的累积, 促进卵巢的发育[27]。Damsteegt等[28]研究发现, 11-KT是通过提高低密度脂蛋白(脂滴的主要成分)受体的表达量来促进卵母细胞对油滴的吸收和积累的。淫羊藿和菟丝子提高血清E2的水平可能是通过调节下丘脑-垂体-性腺生殖轴完成。淫羊藿和菟丝子的总黄酮可刺激哺乳动物下丘脑雌激素受体的表达[29], 提高下丘脑GnRH以及垂体对促性腺激素释放激素的反应性和垂体GtH水平[30-31]。GtH进一步刺激芳香化酶的表达, 提高体内E2水平[19]。但是, 本研究中实验组卵巢芳香化酶基因cyp19a1的表达量很低, 相比对照组没有提高, 而实验组血清E2含量虽然有显著提高, 但依然处于较低水平。以往的研究表明, 日本鳗鲡卵黄生成前期E2的作用相对较小, cyp19a1的表达量也很低, 随着卵黄的生成才逐渐提高[32-33]。因此, 在日本鳗鲡卵黄发生前期淫羊藿和菟丝子提高血清E2的水平作用有限。实验组日本鳗鲡卵巢还未到卵黄生成期, 肝脏卵黄蛋白原基因vtg的表达量很低[34], 实验组肝脏未检测到E2受体erα和erβ的表达, 表明低水平的血清E2不足以刺激肝脏合成卵黄蛋白原[35], 但淫羊藿中黄酮类物质淫羊藿苷,淫羊藿素,朝藿定A、B、C均有一定的雌激素活性[36-37]。它们的雌激素样作用可能促进了肝脏营养物质的积累(肝体比升高)和卵黄蛋白原基因vtg的表达, 为下一步卵黄生成做好准备。
本研究中, 淫羊藿和菟丝子提高卵母细胞发育的同时, 也显著提高了肌肉的总脂肪酸含量。日本鳗鲡在下海产卵过程中不摄食, 卵巢发育完全依靠储存的能量, 在饲料中添加淫羊藿和菟丝子促进了雌鳗对饲料中脂肪的吸收, 为卵巢发育储备了能量和营养物质。实验组日本鳗鲡肌肉总脂肪含量中HUFA和n-3 PUFA的含量显著高于对照组, n-6 PUFA的含量高于对照组但不显著。日本鳗鲡亲鱼和稚鱼一样需要n-3和n-6 PUFA[38]。在其他淡水和海水鱼类的研究表明, AA能够刺激T等类固醇激素的合成和增强GtH的作用, 促进卵母细胞发育成熟, 而EPA却可以抑制AA促进类固醇合成的作用[8]。但是, 研究表明, 饲料中较高的n-3脂肪酸虽然没有显著提高欧洲鳗鲡(A. anguilla)(卵黄生成前期)的血清E2、T和11-KT水平, 但在后期外源激素诱导过程中亲鱼对外源激素更加敏感, 卵泡发育更快至Ⅳ期后的核偏位和胚泡破裂(germinal vesicle break-down, GVBD), n-3脂肪酸和n-6脂肪酸一样可以促在鳗鲡巢中发育成熟[8]。
而在卵子质量和胚胎发育阶段, n-3脂肪酸和n-6脂肪酸的作用不同。Furuita等[39]发现, 日本鳗鲡卵子的n-6脂肪酸含量与卵子质量呈负相关的关系; n-6脂肪酸不利于胚胎发育和降低仔鱼质量, 而n-3脂肪酸能提高受精卵的孵化率[38]。进一步研究发现AA在日本鳗鲡卵巢中的含量高于卵子, 而EPA正好相反, 表明卵巢发育更需要AA。已有研究证明, AA可以诱导类固醇的合成[8], 卵子和仔鱼发育更需要EPA等n-3不饱和脂肪酸[38]。n-3系列不饱和脂肪酸, 尤其是DHA在幼鱼发育中有重要的作用[40-42]。
4 结论在亲鱼饲料中添加中草药淫羊藿和菟丝子可以提高日本鳗鲡卵黄生成前期血清中11-KT和E2水平, 促进了卵母细胞中油滴的累积和肝脏卵黄蛋白原等营养物质的积累; 同时还可以促进肌肉对脂肪酸, 特别是重要的高不饱和脂肪酸AA、EPA和DHA的吸收和储存。日本鳗鲡卵巢发育需要是一个较长的过程和积累, 本文进行的亲鱼培育研究可为下一步注射外源激素人工诱导卵巢发育成熟提供性腺发育成熟度较好的亲鱼, 为后期卵黄生成和卵母细胞进一步发育做好准备, 为提高亲鱼排卵率打好基础。
| [1] |
Masuda Y, Imaizumi H, Oda K, et al. Artificial completion of the Japanese eel, Anguilla japonica, life cycle:challenge to mass production[J]. Bulletin of Fisheries Research Agency, 2012, 35: 111-117. |
| [2] |
Okamura A, Horie N, Mikawa N, et al. Recent advances in artificial production of glass eels for conservation of anguillid eel populations[J]. Ecology of Freshwater Fish, 2013, 23(1): 5-110. |
| [3] |
Yamamoto J, Yamauchi K. Sexual maturation of Japanese eel and production of eel larvae in the aquarium[J]. Nature, 1974, 251(5472): 220-222. DOI:10.1038/251220a0 |
| [4] |
Motonobu T, Yamashita K, Oka H P. A memoir on the hatched larva of the Japanese eel, Anguilla japonica, from the adults matured artificially[J]. Bulletin of the Shizuoka Prefectural Fisheries Experiment Station, 1976, 10: 87-90. |
| [5] |
Satoh H, Yamamori K, Hibiya T. Induced spawning of the Japanese eel[J]. Nippon Suisan Gakkaishi, 1992, 58(5): 825-832. DOI:10.2331/suisan.58.825 |
| [6] |
Ijiri S, Kayaba T, Takeda N, et al. Pretreatment reproductive stage and oocyte development induced by salmon pituitary homogenate in the Japanese eel Anguilla japonica[J]. Fisheries Science, 1998, 64(4): 531-537. DOI:10.2331/fishsci.64.531 |
| [7] |
Sato N, Kawazoe I, Suzuki Y, et al. Adequate interval of sGTH administration to induce vitellogenesis:and induction of ovulation by simultaneous administration of sGTH and17a-hydroxyprogesterone in the Japanese eel[J]. Fisheries Science, 2000, 66(4): 644-654. DOI:10.1046/j.1444-2906.2000.00099.x |
| [8] |
da Silva F F G, Støttrupa J G, Kjørsvik E, et al. Interactive effects of dietary composition and hormonal treatment on reproductive development of cultured female European eel, Anguilla anguilla[J]. Animal Reproduction Science, 2016, 171: 17-26. DOI:10.1016/j.anireprosci.2016.05.007 |
| [9] |
Izquierdo M S, Fernández-Palacios H, Tacon A G J. Effect of broodstock nutrition on reproductive performance of fish[J]. Aquaculture, 2001, 197(1-4): 25-42. DOI:10.1016/S0044-8486(01)00581-6 |
| [10] |
Qiu X C, Zhou H Q, Liu X G, et al. The effect of dietary Chinese herb additives on growth and digestibility of allogynogenetic crucian carp[J]. Journal of Fisheries of China, 2002, 26(6): 551-555. [邱小琮, 周洪琪, 刘小刚, 等. 中草药添加剂对异育银鲫生长和蛋白质消化吸收的影响[J]. 水产学报, 2002, 26(6): 551-555.] |
| [11] |
Wang J Q, Sun Y X, Zhang J C. Effects of Chinese herb additives on growth, digestive activity and non-specific immunity in flounder Paralichthys olivaceus[J]. Journal of Fisheries of China, 2006, 30(1): 90-96. [王吉桥, 孙永新, 张剑诚. 金银花等复方草药对牙鲆生长、消化和免疫能力的影响[J]. 水产学报, 2006, 30(1): 90-96.] |
| [12] |
Li Z Q, Guan R Z, Wang L H, et al. Antibacterial activity analysis for six kinds of Chinese herbs and their compounds against Pathogenic aeromonas from cultured eels in vitro[J]. Acta Hydrobiologica Sinica, 2012, 36(1): 85-92. [李忠琴, 关瑞章, 汪黎虹, 等. 六种中药及其复方对鳗鲡致病性气单胞菌的体外抑制作用[J]. 水生生物学报, 2012, 36(1): 85-92.] |
| [13] |
Yan P X, Du B J, Luo R. Research progress in the similar effect of traditional Chinese medicine as hormones[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2014, 29(2): 531-534. [闫朋宣, 杜宝俊, 罗然. 中药类激素样作用研究进展[J]. 中华中医药杂志, 2014, 29(2): 531-534.] |
| [14] |
Li Y B, Meng F H, Lu X M, et al. Chemical constituents from herb of Epimedium brevicornum[J]. China Journal of Chinese Materia Medica, 2005, 30(8): 586-588. [李遇伯, 孟繁浩, 鹿秀梅, 等. 淫羊蕾化学成分的研究[J]. 中国中药杂志, 2005, 30(8): 586-588. DOI:10.3321/j.issn:1001-5302.2005.08.007] |
| [15] |
Donnapee S, Li J, Yang X, et al. Cuscuta chinensis Lam.:A systematic review on ethnopharmacology, phytochemistry and pharmacology of an important traditional herbal medicine[J]. Journal of Ethnopharmacology, 2014, 157: 292-308. DOI:10.1016/j.jep.2014.09.032 |
| [16] |
Cornwell T, Cohick W, Raskin I. Dietary phytoestrogens and health[J]. Phytochemistry, 2004, 65(8): 995-1016. DOI:10.1016/j.phytochem.2004.03.005 |
| [17] |
Williamson G, Barron D, Shimoi K. In vitro biological properties of flavonoid conjugates found in vivo[J]. Free Radical Research, 2005, 39(5): 457-469. DOI:10.1080/10715760500053610 |
| [18] |
Li F F, Li E, Lü Z J, et al. Effects of icarrin on secretive function of cultured granulosa and adrenal cortical cells of rats[J]. China Journal of Chinese Materia Medica, 1997, 22(8): 499-500. [李芳芳, 李恩, 吕占军, 等. 淫羊藿甙对大鼠卵泡颗粒细胞和肾上腺皮质细胞分泌功能的影响[J]. 中国中药杂志, 1997, 22(8): 499-500. DOI:10.3321/j.issn:1001-5302.1997.08.020] |
| [19] |
Yang L J, Lu D F, Guo J J, et al. Icariin from Epimedium brevicornum Maxim promotes the biosynthesis of estrogen by aromatase (CYP19)[J]. Journal of Ethnopharmacology, 2013, 145(3): 715-721. DOI:10.1016/j.jep.2012.11.031 |
| [20] |
Zhang Z B, Yang Q T. The testosterone mimetic properties of icariin[J]. Asian Journal of Andrology, 2006, 8(5): 601-605. DOI:10.1111/ajan.2006.8.issue-5 |
| [21] |
Yang J X, Wang Y L, Bao Y, et al. The total flavones from Semen cuscutae reverse the reduction of testosterone level and the expression of androgen receptor gene in kidney-yang deficient mice[J]. Journal of Ethnopharmacology, 2008, 119(1): 166-171. DOI:10.1016/j.jep.2008.06.027 |
| [22] |
Yuan H, Cao S P, Chen S Y, et al. Research progress on chemical constituents and quality control of Epimedii folium[J]. Chinese Traditional and Herbal Drugs, 2014, 45(24): 3630-3640. [袁航, 曹树萍, 陈抒云, 等. 淫羊藿的化学成分及质量控制研究进展[J]. 中草药, 2014, 45(24): 3630-3640. DOI:10.7501/j.issn.0253-2670.2014.24.024] |
| [23] |
Zheng H Z, Dong Z H, She J. Modern Study of Traditional Chinese Medicine (volume five)[M]. Beijing: Xueyuan Press, 1998: 4110-4120. [郑虎占, 董泽宏, 佘靖. 中药现代研究与应用(第五卷)[M]. 北京: 学苑出版社, 1998: 4110-4120.]
|
| [24] |
Yang B T, An F L, Liao J F, et al. Effects of herbal feed additives on the reproductive performance of ewes[J]. Chinese Journal of Veterinary Drug, 2010, 44(10): 51-54. [杨保田, 安芳兰, 廖吉方, 等. 中草药饲料添加剂对母羊繁殖性能的影响[J]. 中国兽药杂志, 2010, 44(10): 51-54. DOI:10.3969/j.issn.1002-1280.2010.10.012] |
| [25] |
Wang J Q, Liu G Z, Tian Z X, et al. Effects of Chinese herb medicine supplementation on reproduction of yellow catfish Pelteobagrus fulvidraco[J]. Journal of Dalian Fisheries University, 2008, 23(4): 258-263. [王吉桥, 柳圭泽, 田忠信, 等. 中草药添加剂对黄颡鱼繁殖性能及效果的影响[J]. 大连水产学院学报, 2008, 23(4): 258-263. DOI:10.3969/j.issn.1000-9957.2008.04.003] |
| [26] |
Zhao Q K, Ding W D, Bing X W, et al. The influence of Chinese herbal medicine feed additive on eel (Monopterus albus) sex hormone levels[J]. Chinese Agricultural Science Bulletin, 2014, 30(32): 38-42. [赵庆凯, 丁炜东, 邴旭文, 等. 中草药饲料添加剂对黄鳝性激素含量的影响[J]. 中国农学通报, 2014, 30(32): 38-42.] |
| [27] |
Kazeto Y, Tosaka R, Matsubara H, et al. Ovarian steroidogenesis and the role of sex steroid hormones on ovarian growth and maturation of the Japanese eel[J]. Journal of Steroid Biochemistry and Molecular Biology, 2011, 127(3-5): 149-154. DOI:10.1016/j.jsbmb.2011.03.013 |
| [28] |
Damsteegt E L, Mizuta H, Hiramatsu N, et al. How do eggs get fat? Insights into ovarian fatty acid accumulation in the shortfinned eel, Anguilla australis[J]. General and Comparative Endocrinology, 2015, 221: 94-100. DOI:10.1016/j.ygcen.2014.12.019 |
| [29] |
Wu M S, Zhao S Z, Ren L Z. Effects of total flavonoids of Epimedium sagittatum on the mRNA expression of the estrogen receptor α and β in hypothalamus and hippocampus in ovariectomized rats[J]. Journal of Central South University (Medical Science), 2011, 36(1): 15-20. |
| [30] |
Wang J H, Wang M Z, Ouyang D, et al. Effects of flavonoids from semen cuscutae on changes of beta-EP in hypothalamuses and FSH and LH in anterior pituitaries in female rats exposed to psychologic stress[J]. Journal of Chinese Medicinal Materials, 2002, 25(12): 886-888. [王建红, 王敏璋, 欧阳栋, 等. 菟丝子黄酮对心理应激雌性大鼠下丘脑β-EP与腺垂体FSH、LH的影响[J]. 中药材, 2002, 25(12): 886-888. DOI:10.3321/j.issn:1001-4454.2002.12.015] |
| [31] |
Wu X, Yang W, Zhang L, et al. Influence of hypothalamus-pituitary-gonadal axis blocking on sex hormone secretion promoted by Epimedii folium[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(5): 161-164. [吴瑕, 杨薇, 张磊, 等. 下丘脑-垂体-性腺轴阻断对淫羊藿促性激素作用的影响[J]. 中国实验方剂学杂志, 2011, 17(5): 161-164. DOI:10.3969/j.issn.1005-9903.2011.05.049] |
| [32] |
Matsubara H, Lokman P M, Kazeto Y, et al. Serum steroid profiles in artificially maturing female Japanese eel, Anguilla japonica[J]. Aquaculture, 2005, 243(1-4): 393-402. DOI:10.1016/j.aquaculture.2004.10.018 |
| [33] |
Jeng S R, Pasquier J, Yueh W S, et al. Differential regulation of the expression of cytochrome P450 aromatase, estrogen and androgen receptor subtypes in the brain-pituitary-ovarian axis of the Japanese eel (Anguilla japonica) reveals steroid dependent and independent mechanisms[J]. General and Comparative Endocrinology, 2012, 175(1): 163-172. |
| [34] |
Okumura H, Todo T, Adachi S, et al. Changes in hepatic vitellogenin mRNA levels during oocyte development in the Japanese eel, Anguilla japonica[J]. General and Comparative Endocrinology, 2002, 125(1): 9-16. |
| [35] |
Wang Y S, Lou S W. Structural and expression analysis of hepatic vitellogenin gene during ovarian maturation in Anguilla japonica[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2006, 100(4-5): 193-201. DOI:10.1016/j.jsbmb.2006.04.011 |
| [36] |
Kang H K, Choi Y H, Kwon H, et al. Estrogenic/antiestrogenic activities of a Epimedium koreanum extract and its major components:in vitro and in vivo studies[J]. Food and Chemical Toxicology, 2012, 50(8): 2751-2759. DOI:10.1016/j.fct.2012.05.017 |
| [37] |
Islam M N, Kim U, Kim D H, et al. High-performance liquid chromatography-based multivariate analysis to predict the estrogenic activity of an Epimedium koreanum extract[J]. Bioscience, Biotechnology, and Biochemistry, 2012, 76(5): 923-927. DOI:10.1271/bbb.110922 |
| [38] |
Furuita H, Hori K, Suzuki T, et al. Effect of n-3 and n-6 fatty acids in broodstock diet on reproduction and fatty acid composition of broodstock and eggs in the Japanese eel Anguilla japonica[J]. Aquaculture, 2007, 267(1-4): 55-61. DOI:10.1016/j.aquaculture.2007.01.039 |
| [39] |
Furuita H, Unuma T, Nomura K, et al. Lipid and fatty acid composition of eggs producing larvae with high survival rate in the Japanese eel Anguilla japonica[J]. Journal of Fish Biology, 2006, 69(4): 1178-1189. DOI:10.1111/jfb.2006.69.issue-4 |
| [40] |
Watanabe T. Importance of docosahexaenoic acid in marine larval fish[J]. Journal of World Aquaculture Society, 1993, 24(2): 152-161. DOI:10.1111/jwas.1993.24.issue-2 |
| [41] |
Takeuchi T. Essential fatty acid requirements of aquatic animals with emphasis on fish larvae and fingerlings[J]. Reviews in Fisheries Science, 1997, 5(1): 1-25. |
| [42] |
Furuita H, Konishi K, Takeuchi T. Effect of different levels of eicosapentaenoic acid and docosahexaenoic acid in Artemia nauplii on growth, survival and salinity tolerance of larvae of the Japanese flounder, Paralichthys olivaceus[J]. Aquaculture, 1999, 170(1): 59-69. DOI:10.1016/S0044-8486(98)00386-X |
 2019, Vol. 26
2019, Vol. 26

