2. 云南农业大学动物科学技术学院, 云南 昆明 650201;
3. 中国科学院大学, 北京 100049
2. Animal Science and Technology College, Yunnan Agricultural University, Kunming 650201, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
杂交育种是新品种培育的重要途径。杂交育种可集合双亲的优良性状, 多数杂交后代在生长和存活率上具有杂种优势。种间杂交可产生较大的遗传变异, 具有较大的杂种优势, 但种间杂交易存在繁殖隔离、操作复杂、成功率低等缺陷[1]。牡蛎杂交育种研究中, 种内与种间杂交均有报道, 但主要集中于种间杂交[2-5]。熊本牡蛎(Crassostrea sikamea)与其他牡蛎的种间杂交报道相对较少, 熊本牡蛎(♀)×葡萄牙牡蛎(Crassostrea angulata, ♂)的杂交子代在脂肪含量和脂肪酸组成上具有杂种优势[6];在稚贝与成贝阶段, 熊本牡蛎与长牡蛎(Crassostrea gigas)杂交子代壳长与壳高的生长均小于自交组[7]。目前, 未见熊本牡蛎种内杂交研究的报道。
牡蛎三倍体具有生长快、个体大、繁殖季节死亡率低等优点。多种牡蛎已通过人工诱导获得了三倍体[8-12]。杂交三倍体综合了杂种与三倍体的优势, 子代可能具有更优秀的性状。长牡蛎四倍体与近江牡蛎(Crassostrea ariakensis)二倍体的杂交三倍体子代, 幼虫的生长与变态时间具有优势, 并且其兼具了两亲本的特性[13];长牡蛎中国群体与美国群体的种内杂交三倍体, 幼体与稚贝具有显著的生长优势[14]。因此, 杂交三倍体亦可成为牡蛎育种的新途径。
熊本牡蛎中国群体与美国群体为两个不同的地理群体, 其中美国群体已在美国大面积养殖, 而中国群体为广西北部湾的野生种群, 个体较小, 成体体重一般小于10 g, 显著小于美国群体[12, 15]。本研究将自行人工选育至F3的中国群体与美国群体进行杂交及三倍体诱导实验, 分析杂交二倍体与杂交三倍体的生长与存活优势, 期望生产出既能适应中国沿海养殖环境又具有优良生长性状的熊本牡蛎杂交群体。
1 材料与方法 1.1 材料2016年5月在广西北海贝类养殖基地挑选2~3龄、体重大于50 g的无损伤熊本牡蛎中国群体和美国群体(本课题组选育的F3群体)各100只作为亲贝, 暂养于人工育苗池中(水温26~30℃, 盐度22~25)。
1.2 实验设计将熊本牡蛎美国群体与中国群体进行杂交和诱导, 分别获得杂交二倍体和杂交三倍体诱导组; 并且分别繁育美国群体和中国群体自交组(表 1)。本课题组已有的研究显示(未发表), 熊本牡蛎中国群体(♀)×美国群体(♂)杂交组合未产生显著杂种优势, 因此, 本研究只进行美国群体(♀)×中国群体(♂)的杂交实验。每组实验重复3次。
|
|
表 1 熊本牡蛎中国群体与美国群体杂交实验设计 Tab.1 Design for cross between Chinese and American populations of Crassostrea sikamea |
采用人工解剖法获取亲贝的卵子和精子, 解剖后的雌雄性腺分开放置, 避免意外授精; 人工挤取精卵后, 使用500目筛绢网过滤掉杂质; 将卵子置于新鲜海水浸泡促熟1 h, 授精前使用新鲜海水激活精子。
1.4 二倍体与三倍体的制作采用同一批次的精子和卵子制作二倍体与三倍体。杂交三倍体诱导方法为:当受精卵排出40%~50%的第一极体(PBI)时, 采用0.5 mg/L的细胞松弛素B (CB, C6762-10MG, SIGMA, USA)溶液诱导20 min, 并使用0.1%二甲基亚砜(DT0163, Sangon, Shanghai, China)洗掉残留的CB, 然后置于500 L孵化桶中孵化; 杂交二倍体与自交二倍体不进行处理。
1.5 幼虫、稚贝及成贝的培育幼体培育阶段前期投喂金藻(Isochrysis galbans), 后期等量混合投喂金藻与云维藻(Yunwei alga), 藻细胞浓度为60000~80000个/mL; 每3 d全部换水1次(水温27~30℃, 盐度22~25)。使用成吊的牡蛎壳作为附着基, 幼虫长出眼点与足后开始附着, 附着完毕后转移至自然海区养殖。
1.6 性状测量分别使用显微镜(Olympus CX22, Tokyo, Japan)和游标卡尺(精确至0.01 mm)测量浮游幼虫及稚贝与成贝的壳长与壳高, 测量时间为3、6、9、12、15、40、180和360日龄, 每次采集60个个体。
受精孵化约8 h后随机收集受精卵计算卵裂率; 全部发育至D形幼虫后计算D幼率。使用流式细胞仪(Partec Ⅱ, 德国)测定倍性, 测定方法为:随机采集幼虫置于1.5 mL离心管中, 加入1 mL浓度为10 μg/mL的DAPI溶液(D9542, SIGMA, USA; 配制方法为:取1 mg DAPI加入10 mL双蒸水, 充分溶解后配制成母液, 使用时按1 ː 9的比例用磷酸缓冲液稀释至10 μg/mL备用)制作细胞悬液, 检测3日龄与9日龄的三倍体诱导率。取成贝的鳃组织进行倍性检测, 方法同浮游幼虫的倍性检测。
杂种优势率H(%)=[(F1–P)×100]/P, 其中F1与P分别为杂交二倍体组和二倍体组的均值; 杂交三倍体优势率Td(%)=[(3nH–2nH)×100]/2nH, 其中, 3nH与2nH分别为杂交三倍体诱导组和杂交二倍体组的均值[16]。
1.7 数据处理使用SPSS 18.0软件进行数据分析, 同一因素下不同水平采用单因素方差分析(one-way ANOVA), 采用独立样本的t检验检测组间的成活率差异; 显著水平均为P < 0.05。
2 结果与分析 2.1 三倍体诱导率、卵裂率、D幼率及D幼大小3日龄与9日龄3nAC组的三倍体诱导率分别为(87±10.6)%与(77±9.2)%(图 1)。3nAC具有卵裂率与D幼率劣势, 劣势率分别为–23.67%与–22.75%, 但在D幼大小上具有优势(4.06%, P < 0.05), 而2nAC与之相反(表 2)。2nAA的卵裂率、D幼率和D幼大小均高于2nCC, 但只在D幼率上呈显著差异(P < 0.05)。
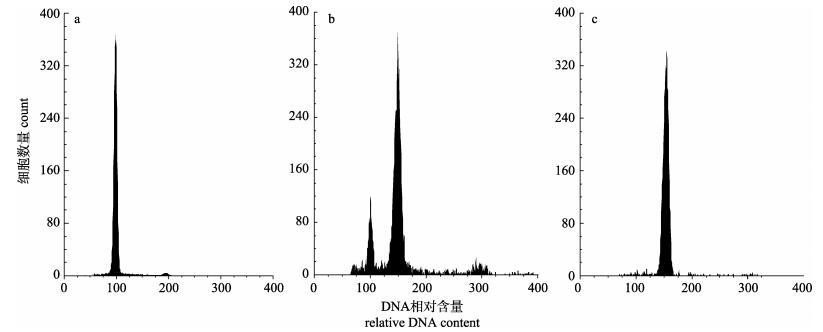
|
图 1 流式细胞仪检测的熊本牡蛎二倍体(a)及杂交三倍体幼虫(b)与成体(c)的倍性 b图中杂交三倍体率为87%. Fig.1 Ploidy examination for diploid (a), hybrid larvae (b), and hybrid triploid (c) in Crassostrea sikamea by flow cytometry The triploidy rate is 87% which is displayed in the subfigure b. |
|
|
表 2 二倍体与三倍体组的卵裂率、D幼率及D幼大小 Tab.2 Cleavage rate, D larvae rate, and D larvae size for the diploid and triploid groups of Crassostrea sikamea |
总体上, 3~15日龄3nAC具有生长优势, 9日龄时优势率最大为5.53%, 平均优势率为3.69%, 且与其他组呈显著差异(P < 0.05)。2nAC仅在9日龄具有生长优势, 平均优势率为–0.43%, 且与自交组差异不显著(P > 0.05)。3~6日龄2nAA的生长显著高于2nCC(P < 0.05), 但6~15日龄时两者无显著差异(P > 0.05, 表 3)。
|
|
表 3 二倍体与三倍体组幼虫壳高生长优势率变化 Tab.3 Growth advantage of shell height for diploid and triploid larvae of Crassostrea sikamea |
总体上, 3~15日龄2nAC组的存活率大于2nCC和2nAA, 平均存活优势率为10.44%, 并且6~15日龄2nAC显著高于2nCC(P < 0.05), 而与2nAA无显著差别(P > 0.05)。3~15日龄3nAC具有存活率劣势, 平均劣势率为-40.54%, 显著低于二倍体自交组与杂交组(P < 0.05, 表 4)。
|
|
表 4 二倍体与三倍体组幼虫的存活优势率变化 Tab.4 Advantage of survival rate in diploids and triploids larvae of Crassostrea sikamea |
40~360日龄3nAC与2nAC均具有壳长与壳高的生长优势(表 5), 并且两者壳长和壳高的平均优势率分别为12.69%与13.64%、3.96%与6.65%。3nAC壳长与壳高的生长优势逐步增大, 日龄越大优势率越大; 且在360日龄与自交组呈显著差异(P < 0.05), 但与2nAC无显著差异(P > 0.05)。2nAC的杂种优势率逐渐降低, 360日龄时处于最低水平, 但与自交组仍具有显著差异(P < 0.05)。
|
|
表 5 二倍体与三倍体组稚贝和成贝壳长与壳高的生长优势 Tab.5 Growth advantage of shell length and shell height for juveniles and adults of diploids and triploids in Crassostrea sikamea |
在180~360日龄二倍体组与杂交三倍体诱导组的存活率急剧减小。因此, 杂交三倍体诱导组在40~180日龄呈生存率劣势, 在360日龄具有优势(P < 0.05, 6.70%)。而40~360日龄2nAC的存活率高于2nCC和2nAA, 一直具有生存率优势(表 6)。
|
|
表 6 二倍体与三倍体组稚贝与成贝的存活优势率变化 Tab.6 Variation of survival advantage in juveniles and adults of diploids and triploids in Crassostrea sikamea |
种内不同种群间的杂交可表现不同程度的杂种优势[1, 17]。不同家系的壳金长牡蛎杂交子代比自交子代表现出较高的生长和存活性能[18]。香港牡蛎(Crassostrea hongkongensis)两个不同地理群体杂交, 幼虫具有一定的存活优势, 且生长呈现母本效应, 稚贝具有较明显的存活优势与生长优势[19]。连续选育至5代的长牡蛎中国群体与日本群体杂交, 幼虫的存活与生长优势较小, 但稚贝与成贝的生长呈现较显著的杂种优势[20]。长牡蛎选育群体F4的中国群体、日本群体、韩国群体双列杂交, 杂交组在180、360、450日龄均表现明显的杂种优势[21]。本研究中熊本牡蛎中国群体与美国群体杂交二倍体的幼虫生长优势较小, 但稚贝与成贝具有较显著的生长与存活优势, 与不同地理群体的长牡蛎及香港牡蛎杂交的研究结果一致[19-20];此外, 本研究中杂交二倍体幼虫亦具有较显著的存活率优势。
3.1 杂种优势熊本牡蛎美国群体自交子代的卵裂率、D幼率、生长速度和存活率均大于中国群体自交子代, 暗示两者的杂交子代可能具有较明显的母本效应[17]。人工选择可提高基因的纯合度, 可促进杂交效应的效果。因此, 本研究中卵裂率与D幼率表现出杂种优势, 原因可能为美国群体具有较高的母本效应。但6日龄时杂交幼虫壳长的杂种优势率为0, 9日龄已具有杂种优势率为1.69%。在扇贝(Argopecten circularis)杂交群体幼体中亦发现了相似的情况, 其11日龄幼虫生长性状的杂种优势率为0, 17日龄增加至6.8%[22]。本研究中, 12日龄与15日龄幼虫壳长生长又表现为杂交劣势。因此, 本研究可能说明熊本牡蛎杂交群体幼虫阶段的杂种优势并不稳定, 母本效应的作用较显著; 亦说明杂种优势与母本效应存在此消彼长的联系, 在厚壳蛤(Mercenaria mercenaria)两个选育群体的杂交后代中也发现幼虫期母本效应掩盖杂种优势的现象[23]。
杂交稚贝与成贝均表现出稳定的杂种优势, 与幼虫的杂种效应有一定差异。长牡蛎不同选育群体的F2杂交, 其杂交幼体与杂交稚贝亦表现出不同模式的杂种优势[24]。此外, 不同生长阶段具有不同的杂种优势亦属常见现象。本研究中40日龄、180日龄、360日龄杂交稚贝与成贝的生长性状的杂种优势呈现下降趋势。生长性状杂种优势的变异可能与外部环境和繁殖季节有关联。40日龄处于8月份, 水温较高, 饵料生物丰富, 而此时性腺又未成熟, 因此具有较高的生长速度和杂种优势, 而180日龄为12月份, 水温较低, 饵料少, 生长速度慢, 360日龄为下一年的6月份, 虽具有较高的水温与饵料密度, 但此时处于繁殖期, 大量能量物质用于性腺发育、配子生成, 个体生长速度变慢。总之, 遗传因素与环境因素共同决定了稚贝与成贝杂种优势的程度。
3.2 杂交三倍体优势本研究中, 杂交三倍体诱导组的卵裂率与D幼率均表现负的三倍体优势, 这可能与CB的毒性有关, CB较大的毒性可致胚胎发育畸形[25]。而杂交三倍体诱导组幼虫、稚贝与成贝的生长均具有三倍体优势。一般认为三倍体细胞的巨态性是三倍体具有生长优势的原因之一[26]。此外, 杂交三倍体中也包含杂交效应, 杂交效应可产生生长优势[27], 例如:使用长牡蛎四倍体与二倍体杂交制作的杂交三倍体比使用化学药物诱导产生的三倍体具有更大的生长优势[28]。本研究中, 40~360日龄杂交三倍体诱导组幼虫、稚贝与成贝的生长均具有优势, 且日龄越大, 生长优势率越大, 但在40~360日龄杂交二倍体的生长优势率逐渐降低, 呈现日龄越大生长优势率越小的趋势。这种现象可能与性腺发育相关。40~360日龄二倍体性腺逐步发育成熟, 二倍体性腺发育和繁殖消耗了大量本该用于个体生长的能量物质, 而三倍体具有不育性, 较多的能量用于个体生长。因此, 特殊的能量利用与分配机制亦是杂交三倍体诱导组后期杂种优势较大的原因。种内杂交三倍体亦可能同时拥有杂种优势和三倍体优势, 两者相互叠加表现出更优秀的经济性状。但杂交三倍体杂种优势的原因比杂交二倍体复杂, 三倍体优势与杂交优势的表现程度及相互作用仍需深入研究。
综上所述, 综合杂交育种与三倍体育种的优势, 可以培育出经济性状更加优秀的新品种。杂交三倍体育种也可成为牡蛎育种的新途径。本研究初步探讨了熊本牡蛎杂交三倍体育种的可行性, 为今后的熊本牡蛎育种研究提供了新思路。
| [1] |
Wang Q Y. Cell Engineering Breeding for Marine Aquaculture Species[M]. Beijing: China Ocean Press, 2007. [王清印. 海水养殖生物的细胞工程育种[M]. 北京: 海洋出版社, 2007.]
|
| [2] |
Du J P, Wang Z P, Yu R H, et al. Effect of salinity on early heterosis of hybrid larvae between Crassostrea hongkongensis×C. angulate[J]. Periodical of Ocean University of China, 2018, 48(1): 31-39. [杜俊鹏, 王昭萍, 于瑞海, 等. 盐度对香港巨牡蛎♀×葡萄牙牡蛎♂杂交子代早期杂种优势的影响[J]. 中国海洋大学学报(自然科学版), 2018, 48(1): 31-39.] |
| [3] |
Zhang Y H, Wang Z P, Yan X W, et al. Interspecific hybridization between two oysters Crassostrea gigas and C. ariakensis[J]. Journal of Fisheries of China, 2012, 36(8): 1215-1224. [张跃环, 王昭萍, 闫喜武, 等. 太平洋牡蛎与近江牡蛎的种间杂交[J]. 水产学报, 2012, 36(8): 1215-1224.] |
| [4] |
Zhang Y H, Wang Z P, Yan X W, et al. Analysis of the early heterosis for interspecific hybrids between Crassostrea hongkongensis and C. gigas[J]. Journal of Fisheries of China, 2012, 36(9): 1358-1366. [张跃环, 王昭萍, 闫喜武, 等. 香港巨牡蛎与长牡蛎种间杂交及早期杂种优势分析[J]. 水产学报, 2012, 36(9): 1358-1366.] |
| [5] |
Zhang Y H, Wang Z P, Yu Z N, et al. Analysis of the medium-term heterosis of Crassostrea hongkongensis (♀)×C. gigas (♂) hybrids in Northern China[J]. Journal of Fisheries of China, 2014, 38(9): 1310-1317. [张跃环, 王昭萍, 喻子牛, 等. 北方沿海香港牡蛎(♀)×长牡蛎(♂)杂种中期优势评估[J]. 水产学报, 2014, 38(9): 1310-1317.] |
| [6] |
Yan L L, Wang Z P, Su J Q, et al. Determination of nutritive components and expression analysis of liplid metabolism related genes of hybrid of Kumamoto oyster (♀) and Portuguese oyster (♂)[J]. Periodical of Ocean University of China, 2017, 47(6): 53-60. [闫路路, 王昭萍, 苏家齐, 等. 熊本牡蛎(♀)×葡萄牙牡蛎(♂)杂交子代的营养成分和脂肪代谢相关基因表达分析[J]. 中国海洋大学学报:自然科学版, 2017, 47(6): 53-60.] |
| [7] |
Teng S S, Li Q, Li J R. Cytological observations of nuclear behavior and comparative growth of the hybrids between Crassostrea gigas and C. sikamea[J]. Oceanologia et Limnologia Sinica, 2010, 41(6): 914-922. [腾爽爽, 李琪, 李金蓉. 长牡蛎(Crassostrea gigas)与熊本牡蛎(C. sikamea)杂交的受精细胞学观察及子一代的生长比较[J]. 海洋与湖沼, 2010, 41(6): 914-922.] |
| [8] |
Allen S K Jr, Downing S L. Performance of triploid Pacific oyster, Crassostrea gigas (Thunberg). Ⅰ. Survival, growth, glycogen content, and sexual maturation in yearlings[J]. Journal of Experimental Marine Biology and Ecology, 1986, 102(2-3): 197-208. DOI:10.1016/0022-0981(86)90176-0 |
| [9] |
Allen S K Jr, Downing S L. Performance of triploid Pacific oyster, Crassostrea gigas:gametogenesis[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1990, 47(6): 1213-1222. DOI:10.1139/f90-141 |
| [10] |
Allen S K Jr, Bushek D. Large-scale production of triploid oysters, Crassostrea virginica (Gmelin), using "stripped gametes"[J]. Aquaculture, 1992, 103(3-4): 241-251. DOI:10.1016/0044-8486(92)90170-P |
| [11] |
Mondol M R, Kim C W, Kang C K, et al. Growth and reproduction of early grow-out hardened juvenile Pacific oyster, Crassosstrea giga in Gamakman Bay, off the south coast of Korea[J]. Aquaculture, 2016, 463: 224-233. |
| [12] |
Zhang Y H, Li J, Qin Y P, et al. A comparative study of the survival, growth and gonad development of the diploid and triploid Hong Kong oyster, Crossostrea hongkongensis (Lam & Morton 2003)[J]. Aquaculture Research, 2017, 48(5): 2453-2462. DOI:10.1111/are.2017.48.issue-5 |
| [13] |
Que H, Allen S K Jr. Hybridization of tetraploid and diploid Crassostrea gigas (Thunberg) with diploid C. ariakensis (Fujita)[J]. Journal of Shellfish Research, 2002, 21(1): 137-143. |
| [14] |
Kong J, Wang Z P, Liu J, et al. Heterosis and triploid advantage between Chinese and American populations of Pacific oysters (Crassostrea gigas)[J]. Journal of Fisheries of China, 2011, 35(5): 675-681. [孔静, 王昭萍, 刘剑, 等. 长牡蛎中国群体和美国群体杂交效应与三倍体的优势[J]. 水产学报, 2011, 35(5): 675-681.] |
| [15] |
Zhang Y H, Li J, Zhang Y, et al. Performance evaluation of reciprocal hybrids derived from the two brackish oysters, Crassostrea hongkongensis and Crassostrea sikamea in southern China[J]. Aquaculture, 2017, 473: 310-316. DOI:10.1016/j.aquaculture.2017.02.031 |
| [16] |
Callam B R, Allen S K Jr, Frank-Lawale A. Genetic and environmental influence on triploid Crassostrea virginica grown in Chesapeake Bay:Growth[J]. Aquaculture, 2016, 452: 97-106. DOI:10.1016/j.aquaculture.2015.10.027 |
| [17] |
Gaffney P M, Allen S K Jr. Hybridization among Crassostrea species:a review[J]. Aquaculture, 1993, 116(1): 1-13. DOI:10.1016/0044-8486(93)90217-M |
| [18] |
Wang X L, Li Q, Kong L F, et al. Comparison of growth and survival of the hybrid and inbred families in the golden shell color strain of Pacific oyster (Crassostrea gigas)[J]. Journal of Fishery Sciences of China, 2016, 23(6): 1358-1367. [王雪磊, 李琪, 孔令锋, 等. 壳金长牡蛎自交和杂交家系生长与存活比较[J]. 中国水产科学, 2016, 23(6): 1358-1367.] |
| [19] |
Guan J L, Zhang Y H, Su J Q, et al. Heterosis in early growth stage of Hong Kong oyster Crassostrea hongkongensis hybridids from two geographical populations[J]. Oceanologia et Limnologia Sinica, 2016, 47(1): 182-187. [官俊良, 张跃环, 苏家齐, 等. 两个地理群体香港牡蛎(Crassostrea hongkongensis)杂交子代早期生长发育的杂种优势研究[J]. 海洋与湖沼, 2016, 47(1): 182-187.] |
| [20] |
Yu Y, Li Q, Yu H, et al. Heterosis of hybrid between Chinese and Japanese populations of the Pacific oyster (Crassostrea gigas)[J]. Periodical of Ocean University of China, 2016, 46(2): 35-41. [余勇, 李琪, 于红, 等. 长牡蛎中国群体和日本群体杂交子代的杂种优势分析[J]. 中国海洋大学学报(自然科学版), 2016, 46(2): 35-41.] |
| [21] |
Wang W J, Li Q, Yang J M, et al. Analysis of growth trait of Pacific oyster Crassostrea gigas using complete diallel cross from three selective breeding strains[J]. Oceanologia et Limnologia Sinica, 2015, 46(3): 628-635. [王卫军, 李琪, 杨建敏, 等. 长牡蛎(Crassostrea gigas)三个选育群体完全双列杂交后代生长性状分析[J]. 海洋与湖沼, 2015, 46(3): 628-635.] |
| [22] |
Cruz P, Ibarra A M. Larval growth and survival of two catarina scallop (Argopecten circularis, Sowerby, 1835) populations and their reciprocal crosses[J]. Journal of Experimental Marine Biology and Ecology, 1997, 212(1): 95-110. DOI:10.1016/S0022-0981(96)02742-6 |
| [23] |
Manzi J J, Hadley N H, Dillon R T Jr. Hard clam, Mercenaria mercenaria, brood stocks:growth of selected hatchery stocks and their reciprocal crosses[J]. Aquaculture, 1991, 94(1): 17-26. DOI:10.1016/0044-8486(91)90125-Q |
| [24] |
Song S L, Li Q, Kong L F. Larval growth and survival of hybrid between different geographic populations of Pacific oyster Crassostrea gigas[J]. Periodical of Ocean University of China, 2011, 41(12): 30-35. [宋盛亮, 李琪, 孔令锋. 不同地理群体长牡蛎杂交子代的早期生长发育[J]. 中国海洋大学学报, 2011, 41(12): 30-35.] |
| [25] |
Stanley J G, Allen S K Jr, Hidu H. Polyploidy induced in the American oyster, Crassostrea virginica, with cytochalasin B[J]. Aquaculture, 1981, 23(1-4): 1-10. DOI:10.1016/0044-8486(81)90002-8 |
| [26] |
Guo X, Allen S K Jr. Reproductive potential and genetics of triploid Pacific oyster, Crassostrea gigas (Thunberg)[J]. The Biological Bulletin, 1994, 187(3): 309-318. DOI:10.2307/1542288 |
| [27] |
Piferrer F, Beaumont A, Falguière J C, et al. Polyploid fish and shellfish:Production, biology and applications to aquaculture for performance improvement and genetic containment[J]. Aquaculture, 2009, 293(3-4): 125-156. DOI:10.1016/j.aquaculture.2009.04.036 |
| [28] |
Guo X M, DeBrosse G A, Allen S K Jr. All-triploid Pacific oyster (Crassostrea gigas Thunberg) produced by mating tetraploids and diploids[J]. Aquaculture, 1996, 142(3-4): 149-161. DOI:10.1016/0044-8486(95)01243-5 |
 2019, Vol. 26
2019, Vol. 26

