2. 四川农业大学动物科技学院, 四川 温江 611130;
3. 雅砻江流域水电开发有限公司, 四川 西昌 615000
2. College of Animal Science and Technology, Sichuan Agricultural University, Wenjiang, Sichuan 611130, China;
3. Yalong River Hydropower Development Company, LTD, Xichang, Sichuan 615000, China
鲤春病毒血症病毒(spring viremia of carp virus, SVCV)属弹状病毒科(Rhabdoviridae), 为单链RNA病毒。它可引起鲤科鱼类大规模爆发鲤春病毒血症(spring viremia of carp, SVC), 尤其是在春季水温10~17℃时流行[1]。目前, 在欧洲、亚洲及北美等地区已有SVCV感染鲤(Cyprinus carpio)[1]、草鱼(Ctenopharyngodon idella)[2]、丁鱥(Tinca tinca)[3]、鳙(Aristichthys nobilis)[4]、鲫(Carassius auratus)[4]、鲢(Hypophthalmichthys molitrix)[5]、锦鲤(Cyprinus carpio Koi)[6]和雅罗鱼(Leuciscus idus)[7]等的报道, 感染鱼主要表现为体表及内脏器官出血等症状, 且一旦发病能引起较高的死亡率。世界动物卫生组织(OIE)将SVC列为必报的重要疫病[8], 中国农业农村部也将其列为一类动物疫病。自1971年Fijian等[1]首次分离出SVCV以来, 国内外学者相继在该病毒的检测技术、基因分型、免疫防治及病毒感染引起宿主的相关免疫调节等方面展开了研究, 这有助于对疾病的准确诊断及有效防控。
鲈鲤(Percocypris pingi)属鲤形目(Cypriniformes), 鲤科(Cyprinidae), 鲈鲤属, 主要分布于四川岷江、雅砻江、青衣江、金沙江下段等长江上游支流, 其肉质鲜嫩, 有很高的营养价值和药用价值, 是产区重要经济鱼类。由于过度捕捞、水环境变迁, 目前野生鲈鲤数量急剧减少, 被列为长江一级急切保护动物[9]。近年来, 中国鲈鲤人工养殖逐步兴起, 在产生经济效益的同时也增加了疾病发生的风险。目前, 已有对鲈鲤细菌病[10]、真菌病与寄生虫病[11]的报道, 但病毒病却未见报道。2016年4月, 四川某养殖场鲈鲤流行一种临床特征为全身多器官出血的传染病, 累计死亡率达35%以上, 给养殖户造成严重的损失。为明确病因, 本研究从自然发病鲈鲤体内分离病原, 并进行组织病理学观察, 人工感染试验和半巢式RT-PCR检测, 同时基于糖蛋白基因构建系统发育树确定其基因型, 旨在为该病的正确诊断及有效防治提供参考。
1 材料与方法 1.1 试验鱼患病鲈鲤, 体重566.7~1150.4 g, 由四川某鲈鲤养殖场送检。健康鲈鲤, 体重(124.6±12.5) g, 购于四川雅安某鲈鲤养殖场。
1.2 主要试剂鲤上皮瘤细胞(EPC)由本实验室保存; 胎牛血清(FBS)(Gibco公司); M199培养基(北京索莱宝科技有限公司); 胰酶(Hyclone公司); PrimeScript 1st Strand cDNA Synthesis Kit反转录试剂盒, RNAiso(宝生物工程有限公司); PCR Master Mix(Invitrogen公司), DL2000 DNA Marker(成都百奥诺维生物科技有限公司)。
1.3 临床症状与组织病理学观察对患病鲈鲤体表和内脏进行观察; 同时取肌肉、鳃、肠、脑、肾、脾和肝等组织于10%中性福尔马林中固定, 酒精梯度脱水, 二甲苯透明, 石蜡包埋, 常规切片, HE染色, 中性树胶封片, 光学显微镜下观察并照相记录。
1.4 病毒分离培养取濒死鲈鲤脾、肾组织, 加入M199培养液按1 ː 10比例匀浆成组织悬液, 4℃ 12000 r/min离心20 min, 上清液经0.22 µm滤膜过滤后接种于EPC细胞, 16℃吸附1 h, 吸弃组织过滤除菌液, 然后加入M199维持液(含2%FBS和100 IU/mL双抗)于16℃培养; 设正常细胞为对照组。每日观察细胞生长状况, 待有70%~80%细胞出现CPE后, 收获病毒液再接种EPC细胞, 至盲传3代后能稳定观察到CPE, 将收获的病毒液于–80℃保存, 并按Reed-Muench法[12]计算病毒滴度(TCID50)。
1.5 人工感染试验将健康鲈鲤分为3组, 每组10尾, 于水温(16.0±1.5)℃中暂养7 d后进行人工感染试验。试验A组每尾鱼腹腔注射0.2 mL组织过滤除菌液; 试验B组每尾鱼腹腔注射0.2 mL细胞培养病毒液; 对照组腹腔注射等量的灭菌生理盐水, 连续观察28 d并统计死亡率。
1.6 电子显微镜观察细胞出现CPE后吸出维持液, 加入25 mL/L戊二醛固定, 3000 r/min离心20 min, 收集细胞沉淀。细胞沉淀经PBS漂洗后, 按常规方法进行1%锇酸再固定、乙醇梯度脱水、环氧树脂包埋, 超薄切片, 醋酸双氧铀及柠檬酸铅染色, 使用透射电子显微镜进行观察, 并拍照记录。
1.7 糖蛋白基因扩增及序列分析按照RNAiso说明书的步骤对有明显临床症状的自然发病鱼、人工感染发病鱼内脏组织和细胞培养病毒液进行总RNA的提取, 然后按照PrimeScript 1st Strand cDNA Synthesis Kit产品说明书以总RNA为模板合成cDNA。参考OIE推荐的半巢式PCR法[13], 合成两对引物(表 1)扩增SVCV糖蛋白基因, F1/R2扩增该基因中的714 bp片段, F1/R4则从该片段中再扩增606 bp片段, 引物由上海生物工程有限公司合成。PCR反应体系为25 μL: cDNA 2 μL, Mix-reaction buffer 12.5 μL, 上下游引物各1 μL, ddH2O 8.5 μL, PCR反应条件参照OIE诊断手册[13]。1%琼脂糖凝胶电泳检测PCR扩增产物大小, 产物纯化后送上海生物工程有限公司测序, 将测序结果上传NCBI与GenBank中已知核酸序列进行Blast比对, 获得的序列采用DNAstar进行多序列比对分析, 并用MEGA6.0构建系统发育进化树。
|
|
表 1 SVCV PCR检测所用引物 Tab.1 PCR primers used for SVCV identification |
疫情发生水温15~17.2℃, 病鱼体色变浅, 离群独游, 食欲减退, 甚至停止摄食, 鳍条基本与腹部充血、出血, 累计死亡率达35%以上。剖检
见病鱼腹腔内有一定量淡黄色或含血腹水, 肝发黄, 弥散性出血, 质地变脆; 脾肿大、出血, 呈紫黑色; 肾肿大、出血; 肠腔内无食物, 有一定量黏液(图 1A); 鳃丝苍白, 点状出血(图 1B); 鱼鳔壁点状血点(图 1C)。

|
图 1 感染鲤春病毒血症病毒鲈鲤的临床病变 A.肝、脾、肾肿大, 出血; B.鳃丝苍白, 出血; C.鱼鳔壁点状出血. Fig.1 Clinical signs of Percocypris pingis infected by spring viremia of carp virus A. Liver, spleen, kidney enlargement and haemorrhage; B. Gills pale and hemorrhage; C. Petechial hemorrhages in the wall of the swim bladder. |
组织病理学观察发现病鱼肝窦充血, 肝细胞肿胀, 空泡变性和脂肪变性(图 2A), 多灶性坏死, 肝细胞核固缩, 溶解(图 2B)。脾脏充血、出血, 脾髓内淋巴细胞坏死, 数量减少, 巨噬细胞和网状内皮组织增生(图 2C)。肾小管上皮细胞空泡变性、坏死, 管腔内见均质红染的蛋白或脱落的上皮细胞形成的管型, 肾间造血组织坏死, 炎症细胞浸润(图 2D)。肠绒毛断裂, 上皮细胞坏死、脱落, 固有膜及黏膜下层炎性细胞浸润(图 2E)。鳃小片毛细血管淤血、出血, 上皮细胞增生, 使邻近的鳃小片融合, 部分区域鳃小片上皮细胞坏死, 脱落(图 2F)。骨骼肌纤维肿胀, 横纹肌消失, 染色不均匀, 甚至断裂, 坏死溶解(图 2G)。脑血管充血, 基质疏松, 神经元细胞肿胀, 出现卫星现象(图 2H)。
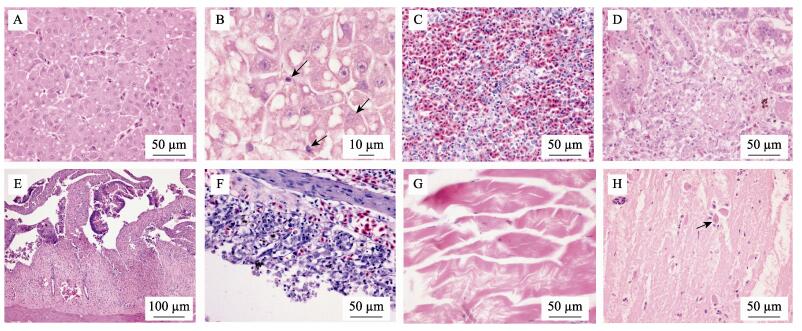
|
图 2 感染鲤春病毒血症病毒鲈鲤的组织病理学损伤 A.肝淤血, 肝细胞空泡变性和脂肪变性; B.肝细胞核固缩, 核溶解(箭头); C.脾出血, 网状细胞增生, 淋巴细胞数量减少; D.肾小管上皮细胞变性、坏死, 肾间造血组织坏死; E.肠黏膜上皮细胞坏死, 脱落; F.鳃小片上皮细胞增生, 坏死; G.肌纤维肿胀, 断裂, 溶解; H.脑神经元细胞肿胀, 出现卫星现象(箭头). Fig.2 Pathohistological lesions of Percocypris pingi infected by spring viremia of carp virus A. Hepatic congestion, vacuolar degeneration and fatty degeneration of hepatocytes; B. Hepatocytes karyopyknosis and karyolysis (arrows); C. Splenic congestion, proliferation of reticular cells and lymphocytes reduction; D. Degeneration and necrosis of the renal tubular epithelia, and interrenal hematopoietic necrosis; E. Intestinal epithelial cells necrosis and fall off; F. Branchial epithelial cells proliferation and necrosis; G. Skeletal muscle fibres swelling, fracture and dissolution; H. Neuronal cell swelling and satellite phenomenon (arrow). |
病鱼组织过滤除菌液接种EPC细胞后, 第3天开始出现CPE (图 3A)。盲传3代后能稳定观察到典型的CPE, 细胞脱落, 呈破鱼网状。而对照组细胞生长状态良好(图 3B)。分离的病毒能在EPC细胞中稳定增值, 按Reed-Muench法测定其病毒滴度为107.24TCID50/mL。
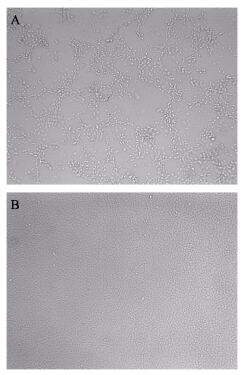
|
图 3 从自然发病的鲈鲤体内分离的病毒株ZLP160415感染EPC细胞的细胞病变 A.病毒株感染出现CPE的细胞形态; B.对照组正常细胞形态. Fig.3 The cytopathic effect (CPE) of the EPC cell monolayers infected by ZLP160415 from naturally diseased Percocypris pingi A. The cell morphology of CPE; B. Normal cell morphology of the control group. |
接种感染7 d后鲈鲤开始出现游动缓慢无力, 食欲减弱等症状, 感染后第10天体色变浅, 体表与鳃点状出血并开始出现死亡。连续观察28 d后统计死亡率, 试验A组死亡6尾, 死亡率为60%; B组死亡5尾, 死亡率为50%, 对照组鱼未见异常。
2.4 电子显微镜观察结果将出现CPE的EPC细胞进行超薄电镜切片观察, 其中可见具有典型弹状的病毒粒子, 长90~ 150 nm, 宽40~60 nm (图 4)。
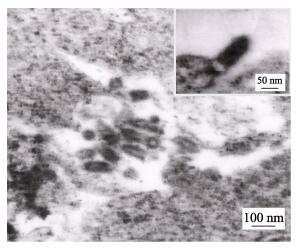
|
图 4 ZLP160415感染EPC细胞后电子显微镜下病毒形态 Fig.4 The viral morphology under electron micrograph after ZLP160415 infecting EPC |
自然发病鱼、人工感染发病鱼内脏组织和细胞培养病毒液分别用针对SVCV糖蛋白基因的2对引物进行半巢式RT-PCR扩增, 产物经1%琼脂糖凝胶电泳后发现分别扩增出约714 bp与606 bp的预期目的片段(图 5), 该结果显示自然发病鱼、人工感染发病鱼内脏组织和细胞培养病毒液均为SVCV阳性。
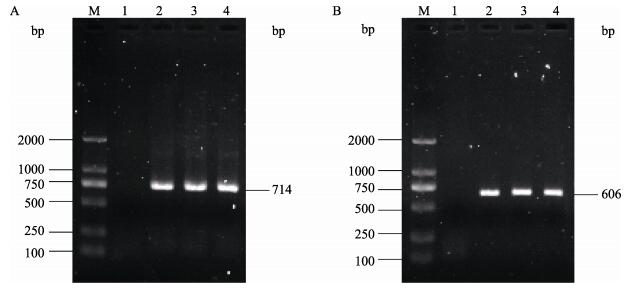
|
图 5 病毒糖蛋白基因的RT-PCR扩增产物电泳图 A.第一轮PCR产物(714 bp); B.第二轮PCR产物(606 bp). M: DNA分子质量标准; 1:阴性对照; 2:自然发病鱼; 3:人工感染发病鱼; 4:细胞培养病毒液. Fig.5 The electrophoresis of RT-PCR product of virus glycoprotein genes A. The first round PCR product (714 bp); B. The second round PCR product (606 bp). M: DL2000 DNA marker; 1: negative control; 2: the natural infected fish; 3: the artificially infected fish; 4: cell culture virus solution. |
第二轮PCR反应产物经上海生物工程有限公司测序后, 将测序结果提交NCBI获得GenBank登录号MG020142。Blast比对结果显示分离株ZLP160415与SVCV同源性最高, 达99%以上。在基于SVCV糖蛋白基因序列构建的系统发育树上(图 6), 分离株ZLP160415属于Ia基因型, 与中国其他SVCV分离株同源性最高。
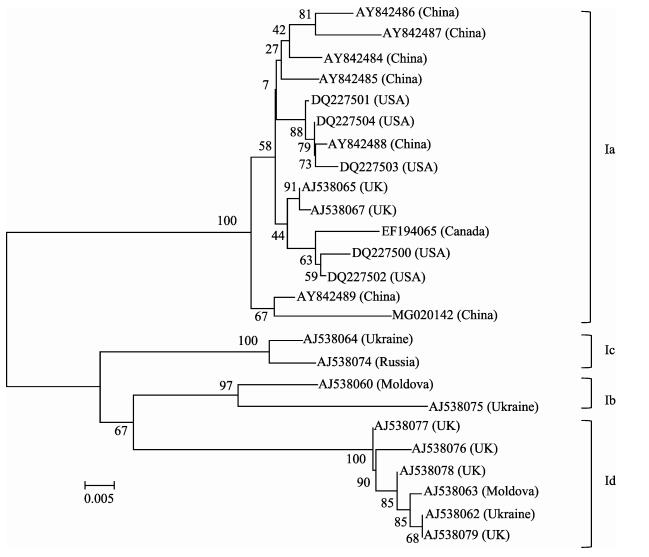
|
图 6 基于鲤春病毒血症病毒糖蛋白基因序列构建的系统发育树 Fig.6 The phylogenetic tree based on the G gene of spring viremia of carp virus sequence |
鲤春病毒血症是由鲤春病毒血症病毒引起的一种急性、出血性、高致死性传染病, 其宿主范围广, 能感染多种鲤科鱼类, 该病的流行和发生对水产养殖业特别是鲤养殖业构成严重威胁。中国于2001年在全国范围内开展SVCV监测工作, 在2003年, 从无临床症状的观赏鱼体内首次分离到SVCV[6], 在此之后陆续有SVCV感染的报道[2, 14]。本研究从以全身多器官出血为临床特征的自然发病鲈鲤体内分离到一株病毒(ZLP160415), 人工感染证实了其病原性, 进一步通过G基因序列分析确认其为SVCV, 该结果表明SVCV自然情况下可感染鲈鲤并致死, 因此, 在鲈鲤的养殖中对该病的危害应引起重视。
本研究中测定分离株病毒滴度为107.24 TCID50/mL, 与其他分离株病毒滴度相比[14]明显偏高, 说明该分离株ZLP160415具有较强的毒力, 人工感染鲈鲤致较高的死亡率也证实了这一点。其感染鲈鲤引起的临床症状和剖解病变与先前报道的胖头鱥(Pimephales promelas)等[15]感染SVCV相似, 均有内脏器官肿大、出血及腹水等现象, 其中鱼鳔出血和腹水具有代表性, 可作为临床上诊断该病的一个参考依据。组织病理学检查显示, SVCV感染鲈鲤可导致全身多组织器官的损伤, 尤其是肝、脾、肾、肠和鳃等组织损伤严重, 表现为明显的肝细胞脂肪变性及灶性坏死; 脾脏充血, 出血, 淋巴细胞数量减少, 内皮网状组织增多; 间质性肾炎; 坏死性肠炎和鳃丝血管充血, 出血, 鳃小片上皮增生与坏死; 非化脓性脑炎等病理损伤。这与SVCV感染斑马鱼[16]和罗非鱼[17]等表现的病理变化基本一致, 表明SVCV感染鲈鲤可引起多组织器官损伤与功能障碍, 从而致感染鱼的死亡。有报道显示SVCV感染鱼会表现出不同程度的肝血管周围炎, 导致血管壁坏死等现象[18], 但在本研究中并未发现, 这与鱼的种属特异性还是与分离株的生物学特性有关还有待进一步的研究。
SVCV毒株在遗传进化上大体可分为两个分支, 即亚洲分支和欧洲分支[7]; 而基于糖蛋白基因的核苷酸序列分析, SVCV毒株又可进一步分为Ia、Ib、Ic和Id型4个亚型。Ia型包含来自亚洲、美国、英国、加拿大的分离株, Ib和Ic包含来自欧洲东部的分离株, Id型包含来自英国和欧洲其他一些国家的分离株[19]。SVCV毒株遗传聚类与地理起源密切相关, 其中Ia型分布最广。本研究中, 基于糖蛋白基因的系统发育分析, 分离株ZLP160415属于Ia型, 且与中国分离株亲缘关系最近。有研究表明, SVCV感染成鱼的死亡率较低[20], 但在本次疫情中达到商品规格的鲈鲤感染后死亡率也达35%左右, 出现这种差异是因宿主种属差异, 还是毒株差异所致值得进一步探索。
目前控制该病最好的方法为疫苗免疫, 近年来, 一些新技术和新型疫苗, 如RNA干扰[21]、病毒样颗粒(VLPs)[22]和口服疫苗[23]等用于预防SVCV感染, 并取得了一定的应用效果, 这为SVCV的预防提供了新的策略与手段。有研究表明通过抗性育种选育对SVC有抵抗力的品种能防止SVCV的感染, 降低放养密度也能明显减少SVC的发病率[13, 18], 由此可见, 抗病育种以及饲养管理也应在SVCV控制中有重要作用。对于鲈鲤SVCV的防控除了加强饲养管理, 防止病原的传入之外, 也应开展针对性的免疫研究, 以切实提高鲈鲤SVCV的特异性防控水平, 降低SVCV对养殖鲈鲤的危害。
| [1] |
Fijan N, Petrinec Z, Sulimanovic D, et al. Isolation of the viral causative agent from the acute form of infectious dropsy of carp[J]. Veterinarski Arhiv, 1971, 41(5-6): 125-138. |
| [2] |
Shao L, Zhao J. Isolation of a highly pathogenic spring viraemia of carp virus strain from grass carp (Ctenopharyngodon idella) in late summer, China, 2016[J]. Virus Research, 2017, 238: 183-192. |
| [3] |
Ahne W. Vergleichende untersuchungen über die stabilit t von vier fischpathogenen viren (VHSV, PFR, SVCV, IPNV)[J]. Zoonoses and Public Health, 1982, 29(6): 457-476. |
| [4] |
Shchelkunov I S, Shchelkunova T I. Rhabdovirus carpio in herpivorous fishes: Isolation, pathology and comparative susceptibility of fishes[M]//Viruses of Lower Vertebrates. Heidelberg: Springer, 1989: 333-348.
|
| [5] |
Jorgensen P E V, Olesen N J, Ahne W, et al. SVCV and PFR viruses:serological examination of 22 isolates indicates close relationship between the two fish rhabdoviruses[M]. Heidelberg: Springer, 1989: 349-366.
|
| [6] |
Liu H, Gao L, Shi X, et al. Isolation of spring viraemia of carp virus (SVCV) from cultured koi (Cyprinus carpio koi) and common carp (C. carpio carpio) in P.R.China[J]. Bulletin European Association of Fish Pathologists, 2004, 24(4): 194-202. |
| [7] |
Stone D M, Ahne W, Denham K L, et al. Nucleotide sequence analysis of the glycoprotein gene of putative spring viraemia of carp virus and pike fry rhabdovirus isolates reveals four genogroups[J]. Diseases of Aquatic Organisms, 2003, 53(3): 203-210. |
| [8] |
Ashraf U, Lu Y, Lin L, et al. Spring viraemia of carp virus:recent advances[J]. Journal of General Virology, 2016, 97(5): 1037-1051. DOI:10.1099/jgv.0.000436 |
| [9] |
Liu J. A quantitative analysis on threat and priority of conservation order of the endemic fishes in upper reaches of the Yangtze River[J]. China Environmental Science, 2004, 24(4): 395-399. [刘军. 长江上游特有鱼类受威胁及优先保护顺序的定量分析[J]. 中国环境科学, 2004, 24(4): 395-399. DOI:10.3321/j.issn:1000-6923.2004.04.003] |
| [10] |
Ren S Y, Geng Y, Zhou Z Y, et al. Diagnosis and treatment of Aeromonas veronii disease in Percocypris pingi[J]. Scientific Fish Farming, 2012(11): 66. [任思宇, 耿毅, 周赵英, 等. 鲈鲤维氏气单胞菌病的诊治[J]. 科学养鱼, 2012(11): 66.] |
| [11] |
Geng Y, Chen D F, Peng C Z. Diagnosis and treatment of mixed infection of gill mildew and wheelworm of Percocypris pingi[J]. Scientific Fish Farming, 2006(3): 58. [耿毅, 陈德芳, 彭成卓. 鲈鲤鳃霉病与车轮虫混合感染的诊治[J]. 科学养鱼, 2006(3): 58.] |
| [12] |
Reed L J, Muench H. A simple method of estimating fifty per cent endpoints[J]. American Journal of Hygiene, 1938, 27(3): 493-497. |
| [13] |
OIE. Spring viraemia of carp[M/OL]//Manual of Diagnostic Tests for Aquatic Animals. http://www.oie.int/index.php?id=2439&L=0&htmfile=chapitre_svc.htm. 2016.
|
| [14] |
An W, Xiao Y, Zhang C W, et al. Preliminary isolation and identification of a spring viremia of carp virus[J]. Fisheries Science & Technology Information, 2014, 41(1): 32-34. [安伟, 肖雨, 张崇文, 等. 一株鲤春病毒血症病毒的初步分离及鉴定[J]. 水产科技情报, 2014, 41(1): 32-34.] |
| [15] |
Misk E, Garver K, Nagy E, et al. Pathogenesis of spring viremia of carp virus in emerald shiner Notropis atherinoides Rafinesque, fathead minnow Pimephales promelas Rafinesque and white sucker Catostomus commersonii (Lacepede)[J]. Journal of Fish Diseases, 2016, 39(6): 729-739. DOI:10.1111/jfd.12405 |
| [16] |
Sanders G E, Batts W N, Winton J R. Susceptibility of zebrafish (Danio rerio) to a model pathogen, spring viremia of carp virus[J]. Comparative Medicine, 2003, 53(5): 514-521. |
| [17] |
Soliman M K, Aboeisa M M, Mohamed S G, et al. First record of isolation and identification of spring viraemia of carp virus from Oreochromis niloticus in Egypt[C]//Proceedings of the Eighth International Symposium on Tilapia in Aquaculture, Cairo, Egypt, 2008: 1287-1306.
|
| [18] |
Woo P T K, Bruno D W. Viral, Bacterial and Fungal Infections[M]//Fish Diseases and Disorders (2nd edition). CABI, 2011:168-179.
|
| [19] |
Zhang N Z, Zhang L F, Jiang Y N, et al. Molecular analysis of spring viraemia of carp virus in China:a fatal aquatic viral disease that might spread in East Asian[J]. PLoS ONE, 2009, 4(7). |
| [20] |
Goodwin A E, Winton J R. Spring viremia of crap[J]. Diseases of Aquatic Organisms, 2003, 52(3): 261-272. |
| [21] |
Gotesman M, Soliman H, Besch R, et al. Inhibition of spring viraemia of carp virus replication in an Epithelioma papulosum cyprini cell line by RNAi[J]. Journal of Fish Diseases, 2015, 38(2): 197-207. DOI:10.1111/jfd.2015.38.issue-2 |
| [22] |
Cao Y C, Xue C Y, Liu D C. A virus like particles and vaccine against spring viremia of carp virus and its preparation method. CN104152418A[P]. 2014. [曹永长, 薛春宜, 刘大才.一种抗鲤春病毒血症病毒的病毒样颗粒和疫苗及其制备方法. CN104152418A[P]. 2014.]
|
| [23] |
Cui L C, Guan X T, Liu Z M, et al. Recombinant lactobacillus expressing G protein of spring viremia of carp virus (SVCV) combined with ORF81 protein of koi herpesvirus (KHV):A promising way to induce protective immunity against SVCV and KHV infection in cyprinid fish via oral vaccination[J]. Vaccine, 2015, 33(27): 3092-3099. DOI:10.1016/j.vaccine.2015.05.002 |
 2019, Vol. 26
2019, Vol. 26

