2. 中国科学院大学, 北京 100049;
3. 广西大学, 广西 南宁 530004
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Guangxi University, Nanning 530004, China
香港牡蛎(Crassostrea hongkongensis)是分布于我国华南地区的一种重要牡蛎品种, 2017年的养殖产量约为176万t, 约占全国牡蛎产量的37.5%, 是华南贝类养殖的支柱产业[1]。在香港牡蛎繁殖期内(5—9月), 随着性腺的发育, 二倍体生长减慢, 牡蛎体内糖原含量下降, 失去了鲜美的味道; 而繁殖期后, 牡蛎的软体部变得消瘦不堪, 含水量增加, 其品质受到很大影响[2]。研究开发品质稳定、四季鲜美的牡蛎养殖新品种, 已成为牡蛎养殖业者和消费者共同的需求。三倍体牡蛎性腺发育程度较低、生长速度更快、周年具有肥满的肉质和鲜美的口味, 这些性状弥补了二倍体牡蛎的不足[2]。因此, 三倍体牡蛎深受国内外重视青睐, 是牡蛎养殖业的一个优良养殖新品种。
1981年Stanley等[3]采用细胞松弛素B (CB)诱导得到美洲牡蛎(Crassostrea virginica)三倍体, 经过几十年的发展, 牡蛎三倍体已经成为牡蛎养殖业的一个优良品种。在太平洋牡蛎(Crassostrea gigas)中, 四倍体的诱导成功, 使规模化生产全三倍体成为可能[4]。要获得牡蛎四倍体, 首先要诱导得到牡蛎三倍体。诱导牡蛎三倍体的方法很多, 如静水压、高盐、低温等物理方法, CB、6-二甲基氨基嘌呤(6-DMAP)等化学方法以及四倍体与二倍体杂交的生物方法, 物理和化学方法主要是通过抑制受精卵第二极体的释放得到牡蛎三倍体[5-8]。CB诱导方法一直深受科学研究者们的青睐, 但是CB诱导方法有几个缺点。首先, CB具有毒性且废液较难处理, 会污染水质和环境[9]。其次, CB价格昂贵, 使用成本较高。最后, CB诱导三倍体会在一定程度上降低卵裂率及D形幼虫率[10-11]。寻找一种性价比高, 操作安全简便及诱导效率高的三倍体诱导方法一直是科研工作者的努力方向。物理诱导方法诱导出的三倍体无残留药物, 不会对消费者健康产生威胁, 所以具有一定的应用前景, 部分研究者通过低渗及热激方法诱导得到了倍化率较高的贝类三倍体[12-14], 但香港牡蛎是高温低盐种, 繁殖期水温一般为25~32℃, 盐度一般为10~30[15], 因此, 高盐及低温方法可能是两种较为合适的物理诱导方法。另据报道, 咖啡因诱导太平洋牡蛎三倍体的效果较好, 且对受精卵发育影响较小[13, 16]。本文就高盐、低温及咖啡因诱导香港牡蛎三倍体幼虫的效果进行了研究探索, 以期了解三种方法诱导香港牡蛎三倍体的优劣并寻求一种诱导香港牡蛎三倍体的优良方法。
1 材料和方法 1.1 亲贝暂养实验使用香港牡蛎二倍体亲本取自广西北海市竹林盐场, 在牡蛎繁殖期运输至中科院南海所湛江海洋经济动物实验站, 并在合适海水环境中(温度31℃, 盐度20)暂养2周左右, 每天投喂足量的角毛藻(Chaetoceros calcitrans)及球等鞭金藻(Isochrysis galbana), 以促进性腺达到Ⅳ期(成熟期)[15]。
1.2 亲贝解剖及受精挑选活力良好的亲贝, 人工解剖并镜检雌雄。显微镜下筛选出卵子没有缺刻、核内物质较丰富的雌性亲贝, 挤取卵子并用300目的筛绢网过滤掉组织, 以500目筛绢收集卵子并洗卵。在海水中浸泡卵子至生发泡破裂, 开始挤取激活精子, 用300目筛绢网过滤掉残余组织, 显微镜下挑选活力较好的一个个体的精子授精, 以保证受精及发育的同步性[3]。为了防止意外受精, 解剖过程中, 雌雄亲贝分开放置, 所有实验用器皿用淡水浸泡。并且在受精前, 镜检卵子是否意外受精[17-18]。浸泡卵子及受精发育过程在温度31℃, 盐度15的海水环境中进行, 在此条件下卵子浸泡至生发泡破裂开始受精, 受精后第一极体释放情况参照Qin等[19]的研究。
1.3 三倍体诱导 1.3.1 高盐诱导三倍体设置以下实验组确定高盐诱导香港牡蛎三倍体的最适诱导组合[7, 10, 12]。①盐度:先把一个雌贝的卵子密度调整为2.5× 107个/L, 分成5组(每组2 L), 在受精后15 min, 分别用盐度为35、40、45、50、55的海水处理受精卵15 min, 然后再把受精卵放在合适条件的海水中(温度31℃、盐度15)孵化。每组实验设置3个重复, 记录每组的卵裂率、D形幼虫发生率, 24 h后收集D型幼虫, 用流式细胞仪检测三倍体率, 确定最适诱导盐度。②持续时间:把另一个雌贝卵子密度调整为2.5×107个/L, 分成4组(每组2 L), 在受精后15 min, 分别用最适诱导盐度处理受精卵10 min、15 min、20 min、25 min, 然后再把受精卵放在合适的海水中孵化。测量分析数据, 确定最适持续时间。③卵子密度:卵子密度的设置要参考预实验及相关参考文献[12, 14, 20], 分别把第3个雌贝卵子密度调整为5.0×106个/L、1.0×107个/L、2.5×107个/L、5.0×107个/L及1.0×108个/L, 在受精后15 min, 分别用最适诱导盐度处理2L卵液最适持续时间, 然后再把受精卵放在合适的海水中孵化。测量分析数据, 确定诱导最适受精卵密度。④开始处理时间:把第4个雌贝卵子密度调整为最适, 分成4组(每组2 L), 分别在受精后12 min、15 min、18 min及21 min用最适盐度处理最适持续时间, 记录分析数据, 确定最适开始处理时间。每组实验设置3个重复组(相同父母本), 并设置二倍体对照组。
1.3.2 低温诱导香港牡蛎三倍体设置以下实验组确定低温诱导香港牡蛎三倍体的最适诱导组合[21-22]。①温度:先把一个雌贝的卵子密度调整为2.0×107个/L, 分成5组(每组2 L), 在受精后15 min, 分别用温度为8℃、10℃、12℃、14℃、16℃的海水处理受精卵15 min, 然后再把受精卵放在温度31℃、盐度15的海水中孵化。记录并比较数据, 确定最适温度。②持续时间:把第2个雌贝的卵子密度调整为2.0×107个/L, 分成4组(每组2 L), 在受精后15 min, 分别用最适温度处理受精卵10 min、15 min、20 min、25 min, 然后再把受精卵放在温度31℃、盐度15的海水中孵化。③卵子密度:卵子密度的设置要参考预实验及相关参考文献[20, 23], 把第3个雌贝的卵子密度分别调整为5.0×106个/L、1.0×107个/L、1.5×107个/L、2.0× 107个/L及4.0×107个/L, 在受精后15 min, 分别用最适温度处理2L卵液最适持续时间, 然后再把受精卵放在温度31℃、盐度15的海水中孵化。④开始处理时间:把第4个雌贝的卵子密度调整为最适, 分成4组(每组2 L), 分别在受精后12 min、15 min、18 min及21 min用最适温度处理最适持续时间, 记录数据[24]。每组实验重复3次(相同父母本), 并设置二倍体对照组。
1.3.3 咖啡因诱导香港牡蛎三倍体设置以下实验组确定咖啡因诱导香港牡蛎三倍体的最适诱导组合[13]。①浓度:先把第1个雌贝的卵子密度调整为4.0×107个/L, 分成5组(每组2 L), 在受精后15 min, 分别用咖啡因浓度为0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L的海水处理受精卵15 min, 然后再把受精卵放在温度31℃、盐度15的海水中孵化。记录并比较数据, 确定最适温度。②持续时间:把第2个雌贝的卵子密度调整为4.0× 107个/L, 分成4组(每组2 L), 在受精后15 min, 分别用最适浓度处理受精卵10 min、15 min、20 min、25 min, 然后再把受精卵放在温度31℃、盐度15的海水中孵化。③卵子密度:卵子密度的设置要参考预实验及相关参考文献[10, 13, 20], 把第3个雌贝的卵子密度分别调整为1.0×107个/L、2.0×107个/ L、4.0×107个/L、8.0×107个/L及1.0×108个/L, 在受精后15 min, 分别用最适浓度处理2 L卵液最适持续时间, 然后再把受精卵放在温度31℃、盐度15的海水中孵化。④开始处理时间:把第4个雌贝的卵子密度调整为最适, 分成4组(每组2 L), 分别在受精后12 min、15 min、18 min及21 min用最适浓度处理最适持续时间。每组实验重复3次(相同父母本), 并设置二倍体对照组。
1.4 卵裂率、D形幼虫发生率及三倍体率测量卵裂率为卵裂的受精卵数量占总受精卵数量的百分比; D形幼虫发生率为D形幼虫数量占总受精卵数量的百分比, 简称D幼率; 三倍体率为三倍体分裂相占总分裂相的百分比; 诱导效率指数为三倍体率与D形幼虫发生率的乘积。浮游幼虫期存活率为存活的浮游幼虫数量占第1天D形幼虫数量的百分比。三倍体率利用日本sysmex流式细胞仪CyFlow Ploidy Analyzer进行检测[19]。
1.5 数据分析利用SPSS18.0统计软件进行数据分析, 不同实验组间采用单因素方差分析(one-way ANOVA)分析方法, 用Turkey法进行比较分析, 显著性水平设为0.05, P < 0.05为差异显著。统计结果均以平均值±标准差(x±SD)表示。
2 结果与分析 2.1 高盐诱导香港牡蛎三倍体根据表 1, 高盐诱导香港牡蛎三倍体的最适条件组合是:密度为1.0×107个/L的卵子在受精后15 min后, 用盐度为40的海水持续处理10 min, 三倍体率可以达到(59.53±5.90)%, 诱导效率指数为0.187。
|
|
表 1 高盐诱导香港牡蛎三倍体的效果 Tab.1 Triploid induction by hyperosmotic shock in Crassostrea hongkongensis |
密度为2.0×107个/L的卵子在受精后15 min, 用10℃的海水持续处理10 min, 可以得到三倍体率为(51.09±2.67)%的群体, 诱导效率指数为0.065, 这是低温诱导香港牡蛎三倍体的最适条件组合(表 2)。
|
|
表 2 低温诱导香港牡蛎三倍体的效果 Tab.2 The effect of different temperatures on triploid induction of Crassostrea hongkongensis |
咖啡因诱导香港牡蛎三倍体的最适条件组合:受精卵密度为1.0×108个/L, 用咖啡因终浓度为2.0 g/L的海水在受精后15 min, 持续处理20 min, 三倍体率可以达到(56.36±2.07)%, 诱导效率指数为0.405(表 3)。
|
|
表 3 咖啡因诱导香港牡蛎三倍体的效果 Tab.3 The effect of caffeine on triploid induction of Crassostrea hongkongensis |
通过对3种诱导方法最适诱导条件的研究, 发现在最适诱导条件下, 高盐的卵裂率为(39.60± 2.14)%、D幼率为(31.46±1.06)%, 低温诱导方法卵裂率为(21.00±4.90)%、D形幼虫发生率为(12.68± 1.21)%, 明显小于咖啡因的卵裂率(85.46±4.78)%、D形幼虫发生率(71.79±3.92)% (表 1、表 2、表 3)。而且在浮游幼虫期, 高盐诱导方法诱导的幼虫存活率第13天仅有(32.72±2.59)%、三倍体率从第1天的(59.53±5.90)%降低至第13天的(24.10± 4.48)%, 低温诱导方法第13天幼虫存活率仅有(24.15±3.34)%, 三倍体率从(51.09±2.67)%降低至(20.26±1.91)%, 而咖啡因诱导方法第13天幼虫存活率仍高达(62.18±3.09)%, 三倍体率也仅仅从(56.36±2.07)%降低至(49.89±1.15)%, 说明咖啡因诱导方法诱导的幼虫浮游期三倍体率相对稳定且存活率高(图 1、图 2)。
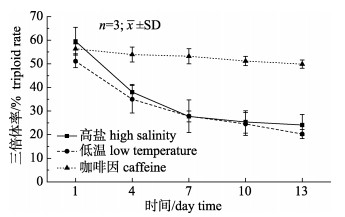
|
图 1 最佳诱导条件下, 三种香港牡蛎三倍体诱导方法诱导的幼虫三倍体率的变化 Fig.1 Variations of triploid rate of swimming larvae under the optimal induction conditions |
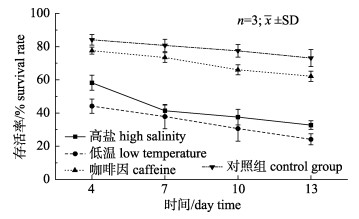
|
图 2 最佳诱导条件下, 三种香港牡蛎三倍体诱导方法诱导的幼虫存活率的变化 Fig.2 Under the optimal induction conditions, the variations of survival rate of planktonic larvae |
通过诱导效率指数更能直观地看出, 最适诱导条件下, 咖啡因诱导效率(0.405)要明显高于高盐(0.187)及低温(0.065)(表 1、表 2、表 3)。综上所述, 说明3种方法中咖啡因可能更适合用于香港牡蛎三倍体幼虫的诱导。
3 讨论 3.1 三种诱导方法原理分析高盐诱导牡蛎三倍体可能与受精卵能量代谢紊乱影响微管与微丝的形成有关[12]。低温休克诱导方法的机制是引起细胞内酶构型的改变, 不利于酶促反应的进行, 导致细胞分裂时形成纺锤丝所需的能量的ATP的供应途径受阻; 而咖啡因诱导方法则是在于提高细胞内的Ca2+浓度, 引起微管二聚体的解聚, 从而阻止细胞分裂, 形成三倍体[2, 13, 18-19]; 根据Komaru等[11]研究, 高盐及低温等物理诱导方法可能主要是阻止核分裂(染色体分离)形成三倍体, 而咖啡因诱导方法主要是阻止胞质分裂(第一极体形成)形成三倍体。根据实验结果, 发现高盐及低温诱导方法的卵裂率、D幼率极低, 而且浮游幼虫期幼虫的存活率降低快, 说明这两种方法对受精卵发育产生较大的影响, 大部分受精卵不能继续正常发育。而咖啡因诱导方法未发现对受精卵的发育有明显影响, 这和太平洋牡蛎三倍体诱导的研究结果类似[10, 12, 24]。
3.2 影响诱导三倍体率的因子分析表 1、表 2及表 3中在每选择完一个因子的最佳条件后三倍体率理论上应该逐步提高, 但是实际并没有。这和以前的研究结果相似, 不同研究者采用同样的方法对同一种牡蛎进行三倍体诱导的结果往往差异较大, 这是有多重原因造成的[10, 13, 18]。
第一, 使用的亲贝来源及配子质量不同对实验结果产生特别重大的影响[6, 25]。在牡蛎三倍体诱导中, 配子都是通过解剖性腺的方法获得, 解剖的雌性生殖细胞基本上还不具备受精能力, 只有在海水中浸泡至生发泡破裂才能使染色体处于第一次减数分裂的前期或中期, 成为具备受精能力的卵子。而不同来源及批次的卵子, 在不同的海水条件中浸泡(温度及盐度)至生发泡破裂所需时间差异很大, 导致卵子自身发育不同步[26]。通过解剖获得的精子, 虽已具备受精能力, 但是不同个体的精子活性不同, 会导致受精过程不同步, 进而导致受精卵发育的差异。所以不同个体的配子在相同的处理条件下, 卵裂率、D幼率及三倍体率有差异。本实验中不同组实验使用不同的亲贝必然导致三倍体率的差异较大, 故三倍体率没有逐步提高。为了减小同组实验的误差及提高解剖卵发育的同步性, 本研究中同一实验组使用相同的父母本, 且卵子在海水中浸泡至生发泡破裂[21]。相同来源的配子成熟度较为一致, 受精卵发育过程比较一致, 诱导三倍体率差异较小[7]。
第二, 诱导时的卵子密度也会对三倍体率产生影响[20]。例如, 咖啡因诱导方法在卵子密度为1.0×108个/L时, 三倍体率最高。而高于这个密度时, 三倍体率降低, 这可能是随着密度的增大受精卵自身的活性降低及每个受精卵受到的抑制力降低造成的[5, 20]。高盐诱导方法在卵子密度为1.0×107个/L及低温诱导方法在卵子密度为2.0× 107个/L时三倍体率最高。诱导处理时的受精卵密度不仅与三倍体率有关, 也与生产成本及三倍体产量相关, 直接关系到该方法的实用性。本研究中卵子密度的设置根据相关参考文献及预实验设置的[13, 18, 23, 25]。
第三, 香港牡蛎三倍体的诱导主要是通过抑制第二极体的释放, 需要观察第一极体释放的规律, 根据Qin等[19]香港牡蛎生发泡破裂时间及受精卵第一极体释放的时间受浸泡时海水温度、盐度及卵子成熟度等影响较大, 开始诱导时间过早会抑制住第一极体释放导致非整倍体比例增高, 过晚则抑制不住部分第二极体释放导致三倍体率降低[27]。因此, 在诱导香港牡蛎三倍体的过程中要准确掌握极体释放规律, 便于把握开始诱导时间及诱导持续时间。对于香港牡蛎卵子在温度31℃, 盐度15的海水环境中生发泡及第一极体释放情况, 已进行了研究[19], 最适开始诱导时间15 min也即是40%~50%第一极体释放的时间, 这和在其他牡蛎三倍体诱导中诱导时机相一致[10, 12]。本研究中的开始诱导时间及诱导持续时间是针对实验中的环境条件有意义, 如果更换实验条件, 还需要根据受精卵极体释放情况适当调整。
3.3 三种诱导方法效果的比较分析分析三倍体诱导方法的实用性, 不仅要考虑三倍体率, 还要综合考虑卵裂率、D幼率、浮游幼虫期三倍体率稳定性及幼虫存活率等因子。试剂浓度或处理强度、开始处理时间、处理持续时间及处理时受精卵密度会对三倍体率及存活率产生直接影响。首先, 三种方法主要是通过抑制香港牡蛎受精卵第二极体释放的方法诱导得到三倍体, 诱导剂或物理因素强度过大会导致幼虫死亡率过高, 过小又会导致三倍体率低[28]。第二, 诱导持续时间会直接影响幼虫孵化率及三倍体率, 在高盐和低温诱导方法中很明显, 随着诱导持续时间的增加, 幼虫卵裂率和D形幼虫发生率明显下降, 即增加诱导持续时间必然要以幼虫发育畸形率提高为代价。高盐及低温诱导方法的最适处理持续时间为10 min, 而咖啡因方法的最适处理持续时间则为20 min, 导致这种差异的原因可能是由于物理方法延长处理时间会引起部分受精卵发育停滞, 所以选择合适的诱导持续时间对于诱导香港牡蛎三倍体来说极其重要[29]。
根据实验结果发现, 最佳诱导条件下, 高盐及低温方法卵裂率、D幼率极低, 而且两种方法在浮游幼虫期幼虫存活率较低且三倍体率不稳定。说明咖啡因诱导方法的实用价值要大于高盐及低温方法(图 1、图 2), 咖啡因诱导方法更有可能应用于香港牡蛎三倍体生产。
根据前述研究, 发现相对于CB诱导方法, 6-DMAP方法更适合于香港牡蛎三倍体的诱导[9]。6-DMAP诱导方法在最佳诱导条件下, 三倍体率达62.52%~72.36%, 且诱导效率指数高达0.47~ 0.65, 远高于高盐的0.187及低温的0.065。参考上述结果, 发现化学诱导方法可能比物理诱导方法更适合用于香港牡蛎三倍体诱导。
| [1] |
Bureau of Fisheries, Ministry of Agriculture. China Fishery Statistical Yearbook[M]. Beijing: China Agriculture Press, 2016. [农业部渔业渔政管理局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2016.]
|
| [2] |
Wang Q Y. Cell engineering applied to breeding of aquaculture organisms in seawater[M]. Beijing: China Ocean Press, 2007: 187-222. [王清印. 海水养殖生物的细胞生物工程育种[M]. 北京: 海洋出版社, 2007: 187-222.]
|
| [3] |
Stanley J, Allen S K, Hidu H. Polyploidy induced in the American oyster, Crassostrea virginica, with cytochalasin B[J]. Aquaculture, 1981, 23(1-4): 1-10. DOI:10.1016/0044-8486(81)90002-8 |
| [4] |
Jeung H D, Keshavmurthy S, Lim H J, et al. Quantification of reproductive effort of the triploid Pacific oyster, Crassostrea gigas raised in intertidal rack and bag oyster culture system off the west coast of Korea during spawning season[J]. Aquaculture, 2016, 464: 374-380. DOI:10.1016/j.aquaculture.2016.07.010 |
| [5] |
Downing S L, Allen S K. Induced triploidy in the Pacific oyster, Crassostrea gigas: Optimal treatments with cytochalasin B depend on temperature[J]. Aquaculture, 1987, 61(1): 1-15. DOI:10.1016/0044-8486(87)90332-2 |
| [6] |
Desrosiers R R, Gerard A, Peignon J M, et al. A novel method to produce triploids in bivalve molluscs by the use of 6-dimethylaminopurine[J]. Journal of Experimental Marine Biology and Ecology, 1993, 170(1): 29-43. DOI:10.1016/0022-0981(93)90127-A |
| [7] |
Fong P P, Kyozuka K, Duncan J, et al. The effect of salinity and temperature on spawning and fertilization in the zebra mussel Dreissena polymorpha (Pallas) from North America[J]. Biological Bulletin, 1995, 189(3): 320-329. DOI:10.2307/1542149 |
| [8] |
Peachey B L, Allen S K. Evaluation of cytochalasin B and 6-dimethylaminopurine for tetraploidy induction in the Eastern oyster, Crassostrea virginica[J]. Aquaculture, 2016, 450: 199-205. DOI:10.1016/j.aquaculture.2015.07.034 |
| [9] |
Qin Y P, Zhang Y H, Zhou Y L, et al. Comparative studies on triploidy induction using CB and 6-DMAP in Crassostrea hongkongensis[J]. Journal of Fisheries of China, 2017, 41(2): 250-257. [秦艳平, 张跃环, 周颖力, 等. CB与6-DMAP诱导香港牡蛎三倍体的效果比较[J]. 水产学报, 2017, 41(2): 250-257.] |
| [10] |
Yu R H, Wang Z P, Wang R C, et al. Comparative studies on triploidy induction using three chemicals in Pacific oyster[J]. Journal of Ocean University of Qingdao, 2000, 30(4): 590-592. [于瑞海, 王昭萍, 王如才, 等. 三种化学诱导剂诱导太平洋牡蛎三倍体的比较研究[J]. 青岛海洋大学报, 2000, 30(4): 590-592.] |
| [11] |
Komaru A, Wada K T. Different processes of pronuclear events in pressure-treated and CB-treated zygotes at the second meiosis in scallop[J]. Nippon Suisan Gakkaishi, 1991, 57(7): 1219-1223. DOI:10.2331/suisan.57.1219 |
| [12] |
Kong J, Wang Z P, Yu R H, et al. Triploid induction in Pacific oyster (Crassostrea gigas) by hypotonic treatment and comparison with other induction methods[J]. Journal of Fishery Sciences of China, 2011, 18(3): 581-587. [孔静, 王昭萍, 于瑞海, 等. 低渗诱导太平洋牡蛎三倍体以及与其他诱导方法的比较[J]. 中国水产科学, 2011, 18(3): 581-587.] |
| [13] |
Yu R H, Wang Z P, Wang R C, et al. Induced triploid in pacific oyster using caffeine combined with thermal shock[J]. Journal of Ocean University of Qingdao, 2001, 31(4): 518-522. [于瑞海, 王昭萍, 王如才, 等. 利用咖啡因和热休克诱导太平洋牡蛎三倍体[J]. 青岛海洋大学学报, 2001, 31(4): 518-522. DOI:10.3969/j.issn.1672-5174.2001.04.025] |
| [14] |
Zhang Q Z, Qiu M Y, Wu X Z, et al. Heat pretreatment induces thermotolerance in the Jinjiang oyster[J]. Ecological Science, 2005, 24(1): 35-37. [张其中, 邱马银, 吴信忠, 等. 热休克诱导近江牡蛎对高温的耐受性[J]. 生态科学, 2005, 24(1): 35-37. DOI:10.3969/j.issn.1008-8873.2005.01.011] |
| [15] |
Qin Y P, Zhang Y H, Ma H T, et al. Comparison of the biochemical composition and nutritional quality between diploid and triploid Hong Kong oysters, Crassostrea hongkongensis[J]. Frontiers in Physiology, 2018, 9: 1674. DOI:10.3389/fphys.2018.01674 |
| [16] |
Lin Q, Wu J S, Zeng Z N, et al. Studies on induction of triploid and technology of culture in Crassostrea gigas[J]. Journal of Oceanography in Taiwan Strait, 2000, 19(4): 479-483. [林琪, 吴建绍, 曾志南, 等. 长牡蛎三倍体的诱导与培育[J]. 台湾海峡, 2000, 19(4): 479-483.] |
| [17] |
Zhang G F, Chang Y Q, Song J, et al. Comprehensive comparison between triploid oysters induced with CB and 6-DMAP[J]. Journal of Fisheries of China, 2000, 24(4): 325-328. [张国范, 常亚青, 宋坚, 等. 不同方法制备的三倍体长牡蛎养殖效果的比较[J]. 水产学报, 2000, 24(4): 325-328.] |
| [18] |
Zheng X D, Wang R C, Wang Z P, et al. Studies on karyotypes of diploid and triploid of Crassostrea gigas[J]. Journal of Fishery Sciences of China, 2000, 7(2): 96-97. [郑小东, 王如才, 王昭萍, 等. 太平洋牡蛎二倍体与三倍体的核型研究[J]. 中国水产科学, 2000, 7(2): 96-97. DOI:10.3321/j.issn:1005-8737.2000.02.022] |
| [19] |
Qin Y P, Xiao S, Ma H T, et al. Effects of salinity and temperature on the timing of germinal vesicle breakdown and polar body release in diploid and triploid Hong Kong oysters, Crassostrea hongkongensis, in relation to tetraploid induction[J]. Aquaculture Research, 2018, 49(11): 3647-3657. DOI:10.1111/are.2018.49.issue-11 |
| [20] |
Yu R H, Wang R C, Wang Z P, et al. A study on the effect of spawn density on triploid induction of Pacific oyster[J]. Transactions of Oceanology and Limnology, 2002(1): 57-60. [于瑞海, 王如才, 王昭萍, 等. 不同卵密度对太平洋牡蛎三倍体诱导效果影响的研究[J]. 海洋湖沼通报, 2002(1): 57-60. DOI:10.3969/j.issn.1003-6482.2002.01.008] |
| [21] |
Tan S H A, Teh C P, Chang G O, et al. Tetraploid induction in tropical oysters, Crassostrea belcheri (Sowerby) and Crassostrea iredalei (Faustino)[J]. Aquaculture Research, 2017, 48(4): 1406-1412. |
| [22] |
Yamamoto S, Sugawara Y, et al. Induced triploidy in the mussel, Mytilus edulis, by temperature shock[J]. Aquaculture, 1988, 72(1-2): 21-29. DOI:10.1016/0044-8486(88)90143-3 |
| [23] |
Allen S K, Bushek D. Large-scale production of triploid oyster, Crassostrea virginica (Gmelin), using "stripped" gametes[J]. Aquaculture, 1992, 103(3-4): 241-251. DOI:10.1016/0044-8486(92)90170-P |
| [24] |
Yang H P, Guo X M. Polyploid induction by heat shock-induced meiosis and mitosis inhibition in the dwarf surfclam, Mulinia lateralis Say[J]. Aquaculture, 2006, 252(2-4): 171-182. DOI:10.1016/j.aquaculture.2005.07.017 |
| [25] |
Yu R H, Wang Z P, Wang R C, et al. Comparison of economic efficiency of triploidy induction in Pacific oysters Crassostrea gigas by two methods[J]. Transactions of Oceanology and Limnology, 2003(1): 57-61. [于瑞海, 王昭萍, 王如才, 等. 两种方法诱导太平洋牡蛎三倍体在生产上的应用效果[J]. 海洋湖沼通报, 2003(1): 57-61. DOI:10.3969/j.issn.1003-6482.2003.01.009] |
| [26] |
Zhang Y H, Li J, Qin Y P, et al. A comparative study of the survival, growth and gonad development of the diploid and triploid Hong Kong oyster, Crassostrea hongkongensis (Lam & Morton 2003)[J]. Aquaculture Research, 2017, 48(5): 2453-2462. DOI:10.1111/are.2017.48.issue-5 |
| [27] |
Eudeline B, Allen S K, Guo X M, et al. Delayed meiosis and polar body release in eggs of triploid Pacific oysters, Crassostrea gigas, in relation to tetraploid production[J]. Journal of Experimental Marine Biology and Ecology, 2000, 248(2): 151-161. DOI:10.1016/S0022-0981(00)00158-1 |
| [28] |
Gerard A, Naciri Y, Peignon J M, et al. Optimization of triploid induction by the use of 6-DMAP for the oyster Crassostrea gigas (Thunberg)[J]. Aquaculture Research, 2012, 25(7): 709-719. |
| [29] |
Nell J A. Farming triploid oysters[J]. Aquaculture, 2002, 210(1-4): 69-88. DOI:10.1016/S0044-8486(01)00861-4 |
 2019, Vol. 26
2019, Vol. 26

