2. 广东海洋大学水产学院, 湛江市海洋生态与养殖环境重点实验室, 广东 湛江 524025
2. Key Laboratory of Marine Ecology and Aquaculture Environment of Zhanjiang; College of Fisheries, Guangdong Ocean University, Zhanjiang 524025, China
凡纳滨对虾(Litopenaeus vannamei)具有较高的经济价值和营养价值, 是世界三大养殖虾类中单产量最高的对虾品种, 也是中国农民增产、国家出口创汇的重要农产品, 其养殖产量占中国虾类养殖产量的80%左右[1]。对虾养殖业在市场的推动下迅速增长, 但同时世界范围内对虾养殖业面临着疾病暴发和高死亡率的威胁。由于水产养殖业的疾病暴发, 中国每年损失1000亿~2000亿元, 其中一半以上的疾病是由细菌感染引起的[2]。为了预防和控制疾病, 水产养殖中广泛使用抗生素, 因此水产品中抗生素的残留引发的食品安全问题也越来越受到关注[3], 抗生素在水产养殖中的应用以及养殖产品中抗生素的残留都有严格的规定[4]。最新研究发现, 天然的植物化合物在替代抗生素方面潜力巨大[5]。其中, 植物单宁是天然产物中研究得较早和较多的一类化合物, 大量研究表明, 单宁中的酚羟基能够与病菌中的酶相互作用, 从而对动物胃肠道微生物产生毒性。利用单宁替代抗生素具有一定的可行性。在单宁的研究领域中, 欧洲长期处于引领地位。欧盟已于2006年全面禁止抗生素在动物饲料中的使用, 用单宁取代之作为动物饲料的添加剂[6]。
单宁通常可分为2种类型, 即缩合单宁和水解单宁。水解单宁是没食子酸与葡萄糖氧化反应的产物[7], 其分子量在500~3000 Da之间[8], 生物活性较强, 具有抗菌、抗寄生虫、抗氧化、抗炎等特性[9], 在医药、化工、食品等领域应用广泛[10]。研究表明, 猪和兔的饲料中添加水解单宁的浓度低于0.5%、鸡饲料中的添加浓度低于0.2%时, 会对生长性能和肠道健康有促进作用。当水解单宁的添加量超过上述浓度时, 很可能会通过影响营养成分的消化和吸收而使生长性能降低[11-14]。目前, 水解单宁在鸡[15]、猪[16]、牛[17]等家禽家畜中的应用较为广泛, 在虾类中的应用尚未见报道。
本实验首次研究水解单宁对凡纳滨对虾生长性能及对其肠道菌群的影响, 综合探讨水产饲料中添加水解单宁的可行性及适宜的添加水平, 旨在为凡纳滨对虾免疫优化型饲料的研发以及水解单宁在水产饲料中的应用提供理论依据。
1 材料与方法 1.1 饲料制备根据凡纳滨对虾的营养需求, 设计了等氮等能的基础饲料, 水解单宁的添加量分别为0% (对照组, control)、0.1% (F1)、0.2% (F2)和0.3% (F3, 表 1)。本实验中所有的水解单宁由斯洛文尼亚Tanin公司提供, 其产品成分分析保证值为水解单宁含量≥65%。饲料制备好后放于通风处晾干, 置于4℃冰箱保存备用。
|
|
表 1 实验饲料组成与营养水平(干物质基础) Tab.1 Composition and nutrient levels of experimental diets (DM basis) |
试验在广东海洋大学东海岛实验基地湛江高新科技园进行。实验虾运输至基地, 放至已消毒的暂养池中暂养2周后, 选取出规格大小统一均匀、身体没有明显损伤、活力较好、平均体重为(7.31±0.44) g的个体作为实验用虾, 平均分为4组, 每组设3个重复, 实验虾于室外水泥池(池长4.9 m, 宽4.5 m, 高1.8 m, 平均水深1.0 m)中用基础饲料驯化7 d后, 采用定量投喂, 初期、后期投喂量分别是体质量的8%和6%[18]。每天投喂4次, 分别在6:00、10:00、18:00和22:00进行。每周根据对虾生长状况相应调节投饲量。养殖周期为60 d, 养殖期间水温为27~29℃, pH为8.0±0.2, 24 h持续充氧, 保持溶氧在6 mg/L以上。
1.3 样品采集养殖实验结束前24 h停止投喂, 每组养殖池中随机取出10尾凡纳滨对虾测量体重、体长等数据。另去壳取其肝胰腺并称重, 用于形体指数计算。肠道微生物的收集参考尚碧娇等[19]的方法进行。
1.4 对虾生长性能分析生长结果计算:
增重率(weight gain rate, WGR, %)=(Wt–W0)/ W0×100%;
特定生长率(specific growth rate, SGR, %/d)= (In Wt–In W0)/t ×100%;
肝体比(hepatosomatic indices, HSI, %)=Wh/Wt×100;
肥满度(condition factor, CF, g/cm3)=Wt/L3×100;
成活率(survival rate, SR, %)=(实验结束时尾数/初始尾数)×100。
式中, W0表示实验鱼体的初始体重(g), Wt表示实验鱼的终末体重(g); t为实验天数(d); Wh为肝脏湿重(g); L表示体长(cm)。
1.5 肠道微生物基因组DNA提取及测序肠道微生物基因组DNA的提取采用天根生化科技(北京)有限公司的海洋动物组织基因组DNA提取试剂盒进行。提取完成后, 将每组中3个重复的提取产物混为一个样品, 按指定测序区域, 合成特异引物进行PCR扩增, 正向引物338F: 5′−ACTCCTACGGGAGGCAGCAG−3′, 反向引物806F: 5′−GGACTACHVGGGTWTCTAAT−3′。PCR产物经回收后, 委托上海美吉生物医药科技有限公司利用Illumina MiSeq平台进行16S rDNA基因V3~V4区高通量测序。
肠道菌群生物信息学分析:测序得到的原始数据经质控和过滤后, 得到高质量的优化数据。然后对优化数据进行OTUs (operational taxonomic units)聚类, 用Usearch软件平台(vsesion 7.0, http://drive5.com/uparse/)对所有样品的优化序列聚类, 默认以97%的相似水平将序列聚类成为OTUs, 利用RDPClassifier贝叶斯算法(http://sourceforge.net/projects/rdp-classifier/)[20]与GreenGene数据库(http://greengenes.lbl.gov/cgi-bin/ nph-index.cgi)[21]进行物种注释分析, 再对OTUs进行丰度、多样性指数等分析, 同时对物种注释在各个分类水平上进行群落结构的统计分析。
2 结果与分析 2.1 生长性能饲料中添加水解单宁对凡纳滨对虾生长性能的影响见表 2。3个水解单宁添加组的增重率、特定生长率、肥满度和存活率与对照组相比均显著升高(P < 0.05), 肝体比均显著降低(P < 0.05)。
|
|
表 2 复合单宁对凡纳滨对虾生长性能的影响 Tab.2 Effects of hydrolyzable tannins on growth performance of Litopenaeus vannamei |
对MiSeq测序原始数据处理后, 4组样品共产生206192条优化序列, 分别为54750 (control)、42315 (F1)、53141 (F2)和55986 (F3), 对数据进行均一化处理后, 4组样品总序列均值为40280。各样品中产生的OTU数目范围在284~351之间, 一共有543个(表 3)。OUT序列分析结果表明, 这些分类单元主要属于24个细菌门, 47个纲, 97个目, 190个科和334个属, 另外, 还有一些OUT在分类上属于未鉴定(unclassified)序列。除了F2以外, F1和F3的OUT数目均高于对照组。通常用Ace和Chao指数来度量样品菌群丰度(community richness), Shannon和Simpson指数来度量菌群多样性(community diversity)[22]。3个实验组的Shannon多样性指数均低于对照组, 而Chao指数实验组均高于对照组, 说明水解单宁的添加可能降低了菌群的多样性, 但是使群落的丰度增加。等级丰度曲线结果显示, F3组的物种丰度最高, F2的物种丰度最低(图 1)。对照组的物种均匀度最低, 但丰度高于F2组, 总体而言, 除F2组外, 实验组的物种丰度和均匀度均高于对照组。
|
|
表 3 各组样品的菌群多样性 Tab.3 The bacterial diversity of samples from different groups |
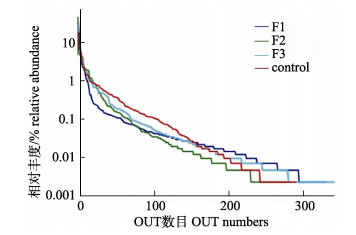
|
图 1 各组样品的等级丰度曲线 Fig.1 The Rank-Abundance curves of 4 samples |
将每个OTU中丰度最高的序列作为代表序列, 进行物种注释分析。各组样品在门水平上的分类学分析显示(将相对丰度小于1%的部分合并为others), 水解单宁的添加使菌群优势门丰度发生了明显改变, 对照组肠道主要菌群为变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes), 试验组中肠道主要菌群为变形菌门、软壁菌门(Tenericutes)、放线菌门、厚壁菌门(Firmicutes)和拟杆菌门(图 2)。试验组与对照组相比, 蓝细菌门、放线菌门和拟杆菌门的比例降低, 变形菌门、软壁菌门和厚壁菌门比例增加, 其中F2组变形菌门比例由对照组的38.76%增加到78.39%, F1组软壁菌门比重由0.61%增加到29.29%, 其中蓝细菌门比例在试验组中含量皆低于1% (表 4)。
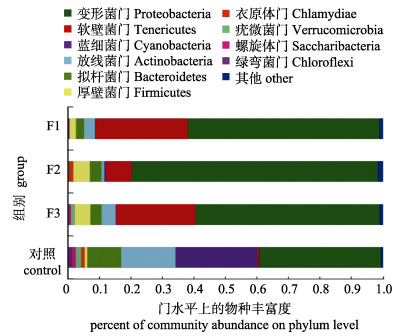
|
图 2 各组样品在门水平上的物种丰度 Fig.2 Community abundance of samples from different groups on phylum level |
|
|
表 4 各组样品前10个优势细菌门的相对丰度 Tab.4 Community abundance of top 10 bacteria on phylum level |
从样本聚类和物种聚类两个层面对属水平上丰度排名前20的物种进行分析。聚类分析热图结果显示, 从样本聚类来说, F1组和F3组聚为一支, 再和F2组聚为一支, 对照组单独聚为一支。对照组中微生物比例较大的是蓝细菌属(Cyanobacteria)和鲁杰氏细菌属(Ruegeria), 而实验组中比例较大的是发光杆菌属(Photobacterium)、Candidatus bacilloplasma、假单胞菌属(Pseudomonas) (图 3)。
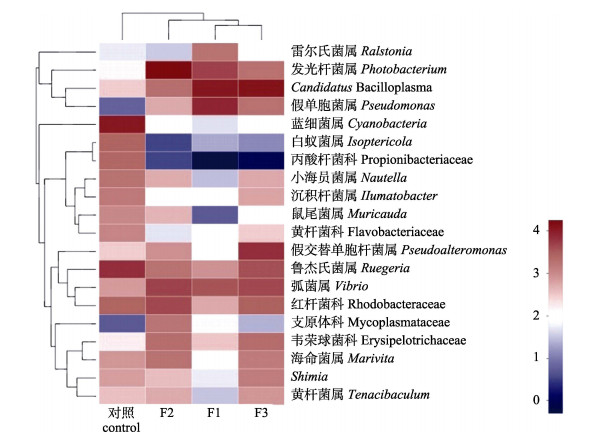
|
图 3 属水平上各样本的物种丰度聚类热图 颜色强度指示了OTU的相对丰富程度 Fig.3 Cluster analysis of community abundance of samples from different groups on the genus level. Color intensity indicates the relative enrichment of OTUs. |
PCoA主成分分析可以用于比较试验样本菌落结构的相似性和差异性, 样本的物种组成越相似, 在PCoA图中的距离越近。对4个样本进行属水平上的PCoA分析发现, F1组与F3组距离较近, 微生物群落组成相似度较高, 与F2组距离较远, 说明F1和F3组的微生物群落组成与F2组相差较大, 而对照组与F1组、F2和F3组的距离均较远, 且F1、F3组与对照组的距离比F2与对照组的距离要近(图 4)。以Weighted Unifrac距离算法对样本距离矩阵进行UPGMA聚类分析, 构建样本层次聚类树, 发现F1与F3组聚为一支, 再与F2聚为一支(图 5), 与PCoA主成分分析的结果一致。
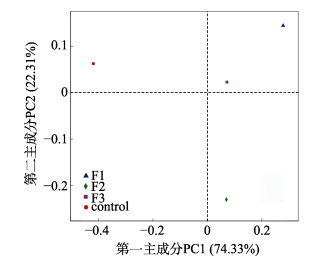
|
图 4 各组亚基于属水平的PCoA分析 Fig.4 PCoA analysis based on genus level |

|
图 5 各组样品基于Unweighted Unifrac算法的UPGMA聚类树 Fig.5 UPGMA clustering tree of samples from different groups based on Unweighted Unifrac algorithm |
单宁广泛存在于大多数植物中, 这类多酚化合物可以与动物机体肠道微生物以及微生物分泌的酶、肠道内源蛋白等结合, 具有抗氧化和抗菌的积极作用, 同时, 也会由于摄入量和生物利用度不同而具有抗营养或毒性作用。最新的研究结果表明, 低浓度的单宁可以改善鸡、兔和猪的健康状况、营养消化和生长性能[23-27]。当水解单宁的添加浓度为0.5%时, 可显著提高肉鸡的生长性能[27]; 当添加浓度为1%时, 可降低肉鸡的体重和摄食量[15], 说明水解单宁具有一定的浓度依赖效应。本研究首次将水解单宁添加到对虾的饲料中, 结果发现3个添加浓度都可以显著提高凡纳滨对虾的生长性能, 添加浓度为0.2%时, 增重率、特定增长率和肥满度与0.1%添加组相比均有下降趋势, 但无显著性差异; 添加浓度增加到0.3%时, 增重率、特定增长率和肥满度又上升至接近0.1%添加组的水平。说明水产动物可能和鸡、兔、猪等单胃动物一样, 生长性能并不会随着水解单宁添加量的增加而上升, 低浓度的水解单宁可能对凡纳滨对虾的生长更有利。然而, 由于水解单宁在水产动物上的应用较少, 其促生长的作用机理仍有待深入的研究和探讨。
3.2 水解单宁对凡纳滨对虾肠道菌群结构的影响微生物具有调控养殖环境和控制潜在病原体的能力, 对水产养殖系统的健康至关重要[28]。肠道微生物菌群的结构和功能与对虾的营养代谢、免疫防御、胃肠道发育等生理过程密切相关, 是维持机体肠道内环境稳定的重要因素[29], 在对虾健康养殖和可持续发展中发挥着关键作用[30]。90%以上的肠道微生物区系为专性厌氧菌, 绝大多数肠道细菌无法分离培养, 使得应用传统分类鉴定方法得到的对虾肠道菌群不能准确、全面地反映其菌群多样性[31], 因此, 水产养殖中微生物的多样性尚未得到充分探讨[32]。
近几年兴起的高通量测序技术是揭示菌群结构多样性和复杂性的有效工具, 解决了肠道大多数微生物难以分离培养的难题, 能够更加精确地研究对虾肠道微生物区系组成, 采用该技术获得的结果能更加全面、真实地反映凡纳滨对虾肠道菌群, 在对虾肠道菌群结构的研究方面得到了广泛的应用[2, 33-36], 而添加水解单宁对凡纳滨对虾肠道菌群结构的影响还未见报道。本研究利用Illumina高通量测序平台进行16S rDNA基因V3~V4区高通量测序, 共检测出24个细菌门, 334个细菌属。在门水平上, 对照组和实验组凡纳滨对虾肠道中含量最高的均是变形菌门, 其次是蓝细菌门、放线菌门和拟杆菌门。前期的研究发现, 在墨吉对虾(Penaeus merguiensis)、斑节对虾(Penaeus monodon)、拟穴青蟹(Scylla paramamosain)和草鱼(Ctenopharyngodon idellus)的肠道中丰度最高的也是变形菌门[37-40], 说明变形菌门可能是水产动物肠道中常见的菌门[41]。应用DGGE技术和高通量测序技术研究正常凡纳滨对虾苗池优势菌群特征时也发现, 菌群主要以变形菌纲、拟杆菌门和放线菌门为主[42-43], 这与本研究的结果是一致的。蓝细菌又称为蓝绿藻, 是广泛存在于淡水环境中的微生物种类[44]。低丰度的蓝细菌对生长有利[45], 而蓝细菌丰度较高时, 会产生对水生动物不利的肝毒性微囊藻毒素[46]。在对虾肠道中检测到高丰度的蓝细菌可能是由于对虾摄食了水体中的蓝藻[47]。本研究中, 3个试验组蓝细菌门、放线菌门和拟杆菌门的丰度均显著降低, 变形菌门、软壁菌门和厚壁菌门比例增加。说明水解单宁对蓝细菌门、放线菌门、拟杆菌门有抑制作用, 且对蓝细菌门的抑制作用尤为明显。
在属水平上, 对照组中蓝细菌属和鲁杰氏菌属的含量较高, 小海员菌属(Nautella)的含量也高于实验组, 有研究表明, 鲁杰氏菌属和小海员菌属的出现表明轮虫生长处于良好状态[48], 说明与实验组相比, 对照组中的轮虫数量可能较多。实验组中含量较高的为发光杆菌属、Candidatus Bacilloplasma、假单胞菌属和假交替单胞菌属(Pseudoalteromonas), 且弧菌属(Vibrio)的含量也高于对照组。Candidatus Bacilloplasma是尚未鉴定出来的一个属[49], 在斑节对虾[50-51]、凡纳滨对虾[52]、黄颡鱼(Pelteobagrus fulvidraco)[51]和挪威龙虾(Nephrops norvegicus)[53]中都鉴定出了这个暂定种, 说明它是高度多样化, 且在海洋生物的肠道中发挥了重要作用[54]。Oxley等[37]比较了野生和养殖对虾的肠道菌群, 发现它们都具有发光杆菌属、假交替单胞菌属、假单胞菌属和弧菌属, Wang等[55]也发现发光杆菌属和弧菌属是野生中国明对虾(Fenneropenaeus chinensis)肠道内的优势种。说明发光杆菌属和弧菌属是对虾肠道中的常见菌属。有研究表明, 对虾肠道中的菌群结构受外界因素影响较大, 以弧菌属较为常见[56], 水产养殖实践中也有将弧菌属和假单胞菌属作为益生菌的报道[57-60]。假交替单胞菌属和弧菌为凡纳滨对虾肠道中的主要菌群, 能够产生多种消化酶类如几丁质酶、淀粉酶和脂肪酶/酯酶等[60]。且有报道指出, 单宁可提高兔和鸡中α-淀粉酶、胰蛋白酶和脂肪酶的活性[61-63]。3个实验组中均检测到高丰度的弧菌属和假单胞菌属, 推测水解单宁的添加可能通过改变这两种菌属的丰度增加了胃肠道中部分消化酶的分泌量, 促进营养物质的消化吸收, 从而改善了对虾的生长性能, 而这一推论尚需要进一步的实验验证。兰萍等[64]将健康凡纳滨对虾肠道内分离出来的美人鱼发光杆菌(Photobacterium damselae)添加到对虾饲料中, 可以提高凡纳滨对虾非特异性免疫水平, 增强抵抗疾病的能力。试验组凡纳滨对虾肠道内发光杆菌和弧菌属所占比例要高于对照组, 说明饲料中添加水解单宁改变了凡纳滨对虾肠道的菌群结构, 试验组对虾肠道中的发光杆菌属和弧菌属可能大多都是有益菌, 一些致病菌的生长可能受到抑制[65]。表明水解单宁可能具有调节虾类肠道微生态平衡、促进肠道有益菌、抑制肠道有害致病菌的作用。
PCoA主成分分析和UPGMA聚类分析结果均显示, 0.1%添加组和0.3%添加组的微生物群落组成相似度较高, 而与对照组和0.2%添加组差别较大。说明饲料中添加0.1%和0.3%的水解单宁对凡纳滨对虾肠道菌群结构的影响差别不大。从生长指标上来说, 0.3%添加组与0.1%添加组也十分接近。从经济成本的角度出发, 认为饲料中添加0.1%的水解单宁可能较为经济有效。
综上所述, 饲料中添加水解单宁, 可以显著提高凡纳滨对虾的生长性能, 添加水解单宁后, 蓝细菌门、放线菌门和拟杆菌门的比例降低, 变形菌门、软壁菌门和厚壁菌门的比例增加。在属水平上, 实验组中比例较大的是发光杆菌属、Candidatus Bacilloplasma和假单胞菌属。说明在饲料中添加水解单宁增加了对虾肠道某些菌群的丰度, 显著改变了肠道菌群的结构, 研究结果可为单宁在水产饲料中的应用提供参考。
| [1] |
Fisheries Bureau of Ministry of Agriculture, People's Republic of China. China Fishery Statistics Yearbook[M]. Beijing: China Agriculture Press, 2017: 15-36. [中华人民共和国农业部渔业局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2017: 15-36.]
|
| [2] |
Wang X T, Lu Y D, Wang L L, et al. Development of antibiotic alternatives on prophylactic and therapeutic treatment for bacterial diseases[J]. Feed and Husbandry, 2015(4): 18-22. [王熙涛, 卢燕丹, 王丽丽, 等. 新型抗生素替代品防治水产动物细菌性疾病的研究进展[J]. 饲料与畜牧, 2015(4): 18-22.] |
| [3] |
Wang H X, Wang N, Wang B, et al. Antibiotics detected in urines and adipogenesis in school children[J]. Environment International, 2016, 89-90: 204-211. DOI:10.1016/j.envint.2016.02.005 |
| [4] |
Defoirdt T, Sorgeloos P, Bossier P. Alternatives to antibiotics for the control of bacterial disease in aquaculture[J]. Current Opinion in Microbiology, 2011, 14(3): 251-258. DOI:10.1016/j.mib.2011.03.004 |
| [5] |
Yang C B, Kabir Chowdhury M A, Hou Y Q, et al. Phytogenic compounds as alternatives to in-feed antibiotics: Potentials and challenges in application[J]. Pathogens, 2015, 4: 137-156. DOI:10.3390/pathogens4010137 |
| [6] |
Zhu Z J. Positive effects of hydrolyzable tannic acid on animal nutrition and health[J]. China Animal Health, 2013, 15(6): 40-42. [朱子洁. 水解单宁酸对动物营养与健康的积极作用[J]. 中国动物保健, 2013, 15(6): 40-42. DOI:10.3969/j.issn.1008-4754.2013.06.018] |
| [7] |
Arapitsas P. Hydrolyzable tannin analysis in food[J]. Food Chemistry, 2012, 135(3): 1708-1717. DOI:10.1016/j.foodchem.2012.05.096 |
| [8] |
Haslam E. Plant Polyphenols: Vegetable Tannins Revisited[M]. Cambridge: Cambridge University Press, 1989: 230.
|
| [9] |
Huang Q Q, Liu X L, Zhao G Q, et al. Potential and challenges of tannins as an alternative to in-feed antibiotics for farm animal production[J]. Animal Nutrition, 2018, 4(2): 137-150. DOI:10.1016/j.aninu.2017.09.004 |
| [10] |
Li D S, Zhang L P. Physiological activities and research progress of plant tannins[J]. Science Information, 2006(5): 8. [李东升, 张力平. 植物单宁的生理活性及其研究进展[J]. 科技信息, 2006(5): 8.] |
| [11] |
Iji P A, Khumalo K, Slippers S, et al. Intestinal function and body growth of broiler chickens on maize-based diets supplemented with mimosa tannins and a microbial enzyme[J]. Journal of the Science of Food and Agriculture, 2004, 84(12): 1451-1458. DOI:10.1002/jsfa.1816 |
| [12] |
Ebadi M R, Pourreza J, Jamalian J, et al. Amino acid content and availability in low, medium and high tannin sorghum grain for poultry[J]. International Journal of Poultry Science, 2005, 4: 27-31. DOI:10.3923/ijps.2005.27.31 |
| [13] |
Mansoori B. Absorption capacity of chicken intestine for d-xylose in response to graded concentrations of tannic acid[J]. Animal Feed Science and Technology, 2009, 151(1-2): 167-171. DOI:10.1016/j.anifeedsci.2009.01.009 |
| [14] |
Mansoori B, Rogiewicz A, Slominski B A. The effect of canola meal tannins on the intestinal absorption capacity of broilers using a D-xylose test[J]. Journal of Animal Physiology and Animal Nutrition, 2015, 99(6): 1084-1093. DOI:10.1111/jpn.12320 |
| [15] |
Ebrahim R, Liang J B, Jahromi M F, et al. Effects of tannic acid on performance and fatty acid composition of breast muscle in broiler chickens under heat stress[J]. Italian Journal of Animal Science, 2015, 14(4): 3956. DOI:10.4081/ijas.2015.3956 |
| [16] |
Bilić-Šobot D, Kubale V, Škrlep M, et al. Effect of hydrolysable tannins on intestinal morphology, proliferation and apoptosis in entire male pigs[J]. Archives of Animal Nutrition, 2016, 70(5): 378-388. DOI:10.1080/1745039X.2016.1206735 |
| [17] |
Xu X F. Study on mechanism of nitrogen utilization in diet of dairy cows with condensed and hydrolyzable tannins addition[D]. Beijing: China Agricultural University, 2013: 13-62. [徐晓锋.缩合单宁与水解单宁对奶牛日粮氮利用影响及作用机制的研究[D].北京: 中国农业大学, 2013: 13-62.] http://cdmd.cnki.com.cn/Article/CDMD-10019-1014111749.htm
|
| [18] |
Liu T, Huang X X, Su M Y, et al. Effects of fermented soybean meal replacing fish meal on the growth performance, immune-related enzymes and gene expression of Litopenaeus vannamei[J]. Journal of Fisheries of China, 2018, 42(9): 1417-1427. [刘韬, 黄旭雄, 苏美英, 等. 发酵豆粕替代鱼粉对凡纳滨对虾生长、免疫相关酶及免疫相关基因表达的影响[J]. 水产学报, 2018, 42(9): 1417-1427.] |
| [19] |
Shang B J, Zuo Z H, Dou C M, et al. Analysis of the characteristics of Litopenaeus vannamei intestinal microflora after being fed with two probiotics using high-throughput sequencing method[J]. Journal of Fisheries of China, 2018, 42(12): 1967-1976. [尚碧娇, 左志晗, 窦春萌, 等. 高通量测序法分析两株益生菌对凡纳滨对虾肠道菌群结构的影响[J]. 水产学报, 2018, 42(12): 1967-1976.] |
| [20] |
Wang Q, Garrity G M, Tiedje J M, et al. Naïve Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [21] |
DeSantis T Z, Hugenholtz P, Larsen N, et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB[J]. Applied and Environmental Microbiology, 2006, 72(7): 5069-5072. DOI:10.1128/AEM.03006-05 |
| [22] |
Preidis G A, Ajami N J, Wong M C, et al. Composition and function of the undernourished neonatal mouse intestinal microbiome[J]. The Journal of Nutritional Biochemistry, 2015, 26(10): 1050-1057. DOI:10.1016/j.jnutbio.2015.04.010 |
| [23] |
Schiavone A, Guo K, Tassone S, et al. Effects of a natural extract of chestnut wood on digestibility, performance traits, and nitrogen balance of broiler chicks[J]. Poultry Science, 2008, 87(3): 521-527. DOI:10.3382/ps.2007-00113 |
| [24] |
Dalle Zotte A, Elena Cossu M. Dietary inclusion of tannin extract from red quebracho trees (Schinopsis spp.) in the rabbit meat production[J]. Italian Journal of Animal Science, 2009, 8(sup2): 784-786. DOI:10.4081/ijas.2009.s2.784 |
| [25] |
Biagi G, Cipollini I, Paulicks B R, et al. Effect of tannins on growth performance and intestinal ecosystem in weaned piglets[J]. Archives of Animal Nutrition, 2010, 64(2): 121-135. DOI:10.1080/17450390903461584 |
| [26] |
Brus M, Dolinšek J, Cencic A, et al. Effect of chestnut (Castanea sativa Mill.) wood tannins and organic acids on growth performance and faecal microbiota of pigs from 23 to 127 days of age[J]. Bulgarian Journal of Agricultural Science, 2013, 19(4): 841-847. |
| [27] |
Starčević K, Krstulović L, Brozić D, et al. Production performance, meat composition and oxidative susceptibility in broiler chicken fed with different phenolic compounds[J]. Journal of the Science of Food and Agriculture, 2015, 95(6): 1172-1178. DOI:10.1002/jsfa.6805 |
| [28] |
Martínez-Córdova L R, Emerenciano M, Miranda-Baeza A, et al. Microbial-based systems for aquaculture of fish and shrimp: An updated review[J]. Reviews in Aquaculture, 2015, 7(2): 131-148. DOI:10.1111/raq.12058 |
| [29] |
Tang Y, Liu W L, Song X L, et al. Effects of dietary with Bacillus cereus on the growth rate and intestinal microflora of Litopenaeus vannamei[J]. Journal of Fisheries of China, 2017, 41(5): 766-774. [唐杨, 刘文亮, 宋晓玲, 等. 饲料中补充蜡样芽孢杆菌对凡纳滨对虾生长及其肠道微生物组成的影响[J]. 水产学报, 2017, 41(5): 766-774.] |
| [30] |
Ninawe A S, Selvin J. Probiotics in shrimp aquaculture: Avenues and challenges[J]. Critical Reviews in Microbiology, 2009, 35(1): 43-66. DOI:10.1080/10408410802667202 |
| [31] |
Jia H R, Wang X, Zhou T. Introduction of intestinal tract microorganisms in honeybees[J]. Progress in Veterinary Medicine, 2014, 35(4): 116-121. [贾慧茹, 王星, 周婷. 蜜蜂肠道微生物研究概况[J]. 动物医学进展, 2014, 35(4): 116-121. DOI:10.3969/j.issn.1007-5038.2014.04.027] |
| [32] |
Martínez-Porchas M, Vargas-Albores F. Microbial metagenomics in aquaculture: A potential tool for a deeper insight into the activity[J]. Reviews in Aquaculture, 2017, 9(1): 42-56. DOI:10.1111/raq.12102 |
| [33] |
Wu J F, Xiong J P, Wang X, et al. Intestinal bacterial community is indicative for the healthy status of Litopenaeus vannamei[J]. Chinese Journal of Applied Ecology, 2016, 27(2): 611-621. [吴金凤, 熊金波, 王欣, 等. 肠道菌群对凡纳滨对虾健康的指示作用[J]. 应用生态学报, 2016, 27(2): 611-621.] |
| [34] |
Sun Z L, Xuan Y M, Zhang H, et al. Bacterial diversity in the Penaeus vannamei Boone intestine and aquaculture environment[J]. Journal of Fishery Sciences of China, 2016, 23(3): 594-605. [孙振丽, 宣引明, 张皓, 等. 南美白对虾养殖环境及其肠道细菌多样性分析[J]. 中国水产科学, 2016, 23(3): 594-605.] |
| [35] |
Pinoargote G, Flores G, Cooper K, et al. Effects on survival and bacterial community composition of the aquaculture water and gastrointestinal tract of shrimp (Litopenaeus vannamei) exposed to probiotic treatments after an induced infection of acute hepatopancreatic necrosis disease[J]. Aquaculture Research, 2018, 49(10): 3270-3288. DOI:10.1111/are.13791 |
| [36] |
Cornejo-Granados F, Lopez-Zavala A A, Gallardo-Becerra L, et al. Microbiome of Pacific whiteleg shrimp reveals differential bacterial community composition between wild, aquacultured and AHPND/EMS outbreak conditions[J]. Scientific Reports, 2017, 7: 11783. DOI:10.1038/s41598-017-11805-w |
| [37] |
Oxley A P A, Shipton W, Owens L, et al. Bacterial flora from the gut of the wild and cultured banana prawn, Penaeus merguiensis[J]. Journal of Applied Microbiology, 2002, 93(2): 214-223. DOI:10.1046/j.1365-2672.2002.01673.x |
| [38] |
Rungrassamee W, Klanchui A, Maibunkaew S, et al. Characterization of intestinal bacteria in wild and domesticated adult black tiger shrimp (Penaeus monodon)[J]. PLoS ONE, 2014, 9(3): e91853. DOI:10.1371/journal.pone.0091853 |
| [39] |
Wu S G, Wang G T, Angert E R, et al. Composition, diversity, and origin of the bacterial community in grass carp intestine[J]. PLoS ONE, 2012, 7(2): e30440. DOI:10.1371/journal.pone.0030440 |
| [40] |
Wang X F, Zhao Y F, Song Z F, et al. Application of high-throughput sequencing techniques for analyzing bacterial communities in pond-raised mud crab (Scylla paramamosain) intestine and its aquaculture environment[J]. Journal of Fishery Sciences of China, 2017, 24(6): 1245-1253. [王贤丰, 赵艳飞, 宋志飞, 等. 应用高通量测序技术分析拟穴青蟹肠道及其养殖环境菌群结构[J]. 中国水产科学, 2017, 24(6): 1245-1253.] |
| [41] |
Wang Y L, Wang B J, Liu M, et al. Aflatoxin B1 (AFB1) induced dysregulation of intestinal microbiota and damage of antioxidant system in pacific white shrimp (Litopenaeus vannamei)[J]. Aquaculture, 2018, 495: 940-947. DOI:10.1016/j.aquaculture.2018.06.065 |
| [42] |
Xue M, Liang H F, He Y Y, et al. Characterization and in-vivo evaluation of potential probiotics of the bacterial flora within the water column of a healthy shrimp larviculture system[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(3): 484-491. DOI:10.1007/s00343-016-5024-2 |
| [43] |
Xue M, He Y Y, Qiu M D, et al. Characterization of aquatic bacterial community of Litopenaeus vannamei larvae during hatchery period with high-throughput sequencing[J]. Journal of Fisheries of China, 2017, 41(5): 785-794. [薛明, 何瑶瑶, 邱孟德, 等. 高通量测序分析凡纳滨对虾育苗期水体菌群结构特征[J]. 水产学报, 2017, 41(5): 785-794.] |
| [44] |
Zhao M, Xie S, Zhu X, et al. Effect of inclusion of blue-green algae meal on growth and accumulation of microcystins in gibel carp (Carassius auratus gibelio)[J]. Journal of Applied Ichthyology, 2006, 22(1): 72-78. DOI:10.1111/j.1439-0426.2006.00706.x |
| [45] |
Jia J M, Chen Q W, Lauridsen T. A systematic investigation into the environmental fate of microcystins and the potential risk: Study in Lake Taihu[J]. Toxins, 2016, 8(6): 170. DOI:10.3390/toxins8060170 |
| [46] |
Kang H S, Sturdy M, Krunic A, et al. Minutissamides E–L, antiproliferative cyclic lipodecapeptides from the cultured freshwater cyanobacterium cf. Anabaena sp[J]. Bioorganic & Medicinal Chemistry, 2012, 20(20): 6134-6143. |
| [47] |
Suo Y T, Li E C, Li T Y, et al. Response of gut health and microbiota to sulfide exposure in Pacific white shrimp Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2017, 63: 87-96. |
| [48] |
Sakami T, Koiso M, Sugaya T. Characterization of bacterial community composition in rotifer cultures under unexpected growth suppression[J]. Fisheries Science, 2014, 80(4): 757-765. DOI:10.1007/s12562-014-0741-y |
| [49] |
Kostanjšek R, Štrus J, Avguštin G. "Candidatus Bacilloplasma, " a novel lineage of mollicutes associated with the hindgut wall of the terrestrial isopod Porcellio scaber (Crustacea: Isopoda)[J]. Applied and Environmental Microbiology, 2007, 73(17): 5566-5573. DOI:10.1128/AEM.02468-06 |
| [50] |
Rungrassamee W, Klanchui A, Chaiyapechara S, et al. Bacterial population in intestines of the black tiger shrimp (Penaeus monodon) under different growth stages[J]. PLoS ONE, 2013, 8(4): e60802. DOI:10.1371/journal.pone.0060802 |
| [51] |
Rungrassamee W, Klanchui A, Maibunkaew S, et al. Bacterial dynamics in intestines of the black tiger shrimp and the Pacific white shrimp during Vibrio harveyi exposure[J]. Journal of Invertebrate Pathology, 2016, 133: 12-19. DOI:10.1016/j.jip.2015.11.004 |
| [52] |
Wu S G, Tian J Y, Wang G T, et al. Characterization of bacterial community in the stomach of yellow catfish (Pelteobagrus fulvidraco)[J]. World Journal of Microbiology and Biotechnology, 2012, 28(5): 2165-2174. DOI:10.1007/s11274-012-1022-5 |
| [53] |
Meziti A, Ramette A, Mente E, et al. Temporal shifts of the Norway lobster (Nephrops norvegicus) gut bacterial communities[J]. FEMS Microbiology Ecology, 2010, 74(2): 472-484. DOI:10.1111/j.1574-6941.2010.00964.x |
| [54] |
Chen W Y, Ng T H, Wu J H, et al. Microbiome dynamics in a shrimp grow-out pond with possible outbreak of acute hepatopancreatic necrosis disease[J]. Scientific Reports, 2017, 7: 9395. DOI:10.1038/s41598-017-09923-6 |
| [55] |
Wang X H, Li H R, Zhang X H, et al. Microbial flora in the digestive tract of adult penaeid shrimp (Penaeus chinensis)[J]. Journal of Ocean University of Qingdao, 2000, 30(3): 493-498. |
| [56] |
Yang Y Y, Li Z J, Lin L, et al. Analyses on intestinal flora of cultured shrimp and water microbial flora[J]. Journal of Tropical Oceanography, 2006, 25(3): 53-56. [杨莺莺, 李卓佳, 林亮, 等. 人工饲料饲养的对虾肠道菌群和水体细菌区系的研究[J]. 热带海洋学报, 2006, 25(3): 53-56. DOI:10.3969/j.issn.1009-5470.2006.03.010] |
| [57] |
Verschuere L, Rombaut G, Sorgeloos P, et al. Probiotic bacteria as biological control agents in aquaculture[J]. Microbiology and Molecular Biology Reviews, 2000, 64(4): 655-671. DOI:10.1128/MMBR.64.4.655-671.2000 |
| [58] |
Schulze A D, Alabi A O, Tattersall-Sheldrake A R, et al. Bacterial diversity in a marine hatchery: Balance between pathogenic and potentially probiotic bacterial strains[J]. Aquaculture, 2006, 256(1-4): 50-73. DOI:10.1016/j.aquaculture.2006.02.008 |
| [59] |
Balcázar J L, Rojas-Luna T, Cunningham D P. Effect of the addition of four potential probiotic strains on the survival of Pacific white shrimp (Litopenaeus vannamei) following immersion challenge with Vibrio parahaemolyticus[J]. Journal of Invertebrate Pathology, 2007, 96(2): 147-150. DOI:10.1016/j.jip.2007.04.008 |
| [60] |
Tzuc J T, Escalante D R, Rojas Herrera R, et al. Microbiota from Litopenaeus vannamei: digestive tract microbial community of Pacific white shrimp (Litopenaeus vannamei)[J]. SpringerPlus, 2014, 3: 280. DOI:10.1186/2193-1801-3-280 |
| [61] |
Longstaff M A, McNab J M. The effect of concentration of tannin-rich bean hulls (Vicia faba L.) on activities of lipase (EC 3.1.1.3) and α-amylase (EC 3.2.1.1) in digesta and pancreas and on the digestion of lipid and starch by young chicks[J]. British Journal of Nutrition, 1991, 66(1): 139-147. DOI:10.1079/BJN19910017 |
| [62] |
Chen S J, Gu X X, Liu T, et al. Effect of tannic acid on intestinal morphology and endogenous enzyme activity of rabbits[J]. Feed Industry, 2015, 36(9): 14-16. [陈赛娟, 谷新晰, 刘涛, 等. 单宁酸对家兔肠道形态和内源酶活性的影响[J]. 饲料工业, 2015, 36(9): 14-16.] |
| [63] |
Liu H W. Study on antioxidant activity of chestnut tannins and its effects on growth performance of Rabbits[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010: 27-46. [刘华伟.栗树单宁的抗氧化能力及其对肉兔生产性能的影响研究[D].北京: 中国农业科学院, 2010: 27-46] http://cdmd.cnki.com.cn/Article/CDMD-82101-2010170770.htm
|
| [64] |
Lan P, Song X L, Zhang H, et al. Effect of Photobacterium damselae on the non-specific immune response and disease resistance of Litopenaeus vannamei[J]. Progress in Fisheries Sciences, 2010, 31(1): 65-73. [兰萍, 宋晓玲, 张辉, 等. 美人鱼发光杆菌对凡纳滨对虾非特异性免疫功能及抗病力的影响[J]. 渔业科学进展, 2010, 31(1): 65-73. DOI:10.3969/j.issn.1000-7075.2010.01.011] |
| [65] |
Pei P B, Wu J Q, Liang H H, et al. Effects of biological water purification grid on intestinal flora composition of Pacific white leg shrimp Litopenaeus vannamei[J]. Fisheries Science, 2018, 37(3): 301-308. [裴鹏兵, 吴洁琼, 梁宏豪, 等. 生物净水栅对凡纳滨对虾肠道菌群组成的影响[J]. 水产科学, 2018, 37(3): 301-308.] |
 2019, Vol. 26
2019, Vol. 26

