线虫隶属于线虫纲(Nematoda)。线虫纲分为尾感器亚纲(Phasmidia)和无尾感器亚纲(Aphasmidia), 各个亚纲再分为若干个目, 种类繁多, 至2009年已描述的线虫有13000多种, 其分布非常广泛, 生存环境多样, 不仅可在淡水、海水和土壤中生存, 还可在沙漠等极端环境中生存, 绝大多数营自由生活, 部分营寄生生活, 可寄生在人、畜、禽、鱼和植物等生物; 在鱼体上寄生的线虫有胃瘤线虫属(Eustrongylides)、鳗居线虫属(Anguillicola)和驼形属(Camallanus)等46个属[1]。鱼类线虫的分类依据经过了从最初的只根据形态学特征到目前的依据分子生物学和形态学特征相结合的过程, 许多线虫新的形态结构特征也在不断被发现和补充完善。由于线虫种类、寄主鱼种类和寄生部位不同, 造成鱼体组织器官的损伤也会不同, 但对鱼体组织损伤的相关报道少, 或已有的报道也不全面。寄生于鲫(Carassius carassius)鳍条皮下的线虫Philometroides sanguineus导致鳍条肿大、虫体附近骨骼肌变性和组织增生的病理变化[2]; 寄生于五彩搏鱼(Betta splendens)和孔雀花鳉(Poecilia reticulata)肠腔内的杜父鱼驼形线虫(Camallanus cotti)可引起这2种鱼肠黏膜充血和水肿的病理变化, 但不形成包囊, 也不出现炎症浸润病理现象[3]; 寄生于美国密西西比河杂交鲈(Morone chrysops×Morone saxatilis)肠腔内的伊格诺图斯胃瘤线虫(Eustrongylides ignotus)可形成包囊等炎症反应的病理变化[4]。本研究于2017年10—11月对上海某湖泊的鱼类调查中, 发现翘嘴鲌(Culter alburnus Basilewsky)和花䱻(Hemibarbus maculatus Bleeker)腹腔内感染线虫, 通过分子生物学、形态学和病理学的研究分析, 探讨该线虫分类地位、特征和其对寄主鱼的危害性, 在补充和丰富该线虫的相关知识以及掌握其对翘嘴鲌和花䱻的组织病理损伤作用等方面都有重要意义。
1 材料与方法 1.1 实验鱼和线虫采集在2017年10—11月, 在上海某淡水湖泊的湖区布设20个捕捞位点, 用丝网随机在每个位点捕捞2~3次, 共捕获7种鱼765尾, 体重0.005~ 4.240 kg, 随即通过肉眼和配有ZEN 2012显微图像分析软件的Carl Zeiss Stemi 2000体视显微镜对所有捕获的鱼进行体内外剖解观察检查, 仅在翘嘴鲌和花䱻腹腔内发现有线虫寄生, 同时用解剖工具采集虫体, 用生理盐水清洗干净, 部分线虫在100%乙醇中保存用于分子生物学分析, 部分线虫在10%中性福尔马林中固定保存用于形态学观察。
1.2 线虫物种鉴定的PCR分析 1.2.1 线虫的DNA提取线虫的DNA提取方法按Utuk等[5]方法略作改进, 称取在100%乙醇中保存的线虫5 mg, 用眼科剪剪成小块, 加入250 μL TEN-SDS裂解液消化, 苯酚:氯仿:异戊醇(25:24:1)反复抽提3次, 提取的DNA作为PCR扩增模板, ‒20℃保存备用。
1.2.2 PCR扩增采用Koehler等[6]报道的18S rDNA上游引物5′-TTTGGTTTTCGGATCTGAGG- 3′和下游引物5′-GTACAAAGGGCAGGGACGTA- 3′进行线虫18S rDNA序列PCR扩增。反应体系为2 μL DNA模板, 上下游引物各2 μL, 25 μL的2×Taq PCR MasterMix (0.1 U Taq DNA聚合酶, 500 μmol/L dNTP, 20 mmol/L Tris-HCl pH 8.3, 100 mmol/L KCl和3 mmol/L MgCl2, 天根生化科技有限公司), 加蒸馏水至50 μL。反应条件为: 94℃预变性5 min; 94℃变性30 s, 53℃退火15 s, 72℃延伸30 s, 共34个循环; 最后72℃延伸10 min。采用Xiong等[7]报道的ITS rDNA上游引物5′-TTGGATGATTCGG TGAGGT-3′和下游引物5′-AACCGCTTAGTAATATGCT-3′进行线虫的ITS rDNA序列PCR扩增。反应体系与18S rDNA序列PCR扩增反应体系相同。反应条件为: 94℃预变性5 min; 94℃变性40 s, 56℃退火30 s, 72℃延伸90 s, 共29个循环; 最后72℃延伸10 min。无模板作为空白对照组。
取扩增产物5 μL, 进行1%的琼脂糖凝胶电泳, 用溴化乙啶染色, 电泳图在凝胶成像系统(Bio-Rad Gel DocTM XR+, 美国)下拍照。PCR产物送上海生工生物有限公司, 在ABI3730xl型测序仪(美国)上进行测序, 然后分别进行18S rDNA和ITS rDNA序列同源性比对。
1.3 线虫的形态结构 1.3.1 显微观察活体线虫在体视显微镜下观察拍照。取10%中性福尔马林固定的线虫置于载玻片上, 用乳酚(苯酚:乳酸:丙三醇:水=1:1:2:1)[8]滴加于虫体上待虫体透明后, 盖上盖玻片, 在配有NIS- Elements F 4.0软件的Nikon Eclipse 55i显微镜下观察拍照, 并分别测量虫体长宽、食道长宽和口腔长等数据。
1.3.2 扫描电镜观察根据Asakawa等[9]的方法, 取10%中性福尔马林固定的线虫, 经梯度乙醇脱水, 醋酸异戊酯处理, CO2临界点干燥法干燥, 挑取线虫至载物台, 喷金后在扫描电子显微镜[Scanning electron microscopy (SEM)] (日立S-3400N, 日本)下观察拍照, 并分别测量棘状乳突、乳头状乳突、侧体斑突和尾斑突等形态结构大小数据。
1.3.3 线虫切片观察取10%中性福尔马林固定的线虫, 蒸馏水冲洗, 经乙醇梯度脱水, 二甲苯透明, 石蜡包埋, 切片, 切片厚度4~5 μm, 苏木精伊红(HE)染色, 中性树胶封片, 在Nikon Eclipse 55i显微镜下观察拍照。
1.4 组织病理切取有线虫寄生的翘嘴鲌和花䱻肝脏组织、脾脏组织、肠系膜和包囊, 在Bouin’s液中分别固定24 h后, 用70%乙醇冲洗并保存备用。组织脱水、透明、石蜡包埋、切片和苏木精伊红(HE)染色等其他处理方法相同于线虫切片方法, 在Nikon Eclipse 55i显微镜下观察拍照。
1.5 数据处理采用SPSS 19.0统计软件, 线虫形态结构所测数据用平均值±标准差(x±SD)表示, 并用t检验法对数值差异作处理分析, P < 0.01为差异极显著, P < 0.05为差异显著, P > 0.05为差异不显著。
2 结果与分析 2.1 线虫感染情况共捕捞到不同大小的7种鱼765尾, 包括122尾体重为(0.16±0.07) kg的翘嘴鲌, 216尾体重为(0.23±0.13) kg的花䱻, 78尾体重为(1.34±0.59) kg的鳙(Aristichthys nobilis), 73尾体重为(1.45± 0.50) kg的鲢(Hypophthalmichthys molitrix), 17尾体重为(1.15±0.92) kg的鲤(Cyprinus carpio), 209尾体重为(0.26±0.32) kg的鲫(Carassius auratus)和50尾体重为(0.11±0.03) kg的黄颡鱼(Pelteobagrus fulvidraco), 但只在翘嘴鲌和花䱻2种鱼腹腔内发现形态相同的线虫寄生, 其他种类鱼体内外均未发现线虫, 被线虫寄生的翘嘴鲌和花䱻体表无明显症状。这2种鱼感染线虫情况见表 1, 翘嘴鲌线虫感染率为64.75%, 平均感染强度为3.01条, 分别高于花䱻线虫感染率(28.70%)和平均感染强度(2.42条), 2种鱼的线虫最高感染强度分别为11条和15条, 线虫寄生于腹腔内, 部分附着于内脏器官表面, 部分以包囊的形式分别寄生于肝脏、脾脏和肠系膜组织器官。
|
|
表 1 翘嘴鲌和花䱻腹腔内感染线虫情况 Tab.1 Infection with nematodes in the abdominal cavities of Culter alburnus Basilewsky and Hemibarbus maculatus Bleeker |
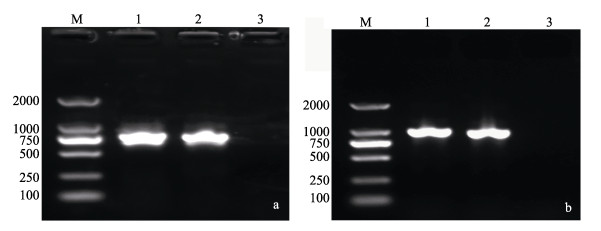
无论是翘嘴鲌还是花䱻体内寄生的线虫18S rDNA PCR扩增产物电泳均出现相同单一的条带(图 1a)。经测序, 来自2种鱼的线虫18S rDNA序列完全相同, 均为802 bp, 与寄生在西太公鱼(Hypomesus transpacificus nipponensis)腹腔的Eustrongylides ignotus[10] 18S rDNA序列(GenBank登录号AB558484.2)相似度达到100%, 与寄生在西部食蚊鱼(Gambusia affinis)腹腔的Eustrongylides ignotus[6] 18S rDNA序列(GenBank登录号EU394732.1)相似度达到99.87%, 与Eustrongylides ignotus 18S rDNA序列(GenBank登录号KT013207.1)相似度也达到99.87%。结果表明, 寄生于翘嘴鲌和花䱻腹腔内线虫均为伊格诺图斯胃瘤线虫(Eustrongylides ignotus, 简称伊胃瘤线虫)。
|
图 1 线虫18S rDNA (a)和ITS rDNA (b) PCR扩增产物电泳图 M: DL2000 marker; 1:翘嘴鲌体内线虫PCR扩增产物; 2:花䱻体内线虫PCR扩增产物; 3:无模板空白对照组. Fig.1 Electrophoresis of PCR products of nematode 18S rDNA (a) and ITS rDNA (b) M: DL2000 marker; 1: PCR product of Culter alburnus Basilewsky; 2: PCR product of Hemibarbus maculatus bleeker; 3: Blank control group. |
来自2种鱼的线虫ITS rDNA PCR扩增产物电泳同样出现相同单一的条带(图 1b), 所测序列完全相同, 均为997 bp。经比对, 未发现Eustrongylides ignotus的ITS rDNA序列在GenBank上有记录, 但与寄生于黄鳝(Monopterus albus)和乌鳢(Channa argus)等鱼腹腔内的未定种Eustrongylides sp.的ITS rDNA序列(GenBank登录号分别为GQ215522.1、GQ215576.1、GQ215551.1、GQ215555.1、GQ215550.1、GQ215536.1、GQ215543.1、GQ215577.1、GQ215573.1和GQ215542.1等)相似度分别达到99.80%~100%。
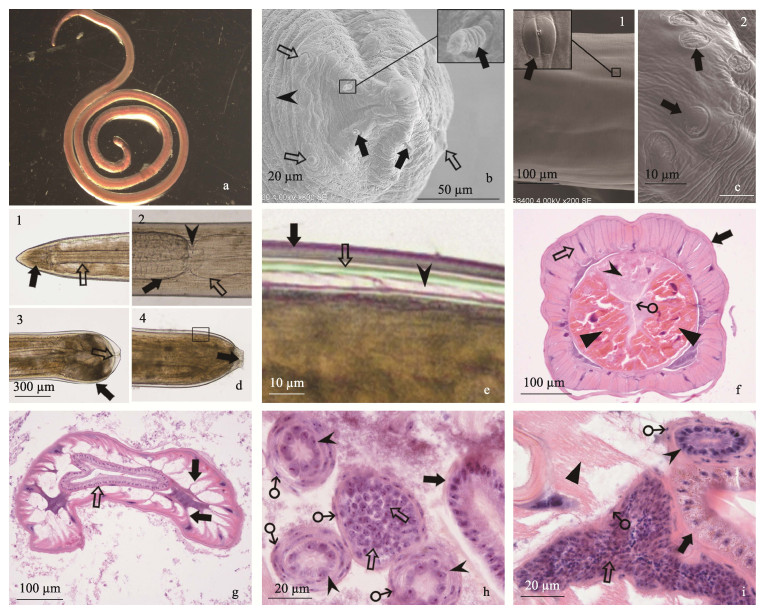
2.3 线虫形态特征 2.3.1 线虫外部特征线虫大部分虫体为粉红色, 圆桶形, 体中部粗细均匀, 两端部逐渐细, 头部呈圆锥形(图 2a), 口呈裂缝状, 雄虫体长和宽分别为(53.69±6.33) mm和(0.58±0.06) mm, 雌虫体长和宽分别为(55.03±5.39) mm和(0.63±0.04) mm。虫体头部有两圈乳突, 内圈有6个棘状乳突, 每个棘状乳突由狭窄基底和棘状的突起组成, 雄虫棘状乳突长、宽和高分别为(3.16±0.42) μm、(2.73±0.37) μm和(7.06±1.23) μm, 雌虫分别为(3.08±0.65) μm、(2.65±0.67) μm和(7.32±1.67) μm; 外圈有6个乳头状乳突, 每个乳头状乳突由宽的基底和乳头状的突起组成, 雄虫乳头状乳突长、宽和高分别为(7.42±1.54) μm、(7.3±1.55) μm和(2.63±0.83) μm, 雌虫分别为(5.79±1.06) μm、(5.64±1.08) μm和(2.06±0.46) μm; 虫体体表有圆环状的横纹(图 2b), 虫体体表两侧分布有体侧斑突, 有直凹纹, 中心处有小点状微突(图 2c-1), 雄虫体侧斑突长和宽分别为(7.19±1.61) μm和(5.36± 1.33) μm, 雌虫分别为(6.91±1.12) μm和(5.49± 1.01) μm; 近肛门周围分布有不规则的近圆形尾斑突, 表面有不规则的凹纹(图 2c-2), 雄虫尾斑突长和宽分别为(6.98±0.84) μm和(4.89±1.04) μm, 雌虫分别为(8.63±2.57) μm和(5.91±1.32) μm; 雄虫虫体后端膨大。除雄虫与雌虫乳头状乳突长和宽差异显著(P < 0.05)外, 其他的外部结构大小无显著性差异(P > 0.05)。虫体有3层角质层, 外层为Ⅱ期幼虫角质层, 中层为Ⅲ期幼虫角质层, 内层为Ⅳ期幼虫角质层(图 2d, 2e), 根据角质层的特征[11-12], 寄生于翘嘴鲌和花䱻腹腔内的线虫均为伊胃瘤线虫的Ⅳ期幼虫。与寄生于其他鱼腹腔内伊胃瘤线虫Ⅳ期幼虫的形态和数据比较(表 2), 本线虫体长和食道长介于Coyner等[11]和Xiong等[12]报道的线虫体长和食道长之间, 虫体头部都具有相同数量的棘状乳突和乳头状乳突。
|
图 2 寄生于翘嘴鲌和花䱻的线虫的形态结构
a.粉红色线虫; b.线虫头部的扫描电镜, 棘状乳突( ), 乳突状乳突( ), 乳突状乳突( ), 环状横纹( ), 环状横纹( ); c. 1:体侧斑突( ); c. 1:体侧斑突( )和2:尾斑突( )和2:尾斑突( )的扫描电镜; d. 1:线虫口腔( )的扫描电镜; d. 1:线虫口腔( )和食道( )和食道( ); 2:食道( ); 2:食道( )与肠道( )与肠道( )连接处( )连接处( ); 3:雄虫体后端膨大( ); 3:雄虫体后端膨大( )和肛门( )和肛门( ); 4:雌虫体后端和肛门( ); 4:雌虫体后端和肛门( ); e. 图 2d-4方框的放大, 3层角质层, Ⅱ期幼虫角质层( ); e. 图 2d-4方框的放大, 3层角质层, Ⅱ期幼虫角质层( ), Ⅲ期幼虫角质层( ), Ⅲ期幼虫角质层( ), Ⅳ期幼虫角质层( ), Ⅳ期幼虫角质层( ); f.虫体前部横切面:角质层( ); f.虫体前部横切面:角质层( )和体肌( )和体肌( ), 食道背侧腺( ), 食道背侧腺( )和下腹腺(▲), 呈三放射形的食道腔(♂), HE; g.虫体中部横切面, 体肌肌细胞一端伸入体腔( )和下腹腺(▲), 呈三放射形的食道腔(♂), HE; g.虫体中部横切面, 体肌肌细胞一端伸入体腔( ), 肠道( ), 肠道( )由单层柱状上皮细胞排列组成, HE; h.雌虫体后部横切面:肠道( )由单层柱状上皮细胞排列组成, HE; h.雌虫体后部横切面:肠道( ), 卵巢中的卵母细胞( ), 卵巢中的卵母细胞( ), 输卵管( ), 输卵管( ), 纤维细胞核(♂), HE; i.雄虫体后部横切面:肠道( ), 纤维细胞核(♂), HE; i.雄虫体后部横切面:肠道( ), 精巢中的精母细胞( ), 精巢中的精母细胞( ), 输精管( ), 输精管( ), 纤维细胞核(♂)和体肌(▲), HE.
Fig.2 Morphological structure of nematode infecting Culter alburnus and Hemibarbus maculatus
a. Pink nematode; b. Cephalic extremity of nematode with spinous papilla ( ), 纤维细胞核(♂)和体肌(▲), HE.
Fig.2 Morphological structure of nematode infecting Culter alburnus and Hemibarbus maculatus
a. Pink nematode; b. Cephalic extremity of nematode with spinous papilla ( ), papillary papilla ( ), papillary papilla ( ) and cyclic horizontal striation ( ) and cyclic horizontal striation ( ), SEM; c. 1: Lateral plaque ( ), SEM; c. 1: Lateral plaque ( ) and 2: Caudal plaque ( ) and 2: Caudal plaque ( ), SEM; d. 1: Mouth cavity ( ), SEM; d. 1: Mouth cavity ( ) and esophagus ( ) and esophagus ( ); 2: Joint ( ); 2: Joint ( ) of the esophagus ( ) of the esophagus ( ) and intestine ( ) and intestine ( ); 3: Intumescence ( ); 3: Intumescence ( ) in the posterior of male body ( ) in the posterior of male body ( ) and anus ( ) and anus ( ); 4: Posterior of female body and anus ( ); 4: Posterior of female body and anus ( ); e. The amplification of pane in Fig. 2d-4, 3 layers of cuticles, second-stage larvae cuticle ( ); e. The amplification of pane in Fig. 2d-4, 3 layers of cuticles, second-stage larvae cuticle ( ), third-stage larvae cuticle ( ), third-stage larvae cuticle ( ), fourth-stage larvae cuticle ( ), fourth-stage larvae cuticle ( ); f. Transection of front nematode: cuticle layer ( ); f. Transection of front nematode: cuticle layer ( ) and body muscle cells ( ) and body muscle cells ( ), dorsal gland ( ), dorsal gland ( ), and ventral gland (▲) and a three radiate esophageal lumen (♂) within the esophagus, HE; g. Transection of middle nematode: one end of body muscle cell stretched into the coelom ( ), and ventral gland (▲) and a three radiate esophageal lumen (♂) within the esophagus, HE; g. Transection of middle nematode: one end of body muscle cell stretched into the coelom ( ), intestine ( ), intestine ( ) with monolayer columnar epithelial cells, HE; h. Transection of posterior female nematode: intestine ( ) with monolayer columnar epithelial cells, HE; h. Transection of posterior female nematode: intestine ( ), oocytes ( ), oocytes ( ) in the ovary, oviduct ( ) in the ovary, oviduct ( ), fibrocyte nuclei (♂), HE; i. Transection of posterior male nematode: intestine ( ), fibrocyte nuclei (♂), HE; i. Transection of posterior male nematode: intestine ( ), spermatocytes ( ), spermatocytes ( ) in the spermary, spermaduct ( ) in the spermary, spermaduct ( ), fibrocyte nuclei (♂) and body muscle cell (▲), HE. ), fibrocyte nuclei (♂) and body muscle cell (▲), HE.
|
|
|
表 2 寄生于翘嘴鲌和花䱻的线虫的形态学特征 Tab.2 Morphological characteristics of nematodes infecting Culter alburnus and Hemibarbus maculatus |
线虫体壁由角质层、皮质层和体肌组成, 口腔、食道、肠道和肛门组成的消化系统以及生殖系统分布在虫体或体腔内的不同部位, 因此线虫前部、中部和后部分布的组织器官和结构有较大差异。口腔呈圆锥形, 食道前部较细, 后部稍粗, 为圆筒型食道, 食道长约占虫体长的1/5, 雄虫和雌虫食道长分别为(11.52± 1.14) μm和(13.40±1.31) μm, 差异极显著(P < 0.01)。肠道与食道相连接, 连接处较细, 肛门开口于虫体末端正中央(图 2d)。食道分为1个背侧腺和2个下腹腺, 每个下腹腺由4~5个导管和分布在其间的食道肌组成, 围成的食道腔呈三放射形, 食道部位外侧的体壁体肌由许多单层纵列肌细胞组成(图 2f)。肠道由前肠部、中肠部和后肠部构成, 雄虫肠道长(43.10±6.54) mm, 雌虫肠道长(41.10±5.49) mm, 肠道通过肠系膜与体壁连接, 由单层柱状上皮细胞组成, 肠道的单层柱状上皮细胞平均数量为(132.18±24.45)。肠道部位外侧的体壁体肌为单层梭形纵列肌细胞层, 数量为(146.4±23.11), 体肌一般被分隔为4个索区, 每一索间区内的肌细胞平均数量达到了(36.6±5.78), 肌细胞附着在下皮层, 另一端伸入体腔, 伸出的末端与其他体肌末端或一些特化肌相连(图 2g)。生殖系统位于在虫体后部, 雌虫生殖系统由卵巢和输卵管组成, 卵巢外层由纤维细胞组成的结缔组织包围, 内部为卵母细胞, 输卵管在体腔内有多个迂回, 输卵管外层为纤维细胞组成的结缔组织, 内层为短柱状上皮细胞(图版2h), 未发现成熟的卵。雄虫生殖系统主要由精巢与长输精管组成, 精巢外层为由纤维细胞组成的薄层结缔组织, 内层为精母细胞, 输精管从虫体中部开始向后延伸, 由外层为纤维细胞组成的结缔组织和内层为短柱状上皮细胞构成(图 2i), 未见伸出体外的针状体结构。
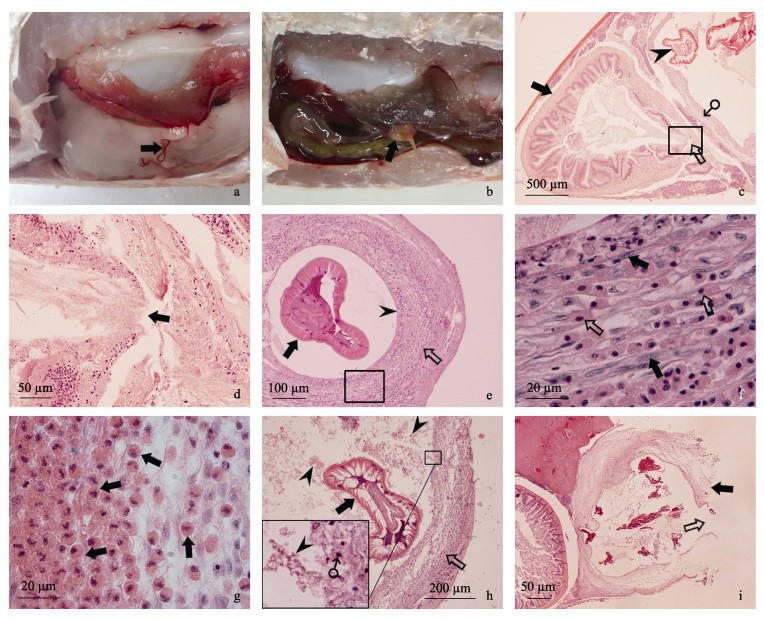
2.4 组织病理变化经观察, 线虫寄生引起的翘嘴鲌和花䱻组织病理变化相同, 引起的组织病理均以翘嘴鲌的组织病理进行说明。大部分线虫附着于这2种鱼腹腔内的内脏组织器官表面(图 3a), 虫体呈卷曲状态, 部分线虫可进入肝脏、脾脏和肠系膜组织, 逐渐被包裹形成包囊。由于线虫一般寄生于这些组织的浅表层, 大多数形成的包囊突起于组织表面, 包囊呈粉红色, 椭圆形或近圆形(图 3b)。剖开包囊, 内有不同浑浊度的液体, 线虫盘曲在包囊内, 包囊内一般线虫有1~2条。腹腔中的线虫来自肠道, 线虫穿过肠道的黏膜层、黏膜下层、肌层和浆膜层, 出现肠道各层缺损现象, 引起肠道穿孔, 留下孔洞, 肠道内含物流出(图 3c, 3d)。
|
图 3 线虫寄生的病鱼和翘嘴鲌腹腔内包囊组织病理
a.花䱻腹腔内附着的线虫( ); b.线虫寄生在翘嘴鲌肝脏形成的包囊( ); b.线虫寄生在翘嘴鲌肝脏形成的包囊( ); c.肠道( ); c.肠道( )穿孔( )穿孔( ), 外已形成的线虫( ), 外已形成的线虫( )包囊(♂), HE; d. 图 3c中的方框的放大, 肠穿孔处肠组织缺损( )包囊(♂), HE; d. 图 3c中的方框的放大, 肠穿孔处肠组织缺损( ), HE; e.包囊初期, 线虫( ), HE; e.包囊初期, 线虫( )由结缔组织的包囊壁( )由结缔组织的包囊壁( )包裹, 内壁表面光滑( )包裹, 内壁表面光滑( ), HE; f. 图 3e中的方框放大, 纤维细胞( ), HE; f. 图 3e中的方框放大, 纤维细胞( )和嗜酸性白细胞( )和嗜酸性白细胞( )浸润, HE; g.包囊壁中出现严重的嗜酸性白细胞( )浸润, HE; g.包囊壁中出现严重的嗜酸性白细胞( )浸润, HE; h.包囊中期, 包裹的线虫( )浸润, HE; h.包囊中期, 包裹的线虫( ), 包囊壁( ), 包囊壁( ), 大量坏死组织细胞脱落( ), 大量坏死组织细胞脱落( )于包囊腔内和坏死细胞固缩的核(♂), HE; i.包囊后期, 包囊壁坏死( )于包囊腔内和坏死细胞固缩的核(♂), HE; i.包囊后期, 包囊壁坏死( )破裂( )破裂( ), HE.
Fig.3 Deseased fish with nematode infection and cystic histopathology of Culter alburnus Basilewsky
a. Nematode ( ), HE.
Fig.3 Deseased fish with nematode infection and cystic histopathology of Culter alburnus Basilewsky
a. Nematode ( ) in the abdominal cavity of Hemibarbus maculatus Bleeker, HE; b. Nematode cyst ( ) in the abdominal cavity of Hemibarbus maculatus Bleeker, HE; b. Nematode cyst ( ) formed in the liver of Culter alburnus Basilewsky, HE; c. Perforation ( ) formed in the liver of Culter alburnus Basilewsky, HE; c. Perforation ( ) of the intestine ( ) of the intestine ( ) and nematode ( ) and nematode ( ) cyst (♂) outside the intestine, HE; d. The amplification of pane in Fig. 3c, intestinal tissues defected at the perforation ( ) cyst (♂) outside the intestine, HE; d. The amplification of pane in Fig. 3c, intestinal tissues defected at the perforation ( ), HE; e. In the early stage of cyst, nematode ( ), HE; e. In the early stage of cyst, nematode ( ) was surrounded by the connective tissue which formed cyst wall ( ) was surrounded by the connective tissue which formed cyst wall ( ), the smooth inner surface ( ), the smooth inner surface ( ) of cyst wall, HE; f. The amplification of pane in Fig. 3e, fibrocytes ( ) of cyst wall, HE; f. The amplification of pane in Fig. 3e, fibrocytes ( ) and eosinophilic leukocytes ( ) and eosinophilic leukocytes ( ) infiltration, HE; g. Severe eosinophilic leukocytes ( ) infiltration, HE; g. Severe eosinophilic leukocytes ( ) infiltration in the cyst wall, HE; h. In the middle stage of cyst, nematode ( ) infiltration in the cyst wall, HE; h. In the middle stage of cyst, nematode ( ) was surrounded by the cyst wall ( ) was surrounded by the cyst wall ( ), a large number of necrotic cells ( ), a large number of necrotic cells ( ) and karyopyknosis (♂) fell off into the cyst cavity, HE; i. In the later stage of cyst, ruptured cyst wall ( ) and karyopyknosis (♂) fell off into the cyst cavity, HE; i. In the later stage of cyst, ruptured cyst wall ( ) was due to cells necrosis ( ) was due to cells necrosis ( ), HE. ), HE.
|
线虫寄生在肝脏、脾脏和肠系膜组织器官内, 都可引起包囊的形成, 包囊组织的病理变化相似。包囊初期, 线虫的发育和刺激, 线虫周围逐渐出现来自虫体寄生组织器官中的纤维细胞, 不断增生形成结缔组织层的包囊壁, 包裹虫体。结缔组织内有血管分布, 出现少量的嗜酸性白细胞浸润现象。随着结缔组织中纤维细胞进一步增生, 包囊壁增厚, 包囊增大, 组成包囊壁的结缔组织内嗜酸性白细胞大量增加, 呈现严重的嗜酸性白细胞浸润现象。由于此时期包囊壁处于形成过程中, 包囊壁中的细胞无变性和坏死现象, 其内壁表面光滑, 包囊腔内只有寄生的线虫而无坏死脱落的细胞(图 3e, 3f, 3g)。包囊中期, 包囊壁的结缔组织中纤维细胞等细胞出现坏死, 坏死细胞从包囊壁的内表面逐渐脱落进入包囊腔内, 腔内分布大量的坏死细胞碎片和固缩的核(图 3h), 并混有包括嗜酸性白细胞等血细胞。包囊后期, 包囊壁坏死细胞增多, 导致包囊壁破裂(图 3i), 线虫可离开包囊, 重新进入鱼腹腔内和邻近组织器官。
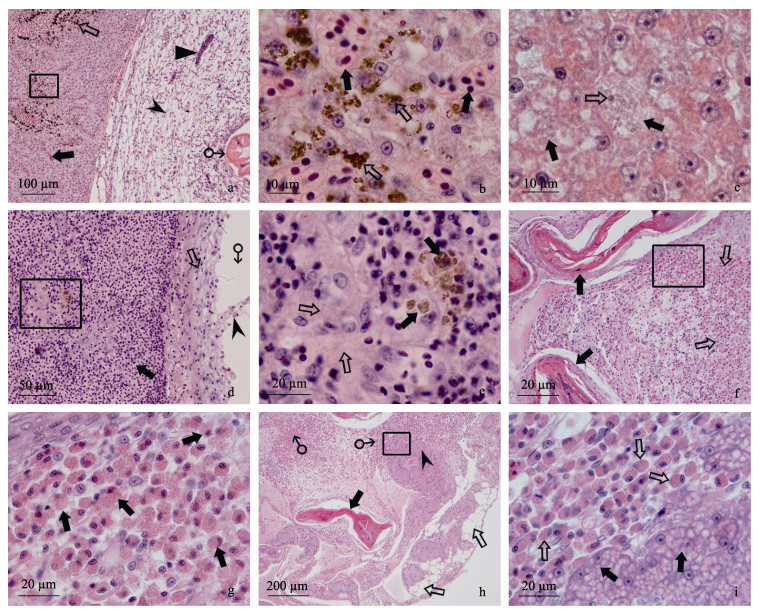
2.4.2 肝脏组织病理线虫寄生肝脏而形成的包囊, 包囊壁中的纤维细胞来自于肝脏组织, 对肝脏有不同程度的损伤作用。初期对肝脏影响不明显, 随着包囊壁增厚, 对肝脏有压迫作用, 引起靠近包囊的肝脏组织充血, 有些与包囊相连处的肝脏组织内会出现嗜酸性白细胞浸润。部分肝脏组织中的肝细胞出现空泡变性, 进一步发展, 肝脏严重充血, 肝脏组织内出现较多含铁血黄素的色素沉着, 部分肝细胞核溶解消失, 肝细胞坏死, 失去肝脏组织应有的结构(图 4a, 4b, 4c)。
|
图 4 被线虫寄生的翘嘴鲌肝、脾脏和肠系膜的组织病理
a.肝脏严重充血( ), 出现含铁血黄素( ), 出现含铁血黄素( ); 包囊( ); 包囊( )、线虫(♂)和包囊壁中分布的血管(▲), HE; b. 图 4a中的方框放大, 肝脏充血( )、线虫(♂)和包囊壁中分布的血管(▲), HE; b. 图 4a中的方框放大, 肝脏充血( )和含铁血黄素沉着( )和含铁血黄素沉着( ), HE; c.肝细胞坏死( ), HE; c.肝细胞坏死( )和核固缩( )和核固缩( ), HE; d.脾脏( ), HE; d.脾脏( )、包囊壁( )、包囊壁( )和坏死的包囊壁组织( )和坏死的包囊壁组织( )脱落于包囊腔(♂)中, HE; e. 图 4d的方框放大, 脾脏出现含铁血黄素( )脱落于包囊腔(♂)中, HE; e. 图 4d的方框放大, 脾脏出现含铁血黄素( )和部分区域出现缺血( )和部分区域出现缺血( )现象, HE; f.多条线虫( )现象, HE; f.多条线虫( )寄生在肠系膜内, 肠系膜内形成的包囊壁中分布大量嗜酸性白细胞( )寄生在肠系膜内, 肠系膜内形成的包囊壁中分布大量嗜酸性白细胞( ), HE; g. 图 4f中的方框放大, 大量浸润的嗜酸性白细胞( ), HE; g. 图 4f中的方框放大, 大量浸润的嗜酸性白细胞( ), HE; h.在肠系膜内的线虫( ), HE; h.在肠系膜内的线虫( )、脂肪组织( )、脂肪组织( )、胰腺组织( )、胰腺组织( )以及浸润的嗜酸性白细胞(♂), HE; i. 图 4h中的方框放大, 胰腺细胞胞质内分泌颗粒( )以及浸润的嗜酸性白细胞(♂), HE; i. 图 4h中的方框放大, 胰腺细胞胞质内分泌颗粒( )增多, 胰腺组织周围出现大量嗜酸性白细胞( )增多, 胰腺组织周围出现大量嗜酸性白细胞( )浸润, HE.
Fig.4 Histopathology of liver, spleen and mesentery of Culter alburnus Basilewsky infected by nematode
a. Liver congestion ( )浸润, HE.
Fig.4 Histopathology of liver, spleen and mesentery of Culter alburnus Basilewsky infected by nematode
a. Liver congestion ( ) and hemosiderosis ( ) and hemosiderosis ( ). Cyst ( ). Cyst ( ), nematode (♂) and blood vessels (▲) within cyst wall, HE; b. The amplification of pane in Fig. 4a, congestion ( ), nematode (♂) and blood vessels (▲) within cyst wall, HE; b. The amplification of pane in Fig. 4a, congestion ( ) and hemosiderosis ( ) and hemosiderosis ( ) in the liver, HE; c. Liver cell necrosis ( ) in the liver, HE; c. Liver cell necrosis ( ) and nuclear disappearance ( ) and nuclear disappearance ( ), HE; d. Spleen ( ), HE; d. Spleen ( ), cyst wall ( ), cyst wall ( ) and necrotic cells ( ) and necrotic cells ( ) fell off into the cyst cavity (♂), HE; e. The amplification of pane in Fig. 4d, hemosiderosis ( ) fell off into the cyst cavity (♂), HE; e. The amplification of pane in Fig. 4d, hemosiderosis ( ) and ischemia ( ) and ischemia ( ) in the spleen, HE; f. Nematodes ( ) in the spleen, HE; f. Nematodes ( ) in the mesentery ( ) in the mesentery ( ) caused a large number of eosinophilic leukocytes infiltration in the cyst wall, HE; g. The amplification of pane in Fig. 4f, a large number of eosinophilic leukocytes ( ) caused a large number of eosinophilic leukocytes infiltration in the cyst wall, HE; g. The amplification of pane in Fig. 4f, a large number of eosinophilic leukocytes ( ) infiltration, HE; h. Nematodes ( ) infiltration, HE; h. Nematodes ( ), adipose tissue ( ), adipose tissue ( ), pancreatic tissue ( ), pancreatic tissue ( ) and a large number of infiltrated eosinophilic leukocytes in the mesentery, HE; i. The amplification of pane in Fig. 4h, secretory granules ( ) and a large number of infiltrated eosinophilic leukocytes in the mesentery, HE; i. The amplification of pane in Fig. 4h, secretory granules ( ) increased in pancreatic cytoplasm and a large number of eosinophilic leukocytes ( ) increased in pancreatic cytoplasm and a large number of eosinophilic leukocytes ( ) infiltrated around the pancreas tissue, HE. ) infiltrated around the pancreas tissue, HE.
|
脾脏是鱼类的造血器官, 主要由被膜、脾索、脾血窦构成。线虫寄生脾脏而形成的包囊, 包囊的纤维细胞来自于脾脏组织, 有些与包囊相连处的脾脏组织内会出现嗜酸性白细胞浸润。包囊对脾脏造成的损伤较小, 但受到包囊的压迫作用, 脾脏组织中的血细胞明显减少, 部分区域出现缺血, 并有含铁血黄素的色素沉着, 未发现脾脏组织细胞的坏死现象(图 4d, 4e)。
2.4.4 肠系膜组织病理肠系膜是线虫寄生形成包囊的主要部位, 包囊的纤维细胞来自于肠系膜中的纤维细胞或胰腺组织中的纤维细胞。感染严重的肠系膜, 形成的包囊壁内常有大量的嗜酸性白细胞浸润(图 4f, 4g)。分布在肠系膜中的胰腺组织细胞细胞质内分泌颗粒增多, 分泌力增强, 胰腺组织周围常出现大量的嗜酸性白细胞浸润, 肠系膜中的脂肪组织没有出现病理变化(图 4h, 4i)。
3 讨论 3.1 线虫的物种鉴定伊胃瘤线虫隶属于线虫纲(Nematoda)、无尾感器亚纲(Aphasmidia)、嘴刺目(Enoplida)、膨结科(Dioctophmidae)、胃瘤线虫属(Eustrongylides)[1]。在分子生物学应用于线虫分类前, 线虫的分类和其他物种一样, 都是通过形态学进行分类鉴定, 由于种间大多数形态结构高度的相似性或种内某些形态结构的细微差异常常导致分类上的错误, 应为同种线虫被误认为不同种类或应为不同种线虫被误认为同种的现象时常发生, 如Cyathostoma verrucosum和Cyathostoma phenisci曾经被认为是不同种的线虫, 通过ITS 2基因序列分析比较, 确定了这2种生物为同种线虫[13]。随着分子生物学的不断发展, 采用分子生物学技术对线虫种类进行分类鉴定也越来越广泛, 本研究通过线虫18S rDNA基因序列分析, 与寄生在西太公鱼和西部食蚊鱼腹腔内的Eustrongylides ignotus的18S rDNA序列相似度分别达到100%和99.87%[6, 10], 确定了寄生于翘嘴鲌和花䱻腹腔内线虫均为伊胃瘤线虫。伊胃瘤线虫的ITS rDNA序列未见报道, 在GenBank上也没有记录, 首次明确了伊胃瘤线虫的ITS rDNA为997 bp序列, 与GenBank上的一些胃瘤线虫属未定种的ITS rDNA序列相似度分别达到99.80%以上, 说明这些尚未明确种类的胃瘤线虫属线虫均为伊胃瘤线虫。
3.2 幼虫的鉴定线虫种类繁多, 分布广, 有些营自由生活, 有些营寄生生活, 营寄生生活的线虫其生活史一般经过卵、幼虫和成虫3个阶段, 幼虫阶段分为Ⅰ、Ⅱ、Ⅲ和Ⅳ4个时期, 需要多个寄主。伊胃瘤线虫Ⅰ期和Ⅱ期幼虫在自然条件下的第一中间寄主尚未明确[14], 完整的生活史还不清楚, 但Ⅲ期和Ⅳ期幼虫寄生在东部食蚊鱼(Gambusia holbrooki)[4]等鱼类作为第二中间寄主, 成虫寄生于生食感染Ⅳ期幼虫鱼的大白鹭(Casnierodius albus)等鸟类[15], 这些鸟类成为终末寄主。根据Ⅳ期幼虫具有3层角质层的特征, 外层、中层和内层分别为Ⅱ期幼虫、Ⅲ期幼虫和Ⅳ期幼虫的角质层[11-12], 翘嘴鲌和花䱻腹腔内只发现Ⅳ期幼虫寄生, 未见Ⅲ期幼虫, 这可能与本研究采样时间在10—11月的季节有关, 在采样前几个月就已被感染, 采样时鱼腹腔内的Ⅲ期幼虫可能都已发育为Ⅳ期幼虫。
3.3 伊胃瘤线虫Ⅳ期幼虫的形态结构特征伊胃瘤线虫于1909年由Jägerskiöld根据寄生在食鱼鸟胃内的成虫形态结构进行命名[16], 以后又有学者对成虫形态结构进行了重描述和补充, 对自然感染于大蓝鹭(Ardea herodias)的伊胃瘤线虫成虫进行了虫体体长、内圈棘状乳突和外圈乳头状乳突的高和宽以及食道长等测定[17], 通过人工感染鸭子[Anas platyrhynchos domestica (L.)]得到的伊胃瘤线虫成虫, 其成虫体型大于Ⅳ期幼虫体型, 雄性成虫后端具有雄性特有的针状体结构[12]。线虫不同时期的幼虫和成虫形态结构有较大差异, 自然感染于中间寄主鱼类上的伊胃瘤线虫Ⅳ期幼虫的形态特征只有部分形态结构测定和简单描述的报道[12-13]。本研究除对寄生于翘嘴鲌和花䱻腹腔内的Ⅳ期幼虫虫体长宽、食道长宽和口腔长测定外, 补充测定了肠道长宽、棘状乳突和乳头状乳突的长、宽和高以及体侧斑突和尾斑突长宽等数据, Ⅳ期幼虫在体长、棘状乳突和乳头状乳突的高宽等方面明显小于已报道的成虫形态结构大小[17]。雄性Ⅳ期幼虫尚未见伸出体外的针状体结构, 雌性Ⅳ期幼虫也没有发现体内成熟卵。通过切片对伊胃瘤线虫Ⅳ期幼虫内部结构观察有报道, 但仅指出了体壁肌、肠系膜和肠道等组织器官的位置, 未对虫体内部组织器官的形态结构类型和特点进行更多的描述[15]。线虫体肌由单层的肌细胞组成, 一般被分隔为4个索区, 根据肌细胞数目, 排列形式等不同分为3种类型, 在一索间区中只有2~5个纵肌细胞为少肌型, 有很多纵肌细胞同时其一端伸入体腔为多肌型, 有很多纵肌细胞但其一端不伸入体腔为全肌型[18], 根据本线虫Ⅳ期幼虫体肌的肌细胞数量和同时其一端伸入体腔的特征, 体肌属于多肌型类型。根据食道腔横切面呈三放射形等食道结构的特点, Ⅳ期幼虫食道类似于蛔虫类ascaroid的食道类型[18]。由单层柱状上皮细胞组成的肠道, 肠细胞少于128个为少胞类, 128~800个为多胞类, 其余为极多胞类[18], 根据组成肠道细胞的数量, Ⅳ期幼虫属于多胞类的肠道结构。这些Ⅳ期幼虫的形态结构数据、体侧斑突和虫体内部结构等特征的进一步补充描述, 不仅丰富了该线虫的理论知识, 而且对该寄生虫的正确诊断等方面也有指导意义。
3.4 伊胃瘤线虫Ⅳ期幼虫的寄生特性伊胃瘤线虫对第二中间宿主鱼类具有明显的寄主特性, 在同一湖泊中只发现翘嘴鲌和花䱻腹腔内有寄生, 鳙、鲢、鲤、鲫和黄颡鱼的鱼体内外均未发现有该线虫寄生, 也没有鳙、鲢、鲤、鲫和黄颡鱼中感染该线虫的报道。翘嘴鲌广泛分布于中国黑龙江、辽河、黄河、长江、钱塘江、闽江、珠江等水系以及台湾地区, 已发展成为一种重要的养殖品种, 花䱻从黑龙江流域向南一直到浙江和福建等地都有分布, 在浙江和福建等地也已作为养殖种类之一[19], 这2种鱼中花䱻有寄生胃瘤线虫属线虫未定种的报道[7, 20], 在翘嘴鲌和花䱻腹腔内寄生线虫种类为伊胃瘤线虫均属首次报道。伊胃瘤线虫自然感染寄生于杂色剑尾鱼(Xiphophorus variatus)、黑莓鲈(Pomoxis nigromaculatus)、蓝鳍卢氏鳉(Lucania goodei)、加洲鲈(Micropterus salmoides)、蓝鳃太阳鱼(Lepomis macrochirus)、密西西比河太阳鱼(Lepomis gulosus)和黄鳝[12, 14]等淡水鱼类, 也寄生于美丽异小鳉(Heterandria formosa)、东部食蚊鱼和西部食蚊鱼[6, 14]等半咸水鱼类, 以及西太公鱼和杂交鲈等广盐性鱼类, 但这些广盐性鱼类只有生活在淡水或半咸水水域时才能被寄生[4, 10]。伊胃瘤线虫寄生鱼类对盐度有一定的要求, 不能寄生感染生活在高盐度水域中的鱼类, 因此属于非广盐性寄生的种类。伊胃瘤线虫对第二中间寄主鱼类寄生部位有特异性, 寄生在翘嘴鲌和花䱻腹腔内, 附着在内脏器官的表面和寄生在腹腔内的肝脏、脾脏和肠系膜形成包囊, 未在肾脏中发现, 与在黑莓鲈、蓝鳃太阳鱼、黄鳝和杂交鲈[4, 12, 14]等鱼类腹腔内寄生情况相似。观察到伊胃瘤线虫部分虫体裸露在鱼体表而认为可以寄生于西太公鱼腹壁组织的报道[10]实际是线虫穿越腹壁的一种现象, 在杂交鲈体表出现同样的现象被确认是线虫穿越腹壁的结果[4]。因此伊胃瘤线虫属于体内寄生虫, 不寄生于鳃、鳍条和腹壁鳞片下表皮和肌肉等组织器官。
3.5 寄主鱼的组织病理和炎症反应有研究报道伊胃瘤线虫成虫对终末寄主鸟类和其Ⅳ期幼虫对第二中间寄主鱼类的组织病理, 伊胃瘤线虫成虫寄主于大白鹭(Casmerodius albus)等鹳形目鸟类, 导致它们的胃肠穿孔、充血、出血和虫体周围的组织坏死, 进入鸟类腹腔后, 可寄生于肝脏、胰腺、脾脏和肾等内脏组织器官, 出现不同程度的肉芽肿等炎症反应[15, 21]。自然感染伊胃瘤线虫Ⅳ期幼虫的寄主鱼体组织病理变化鲜有报道, 只有寄生引起杂交鲈病理变化的简单描述, Ⅳ期幼虫寄生在杂交鲈的肠道和腹腔内, 组织病理变化只提及在腹腔壁引起由纤维细胞、小毛细血管和少量分散淋巴细胞组成的慢性肉芽肿炎症反应而形成的包囊, 对腹腔壁的横纹肌有压迫作用[4]。伊胃瘤线虫Ⅳ期幼虫对翘嘴鲌和花䱻寄生部位的组织病理损伤作用属首次报道, 形成的包囊壁结构与伊胃瘤线虫感染杂交鲈形成的包囊壁相似, 但在包囊壁组织内浸润的白细胞种类上有本质区别, 杂交鲈形成的包囊壁组织中浸润的白细胞为淋巴细胞, 数量少而分散, 而翘嘴鲌和花䱻形成的包囊壁组织中浸润的白细胞为嗜酸性白细胞, 随着包囊发生发展, 嗜酸性白细胞大量聚集在包围虫体周围的包囊壁组织内, 出现严重的炎症反应。同时本文首次报道了包囊发生、发展和破裂的过程, 包囊壁从纤维细胞、毛细血管和嗜酸性白细胞逐渐增多到最大程度后, 包囊壁组织细胞逐渐出现坏死到大量坏死脱落而破裂的过程, 线虫又可以进入腹腔, 包囊壁组织细胞大量坏死而破裂是否是由于线虫分泌某些物质造成的有待进一步证实。肝脏紧靠肠道且该器官相对比较大, 是线虫的主要靶器官, 除对肝脏有压迫作用外, 感染严重时肝脏组织出现充血和含铁血黄素沉着, 部分肝细胞出现坏死现象。脾脏组织器官相对比较小, 偶尔有线虫寄生, 会出现缺血和含铁血黄素沉着的病理现象。含铁血黄素沉着属于变性的组织病理之一, 一般当红细胞破坏时, 由血红蛋白分解而产生, 沉积在组织中所表现的结果[22], 表明伊胃瘤线虫寄生还对肝脏和脾脏组织中的红细胞有损伤作用。肠道组织病理表现肠道壁穿孔, 留下孔洞, 线虫穿过肠道的黏膜层、黏膜下层、肌层和浆膜层, 留下各层缺损而进入腹腔, 显然腹腔中的线虫是通过消化道而感染的。尽管伊胃瘤线虫寄生的翘嘴鲌和花䱻无体外症状, 但不同程度地对鱼尤其感染强度高的鱼内脏组织产生显微病理的损伤作用, 可降低抗病力, 也可引起细菌等病原继发性感染等方面的负面影响, 因此应该积极做好防控工作, 由于该线虫寄生在鱼腹腔内, 通过药物治疗很难奏效, 弄清其生活史, 通过杀灭第一中间寄主的生物从而切断生活史是最有效的防控方法之一。
| [1] |
Zhang J Y, Qiu Z Z, Ding X J, et al. Parasites and Parasitic Diseases of Fishes[M]. Beijing: Science Press, 1999: 560-616. [张剑英, 邱兆祉, 丁雪娟. 鱼类寄生虫与寄生虫病[M]. 北京: 科学出版社, 1999: 560-616.]
|
| [2] |
Williams C F, Moravec F, Turnbull J F, et al. Seasonal development and pathological changes associated with the parasitic nematode Philometroides sanguineus in wild crucian carp Carassius carassius (L.) in England[J]. Journal of Helminthology, 2012, 86(3): 329-338. DOI:10.1017/S0022149X11000356 |
| [3] |
Menezes R C, Tortelly R, Tortelly-Neto R, et al. Camallanus cotti Fujita, 1927 (Nematoda, Camallanoidea) in ornamental aquarium fishes: Pathology and morphology[J]. Memórias do Instituto Oswaldo Cruz, 2006, 101(6): 683-687. DOI:10.1590/S0074-02762006000600018 |
| [4] |
Mitchell A J, Overstreet R M, Goodwin A E. Eustrongylides ignotus infecting commercial bass, Morone chrysops female X Morone saxatilis male, and other fish in the southeastern USA[J]. Journal of Fish Diseases, 2009, 32(9): 795-799. DOI:10.1111/j.1365-2761.2009.01051.x |
| [5] |
Utuk A E, Piskin F C, Balkaya I. Molecular detection of Anisakis pegreffii in horse mackerels (Trachurus trachurus) sold for human consumption in Erzurum province of Turkey[J]. Kafkas niversitesi Veteriner Fakültesi Dergisi, 2012, 18(2): 303-307. |
| [6] |
Koehler A V A, Hoberg E P, Torres-Pérez F, et al. A molecular view of the superfamily Dioctophymatoidea (Nematoda)[J]. Comparative Parasitology, 2009, 76(1): 100-104. DOI:10.1654/4366.1 |
| [7] |
Xiong F, Li W X, Wu S G, et al. Molecular phylogeny and host specificity of the larval Eustrongylides (Nematoda: Dioctophmidae) from freshwater fish in China[J]. Journal of Parasitology, 2013, 99(1): 137-144. DOI:10.1645/GE-3163.1 |
| [8] |
Ederli N B, Gallo S S M, Oliveira L C, et al. Description of a new species Physaloptera goytaca n. sp. (Nematoda, Physalopteridae) from Cerradomys goytaca Tavares, Pess a & Gon alves, 2011 (Rodentia, Cricetidae) from Brazil[J]. Parasitology Research, 2018, 117(9): 2757-2766. DOI:10.1007/s00436-018-5964-x |
| [9] |
Asakawa M, Kimoto Y, Murata K. First record of Eustrongylides tubifex (Dioctophymatidae) from little grebe, Tachybaptus ruficollis in Japan[J]. Journal of Veterinary Medical Science, 1997, 59(10): 955-956. DOI:10.1292/jvms.59.955 |
| [10] |
Abe N. Molecular and morphological identification of helminthes found in Japanese smelt, Hypomesus transpacificus nipponensis, with notes on new host records of Eustrongylides ignotus and Raphidascaris gigi[J]. Acta Parasitologica, 2011, 56(2): 227-231. |
| [11] |
Coyner D F, Spalding M G, Forrester D J. Epizootiology of Eustrongylides ignotus in Florida: Transmission and development of larvae in intermediate hosts[J]. Journal of Parasitology, 2003, 89(2): 290-298. DOI:10.1645/0022-3395(2003)089[0290:EOEIIF]2.0.CO;2 |
| [12] |
Xiong F, Wang G T, Wu S G, et al. Development of Eustrongylides ignotus (Nematoda: Dioctophmida) in domestic ducks (Anas platyrhynchos domestica (L.))[J]. Journal of Parasitology, 2009, 95(5): 1035-1039. DOI:10.1645/GE-2057.1 |
| [13] |
Kanarek G, Horne E C, Zaleśny G. Cyathostoma (Cyatho stoma) phenisci Baudet, 1937 (Nematoda: Syngamidae), a parasite of respiratory tract of African penguin Spheniscus demersus: Morphological and molecular characterisation with some ecological and veterinary notes[J]. Parasitology International, 2013, 62(5): 416-422. DOI:10.1016/j.parint.2013.05.002 |
| [14] |
Coyner D F, Spalding M G, Forrester D J. Epizootiology of Eustrongylides ignotus in Florida: Distribution, density, and natural infections in intermediate hosts[J]. Journal of Wildlife Diseases, 2002, 38(3): 483-499. DOI:10.7589/0090-3558-38.3.483 |
| [15] |
Spalding M G, Forrester D J. Pathogenesis of Eustrongylides ignotus (Nematode: Dioctophymatoidea) in ciconiiformes[J]. Journal of Wildlife Diseases, 1993, 29(2): 250-260. DOI:10.7589/0090-3558-29.2.250 |
| [16] |
J gerski ld L A. Zur kenntnis der nematoden-gattungen Eustrongylides und Hystrichis[J]. Nova acta Regiae Societatis Scientiarum Upsaliensis, 1909, 2(4): 1-48. |
| [17] |
Measures L N. Revision of the genus Eustrongylides J gerski ld, 1909 (Nematoda: Dioctophymatoidea) of piscivorous birds[J]. Canadian Journal of Zoology, 1988, 66(4): 885-895. DOI:10.1139/z88-131 |
| [18] |
Tang Z Z, Tang C T. Human and Animal Nematology[M]. Beijing: Science Press, 2009: 1-75. [唐仲璋, 唐崇惕. 人兽线虫学[M]. 北京: 科学出版社, 2009: 1-75.]
|
| [19] |
Shi Q, Fan M J, Zhang Y. Economically Important Fish in China[M]. Wuhan: Huazhong University of Science & Technology Press, 2015: 55-149. [石琼, 范明君, 张勇. 中国经济鱼类志[M]. 武汉: 华中科技大学出版社, 2015: 55-149.]
|
| [20] |
Jin S, Wang G L, Zhao Q S, et al. Scanning electron microscopic observation on the pathogen of nematode disease in freshwater fish[J]. Chinese Journal of Veterinary Science, 2005, 25(2): 159-161. [金珊, 王国良, 赵青松, 等. 淡水鱼类线虫病的病原及其扫描电镜观察[J]. 中国兽医学报, 2005, 25(2): 159-161. DOI:10.3969/j.issn.1005-4545.2005.02.015] |
| [21] |
Pinto R M, Barros L A, Tortelly L, et al. Prevalence and pathology of helminths of ciconiiform birds from the Brazilian swamplands[J]. Journal of Helminthology, 2004, 78(3): 259-264. DOI:10.1079/JOH2004243 |
| [22] |
Li P L, Wang S Q, Qiu Z D, et al. Animal Pathology[M]. Changchun: Jilin Science and Technology Press, 1994: 90-121. [李普霖, 王水琴, 邱震东, 等. 动物病理学[M]. 长春: 吉林科学技术出版社, 1994: 90-121.]
|
 2019, Vol. 26
2019, Vol. 26

