2. 上海海洋大学教育部水产遗传资源开发利用重点实验室, 上海 201306;
3. 上海海洋大学上海水产养殖工程技术研究中心, 上海 201306
2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Ocean University, Shanghai Aquaculture Engineering Technology Research Center, Shanghai 201306, China
牙鲆(Paralichthys olivaceus)不仅是中国重要的海水经济鱼类, 同时也是研究脊椎动物变态发育的模式鱼类, 在其早期生活史中, 有一个从仔鱼到稚鱼阶段的典型变态过程。牙鲆变态前后, 其组织结构、形态、生理和行为等都发生了剧烈而显著的变化, 比如右眼移到左侧、浮游生活到底栖伏底生活[1]。随着牙鲆仔鱼眼睛的移位和生活方式的改变, 其生活环境光线等发生了显著变化, 光线感受能力也发生了改变。那么其视网膜感光系统在变态过程中是否也发生了改变, 或者发生了哪些改变?到目前为止, 并未见这方面的报道。之前已研究表明, 甲状腺激素(thyroid hoemone, TH)对牙鲆仔鱼变态起着关键的调控作用, 在变态前仔鱼中加入外源性TH能显著加速其变态进程[2]。在牙鲆变态发育过程中, TH是否调控变态仔鱼的视网膜感光系统发育, 到目前为止, 未见有研究报道。
在鱼类中, 视网膜感光系统参与对外界光环境的适应, 形成的视觉是其接收外界信息的重要途径, 在集群、生殖、摄食、求偶、逃避敌害、环境适应及生理学功能等方面发挥重要的生物学作用。感光系统是由眼睛组织中具有感光功能的视网膜组成。视网膜为精细的感光细胞层, 包括视锥细胞和视杆细胞, 由同一多向分化潜能的视网膜光感受器前体细胞(PPC)分化而来, 在特异性转录因子的作用下分化为不同类型的感光细胞亚型。同源异型框蛋白2(Otx2)属OTX家族[3], 作为重要的转录因子可诱导视网膜干细胞(RSC)向PPC分化, 参与视网膜光感受器细胞的分化过程, 是感光细胞产生和成熟过程中的关键因子[4]。在脊椎动物发育中, Otx2的表达具有一定的时间性和空间性。胚胎发育早期, Otx2广泛分布在外胚层中; 但在发育后期, Otx2主要分布在前脑和包括眼区在内的中脑[5]。此外, Otx2与脊椎动物的脑垂体、松果体[6]、眼睛[7]等组织的发育密切相关。体外实验还表明Otx2可以激活视紫红质和M视锥蛋白启动子的活性[6]。
MicroRNAs(miRNAs)是一类长度21~23 nt的内源性单链小分子RNA[8-9], 通过和其靶基因3′UTR区部分或完全碱基互补配对, 不同程度的降解或抑制靶基因的蛋白表达, 从而实现对基因的转录后调控[10-11]。miR-124是中枢神经系统特异性表达的miRNA, 从低等的秀丽线虫到高等的人类均有表达, 其结构和功能高度保守[12]。本实验通过对牙鲆变态早期和高峰期进行高通量测序, 鉴定出多个差异性miRNAs, 并筛选感光相关miRNA miR-124。Lagos-Quintana等[13]首次在小鼠中发现miR-124在神经系统中特异表达, 随后开始被广泛关注。其在哺乳动物中枢神经系统中的表达量是其他组织的100多倍[14]。此外在多个物种的眼睛组织中表达丰富, 主要集中表达于神经视网膜感光细胞, 在神经发生、分化, 视觉感光, 神经免疫等多种生理功能中均有参与。
在本研究中, 拟以变态期牙鲆仔鱼为研究对象, 利用生物信息学、分子生物学和细胞生物学等技术方法, 分析Otx2和pol-miR-124基因在牙鲆组织和变态过程中的表达模式, 以及在外源性TH调控牙鲆仔鱼变态过程中Otx2和pol-miR-124基因的表达调控, 最后将进一步分析pol-miR-124与Otx2基因之间的靶向关系。通过此研究, 将初步了解TH在调控牙鲆变态过程中对视网膜感光系统发育相关的转录因子以及miRNAs小分子的调控作用, 进而为进一步了解TH在变态过程中调控感光系统发育的分子机制奠定基础, 并期望为揭示甲状腺激素调控牙鲆变态发育的机制提供研究积累。
1 材料与方法 1.1 实验材料与试剂 1.1.1 实验用鱼及采集牙鲆变态时期仔鱼采集于中国水产科学研究院北戴河中心实验站。仔鱼养殖期间每天换水、吸污, 水温控制在17±2℃, 盐度30, 每天定时定量投喂轮虫和卤虫无节幼体。将孵化后13 d (13dph)的仔鱼随机分为2组(每组各3个缸饲养), 继续饲养至15 d (15dph)进行药物处理: ①正常对照组(NC组), 在天然过滤海水中饲养; ②甲状腺激素处理组(TH组), 在天然过滤海水中外源添加0.1 mg/L的TH(L-Thyroxine, T4)饲养[15]。根据Minami[16]牙鲆早期发育阶段的划分方法选取6个发育时期进行采样, 17 d (17 dph, 变态未开始); 20 d (20 dph, 右眼刚刚开始移位); 24 d (24 dph, 变态前期, 右眼移至背侧但在另一侧无法看到右眼); 28 d (28 dph, 变态高峰期, 在另一侧能够看到右眼但还未移至背中线处); 32 d (32 dph, 变态后期, 右眼移至背中线处)和36 d (36 dph, 变态完成期, 两只眼睛均位于头部左侧)。每个发育时期均采取3组平行样品作为生物学重复, NC组与TH组同步采样, 保证实验准确性, 减少误差。采取的仔鱼样品迅速用DEPC水清洗后立刻放入Trizol中并置于–80℃冰箱中保存备用。
牙鲆成鱼购买自上海水产市场, 实验室暂养一周, 分别采取性腺、脑、眼睛、腮、胃、心脏、肠、肾脏、肌肉、肝脏共10个成鱼组织, 采取的成鱼各组织样品迅速用DEPC水清洗后立刻放入Trizol中并置于–80℃冰箱中保存备用。
1.1.2 主要试剂总RNA提取试剂Trizol® Reagent购自Invitrogen公司; DNaseⅠ、反转录试剂盒、T4 DNA连接酶、FuGENE® HD转染试剂购自Promega公司; Ex TaqTM、pMD19-T Vector Cloning Kit购自TAKARA公司; iTaq Universal SYBR® Green Supermix购自BIO-RAD公司; 琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒购自OMEGA公司; DNA Marker、琼脂糖、L-Thyroxine购自上海生工生物有限公司; SacⅠ、XhoⅠ限制性内切酶购自NEB公司; Dual-Luciferase® Reporter Assay System试剂盒购自上海翌圣生物有限公司; pmirGLO Vector由本实验保存; MicroRNA mimics由吉玛基因合成; 引物合成及菌液测序均在上海生工进行。
1.2 靶基因预测根据已筛选得到的pol-miR-124成熟体序列以及NCBI牙鲆基因组中Otx2 3′UTR区序列。我们通过miRNAs数据库网站miRBase (http://www.mirbase.org/)和靶基因在线预测网站RNAhybrid (http://bibiserv.techfak.uni-bielefeld.de/rnahybrid/submission.html)等预测pol-miR-124与潜在靶基因Otx2 3′UTR区的结合位点。
1.3 总RNA提取及反转录按照Trizol® Reagent试剂说明书中的方法提取各样品的总RNA。用NANODROP 2000C测定各样品总RNA的浓度和OD260/OD280的比值(OD260/ OD280均在1.8~2.0之间)。用1%的琼脂糖凝胶电泳检测各样品总RNA的完整性, 确认各样品的总RNA均符合实验要求, 放于–80℃冰箱保存备用。以DNaseⅠ处理后的总RNA作为模板, 利用反转录试剂盒合成cDNA, 反转录引物见表 1。反转录后的cDNA用于PCR扩增或放于–20℃冰箱用于后续实验。
|
|
表 1 本实验中所用引物 Tab.1 Designed primers used in the experiment |
利用CFX96 TouchTM Real-Time PCR Detection System(Bio-Rad, 美国)仪器进行RT-qPCR实验。使用Primer Premier 5.0软件设计pol-miR-124以及Otx2的定量引物(表 1), 以5倍稀释后cDNA为模板, 反应体系如下: iTaq Universal SYBR® Green Supermix 10 μL, cDNA 1 μL, 上下游引物各0.4 μL, 加ddH2O补至20 μL。qPCR程序采用两步法, 循环参数设为94℃预变性30 s, 94℃变性15 s, 60℃退火20 s, 40个循环, 然后进行溶解曲线扩增。分别以5S rRNA、β-actin为内参基因, 每个样品设置3个生物学重复和两个技术重复。定量数据采用2–ΔΔCT的方法分析, 数值的表示方式采用平均值±标准误差(mean±SE)表示, n=3。通过SigmaPlot 12.5软件进行作图分析, 当P < 0.05时差异显著。
1.5 Otx2 3′UTR区克隆及重组载体的构建根据Otx2基因的3′UTR序列, 运用Primer5.0软件设计扩增引物(表 1), 以牙鲆的cDNA为模板进行普通PCR扩增。反应体系如下: Ex Taq 0.2 μL、10×Ex Taq Buffer 2.0 μL、dNTP Mixture(2.5 nmol/L) 2.0 μL、25 nmol/L MgCl2 2.0 μL、cDNA 1.0 μL、上下游引物各1.0 μL, 用ddH2O补至20 μL。反应条件为: 94℃预变性5 min; 94℃变性30 s, 58℃退火30 s, 72℃延伸1 min, 共计35个循环。PCR产物用1%琼脂糖凝胶电泳分离并割取目的条带, 目的条带用OMEGA琼脂糖凝胶回收试剂盒纯化回收。将回收纯化产物连接到pMD19-T克隆载体上, 16℃连接过夜后转化到DH5α大肠杆菌中, 随后进行蓝白斑筛选, 挑取单克隆菌斑, 菌液PCR验证后选取阳性克隆送至上海生工测序, 测序正确后将载体命名为pMD19T-Otx2。
使用XhoⅠ、XbaⅠ限制性内切酶对pmirGLO Vector和pMD19T-Otx2进行双酶切, 回收目的产物并使用T4 DNA连接酶连接过夜, 转化到DH5α大肠杆菌中, 进行蓝白斑筛选, 质粒小提后进行双酶切和测序验证, 验证成功的野生型重组载体命名为pmirGLO-Otx2。
1.6 细胞培养及转染293T细胞培养于10%-FBS的培养液中, 隔天传代一次。转染前一天将细胞接种于48孔细胞培养板中, 当细胞密度达到70%左右进行转染实验。将0.4 μg野生型重组载体pmirGLO-Otx2和12 pmol的各negative control mimicis、miR-124 mimicis、1 μL FuGENE® HD转染试剂分别用不含FBS和抗生素的细胞培养液稀释到50 μL (n=3), 两者混匀后孵育20 min, 分别加到对应的细胞孔中, 6 h后更换新鲜的完全培养液, 37℃, 5%CO2继续培养24 h。荧光素酶活性检测按照Dual- Luciferase® Reporter Assay System说明书进行, 记录Firefly Luciferase与Renilla Luciferase比值(n=3), 用SigmaPlot12.5软件作图, 用One-Way方差分析(ANOVA)分析各组数据的显著性差异, 当P < 0.05时差异显著。
2 结果与分析 2.1 pol-miR-124和Otx2在成鱼组织中的表达荧光定量结果显示, pol-miR-124和Otx2在成鱼各组织中均有不同的表达水平(图 1)。如图 1A所示, pol-miR-124在成鱼脑、眼睛组织中特异性表达(P < 0.05), 肝脏、性腺组织表达次之, 其他组织表达较低; 如图 1B所示, Otx2基因在眼睛、脑组织中表达特异(P < 0.05), 性腺组织表达水平较高, 其他各组织表达无差异。
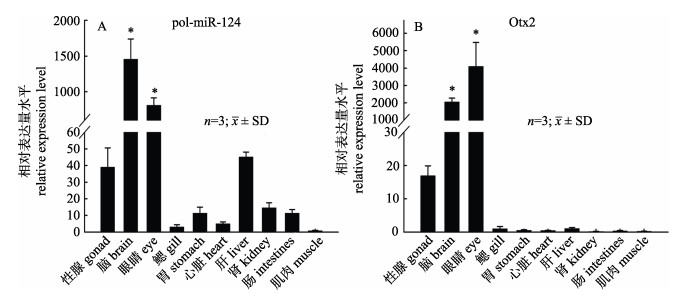
|
图 1 牙鲆miR-124和Otx2基因在成鱼组织中的表达 Fig.1 The levels of expression pol-miR-124 and Otx2 in adult tissues of Paralichthys olivaceus |
定量结果显示: pol-miR-124和Otx2在牙鲆仔鱼正常变态期间具有不同的表达模式(图 2)。如图 2A所示, pol-miR-124在17~28 dph期间表达量逐渐上升至28 dph变态高峰期达到峰值(P < 0.05), 后期逐渐下降; 如图 2B所示, Otx2的表达模式与pol-miR-124相似, 在17~20 dph表达量上升, 24 dph略有下降, 28 dph变态高峰期表达量最高(P < 0.05), 变态后期逐渐下降, 但在变态期整体表达水平均高于pol-miR-124的表达。
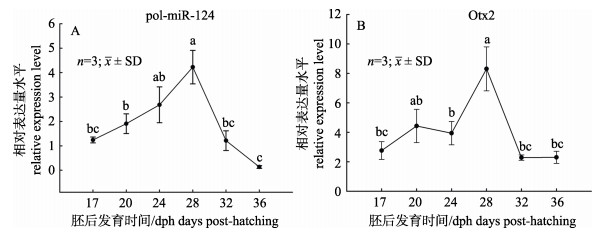
|
图 2 牙鲆miR-124和Otx2基因在早期发育中的表达 Fig.2 Expression levels of pol-miR-124 and Otx2 during early development |
外源添加T4处理未变态仔鱼, 其形态发生改变, 明显加速其变态。如图 3所示, NC组仔鱼体型较大, 在17~28 dph期间, 冠状幼鳍逐渐吸收消失, 右眼缓慢移动至头顶处, 体表黑色素沉积, 28 dph变态高峰期进入底栖生活; 而TH组仔鱼体型较小, 在24 dph眼睛移动基本完成, 体表色素沉积明显, 已进入底栖生活渡过变态期。
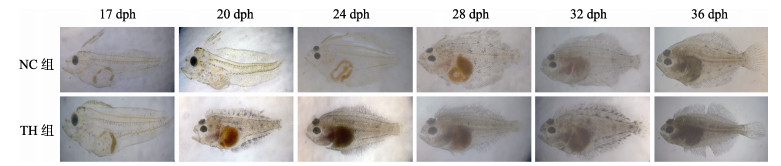
|
图 3 NC组与TH组仔鱼形态变化对比 Fig.3 The comparison of morphological changes between the NC and TH groups larvae |
为了探究牙鲆变态期TH对pol-miR-124的调控作用, 以及在pol-miR-124的作用下, 对Otx2表达量的影响, 首先用外源性TH处理未变态的牙鲆仔鱼, pol-miR-124和Otx2表达量在仔鱼变态期不同时间点进行了研究。结果表明, pol-miR- 124和Otx2的表达水平受TH的影响(图 4)。如图 4A所示, 与正常组pol-miR-124的表达量相比, 在TH处理组17 dph、20 dph、24 dph中pol-miR- 124表达量下降, 且24 dph显著降低(P < 0.05), 但在28 dph、32 dph、36 dph中pol-miR-124表达量上升。然而, Otx2的表达量则呈现相反趋势。如图 4B所示, 与正常组Otx2的表达量相比, 在TH处理组17 dph、20 dph、24 dph中Otx2表达量上升, 在28 dph、32 dph、36 dph中pol-miR-124表达量降低, 36 dph显著降低(P < 0.05)。由此可知, 在外源TH的作用下, 牙鲆miR-124能够负性调节Otx2的表达。
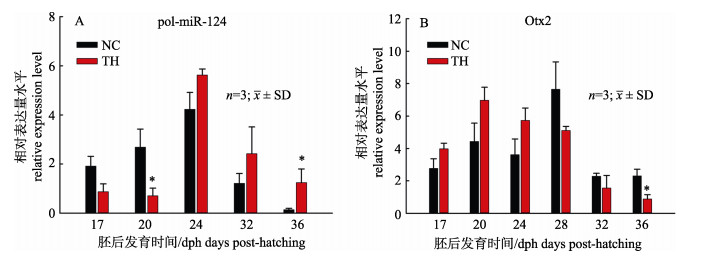
|
图 4 牙鲆变态期间pol-miR-124和Otx2在外源TH作用下的相对表达量 带星号的数值与正常对照组(NC)的相应值有显著差异(P < 0.05). Fig.4 Relative expression levels of pol-miR-124 and Otx2 mRNAs on exogenous TH treatment of Paralichthys olivaceus Values with asterisk are significantly different (P < 0.05) from the corresponding value for the normal control (NC). |
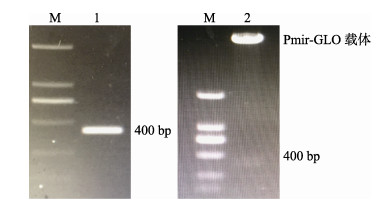
以牙鲆cDNA为模板, 根据Otx2 3′UTR区序列设计特异性扩增引物, 克隆出长度为400 bp的Otx2 3′UTR区序列, 电泳特异性条带如图所示(图 5, 泳道1), 与预测条带大小相符, 表明成功克隆出了Otx2 3′UTR区序列。将构建好的野生型重组载体pmirGLO-Otx2用XhoⅠ、XbaⅠ进行双酶切验证, 得到线性质粒和Otx2 3′UTR区基因片段, 电泳分析显示(图 5, 泳道2)大小分别约为7300 bp和400 bp, 将重组质粒送至上海生工进行测序鉴定, 与预期结果相符, 表明野生型pmirGLO-Otx2重组报告载体构建成功。
|
图 5 Otx2 3′UTR克隆及pmirGLO-Otx2重组载体双酶切鉴定 M: DL2000 DNA Marker; 1: Otx2 3′UTR克隆片段; 2: pmirGLO-Otx2双酶切产物鉴定. Fig.5 Result of Otx2 3′UTR cloning fragment and recombinant plasmid of pmir-GLO-Otx2 by double digestion M: DL2000 DNA Marker; 1: Otx2 3′UTR fragment; 2: Recombinant plasmid of pmir-GLO-Otx2 by double digested fragment. |
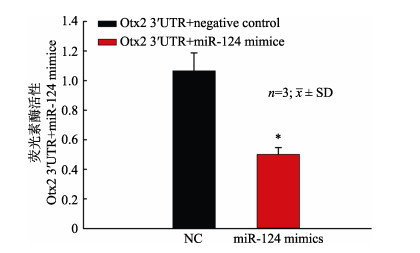
为验证pol-miR-124与Otx2之间是否存在负调控关系。将构建好的野生型重组载体pmirGLO- Otx2分别和negative control mimicis、pol-miR-124 mimicis共同转染于293T细胞中进行荧光素酶活性检测。结果显示(图 6), pmirGLO-Otx2+pol- miR-124 mimicis组的荧光素酶活性明显低于对照组活性(P < 0.05)。结果表明: pol-miR-124与Otx2 3′UTR通过种子序列之间的互补配对Otx2产生抑制效果, 验证了pol-miR-124靶向负调控Otx2基因的表达。
|
图 6 转染重组载体pmirGLO-Otx2后荧光酶活性分析 NC:对照组, pmirGLO-Otx2质粒+negative control mimics; A: pmirGLO-Otx2质粒+pol-miR-124 mimics; *代表显著差异(P < 0.05). Fig.6 Luciferase activity of reporter plasmid containing Otx2 3′UTR NC: Control group, pmirGLO-Otx2 and negative control mimics; A: pmirGLO-Otx2 and pol-miR-124 mimics; Asterisks represented the statistical significant differences (P < 0.05). |
MiRNAs在眼睛组织中特异性表达并参与视网膜形成过程中的细胞增殖、分化等生物过程。目前, 在视网膜中优先或特异性表达的miRNAs至少有78种, 并且有21种可能是视网膜所特有的[17]。miR-124是视网膜发育过程中的关键调控因子, 通过特异性作用于靶基因3′UTR的结合位点, 调控眼睛视网膜细胞的发育、分化和衰老等过程。miR-124在不同物种间高度保守, 在物种间miR-124家族成员不同, 例如:多数无脊椎动物只具有一个miR-124, 在斑马鱼中, miR-124家族成员有6个(miR-124-1、miR-124-2、miR-124-3、miR-124-4、miR-124-5、miR-124-6), 在鸟类和哺乳类动物中, miR-124家族通常具有3个成员(miR-124-1、miR-124-2、miR-124-3), 在低等动物到高等动物的进化过程中miR-124家族出现了多个拷贝, 可能是基因重复造成的[18]。miR-124还可以通过沉默转录因子(CoREST)调节产生神经细胞Nrp-1, 通过改变Sema3A在视网膜神经节细胞轴突发生及生长过程的作用, 引起视网膜神经节细胞轴突生长方式发生改变[19]。本实验通过生物信息学方法预测pol-miR-124的潜在靶基因, 筛选与感光相关基因Otx2。Otx2是眼区建立的相关转录因子[20], 参与脊椎动物视网膜的形成过程。Otx2+/–小鼠会导致多种眼部缺陷, 例如视网膜色素上皮增生、角膜缺失等[21]。除此之外, Otx2还能够调控视网膜色素上皮细胞的产生并维持其功能, 对感光细胞起到重要的保护作用[22]。这些研究表明miR-124和Otx2调控着生物体中枢神经和感光的发育, 但迄今为止两者在牙鲆变态过程的中的相关研究还未见报道。
本实验研究了pol-miR-124和Otx2基因在牙鲆成鱼各组织中的表达水平, 探讨二者对牙鲆各组织的调控表达模式。定量结果表明:在成鱼各组织中均检测到pol-miR-124和Otx2的表达, 但两者主要集中在脑、眼睛组织表达, 表达量是其他组织的几千倍。二者在牙鲆各组织的表达水平与其他物种具有相似性。两者与牙鲆仔鱼头部发育密切相关, 尤其是眼睛感光的发育。pol-miR- 124和Otx2在变态早期发育过程中的表达模式与变态发育过程相一致, 具有明显的发育性调节。前期表达量逐渐增强, 在28 dph变态高峰期表达量达到峰值, 变态后期逐渐下降, 但Otx2在整个发育时期明显高于pol-miR-124的表达。值得关注的是, pol-miR-124和Otx2均在28 dph表达量最高, 此时期是仔鱼眼睛移位、视轴的偏转、从浮游性向底栖稚鱼型转变的重要时期[23-24]。此结果表明发育性调节因子pol-miR-124和Otx2调控变态期仔鱼眼睛感光系统的发育。
牙鲆的变态发育受多种激素调节, 在变态期TH的表达和分布存在时间差异性, 能够加速仔鱼向稚鱼的变态进程[25-26]。TH依赖于与分布在生物体各组织中的甲状腺受体结合, 实现其对靶基因的转录调节, 对生物有机体的生长发育和正常代谢具有十分重要的作用[27]。外源T4处理未变态仔鱼后, 与正常组仔鱼相比形态上发生显著变化, 从体型对称的浮游仔鱼向非对称的底栖仔鱼发育, 冠状幼鳍消失、双眼位于一侧、体表色素沉积、体型较小, 在24 dph提前完成变态。本实验发现牙鲆miR-124和Otx2基因的表达受TH调控, 并且与形态变化相对应, 在变态前期, pol- miR-124表达量低于正常组, Otx2表达量高于正常组; 在变态高峰期和变态后期, pol-miR-124表达量高于正常组, Otx2表达量低于正常组。TH调控下, pol-miR-124与Otx2两者在牙鲆变态期间用下呈现负调控关系。上述结果表明在TH调控牙鲆变态感光发育的分子信号通路中, pol-miR-124和Otx2发挥重要功能且二者之间可能存负调控关系。
MiRNAs的靶基因验证, 是探讨miRNAs功能的重要依据。为了验证pol-miR-124与Otx2是否存在靶向关系, 报告基因检测方法是现在常用的一种验证手段, 敏感性高, 操作性强等[28]。因此通过构建pmirGLO-Otx2重组报告载体并转染293T细胞, 在细胞水平验证其靶向关系。结果表明pmirGLO-Otx2+ pol-miR-124 mimicis组的荧光素酶活性明显低于对照组活性(P < 0.05), Otx2基因是pol-miR-124的靶基因, 进一步验证了pol-miR-124能够负调控Otx2基因。综上所述, pol-miR-124和Otx2在变态期受TH调控, 且miR-124通过下游Otx2基因调控仔鱼感光系统的发育, 表明了TH、pol-miR-124、Otx2三者必然存在一种共调控关系, 保证仔鱼感光细胞的发育成熟和变态的顺利完成。但其具体的调控关系还需今后进一步探讨挖掘。为牙鲆仔鱼变态机制的研究提供了新的理论依据。
| [1] |
Inui Y, Yamano K, Miwa S. The role of thyroid hormone in tissue development in metamorphosing flounder[J]. Aquaculture, 1995, 135(1-3): 87-98. DOI:10.1016/0044-8486(95)01017-3 |
| [2] |
Zhang Z Y, Bao B L. The effects of thyroid hormone on the early developmental stage of fish[J]. Journal of Shanghai Fisheries University, 1999, 8(1): 68-75. [张臻宇, 鲍宝龙. 鱼类早期发育阶段甲状腺激素的作用[J]. 上海海洋大学学报, 1999, 8(1): 68-75.] |
| [3] |
Nishida A, Furukawa A C, Tano Y, et al. Otx2 homeobox gene controls retinal photoreceptor cell fate and pineal gland development[J]. Nature Neuroscience, 2003, 6(12): 1255-1263. DOI:10.1038/nn1155 |
| [4] |
Qiu Y, Peng G H. Research advances in OTX2 and CRX regulating development and differentiation of retinal photoreceptors[J]. Recent Advances in Ophthalmology, 2015, 35(3): 287-289. [邱莹, 彭广华. OTX2和CRX调控视网膜光感受器细胞发育分化的研究进展[J]. 眼科新进展, 2015, 35(3): 287-289.] |
| [5] |
Simeone A, Acampora D, Mallamaci A, et al. A vertebrate gene related to orthodenticle contains a homeodomain of the bicoid class and demarcates anterior neuroectoderm in the gastrulating mouse embryo[J]. The EMBO Journal, 1993, 12(7): 2735-2747. DOI:10.1002/j.1460-2075.1993.tb05935.x |
| [6] |
Morsli H, Tuorto F, Choo D, et al. Otx1 and Otx2 activities are required for the normal development of the mouse inner ear[J]. Development, 1999, 126(11): 2335-2343. |
| [7] |
Koike C, Nishida A, Ueno S, et al. Functional roles of Otx2 transcription factor in postnatal mouse retinal development[J]. Molecular & Cellular Biology, 2007, 27(23): 8318-8329. |
| [8] |
Lagos-Quintana M, Rauhut R, Lendeckel W, et al. Identification of novel genes coding for small expressed RNAs[J]. Science, 2001, 294(5543): 853-858. DOI:10.1126/science.1064921 |
| [9] |
Carthew R W, Sontheimer E J. Origins and mechanisms of miRNAs and siRNAs[J]. Cell, 2009, 136(4): 642-655. |
| [10] |
Bushati N, Cohen S M. MicroRNA functions[J]. Annual Review of Cell and Developmental Biology, 2007, 23(1): 175-205. DOI:10.1146/annurev.cellbio.23.090506.123406 |
| [11] |
Bartel D P. MicroRNAs:genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297. DOI:10.1016/S0092-8674(04)00045-5 |
| [12] |
Meza-Sosa K F, Valle-García D, Pedraza-Alva G, et al. Role of microRNAs in central nervous system development and pathology[J]. Journal of Neuroscience Research, 2012, 90(1): 1-12. |
| [13] |
Chen J S, Zeller R W. Using engineered microRNAs as vectors for animal RNA interference:promises and challenges[J]. Advances in Bioscience and Biotechnology, 2014, 5(4): 301-310. DOI:10.4236/abb.2014.54037 |
| [14] |
Mishima T, Mizuguchi Y, Kawahigashi Y, et al. RT-PCR-based analysis of microRNA (miR-1 and -124) expression in mouse CNS[J]. Brain Research, 2007, 1131: 37-43. DOI:10.1016/j.brainres.2006.11.035 |
| [15] |
Inui Y, Miwa S. Thyroid hormone induces metamorphosis of flounder larvae[J]. General and Comparative Endocrinology, 1985, 60(3): 450-454. DOI:10.1016/0016-6480(85)90080-2 |
| [16] |
Minami T. The early life history of a flounder Paralichthys olivaceus[J]. Nippon Suisan Gakkai Shi, 1982, 48(11): 1581-1588. DOI:10.2331/suisan.48.1581 |
| [17] |
Xu S B, Witmer P D, Lumayag S, et al. MicroRNA (miRNA) transcriptome of mouse retina and identification of a sensory organ-specific miRNA cluster[J]. Journal of Biological Chemistry, 2007, 282(34): 25053-25066. DOI:10.1074/jbc.M700501200 |
| [18] |
Peng J, Li S G, Luo D D, et al. Molecular evolution and targets prediction of miR-124 gene family[J]. Biotechnology Bulletin, 2011(10): 167-178. [彭娟, 李思光, 罗丹丹, 等. miR-124基因家族的分子进化与靶基因预测[J]. 生物技术通报, 2011(10): 167-178.] |
| [19] |
Baudet M L, Zivraj K H, Abreu-Goodger C, et al. MiR-124 acts through CoREST to control onset of Sema3A sensitivity in navigating retinal growth cones[J]. Nature Neuroscience, 2011, 15(1): 29-38. |
| [20] |
Conover J C, Doetsch F, Garcia-Verdugo J M, et al. Disruption of Eph/ephrin signaling affects migration and proliferation in the adult subventricular zone[J]. Nature Neuroscience, 2000, 3(11): 1091-1097. DOI:10.1038/80606 |
| [21] |
Nishida A, Furukawa A, Koike C, et al. Otx2 homeobox gene controls retinal photoreceptor cell fate and pineal gland development[J]. Nature Neuroscience, 2003, 6(12): 1255-1263. DOI:10.1038/nn1155 |
| [22] |
Bovolenta P, Mallamaci A, Briata P, et al. Implication of OTX2 in pigment epithelium determination and neural retina differentiation[J]. The Journal of Neuroscience, 1997, 17(11): 4243-4252. DOI:10.1523/JNEUROSCI.17-11-04243.1997 |
| [23] |
Yamano K, Miwa S, Obinata T, et al. Thyroid hormone regulates developmental changes in muscle during flounder metamorphosis[J]. General and Comparative Endocrinology, 1991, 81(3): 464-472. DOI:10.1016/0016-6480(91)90174-5 |
| [24] |
Graf W, Baker R. The vestibuloocular reflex of the adult flatfish. Ⅱ. Vestibulooculomotor connectivity[J]. Journal of Neurophysiology, 1985, 54(4): 900-916. |
| [25] |
de Jesus E G, Hirano T, Inui Y. Changes in cortisol and thyroid hormone concentrations during early development and metamorphosis in the Japanese flounder, Paralichthys olivaceus[J]. General and Comparative Endocrinology, 1991, 82(3): 369-376. DOI:10.1016/0016-6480(91)90312-T |
| [26] |
Bao B L, Zhang Z Y, Gong X L, et al. The effects of exogenous thyroxine (T4) and cortisone on the growth, development and metamorphosis of Paralichthys olivaceus during early development stage[J]. Journal of Shanghai Fisheries University, 1999, 8(3): 242-246. [鲍宝龙, 张臻宇, 龚小玲, 等. 外源甲状腺素及可的松对牙鲆早期发育阶段生长、发育和变态的影响[J]. 上海水产大学学报, 1999, 8(3): 242-246.] |
| [27] |
Marimuthu A, Feng W J, Tagami T, et al. TR surfaces and conformations required to bind nuclear receptor corepressor[J]. Molecular Endocrinology, 2002, 16(2): 271-286. DOI:10.1210/mend.16.2.0777 |
| [28] |
Xue L X, Tong T J, Zhang Z Y. Reporter gene selection and its research trends[J]. Progress in Physiological Sciences, 2002, 33(4): 364-366. [薛丽香, 童坦君, 张宗玉. 报告基因的选择及其研究趋向[J]. 生理科学进展, 2002, 33(4): 364-366. DOI:10.3321/j.issn:0559-7765.2002.04.020] |
 2019, Vol. 26
2019, Vol. 26

