2. 中国水产科学研究院长江水产研究所, 农业农村部淡水生物多样性保护重点实验室, 湖北 武汉 430223;
3. 长江大学动物科学学院, 湖北 荆州 434025
2. Key Laboratory of Freshwater Biodiversity Conservation, Ministry of Agriculture and Rural Affairs; Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China;
3. College of Animal Science, Yangtze University, Jingzhou 434025, China
鱼类的免疫系统是参与鱼体免疫应答的细胞、组织和器官的总称[1]。硬骨鱼类的免疫器官(组织)主要是胸腺、头肾、脾脏和黏膜淋巴组织, 它们是免疫细胞发生、分化、成熟、定居和增殖以及产生免疫应答的场所。免疫器官(组织)和细胞是鱼类防御系统的基础, 为鱼类防止病原侵入提供了最初的防线, 因而对鱼体免疫器官及淋巴组织的发育进行研究, 是深入认识鱼体免疫活性何时建立的基础[2]。
目前, 国内外学者在鱼类免疫器官发育方面已做了许多研究, 研究对象涉及淡水和海水的众多种类。例如淡水有南方鲇(Silurus meridionalis)[3]、细鳞鲑(Brachymystax lenok)[4]和澳洲肺鱼(Neoceratodus forsteri)[5]等, 海水有牙鲆(Paralichthys olivaceus )[6]、大西洋庸鲽(Hippoglossus hippoglossus )[7]、金头鲷(Sparus aurata L.)[8]和太平洋黑鲔(Thunnus orientalis)[9]等, 这些种类分属于鱼类分类学的多个分支, 鲟形目鱼类免疫器官的早期发育研究仅见大西洋鲟(Acipenser oxyrinchus )[10]有部分报道。
中华鲟(Acipenser sinensis)隶属于鲟形目(Acipenseriforms)、鲟科(Acipenseridae)、鲟属, 国家一级保护动物, 全人工繁殖技术于2012年实现, 可稳定获得规模化初孵仔鱼[11]。然而, 仔鱼至幼鱼期是疾病发生的主要阶段, 尤以仔鱼开口和幼鱼转食最为敏感, 往往出现大规模死亡, 这对中华鲟种质资源的保护和利用造成了严重制约。想要解决该阶段的育苗难题, 需要对免疫系统的早期发育进行研究, 搞清该阶段免疫系统的机能和状态。因此, 本研究从中华鲟免疫器官的早期发育着手, 了解淋巴器官的发育过程, 为中华鲟淋巴器官的早期发育提供形态和组织学资料, 也为鲟形目鱼苗的规模化培育积累基础生物学数据。
1 材料与方法 1.1 试验鱼实验所用中华鲟子二代仔鱼、稚鱼和幼鱼均来自中国水产科学研究院长江水产研究所中华鲟繁育基地(荆州)。参照密苏里铲鲟(Scaphirhynchus albus)[12]和施氏鲟(Acipenser schrenckii)[13]的胚后形态学研究, 结合鱼类早期生活史阶段的划分方法, 1~35 (day post hatching)鱼苗为仔鱼(1~11 dph为早期仔鱼, 12~35 dph为晚期仔鱼), 36~119 dph鱼苗为稚鱼, 120 dph起为幼鱼。实验期间, 鱼苗培育水温起始为18.3℃, 截止为20.4℃, 变化幅度为12.9~22.6℃, 鱼苗全长为13.0~541.0 mm, 体重0.04~537.1 g。
1.2 采样方法采样周期为1~300 dph, 采样频率为1~20 dph, 1 d/次; 21~45 dph, 3 d/次; 46~65 dph, 5 d/次; 92 dph采样1次; 120~300 dph, 30 d/次。每次随机选取3~5尾鱼苗样品用Bouin’s液固定, 其中1~ 92 dph鱼苗去吻和尾固定, 120~300 dph鱼苗采取免疫器官组织样(头肾、胸腺和脾脏)固定, 用于制作组织切片。
1.3 组织切片制作与观察将Bouin’s液固定的组织样品经梯度乙醇脱水、二甲苯透明和石蜡包埋处理。通过KD2258型轮转石蜡切片机做横、纵向和偶尔水平的连续切片(厚5~8 μm), 经HE染色, 中性树胶封片, 置于Leica DM 5000B型自动数码显微摄影系统观察和拍照, 使用Photoshop CS6进行图片排版。
2 结果与分析中华鲟免疫器官原基出现的先后顺序为头肾(3 dph)、胸腺(7 pdh)和脾脏(9 pdh), 免疫器官淋巴化(依照小淋巴细胞出现的先后顺序)顺序为胸腺(12 dph)、头肾(15 dph)和脾脏(33 dph), 其免疫器官发育具有原基发生时间早、发育速度慢和发育周期长的特点。
2.1 头肾中华鲟的头肾位于心脏腹隔膜前背方, 为肾管向前延伸至最前端的膨大部位, 左右两叶呈对称分布, 右侧略大于左侧(图 1A)。解剖学观察头肾为红褐色扁平器官, 表面基膜覆盖, 组织基部相连, 后接腹腔肾脏最前端, 组织前期呈弥散状, 后期逐渐发育成实质状。

|
图 1 中华鲟主要免疫器官解剖图 A. 270日龄头肾(HK)和中肾(MK)位置, 头肾用黑色箭头表示, 插图为单侧头肾; B. 150日龄胸腺(Th)位置, 黑色箭头表示, 插图为单侧腺体; C. 270日龄脾脏(Sp)位置, 黑色箭头表示, 插图为脾脏主体部分. Fig.1 Anatomical sketch of main immune organs in Chinese sturgeon Acipenser sinensis A. showing the location of head kidney (HK) and middle kidney (MK), (270 day post hatching, head kidney indicated by black arrow, the insert shows a dissected tissue; B. showing the location of thymus (Th), 150 dph, indicated by black arrow, the insert shows a dissected gland; C. showing the location of spleen (Sp), 270 dph, spleen indicated by black arrow, the insert shows the main part of the spleen. |
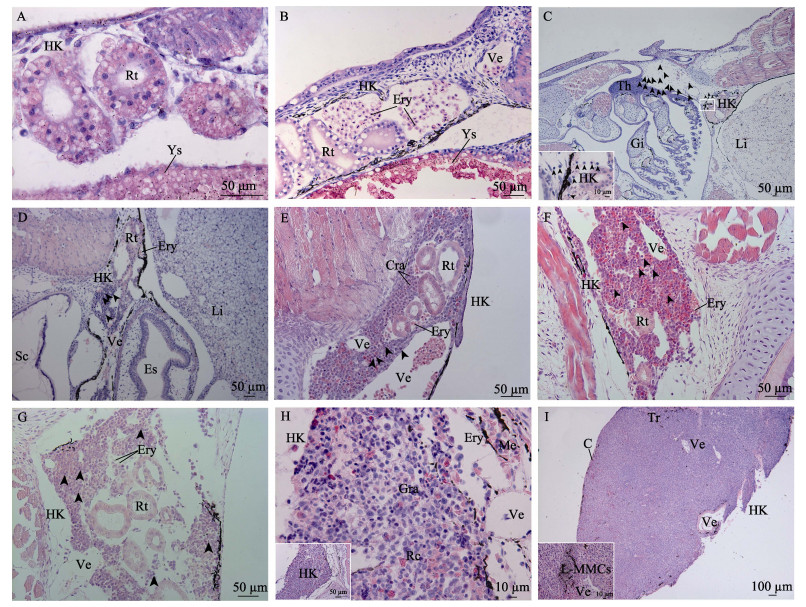
1 dph头肾部位已出现若干盘绕卷曲的肾小管, 肾管主要由单层锥状细胞和立方上皮细胞组成, 其细胞质呈淡粉色, 细胞核较大, 深染为蓝紫色, 细胞排列较疏松(图 2A)。3 dph头肾出现造血干细胞, 细胞大而圆, 细胞质淡染色, 细胞核深染色, 5 dph可见肾小管快速扩张, 血细胞聚集成团(图 2B)。9 dph头肾体积增大, 血细胞增殖为优势细胞, 肾管间偶见淋巴样细胞分布, 15 dph可见头肾和胸腺间存在淋巴细胞“桥”连接现象, 头肾组织内有小淋巴细胞(图 2C)。19 dph头肾淋巴母细胞和小淋巴细胞(直径较小核深染)数量大幅增加并形成聚集区, 肾管间静脉内有红细胞分布(图 2D)。26 dph肾小管逐渐向头肾中央集中, 肾管间淋巴细胞丰富, 粒细胞聚集, 偶见网状内皮细胞(图 2E)。39 dph头肾体积显著增加, 肾小管开始退化, 上皮细胞核模糊不清, 细胞质呈伊红深染, 部分细胞轮廓和界限已不易辨别, 组织内可见头肾静脉和血窦数量增加(图 2F)。65 dph仍可见退化中的肾小管, 器官内淋巴造血组织增加(图 2G)。92~150 dph肾小管已完全退化, 头肾主要由网状内皮系统支持下的淋巴组织构成, 可见淋巴细胞、粒细胞和血细胞分布其中, 血窦和肾静脉相间分布, 组织边缘有许多黑色素细胞(图 2H)。180~300 dph, 头肾组织中可见小梁渗入, 边缘被膜增厚, 组织内细胞排列紧密, 实质组织可区分出中央区和外周区, 二者无明显界限, 中央区淋巴组织环绕血管, 略呈索状放射分布, 淋巴索之间有血窦, 血管附近散布有类似黑色素巨噬细胞中心的不规则结构, 外周区以淋巴细胞排列密集的弥散性淋巴组织为特征, 其血窦小而少(图 2I)。
|
图 2 中华鲟头肾显微观察 A. 1日龄仔鱼, 示头肾(HK)、肾小管(Rt)和卵黄囊(Ys); B. 5日龄仔鱼, 示血细胞(Ery); C. 15日龄仔鱼, 示头肾(HK)和胸腺(Th)间淋巴细胞(黑色箭头)迁移现象, 插图为相应图中矩形区域的放大; D. 19日龄仔鱼, 示淋巴细胞(黑色箭头)聚集; E. 26日龄仔鱼, 示粒细胞(Gra)、头肾静脉(Ve); F. 39日龄仔鱼, 示肾小管(Rt)开始退化; G. 65日龄稚鱼, 示继续退化的肾小管(Rt); H. 92~150日龄幼鱼, 示网状内皮系统支持下的淋巴组织和黑色素细胞(Me), 插图为整体区域展示; I. 180~300日龄幼鱼, 示小梁(Tr)嵌入头肾(HK)实质, 插图示300日龄类似黑色素巨噬细胞中心(L-MMCs)结构. Fig.2 Micro-observation on the head kidney of Chinese sturgeon Acipenser sinensis A. 1 dph, showing the head kidney (HK), renal tubule (Rt) and yolk sac (Ys), the insert shows the whole area; B. 5 dph, showing the erythrocyte (Ery); C. 15 dph, showing the migration of lymphocytes (black arrow) between head kidney (HK) and thymus, the insert shows a high magnification view of box area; D. 19 dph, showing the aggregated lymphocytes (black arrow); E. 26 dph, showing the granulocyte (Gra) and vein (Ve); F. 39 dph, showing the renal tubules (Rt) began to degenerate; G. 65 dph, showing the degenerated renal tubules (Rt); H. 92-150 dph, showing the lymphocyte (black arrow) and granulocyte (Gra) supported by reticuloendothelial system and melanocyte (Me), the insert shows the whole area; I. 180~300 dph, showing the trabecular (Tr) embedded in head kidney, the insert shows the like Melano-macrophage centres (L-MMCs) in 300 dph. C, Capsule; Es, esophagus; Li, liver; Rc, reticular cell; Sc, spinal cord. |
中华鲟的胸腺位于第2鳃弓背侧, 前端伸入鳃盖深处, 近头部顶骨, 后端延伸至鳃腔背角, 左右各一, 呈对称分布(图 1B)。解剖学观察胸腺为质地松软的薄片状实质器官, 其表面光滑, 有微血管分布, 颜色多为乳白色半透明, 偶见血色斑痕。
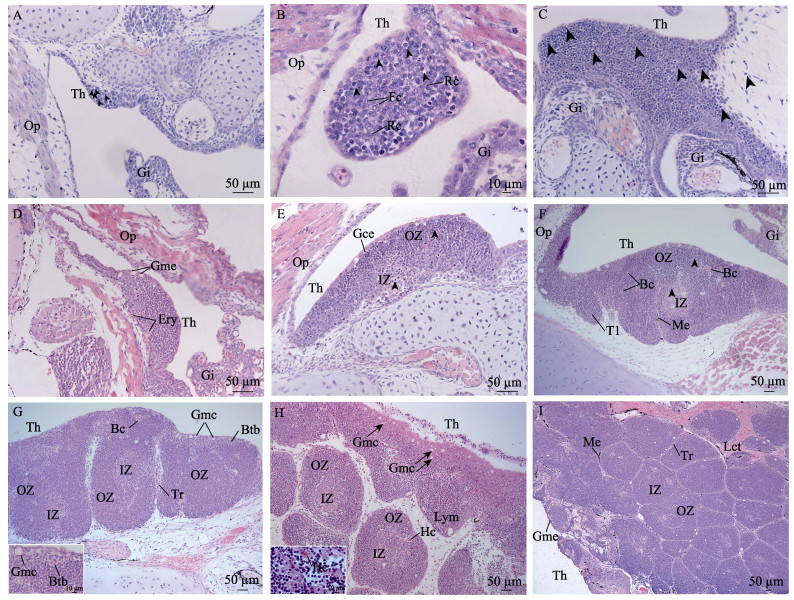
7 dph胸腺原基似椭圆形, 主要由淋巴母细胞和未分化细胞组成, 细胞圆形或不规则形, 细胞核质比大, 嗜碱性, 未分化细胞染色较淋巴母细胞稍浅, 不易区别, 胸腺腹面为一层扁平上皮细胞与鳃腔相隔(图 3A)。12 dph胸腺逐渐形成疏松网状结构, 可见网状上皮细胞胞质突起连接成网, 淋巴细胞和成纤维细胞等分布其中, 淋巴细胞增多并开始淋巴化(图 3B)。15 dph胸腺体积增加, 器官主要由分化的淋巴细胞组成, 淋巴细胞呈圆形, 体积较小, 嗜碱性强, 细胞核质比大(图 3C)。20 dph结缔组织和毛细血管开始渗入胸腺实质, 血管附近可见数个红细胞; 淋巴细胞数量增加, 组织逐渐致密, 体积增大; 胸腺腹面为一层完整的鳃腔上皮, 杯状黏液细胞分布其间(图 3D)。26 dph胸腺出现分区, 内区(相当于哺乳动物的髓质)细胞分布稀疏, 成纤维细胞、网状上皮细胞较多, 淋巴细胞分布于网状基质内, 该区染色较浅; 外区(相当于哺乳动物的皮质)为胸腺腹侧部分, 淋巴细胞数量多, 体积小而密集, 细胞深染(图 3E)。36~65 dph胸腺分区明显, 外区可见毛细血管分布, 内含红细胞, 组织边缘开始分叶, 毛细血管旁出现黑色素细胞(图 3F)。92~120 dph胸腺分叶明显, 可见多个皮髓质分区, 结缔组织和微血管形成小梁, 皮质内毛细血管和网状上皮细胞增多, 偶见血胸屏障(图 3G)。150~180 dph胸腺分化成许多可见皮髓质分区的胸小叶, 髓质区细胞较稀疏, 可见胸腺小体及其类似结构; 鳃腔上皮由多层上皮细胞、类肌细胞和黏液细胞组成, 部分黏液细胞渗入皮质区域(图 3H)。210~300 dph胸腺内可见大量疏松结缔组织, 类肌细胞增加, 小梁组织增厚, 血管周围可见黑色素细胞, 但未形成黑色素巨噬细胞中心, 鳃腔上皮与皮质区界限不明, 黏液细胞嵌入皮质形成环状区域(图 3I)。
|
图 3 中华鲟胸腺显微观察(HE) A. 7日龄仔鱼, 示胸腺原基(Th)、淋巴母细胞(黑色箭头)、鳃盖(Op)和鳃(Gi); B. 12日龄仔鱼, 示疏松网状纤维结构; C.15日龄仔鱼, 示淋巴细胞(黑色箭头); D. 20日龄仔鱼, 示毛细血管进入胸腺; E. 26日龄仔鱼, 示胸腺内区(IZ)、外区(OZ)和鳃腔上皮(Gce); F. 65日龄稚鱼, 示胸腺小叶(Tl)、黑色素细胞(Me); G. 92~120日龄稚鱼, 示血胸屏障(Btb), 插图为相应图中矩形区域的放大; H. 150~180日龄幼鱼, 示哈氏小体(Hc)结构, 以及黏液细胞(Gmc)渗入皮质, 插图为180日龄哈氏小体(Hc); I. 210~300日龄幼鱼, 示胸腺(Th)整体结构, 疏松结缔组织(Lct)嵌入胸腺. Fig.3 Micro-observation on the thymus of Chinese sturgeon Acipencer sinensis A. 7 dph, showing the thymus (Th), Lymphoblasts (black arrow), operculum (Op) and gill (Gi); B. 12 dph, showing the loose reticular fibre structure; C. 15 dph, showing the lymphocyte (black arrow); D. 20 dph, showing the capillaries enter the thymus; E. 26 dph, showing the inner zone (IZ), outer zone (OZ) and gill cavity epithelium (Gce) of thymus; F. 65 dph, showing the thymic lobulation (Tl) and melanocyte (Me); G. 92-120 dph, showing the blood thymus barrier (Btb), the insert shows a high magnification view of box area; H.150-180 dph, showing the Hassall's corpuscles (Hc), and the goblet mucous cell (Gmc) infiltration into cortex, the insert shows the structure of Hassall's corpuscles in 180 dph.; I. 210-300 dph, showing the whole structure of thymus, and loose connective tissue (Lct) embedded in thymus. Bc, blood capillary; Ery, erythrocyte; Fc, fibroblast; Li, liver; Rc, reticular cell; Tr, trabecular. |
中华鲟的脾脏位于胃和十二指肠之间的系膜上。解剖学观察脾脏为暗红色实质器官, 其表面光滑, 有基膜覆盖, 分为前部的条带状和后部蝴蝶状两叶, 稍扁平(图 1C)。
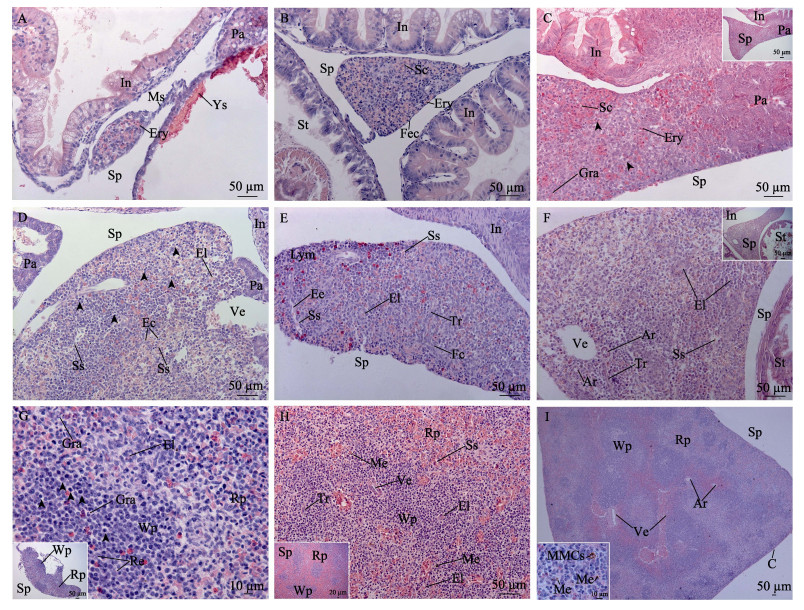
9 dph观察到仔鱼卵黄囊未完全吸收, 胃的结构不完善, 脾脏原基位于肠壁、胰脏和卵黄囊组织之间, 靠近或者连接胰脏组织, 呈椭圆形。脾脏原基主要由疏松的间充质细胞和毛细血管网组成, 内含网状细胞, 造血干细胞和少数红细胞, 组织外围的间充质细胞形成索状(图 4A)。15 dph脾脏体积增大, 被膜为扁平成纤维上皮; 血细胞分化活跃, 分布在间充质细胞形成的索间, 偶见圆形嗜碱性淋巴样细胞分布(图 4B)。26 dph脾脏与胰脏相连, 组织内红细胞数量激增, 成为优势细胞; 微血管发达, 形成原始脾窦; 网状组织内有淋巴细胞, 粒细胞和少量巨噬细胞分布(图 4C)。33 dph脾脏血管系统发达, 可见脾窦和椭圆体分布。脾窦即脾静脉窦, 形状不规则, 大小不一, 窦壁由不连续的内皮细胞构成, 细胞间隙大, 胞核常突出于腔内, 窦腔内含红细胞、淋巴细胞和少量巨噬细胞。椭圆体是具有厚壁的毛细血管, 血管的管腔狭小, 大多只能容单个红细胞通过, 稍大管腔可容2~4个红细胞通过; 血管内皮细胞外通常为一层巨噬细胞包围, 椭圆体末端开放于脾髓中, 脾髓中血管及小淋巴细胞增多(图 4D)。42 dph脾脏被膜结缔组织伸入实质形成由2~3层成纤维细胞构成的索状小梁, 未见平滑肌。小梁间填充有网状组织, 构成脾脏实质的海绵状多孔隙细微支架; 脾脏内淋巴细胞有聚集趋势, 未分化出白髓和红髓(图 4E)。65 dph脾脏网状内皮组织发达, 血管系统进一步完善, 可见中央动脉和静脉并行排列。动脉壁较厚, 管腔内皮为一层扁平细胞, 细胞核呈椭圆形向管腔内突起, 管壁含丰富的平滑肌, 管腔小而规则; 静脉壁较薄, 管腔内皮不如动脉清晰, 内含平滑肌薄, 管腔较大(图 4F)。92~ 120 dph脾脏分化出白髓和红髓区域, 二者相间分布, 无明显界限。白髓主要由淋巴细胞组成, 可见淋巴细胞聚集区; 红髓主要为密集的红细胞, 由脾索和脾窦组成, 二者不易辨别(图 4G)。150~ 180 dph脾脏髓质分化为多个不规则区域, 红髓连接成片, 白髓面积较小; 白髓中可见散布的黑色素巨噬细胞, 胞核大而胞质少, 含有黄褐色颗粒(图 4H)。240 dph脾脏内观察到聚集成团的黑色素–巨噬细胞中心(MMCs), 300 dph可见中央区白髓面积较大, 边缘区较小, 而红髓几乎连接成片, 大静脉和中央动脉分布在组织内清晰可见(图 4I)。
|
图 4 中华鲟脾脏显微观察(HE) A. 9日龄仔鱼, 示脾脏(Sp)、胰脏(Pa)、肠(In)和卵黄囊(Ys); B. 15日龄仔鱼, 示脾索(Sc)、纤维上皮(Fec)、胃(St); C. 26日龄仔鱼, 示脾窦(Ss)、粒细胞(Gra)和淋巴细胞(黑色箭头); D. 33日龄仔鱼, 示脾窦(Ss)、椭圆体(El); E. 42日龄稚鱼, 示小梁(Tr)、淋巴聚集区(Lym); F. 65日龄稚鱼, 示静脉(Ve)、中央动脉(Ar), 插图为整体区域展示; G. 92~120日龄稚鱼, 示白髓(Wp)和红髓(Rp), 插图为整体区域展示; H. 150~180日龄幼鱼, 示白髓(Wp)内部结构, 插图为整体区域展示; I. 210~300日龄幼鱼, 示脾脏(Sp)整体结构, 插图示240日龄黑色素巨噬细胞中心(MMCs). Fig.4 Micro-observation on the spleen of Chinese sturgeon Acipenser sinensis A. 9 dph, showing spleen (Sp), pancreas (Pa), intestine (IN) and yolk sac (Ys); B. 15 dph, showing splenic cord (Sc), fibre epithelia cell (Fec), stomach (St); C. 26 dph, showing splenic sinusoids (Ss), granulocyte (Gra) and lymphocyte (black arrow); D. 33 dph, showing splenic sinusoids (Ss), ellipsoid (El); E. 42 dph, showing trabecular (Tr), lymphocyte (Lym); F. 65 pdh, showing the vein (Ve), central artery (ar), the insert shows the whole area; G. 92-120 dph, showing white pulp (Wp) and red pulp (Rp), the insert shows the whole area; H. 150-180 dph, showing internal structure of white pulp, the insert shows the whole area; I. 210-300 dph, showing spleen structure, the insert shows the Melano-macrophage centres (MMCs) in 240 dph.Ec, endothelial cell; Ery, erythrocyte; Fc, fibroblast; Ms, mesenchymal cell; Rc, reticular cell. |
中华鲟免疫器官原基出现的先后顺序是头肾、胸腺和脾脏, 淋巴化顺序是胸腺、头肾和脾脏, 该结果与大多数淡海水鱼类存在差异, 但同大西洋庸鲽[7]和鳜(Siniperca chuatsi)[14]的发育相同。研究发现淡水和海水鱼类免疫器官原基的发生顺序不同, 如草鱼(Ctenopharyngodon idellus)[15], 南方鲇3]和细鳞鲑[4]等淡水鱼类大多为胸腺、头肾和脾脏, 而大菱鲆(Scophthalmus maximus)[16], 金头鲷[8]和太平洋黑鲔[9]等海水鱼类为头肾、脾脏和胸腺。淡水和海水鱼类免疫器官的淋巴化顺序大多一致, 均为胸腺、头肾和脾脏, 但条石鲷(Oplegnathus fasciatus)[17]和大西洋鳕(Gadus morhua L.)[18]较特殊, 均为头肾先淋巴化, 然后才是胸腺或脾脏。关于这种发育顺序的不同, 目前还没有确切的证据解释, Schroder等[18]认为可能是鱼体对养殖环境水温的适应结果, 马红等[14]在鳜的研究中认为可能与仔鱼孵化后要经历环境渗透压调节和变态过程有关系, 而Liu等[6]认为可能与鱼类免疫机制的差别有关。
现有研究表明, 脊椎动物的免疫活性主要依赖淋巴器官(组织)的生成和发育, 而成熟淋巴细胞的分化迟于淋巴器官(组织)的发生, 因此鱼类淋巴细胞具有免疫功可能更晚, 要到幼鱼期以后[4]。实验结果表明, 中华鲟免疫器官原基出现较早, 但发育速度较慢, 其组织形态学的变化持续至幼鱼阶段。我们推测仔鱼至幼鱼阶段鱼苗的免疫力较低, 容易出现死亡高峰, 可能与免疫器官发育缓慢, 早期免疫功能不完善有关系。另外, 鱼类黑色素–巨噬细胞中心(MMCs)有储存铁血黄素和参与红细胞凋亡过程的作用, 通常出现在淋巴器官发育成熟后的幼鱼阶段[19-20]。中华鲟头肾、胸腺和脾脏组织在幼鱼阶段可见黑色素细胞和MMCs也说明其免疫器官成熟较晚, 这同牙鲆[6]和真裸南极鱼(Harpagifer antarcticus)[21]的研究结果相似。因此, 建议早期仔稚幼鱼的培育过程中加强病害防治和早期疫苗的开发, 但疫苗免疫的最佳时机还需进一步研究。
3.2 中华鲟头肾的发育特征鱼类肾脏的形态分为5种, 解剖学表明中华鲟的肾脏属于第3种, 即左右肾脏的后部相连, 头肾较明显, 位于心脏腹隔膜前背方, 左右两叶对称分布, 这与白鲟(Psephurus gladius)[22]的肾脏解剖学结果相似。中华鲟在出膜时即可见许多肾小管分布, 3 dph开始出现造血干细胞, 15 dph组织开始淋巴化, 39~65 dph肾小管出现退化, 组织内出现血窦, 器官进一步淋巴化, 92 dph肾小管已完全退化, 头肾主要由血窦、血细胞、各类粒细胞和淋巴细胞构成。头肾由最初具有泌尿功能的器官转变为免疫器官, 中间经历了兼有泌尿、造血和免疫功能的混合型阶段, 组织在解剖形态学上也经历了由弥散状向实质状的转变过程, 这与条石鲷[17]、五条鰤(Seriola quinqueradiata)、真鲷(Pagrus major)和日本牙鲆(Paralichthys olivaceus)等[23]硬骨鱼类的头肾发育过程相似。15 dph头肾与胸腺之间可见淋巴细胞“桥”连接现象, 此时头肾淋巴细胞数量少, 主要由血细胞和肾小管组成, 而胸腺已开始淋巴化, 内含大量淋巴细胞, 组织周围亦可见淋巴细胞散布。因此我们推测淋巴细胞的迁移方向可能是从胸腺向头肾迁移, 这与牙鲆[6]、金头鲷[8]和太平洋黑鲔[9]等的发育过程相似。180~300 dph头肾组织学形态变化已不明显, 完全成为由淋巴组织和血窦构成的实质器官, 执行造血和免疫功能。
3.3 中华鲟胸腺的发育特征鱼类胸腺通常只有一对, 分布在鳃腔背侧, 左右对称, 具有表面化特点, 对鱼类口腔和鳃的抗感染发挥重要作用[4]。中华鲟胸腺与大部分硬骨鱼类相似, 位于鳃腔背角, 呈对称分布, 但有少数鱼类的胸腺位置或数量较特殊, 例如虹鳟(Salmo gairdneri)[24]的胸腺位于咽腔上皮之下, 澳洲肺鱼[5]的胸腺位于鳃弓的前侧, 杯吸盘鱼(Sicyases sanguineus)[25]的胸腺虽在鳃弓背侧, 但其拥有多个胸腺, 外胸腺不发达而内胸腺随年龄内陷。中华鲟在7 dph可见胸腺原基, 12 dph开始淋巴化, 26 dph出现内外分区, 65 dph已开始分叶。该过程与太平洋黑鲔[9]的早期发育相似, 但与大西洋鲟[10]的发育不同, 前者5 dph可见胸腺原基, 15 dph即出现胸腺分区, 而后者48 dph才观察到胸腺原基, 且已出现胸腺分区。我们推测可能与养殖水温的不同有关, 中华鲟和太平洋黑鲔的培育水温分别为12.9~22.6℃和27℃, 而大西洋鲟培育水温一直为11℃, 可能是低温导致器官发育迟缓。150~180 dph胸腺分化成许多小叶, 髓质区可见胸腺小体分布, 这与Salkova等[26]对小体鲟(Acipenser ruthenus)和短吻鲟(Acipenser brevirostrum)幼鱼胸腺的研究结果一致。210~300 dph疏松结缔组织嵌入胸腺实质, 类肌细胞激增, 胸腺结构致密, 这与成年澳洲肺鱼[5]和罗非鱼(Oreochromis niloticus)[27]的胸腺结构相似。本研究内未观察到中华鲟胸腺大量脂肪细胞分布和皮髓质区域模糊不清现象, 所以无法判断中华鲟胸腺在该阶段是否出现退化。
3.4 中华鲟脾脏的发育特征脾脏是鱼体最大的淋巴髓质组织, 其位置和形状与鱼的体型及内脏器官的形态有关系。中华鲟的脾脏位于胃和十二指肠间的系膜上, 分为前部的条带状和后部的蝴蝶状两叶, 这与南方鲇[3]的脾脏形态略相似, 但不同于鲨类的三角形脾脏和狗鱼的铲形脾脏[22]。中华鲟在9 dph可见脾脏原基, 33 dph左右脾脏开始淋巴化, 组织内含大量血细胞, 脾窦和椭圆体结构, 92 dph可见脾脏分化出红白髓区域。这与大西洋庸鲽[7]、真裸南极鱼[21]和大西洋鲟[10]脾脏的早期发育过程相似, 其脾脏发育速度较慢, 最终分化出椭圆体结构和红白髓分区。180 dph脾脏内可见黑色素巨噬细胞分布并形成聚集中心, 这与新西兰长体多锯鲈(Polyprion oxygeneios)[28]、五条鰤和真鲷[23]等幼鱼脾脏发育的结果相同。中华鲟脾脏的微血管系统较发达, 内含许多脾窦和椭圆体, 小梁不发达, 红白髓分区较明显, 具有类似动脉周围淋巴鞘的结构, 但未形成明显的淋巴小结和生发中心, 因此推断中华鲟脾脏具有免疫、造血、滤血和贮血的功能。
| [1] |
Xiao K Y. Aquatic Animal Immunology[M]. Beijing: China Agriculture Press, 2011: 161-167. [肖克宇. 水产动物免疫学[M]. 北京: 中国农业出版社, 2011: 161-167.]
|
| [2] |
Wu J Y, Lin H R. Ontogeny of lymphoid organs in the orange-spotted grouper (Epinephelus coioides)[J]. Acta Zoologica Sinica, 2003, 49(6): 819-828. [吴金英, 林浩然. 斜带石斑鱼淋巴器官个体发育的组织学[J]. 动物学报, 2003, 49(6): 819-828.] |
| [3] |
Shi Z C. Ontogeny of main immune organs in southern catfish (Silurus meridionalis)[D]. Wuhan: Huazhong Agricultural University, 2007. [史则超.南方鲇主要免疫器官发育的研究[D].武汉: 华中农业大学, 2007.] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1198326
|
| [4] |
Xu G F, Liu Y, Mou Z B, et al. Ontogeny of immune organs during early developmental stages of Brachymystax lenok[J]. Journal of Fishery Sciences of China, 2012, 19(4): 568-576. [徐革锋, 刘洋, 牟振波, 等. 细鳞鲑早期发育过程中免疫器官发生[J]. 中国水产科学, 2012, 19(4): 568-576.] |
| [5] |
Mohammad M G, Chilmonczyk S, Birch D, et al. Anatomy and cytology of the thymus in juvenile Australian lungfish, Neoceratodus forsteri[J]. Journal of Anatomy, 2007, 211(6): 784-797. DOI:10.1111/j.1469-7580.2007.00814.x |
| [6] |
Liu Y, Zhang S C, Jiang G L, et al. The development of the lymphoid organs of flounder, Paralichthys olivaceus, from hatching to 13 months[J]. Fish & Shellfish Immunology, 2004, 16(5): 621-632. |
| [7] |
Patel S, Sørhus E, Fiksdal I U, et al. Ontogeny of lymphoid organs and development of IgM-bearing cells in Atlantic halibut (Hippoglossus hippoglossus L.)[J]. Fish & Shellfish Immunology, 2009, 26(3): 385-395. |
| [8] |
Jósefsson S, Tatner M F. Histogenesis of the lymphoid organs in sea bream (Sparus aurata L.)[J]. Fish & Shellfish Immunology, 1993, 3(1): 35-49. |
| [9] |
Watts M, Kato K, Munday B L, et al. Ontogeny of immune system organs in northern bluefin tuna (Thunnus orientalis, Temminck and Schlegel 1844)[J]. Aquaculture Research, 2003, 34(1): 13-21. DOI:10.1046/j.1365-2109.2003.00779.x |
| [10] |
Gradil A M, Wright G M, Wadowska D W, et al. Ontogeny of the immune system in Acipenserid juveniles[J]. Developmental & Comparative Immunology, 2014, 44(2): 303-314. |
| [11] |
Wei Q W, Li L X, Du H, et al. Research on technology for controlled propagation of cultured Chinese sturgeon (Acipenser sinensis)[J]. Journal of Fishery Sciences of China, 2013, 20(1): 1-11. [危起伟, 李罗新, 杜浩, 等. 中华鲟全人工繁殖技术研究[J]. 中国水产科学, 2013, 20(1): 1-11.] |
| [12] |
Snyder D E. Pallid and shovelnose sturgeon larvae-morphological description and identification[J]. Journal of Applied Ichthyology, 2002, 18(4-6): 240-265. DOI:10.1046/j.1439-0426.2002.00429.x |
| [13] |
Liu H B, Song S X, Sun D J, et al. Embryonic and larval development of Amur sturgeon Acipenser schrenckii[J]. Journal of Fishery Sciences of China, 2000, 7(3): 5-10. [刘洪柏, 宋苏祥, 孙大江, 等. 施氏鲟的胚胎及胚后发育研究[J]. 中国水产科学, 2000, 7(3): 5-10. DOI:10.3321/j.issn:1005-8737.2000.03.002] |
| [14] |
Ma H, Chang O Q, Shi C B, et al. Ontogeny of lymphoid organs in mandarinfish (Siniperca chuatsi)[J]. Journal of Fishery Sciences of China, 2007, 14(5): 756-761. [马红, 常藕琴, 石存斌, 等. 鳜淋巴器官的个体发育[J]. 中国水产科学, 2007, 14(5): 756-761. DOI:10.3321/j.issn:1005-8737.2007.05.008] |
| [15] |
Lei X B. Microstructure and immune cells' distribution of early development immune organs in Ctenopharyngodon idellus[D]. Shanghai: Shanghai Ocean University, 2013. [雷雪彬.草鱼免疫器官个体发育的组织结构和免疫细胞变化[D].上海: 上海海洋大学, 2013.] http://cdmd.cnki.com.cn/Article/CDMD-10264-1014013614.htm
|
| [16] |
Padrós F, Crespo S. Ontogeny of the lymphoid organs in the turbot Scophthalmus maximus:a light and electron microscope study[J]. Aquaculture, 1996, 144(1-3): 1-16. DOI:10.1016/S0044-8486(96)01326-9 |
| [17] |
Xiao Z Z, He T, Li J, et al. Ontogeny of the immune system in rock bream Oplegnathus fasciatus[J]. Chinese Journal of Oceanology and Limnology, 2013, 31(5): 1028-1035. DOI:10.1007/s00343-013-2278-9 |
| [18] |
Schrøder M B, Villena A J, Jørgensen T . Ontogeny of lymphoid organs and immunoglobulin producing cells in Atlantic cod (Gadus morhua L.)[J]. Developmental & Comparative Immunology, 1998, 22(5-6): 507-517. |
| [19] |
Agius C. The role of melano-macrophage centres in iron storage in normal and diseased fish[J]. Journal of Fish Diseases, 1979, 2(4): 337-343. DOI:10.1111/j.1365-2761.1979.tb00175.x |
| [20] |
Agius C. Preliminary studies on the ontogeny of the melano-macrophages of teleost haemopoietic tissues and age-related changes[J]. Developmental & Comparative Immunology, 1981, 5(4): 597-606. |
| [21] |
O'Neill J G. Ontogeny of the lymphoid organs in an Antarctic teleost, Harpagifer antarcticus (Notothenioidei:Perciformes)[J]. Developmental & Comparative Immunology, 1989, 13(1): 25-33. |
| [22] |
Meng Q W, Li W D, Su J X. Comparative Anatomy of Fish[M]. Beijing: Science Press, 1987: 251-262. [孟庆闻, 李婉端, 苏锦祥. 鱼类比较解剖[M]. 北京: 科学出版社, 1987: 251-262.]
|
| [23] |
Chantanachookhin C, Seikai T, Tanaka M. Comparative study of the ontogeny of the lymphoid organs in three species of marine fish[J]. Aquaculture, 1991, 99(1-2): 143-155. DOI:10.1016/0044-8486(91)90294-H |
| [24] |
Tatner M F, Manning M J. The morphology of the trout, Salmo gairdneri Richardson, thymus:some practical and theoretical considerations[J]. Journal of Fish Biology, 1982, 21(1): 27-32. DOI:10.1111/j.1095-8649.1982.tb02820.x |
| [25] |
Gorgollon P. Fine structure of the thymus in the adult cling fish Sicyases sanguineus (Pisces, Gobiesocidae)[J]. Journal of Morphology, 1983, 177(1): 25-40. DOI:10.1002/jmor.1051770103 |
| [26] |
Salkova E, Flajshans M. The first finding of Hassall's corpuscles in the thymi of cultured sturgeons[J]. Veterinární Medicína, 2017, 61(8): 464-466. DOI:10.17221/247/2015-VETMED |
| [27] |
Cao J M, Chen Q, Lu M X, et al. Histology and ultrastructure of the thymus during development in tilapia, Oreochromis niloticus[J]. Journal of Anatomy, 2017, 230(5): 720-733. DOI:10.1111/joa.12597 |
| [28] |
Parker S, La Flamme A, Salinas I. The ontogeny of New Zealand groper (Polyprion oxygeneios) lymphoid organs and IgM[J]. Developmental & Comparative Immunology, 2012, 38(2): 215-223. |
 2019, Vol. 26
2019, Vol. 26

