2. 海南大学海洋学院, 海南 海口 570228
2. College of Oceanography, Hainan University, Haikou 570228, China
近年来, 随着水产养殖业的发展, 由此引起的环境问题也逐渐得到广泛的关注。海水养殖尾水中残留饵料、养殖体排泄物、水生生物残骸等引发水体中有机碎屑(TSS)、化学需氧量(COD)和N、P营养物质含量过高, 导致养殖水域环境恶化[1-2]。传统的物理处理法无法对废水进行深度处理[3]; 化学处理法处理成本高并产生相应的副产物[4-7]; 生物处理法虽可有效去除有机物, 但对N、P的处理效果较差, 较难达到相关排放标准[6, 8]。利用微藻对水环境中无机态离子(如: NH4+, NO3–, NO2–和H2PO4–)和有机态(如:尿素)N、P元素的吸收而发展的藻–菌共生生物处理技术有效的填补了生物处理中氮、磷去除的短板。同时, 藻–菌共生还可降解养殖污水中的偶氮染料、重金属以及有机物等[9~10]。
藻–菌共生技术基于二者在代谢功能上的互利共生, 细菌生长分解废水中有机污染物释放CO2, 产生有机酸, 生长素, 无机盐等, 微藻光合作用吸收这些物质并消耗水中的CO2, 释放O2, 使得废水中溶解氧增加, 进而有利于细菌的新陈代谢[11-14]。二者在废水中消耗污染物的同时降低积累生物质的成本, 甚至产生高附加值生物产品[15], 达到能源开发和环境污染治理的双赢局面。现今国内对藻–菌共生的研究涉及微生态制剂的配比[16-18], 光生物反应器设计[19-20]以及藻–菌固定化技术。固定化技术为藻水分离、提高处理效率、延长生长周期等提供了技术优势[21-22], 国内研究的废水类型主要为养猪废水[23], 生活污水以及工业废水, 其在水产养殖中的应用研究目前还处于初级阶段, 对于海水养殖尾水的研究相对较少, 而综合对比游离态和固定态单一或共生藻及菌对海水养殖尾水的处理效果研究甚少。
故本文选取普通小球藻(Chlorella vulgaris)和芽孢杆菌(Bacillus spp.)为供试生物, 研究单一和共生藻–菌系统分别在游离态和固定态下的细胞生长情况, 重点对比对模拟海水养殖尾水中氨氮(NH4+-N)、正磷酸盐(PO43–-P)、总磷(TP)和化学需氧量(CODMn)的去除效果。旨在筛选海水养殖尾水污染治理的最优投加条件, 为实际应用奠定基础。
1 材料与方法 1.1 供试材料 1.1.1 藻种和菌种浓缩液的制备试验藻种普通小球藻由海南大学海洋学院藻种保存实验室提供; 选用f/2培养基[24]培养; 供试菌种芽孢杆菌由海南大学热带农林学院环境毒理实验室提供, 选用Saline Lactose Broth (SLB)培养基(每1 L抽滤海水, 牛肉膏5 g/L, 蛋白胨10 g/L, pH 7.8~8.0)培养。
在超净工作台中, 将小球藻接入经高温高压灭菌冷却至室温的f/2培养基中, 采用无菌封口膜封口后置于恒温光照培养箱中(温度33℃±0.5℃, 光照度3000 lx, 光暗比12︰12)连续培养7 d, 离心(4000 r/min, 4℃, 10 min)浓缩备用。超净工作台中将芽孢杆菌接种到含灭菌SLB培养基的锥形瓶中, 瓶口用封口膜封住后置于恒温摇床中(速度160 r/h, 温度30℃±0.5℃), 震摇16 h后离心(4000 r/min, 4℃, 10 min)备用。
1.1.2 海水养殖尾水的配制基于笔者前期对海水养殖调研情况, 根据尾水主要污染物组成配制模拟海水养殖尾水, 配制好的模拟养殖尾水经过灭菌处理后, 冷却到室温待用, 具体组成及含量见表 1。
|
|
表 1 尾水污染物含量和国家标准对比 Tab.1 Comparison of pollutant content and national standards in wastewater |
藻胶球:无菌条件下, 取普通小球藻浓缩液与预先灭菌的6%的海藻酸钠溶液1︰1(体积比)均匀混合, 形成3%的海藻酸钠和小球藻混合液, 摇匀后在距离0.1 mol/L的CaCl2溶液液面20 cm处, 滴入该混合液制成藻胶球, 每200 mL混合液可滴出约1万个胶球。胶球在冰箱静置10 h硬化后, 试验时筛选出形状圆润, 无拖尾, 直径为4 mm, 体积大小一致的胶球(每个胶球约0.018 mL), 用无N、P的灭菌海水洗涤后进行实验。胶球经过脱固定后计数测定得到藻细胞初始密度为9×105 cells/mL, 可用9×105细胞/胶球表示。
菌胶球:芽孢杆菌固定化方法同藻胶球。每个胶球中芽孢杆菌光密度(OD600)为0.183。
1.1.4 指标测定和仪器设备NH4+-N采用靛酚蓝分光光度法, PO43–-P采用磷钼蓝分光光度法, TP采用过硫酸钾氧化法, CODMn采用碱性高锰酸钾法[27]。小球藻用血球计数板计数细胞密度同时测定光密度(OD680)确定细胞干重。用OD600估算芽孢杆菌细胞生长量。胶球以1︰1(个/mL)的比例加入3%的柠檬酸钠溶液脱固定后用血球计数板计数测定细胞生长量。
所用仪器有高压蒸汽灭菌锅(LDZM-60L-Ⅱ, 上海申安), 恒温光照培养箱(MGC-100, 上海一恒Blue Pard), 台式摇床(ZQP-75D, 天津莱玻特瑞Labortary), 超净工作台(SW-CJ-1FD, 智净, 苏州净化), 实验用药品均为分析纯和优级纯, 试验用水为Spring-S60i+PALL超纯水系统制备。
1.2 实验方法在500 mL的三角烧瓶中放置无菌模拟海水养殖尾水300 mL, 如表 2所示, 以无菌尾水作对照, 分别接入游离态和固定态的单一或共生藻及菌。保证游离态和固定态接入的小球藻初始细胞浓度保持一致, 接入芽孢杆菌的OD600值保持一致, 每个处理重复3次。所有处理在光照强度为660 µmol/(m2·s), 光暗比12 h︰12 h的光照培养箱中连续培养, 每天至少摇瓶3次以保证藻、菌生长所需的CO2和O2。实验持续8天, 每24 h从瓶中取出5个菌胶球和5个藻胶球脱固定后测定细胞数和吸光度, 取20 mL尾水离心去藻、菌后测定CODMn和TP含量, 经0.45 µm滤膜过滤后测定尾水中NH4+-N, PO43–-P含量。
|
|
表 2 游离和固定态单一或共生藻–菌体系对模拟海水养殖尾水的处理 Tab.2 Experimental treatment of artificial marine aquaculture wastewater after adding single or symbiotic microalgae-bacteria system under free or immobilization state |
实验数据利用Microsoft Office ExcelTM处理, 数据以平均值±标准误(SE)表示, 用SPSS Statistics 17.0对水体中CODMn, NH4+-N, PO43–-P和TP含量进行单因素方差分析(one-way ANOVA), 差异显著度为P < 0.05。实验作图采用Originlab Origin Pro 8.0TM。计算各个测定指标的去除率, 去除率的计算公式如下所示:
| $ R_{i}=\frac{S_{0, i}-S_{i}}{S_{0, i}} \times 100 \% $ | (1) |
式中, Ri (i=PO43–-P, NH4+-N, TP或CODMn)是各个营养盐的去除率; S0, i是各个指标的初始值; Si是在时间t时对应的指标测定值。
2 结果与分析 2.1 海水养殖尾水中小球藻细胞生长情况如图 1所示, 游离态和固定态藻细胞对模拟尾水的适应时间较长, 达到约100 h。单一小球藻IC和FC在第六天细胞干重分别达到0.24 g/L和0.53 g/L, 可知游离态小球藻细胞生长量高于固定态, 藻–菌共生系统Co-I和Co-F呈现类似趋势。结果显示, Co-F细胞干重(0.73 g/L)高于FC (0.52 g/L), 增长率高达0.10 g/(L·d), 说明游离状态下, 藻–菌共生系统小球藻生长量高于单一微藻。但Co-I和IC细胞干重差别不显著(P > 0.05), 分别为0.21 g/L和0.24 g/L, 说明固定胶球内, 芽孢杆菌对小球藻细胞生长量无明显促进作用。对比所有处理, 游离态更有利于小球藻和尾水进行营养物质的交换和细胞积累, Co-F在模拟养殖尾水中小球藻细胞积累量最大。
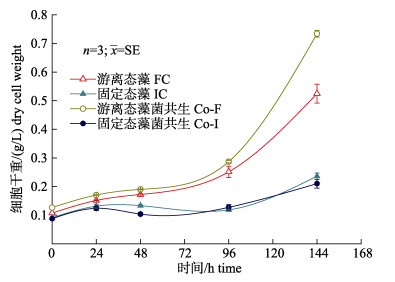
|
图 1 游离态和固定态的单一小球藻和藻–菌共生系统在模拟海水养殖尾水中生长情况 (FC, IC, Co-F, Co-I分别代表不同处理方式, 详见表 2) Fig.1 Cell growth of monoculture Chlorella vulgaris and C. vulgaris -Bacillus spp. symbiosis in free and immobilized state in simulated aquaculture wastewater (Symbol "FC, IC, Co-F, Co-I" indicates different treatments as shown in Tab. 2) |
由图 2可知, 单藻、单菌以及藻–菌共生处理的体系中第24 h, 48 h, 72 h, 96 h, 144 h和192 h的NH4+-N浓度显著低于第0 h (P < 0.05), 且均在第48~96 h达到最低残留量(P < 0.05)。48 h内FC, IC, FB, IB, Co-F, Co-I组NH4+-N浓度显著低于AWW组(P < 0.05)。其中FB, IC和Co-I处理下尾水中NH4+-N均迅速降至较低水平(小于0.10 mg/L), 残留量分别为0.01 mg/L, 0.04 mg/L和0.08 mg/L。对比72 h的最大去除率, IC(100%)的去除率略高于FC(98.71%), 二者对尾水NH4+-N处理差别不显著(P > 0.05)。由图可知, 几乎所有的处理均可达到NH4+-N的完全去除, 但Co-I对尾水中NH4+-N的净化效率最快, 24 h时去除效果显著优于其他处理(P < 0.05), 48 h内去除率达到94.78%。
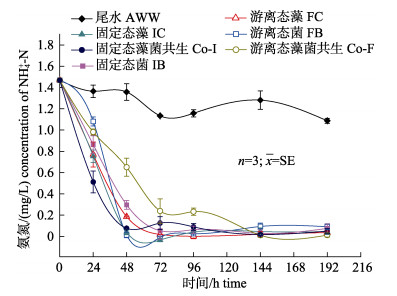
|
图 2 游离态和固定态的单一小球藻和藻–菌共生系统对模拟海水养殖尾水中NH4+-N的去除 (AWW, FC, IC, FB, IB, Co-F和Co-I分别代表不同处理方式, 详见表 2) Fig.2 Removal of NH4+-N from simulated aquaculture wastewater by monoculture of Chlorella vulgaris and symbiosis systems of C. vulgaris -Bacillus spp. in free and immobilized state (Symbol "AWW, FC, IC, FB, IB, Co-F and Co-I" indicates different treatments as shown in Tab. 2) |
对尾水中PO43–-P的结果显示(图 3), 所有处理在第24 h, 48 h, 72 h和96 h的PO43–-P浓度显著低于初始浓度(P < 0.05), 说明随时间变化尾水中PO43–-P显著降低。对比固定时间内不同处理对PO43–-P的影响, 处理组尾水浓度均显著低于AWW组(P < 0.05), 说明随实验进行, 藻、菌生物处理可有效降低尾水中PO43–-P含量。24 h内, PO43–-P去除率由高到低排序为: Co-F > FC > Co-I > IC > IB > FB, 其中FC, Co-F和Co-I处理将PO43–-P浓度均降低至0.02 mg/L, 达到中国《海水养殖水排放要求》二级标准(< 0.1 mg/L)。48 h内, 所有处理PO43–-P残留量降低至近零水平, 去除率达到98%及以上。由图可见Co-F处理效果相对最优, 净化效率达到近100%, 略高于单藻处理, 远高于单菌处理。对比两种投加状态, 游离态对PO43–-P的去除效果总体优于固定态, 两种状态下的单一小球藻对尾水中PO43–-P浓度去除呈显著差异, 单一菌体系和藻–菌共生系统游离态去除率略高于固定态, 但差异不显著(P > 0.05)。所有处理中, IB和FB体系净化效率最慢, 可知小球藻在模拟海水养殖尾水中对PO43–-P的吸收效果相对更优, 其直接吸收水体中的无机N、P元素和空气中的CO2, 通过光合作用转化为有机物并释放出O2[28]。
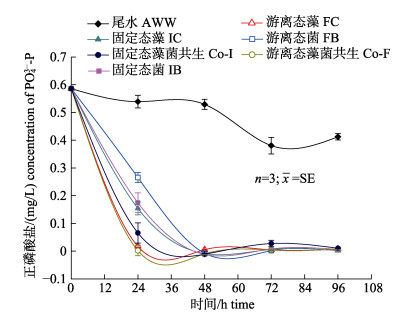
|
图 3 游离态和固定态的单一小球藻和藻–菌共生系统对模拟海水养殖尾水中PO43–-P的去除 Fig.3 Removal of PO43–-P from simulated aquaculture wastewater by monoculture of Chlorella vulgaris and symbiosis systems of C. vulgaris-Bacillus spp. in free and immobilized state |
如图 4所示, 所有处理组对尾水中TP浓度均显著降低。单藻体系IC和FC对TP去除率差异不显著(P > 0.05), 去除率均为80%左右。而单菌体系FB和IB对TP的去除率分别为56.57%和76.49%, 藻–菌共生系统Co-F和Co-I的去除率分别为75.77%和89.89%, 分别提高了19.92%和14.12%, 呈显著差异(P < 0.05)。96 h以后, 除了FB (0.19 mg/L), 所有处理TP浓度均可降至0.10 mg/L以下, 可见基于微藻的藻–菌共生系统对尾水中TP有去除效果。对比所有处理, Co-I对尾水中TP处理效果最优, 该处理在前24 h即达到较低残留量(0.07 mg/L), 去除率90%。
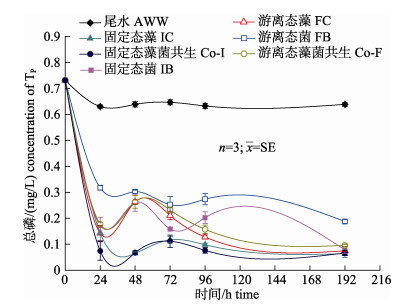
|
图 4 游离态和固定态小球藻和藻–菌共生系统对模拟海水养殖尾水中TP的去除 Fig.4 Removal of TP from simulated aquaculture wastewater by monoculture of Chlorella vulgaris and symbiosis systems of C. vulgaris-Bacillus spp. in free and immobilized state |
如图 5所示, 48 h内, 固定态单藻IC, 单菌IB和藻–菌共固定Co-I对尾水中CODMn去除率分别为39.49%, 35.77%和39.09%, 而游离态单藻FC, 单菌FB和藻–菌共生Co-F去除率分别为39.69%, 71.40%和57.56%, 可知游离态对尾水中CODMn的去除效果更好。对比所有处理, 芽孢杆菌的去除效果显著优于小球藻(P < 0.05), 且悬浮态单一菌的处理效果最优, 去除率最高达到80.26%。所有处理在96 h内将尾水中CODMn降至最低水平, 实验后期由于微生物降解效应减弱, CODMn值无明显波动。FB、FC、Co-F对CODMn净化效果显著, 去除率由高到低排序为: FB > Co-F > FC, 而IB, Co-I和IC效果相对较差, 且三者差异不显著(P > 0.05)。
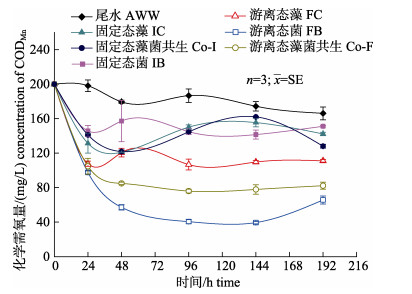
|
图 5 游离态和固定态小球藻和藻–菌共生系统对模拟海水养殖尾水中CODMn的去除 Fig.5 Removal of CODMn in simulated aquaculture wastewater by monoculture of Chlorella vulgaris and symbiosis systems of C. vulgaris-Bacillus spp. in free and immobilized state |
本实验结果表明投加条件的不同影响藻细胞积累量, 单一小球藻两种投加条件下, 游离态细胞增长量比固定态更大, 此现象可解释为包埋凝胶珠内部藻细胞密度逐渐增大, 部分光照被阻隔, 营养物耗尽, 微生物停止生长出现惰性区间[29-30]。此结果和杨海波等[31]前6 d的研究结果相似, 在配制的康维营养液中, 游离态小球藻的生长速率明显高于固定态小球藻, 但经历了对数生长期后(20 d), 迅速进入死亡期。本实验重点关注养殖水净化, 实验周期较短(6 d), 未观测到藻细胞衰亡。对比本实验单一藻和藻–菌共生系统, 共生条件藻细胞增长量更大, 此结果和张元长等[32]的研究结果不同, 枯草芽孢杆菌(Bacillus subtilis)在实验前期(5 d)不影响蛋白核小球藻(Chlorella pyrenoidosa)生长, 但是在后期培养中, 对小球藻的生长具有显著的抑制作用。本实验测定周期较短未观测到抑制作用, 和王书亚等[33]的研究结果类似, 芽孢杆菌和小球藻具有协同作用, 此过程中芽孢杆菌降解水中的有机碎屑[34], 为小球藻光合作用提供CO2, 同时吸收小球藻释放的O2和多糖等有机物。经对比, 本实验小球藻细胞积累量相对偏小。可能是因为培养周期较短和养殖尾水中低磷的限制。有研究表明, 磷缺乏会降低微藻的光合效率和速率, 影响其光合作用的生理机能, 抑制藻细胞的生长与繁殖[35]。在海水养殖尾水初始P浓度偏低的条件下, 小球藻细胞生长活性较低, 细胞生长量小。
3.2 海水养殖尾水中NH4+-N的去除由于藻类可直接吸收NH4+-N作为合成氨基酸的底物, 而NO3–-N要通过酶还原成NO2–-N再还原成NH4+-N方能被利用, 所以大多数微藻尤其是蓝绿藻对NH4+-N的吸收利用优于其他形态的氮[36~37]。本实验结果表明, 单一藻体系下, 固定态更有利于NH4+-N的去除。此结果和颜胜华等[38]的研究结论类似, 在模拟印染废水中, 固定态小球藻对NH4+-N的净化效率比游离态藻高出22.49%。严清等[39]利用小球藻在城市污水处理中也得到了类似的结论。对比本实验所有处理, 固定态藻–菌共生系统Co-I对尾水NH4+-N的净化速度最快, 可能由于包埋固定的海藻酸盐凝胶表面具有丰富的羧基离子团, 其先与尾水中的NH4+-N进行化学交联被吸附在胶球表面[39], 而后扩散穿透基质被内部藻或菌吸收[40]。此结果和郑耀通等[41]利用小球藻, 螺旋藻(Spirulina sp.), 光合细菌以及硝化细菌处理尾水NH4+-N的结果类似, 固定态藻–菌共生系统对NH4+-N的去除率高于游离态。Shen等[42]对比研究了小球藻和恶臭假单胞菌(Pseudomonas putida)在悬浮态和固定态处理城市污水的效果, 对比单一处理, 共固定化处理在去除NH4+-N方面显示出更好效果。同时, 藻和菌的投加状态影响尾水中NH4+-N的去除, Ghulam等[43]的研究表明游离态恶臭假单胞菌和固定态小球藻的投加条件更有利于尾水NH4+-N的去除。
3.3 海水养殖尾水中P的去除游离态或固定态单一藻, 单一菌和藻–菌共生系统对海水养殖尾水中PO43–-P的去除率均接近完全去除(去除率98%左右)。类似的结果在Wang等[44]的研究中出现, 其利用小球藻和活性污泥共同处理尾水22 h后, 尾水中PO43–-P去除率达到100%, Goncalves等[45]的研究也发现小球藻和天然活性污泥菌的联用可完全去除生活尾水中的PO43–-P。同时, 本实验结果表明单一及复合藻–菌体系中游离态对PO43–-P的去除效果总体优于固定态, 这可能与微生物对P的吸收受到固定化载体、底物浓度、藻细胞密度、pH值及温度等因素的影响[46]有关。游离态藻–菌体系中, 微生物直接吸收利用水中PO43–-P以支持自身细胞生长代谢, 而固定化载体对光能获得和物质传递的阻碍, 在一定程度上限制了藻、菌对尾水中PO43–-P的去除。
水体中的磷一方面通过生物吸收同化合成自身物质, 另一方面则通过吸附作用吸附在生物体表面上[47]。本实验结果表明, 对比所有单一菌和藻–菌共生系统, 固定态TP的去除效果优于游离态, 其中固定化藻–菌共生系统去除效率最快, 周期最短, 去除率最高。固定化藻–菌共生系统对尾水中TP的去除由两部分组成, 一是胶球本身吸附、固定污染物的能力; 二是芽孢杆菌和小球藻的协同生长。即芽孢杆菌在生长过程中向周围释放磷酸酶等, 这些胞外酶主要通过水解作用分解大分子物质, 使之变成可以通过细胞质膜的小分子物质[48], 而小球藻在生长时, 分泌细菌生长所需的胞外分泌物, 而细菌在利用这些分泌物的同时相应地产生CO2, 无机盐, 以及生长因子, 进而促进藻细胞生长[49]。
3.4 海水养殖尾水中CODMn的去除对比本实验所有处理, 游离态单一芽孢杆菌对CODMn的处理效果最优。这可能是由于芽孢杆菌丰富的酶系, 如葡萄糖苷酶、蛋白酶、淀粉酶、脂肪酶、氧化酶、纤维素酶、脱氢酶、脱羧酶等[50], 可促进尾水中碳系有机物、蛋白质、复杂多糖以及水溶性有机物的分解[51], 从而降低尾水中CODMn含量。单菌体系对CODMn的去除率高于藻–菌共生系统, 可能由于本实验养殖尾水中外源有机碳浓度过高(葡萄糖浓度200 mg/L), 芽孢杆菌生长速度加快, 藻–菌对限制性营养物质产生竞争, 导致小球藻的生长受到抑制[52]。加之海水养殖尾水中PO43–-P浓度较低(远低于f/2培养基PO43–-P含量5 g/L), 被迅速消耗后, 无P或低P条件限制了小球藻生长, 导致藻细胞生长速率降低甚至死亡。
本实验所有处理CODMn去除率为20%~80%, 未涉及其它硝化细菌, 亚硝化细菌, 异养菌和好氧菌等, 这可能限制藻、菌对CODMn的去除。孟睿等[53]利用地衣芽孢杆菌(Bacillus licheniformis)、硝化细菌、月芽藻(Selenastrum reinsch)、四尾栅藻(Scenedesmus quadricauda)按比例混合后处理淡水养殖尾水, 结果表明COD去除率达到44.05%, 且地衣芽孢杆菌主要去除COD, NO3–-N; 月芽藻主要去除NH4+-N; 四尾栅藻主要去除NO2–-N; 硝化细菌主要去除溶解态磷。赵秀侠等[54]研究了3种微藻对龟鳖养殖尾水(淡水)中的氮磷去除效果, 结果表明:栅藻(Scenedesmus sp.)对总氮(TN)去除效果最好, 小球藻(Chlorella sp.)对TP去除效果最好, 而螺旋藻则最易去除NH4+-N。海水养殖尾水高盐特性可能会影响藻–菌体的生长及对CODMn的去除, 谢航等[55]的研究表明, 当养殖尾水盐度为2%~3%时, 地衣芽孢杆菌对尾水中蛋白质, 淀粉的降解率较低, 这也是海水养殖尾水处理的挑战之一。
4 结论本研究结果表明, 在模拟海水养殖尾水中, 悬浮态更有利于小球藻细胞生长, 6 d内芽孢杆菌和小球藻细胞生长协同共生; 固定化藻–菌共生系统对尾水中NH4+-N, TP的去除效果最优; 悬浮态藻–菌共生系统对尾水中PO43–-P去除效果最优; 悬浮态芽孢杆菌对尾水中CODMn的去除效果最优。综合对比, 固定态藻–菌共生系统对尾水的处理效果相对最优, 对NH4+-N, PO43–-P, TP和CODMn的去除率分别达到96.57%, 98.62%, 89.89%和39.09%。因此, 固定化藻–菌共生系统应用于小规模海水养殖尾水处理中是可行的, 可通过添加其它光合细菌, 硝化细菌以及反硝化细菌以加强系统对CODMn的去除效果。
| [1] |
Meng F P, Gong Y Y, Ma D D. Recent progress in treatment of aquaculture wastewater based on microalgae-A review[J]. Acta Microbiologica Sinica, 2009, 49(6): 691-696. [孟范平, 宫艳艳, 马冬冬. 基于微藻的水产养殖废水处理技术研究进展[J]. 微生物学报, 2009, 49(6): 691-696. DOI:10.3321/j.issn:0001-6209.2009.06.002] |
| [2] |
Carlose R, Rubene A H. Microalgae and bacteria interaction in the aquatic environment and their potential use in aquaculture[J]. Revista Chilena de Historia Natural, 2003, 76(4): 725-736. |
| [3] |
Guo A T. Research on aquaculture wastewater treatment technology[J]. Agricultural Information of China, 2015(7): 150. [郭安托. 水产养殖废水处理技术研究[J]. 中国农业信息, 2015(7): 150.] |
| [4] |
Wang C H. Aquaculture wastewater treatment technology[J]. Guidelines for Fisheries Prosperity, 2017(3): 37-38. [王春华. 水产养殖废水处理技术[J]. 渔业致富指南, 2017(3): 37-38.] |
| [5] |
Kiran B, Pathak K, Kumar R, et al. Cultivation of Chlorella sp. IM-01 in municipal wastewater for simultaneous nutrient removal and energy feedstock production[J]. Ecological Engineering, 2014, 73: 326-330. DOI:10.1016/j.ecoleng.2014.09.094 |
| [6] |
Guldhe A, Ansari F A, Singh P, et al. Heterotrophic cultivation of microalgae using aquaculture wastewater:a biorefinery concept for biomass production and nutrient remediation[J]. Ecological Engineering, 2017, 99: 47-53. DOI:10.1016/j.ecoleng.2016.11.013 |
| [7] |
Mook W T, Chakrabarti M H, Aroua M K, et al. Removal of total ammonia nitrogen (TAN), nitrate and total organic carbon (TOC) from aquaculture wastewater using electrochemical technology:a review[J]. Desalination, 2012, 285: 1-13. DOI:10.1016/j.desal.2011.09.029 |
| [8] |
Wang S H, Wang L, Li J X, et al. Microalgae wastewater treatment technology and its application[C]//Proceedings of the 2013 Annual Conference of Chinese Society of Environmental Sciences. 2013, 5: 3644-3649. [王淑慧, 汪靓, 李继香, 等.微藻污水处理技术及其应用[C]//2013中国环境科学学会学术年会论文集. 2013, 5: 3644-3649.]
|
| [9] |
Gao Q T, Wong Y S, Tam N F Y. Removal and biodegradation of nonylphenol by different Chlorella species[J]. Marine Pollution Bulletin, 2011, 63(5-12): 445-451. DOI:10.1016/j.marpolbul.2011.03.030 |
| [10] |
Fan W. Simulation research on treatment of coking wastewater by immobilized algal system[D]. Wuhan: Wuhan University of Science and Technology, 2008. [范唯.固定化藻菌系统处理焦化废水的模拟研究[D].武汉: 武汉科技大学, 2008.] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1423527
|
| [11] |
Guo P F. Advances and prospects of applying microalgal and artificial algalfungal symbiotic system in disposing biogas and biogas slurry[J]. Environmental Science & Technology, 2017, 40(S2): 184-191. [郭鹏飞. 应用微藻及人工藻菌处理沼液沼气的研究进展[J]. 环境科学与技术, 2017, 40(S2): 184-191.] |
| [12] |
Gultom S, Hu B. Review of microalgae harvesting via co-pelletization with filamentous fungus[J]. Energies, 2013, 6(11): 5921-5939. DOI:10.3390/en6115921 |
| [13] |
Peng L C, Lan C Q, Zhang Z S, et al. Control of protozoa contamination and lipid accumulation in Neochloris oleoabundans culture:Effects of pH and dissolved inorganic carbon[J]. Bioresource Technology, 2015, 197: 143-151. DOI:10.1016/j.biortech.2015.07.101 |
| [14] |
Peng L C, Zhang Z S, Lan C Q, et al. Alleviation of oxygen stress on Neochloris oleoabundans:effects of bicarbonate and pH[J]. Journal of Applied Phycology, 2017, 29(1): 143-152. DOI:10.1007/s10811-016-0931-3 |
| [15] |
Markou G, Nerantzis E. Microalgae for high-value compounds and biofuels production:a review with focus on cultivation under stress conditions[J]. Biotechnology Advances, 2013, 31(8): 1532-1542. DOI:10.1016/j.biotechadv.2013.07.011 |
| [16] |
Liu M, Yuan J L, He H S, et al. Removal of nitrogen and phosphorus by eight strains of microalgae and their growth characteristics in Penaeus vannamei sewage[J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(4): 866-872. [刘梅, 原居林, 何海生, 等. 微藻在南美白对虾养殖废水中的生长及净化效果[J]. 应用与环境生物学报, 2018, 24(4): 866-872.] |
| [17] |
Wang G X, Yao J Y, Wang S B. Study on establishment of water purification model of alga-bacteria system and its application in purifying the deteriorated aquacultural water[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2006, 15(2): 22-27. [王高学, 姚嘉赟, 王绥标. 复合藻-菌系统水质净化模型建立与净化养殖水体水质的研究[J]. 西北农业学报, 2006, 15(2): 22-27. DOI:10.3969/j.issn.1004-1389.2006.02.006] |
| [18] |
Wu H W, Lu K H, Qian W, et al. Effectiveness of remediating aquaculture wastewater by immobilized microorganisms and Myriophyllum aquaticum[J]. Journal of Fishery Sciences of China, 2013, 20(2): 316-326. [伍华雯, 陆开宏, 钱伟, 等. 固定化微生物联合大型水生植物净化养殖废水的实验研究[J]. 中国水产科学, 2013, 20(2): 316-326.] |
| [19] |
Mu J L, Ma H J, Xiong Z H. The study and application of algal-bacterial symbiotic system for sewage purification[J]. Journal of Nanping Teachers College, 2005, 24(2): 64-67. [穆寄林, 马华继, 熊振湖. 藻菌共生系统在城市污水处理中的研究与应用[J]. 南平师专学报, 2005, 24(2): 64-67. DOI:10.3969/j.issn.1674-2109.2005.02.019] |
| [20] |
Niu M, Zhang X P, Wang X, et al. Study on bacterial-algal-bacterial system for high concentration organic wastewater treatment[J]. Chinese Journal of Environmental Engineering, 2010, 4(8): 1819-1822. [牛曼, 张小平, 王秀, 等. "菌藻-菌"系统处理高浓度有机废水的研究[J]. 环境工程学报, 2010, 4(8): 1819-1822.] |
| [21] |
Fan Z X, Shen Y, Xu X M. Application and progress of immobilization technology in microbial and microalgae culture[J]. Mechanical & Electrical Technology, 2015(1): 130-132. [范志翔, 沈英, 徐新苗. 固定化技术在微生物与微藻培养中运用与进展[J]. 机电技术, 2015(1): 130-132. DOI:10.3969/j.issn.1672-4801.2015.01.043] |
| [22] |
Xu F K, Huang R, Li Y. Study on microencapsulated culture three marine microalgae[J]. Transactions of Oceanology and Limnology, 2015(1): 107-111. [徐丰恺, 黄瑞, 李赟. 3种海洋微藻微胶囊培养的初步研究[J]. 海洋湖沼通报, 2015(1): 107-111.] |
| [23] |
Yang K, Li J, Zhao X X, et al. A comparative study on growth and purification efficiency of Scenedesmus obliquus and Chlorella vulgaris in four kinds of breeding wastewater[J]. Chinese Journal of Environmental Engineering, 2017, 11(7): 4411-4418. [杨坤, 李静, 赵秀侠, 等. 栅藻和小球藻在4种养殖废水中的生长及净化效果对比研究[J]. 环境工程学报, 2017, 11(7): 4411-4418.] |
| [24] |
Guillard R R L. Culture of phytoplankton for feeding marine invertebrates[M]. Boston: Springer, 1975: 29-60.
|
| [25] |
State standard of the People's Republic of China-fisheries for standard quality Water (GB 11607-89)[J]. Environmental Protection, 1989, 17(12): 25-27. [中华人民共和国国家标准——渔业水质标准(GB 11607-89)[J].环境保护, 1989, 17(12): 25-27.]
|
| [26] |
SC/T 9103-2007 Water drainage standard for sea water mariculture[S]. 2007. SC/T 9103-2007 [海水养殖水排放要求[S]. 2007.]
|
| [27] |
State standard of the People's Republic of China-standard quality water Sea (GB 17378.4-2007)[J]. Environmental Protection, 2007. [中华人民共和国国家标准-海水水质标准(GB 17378.4-2007)[J].环境保护, 2007.]
|
| [28] |
Stumm W, Morgan J J. Aquatic Chemistry:an Introduction Emphasizing Chemical Equilibria in Natural Waters[M]. New York: Wiley-Interscience Publication, 1981: 780.
|
| [29] |
Liang J J, Jiang X M, Jiang M W, et al. Study on removal rate of NH4+-N and PO43--P by immobilized Nannochloropsis oculata[J]. Acta Hydrobiologica Sinica, 2016, 40(5): 1033-1040. [梁晶晶, 蒋霞敏, 江茂旺, 等. 固定化微绿球藻去除NH4+-N、PO43--P效果的研究[J]. 水生生物学报, 2016, 40(5): 1033-1040.] |
| [30] |
Omar S H. Oxygen diffusion through gels employed for immobilization. part 2. in the presence of microorganisms[J]. Applied Microbiology and Biotechnology, 1993, 40(2-3): 173-181. |
| [31] |
Yang H B, Yu Y, Zhang X H, et al. Study on immobilization culture of marine microalga, Chlorella vulgaris[J]. Fisheries Science, 2001, 20(5): 4-7. [杨海波, 于媛, 张欣华, 等. 小球藻固定化培养的初步研究[J]. 水产科学, 2001, 20(5): 4-7. DOI:10.3969/j.issn.1003-1111.2001.05.002] |
| [32] |
Zhang Y C, Fan M K, Xie Y J. Effects of mixed cultivation on the growth of probiotics and Chlorella pyrenoidosa[J]. Journal of Jimei University, 2018, 23(6): 416-420. [张元长, 范明坤, 谢仰杰. 混合培养对益生菌和小球藻生长的影响[J]. 集美大学学报:自然科学版, 2018, 23(6): 416-420.] |
| [33] |
Wang S Y, Li Z, Gao Y F, et al. Screening of the dominant strains in the algae-bacteria symbiotic system and effects of biogas slurry treatment[J]. Journal of Agricultural Resources and Environment, 2019, 36(1): 121-126. [王书亚, 李志, 高仪璠, 等. 藻菌共培养体系优势菌株筛选及沼液处理[J]. 农业资源与环境学报, 2019, 36(1): 121-126.] |
| [34] |
Liu Z Y, Sun X Q. Comprehensive application of biological control techniques for water purification in aquaculture[J]. South China Fisheries Science, 2007, 3(1): 69-74. [刘朝阳, 孙晓庆. 生物控制法在水产养殖水质净化中的综合应用[J]. 南方水产, 2007, 3(1): 69-74. DOI:10.3969/j.issn.2095-0780.2007.01.012] |
| [35] |
Fabregas J, Abalde J, Herrero C. Biochemical conposition and growth of the marine microalga Dunaliella tertiolecta (Butcher) with different ammonium nitrogen concentrations as chloride, sulphate, nitrate and carbonate[J]. Aquaculture, 1989, 83(3-4): 289-304. DOI:10.1016/0044-8486(89)90041-0 |
| [36] |
Ohmori M, Ohmori K, Strotmann H. Inhibition of nitrate uptake by ammonia in a blue-green alga, Anabaena cylindrica[J]. Archives of Microbiology, 1977, 114(3): 225-229. DOI:10.1007/BF00446866 |
| [37] |
Guerrero M G, Vega J M, Losada M. The assimilatory nitrate reducing system and its regulation[J]. Annual Review of Plant Physiology, 1981, 32(1): 169-204. DOI:10.1146/annurev.pp.32.060181.001125 |
| [38] |
Yan S H, Lu M, Lu S X, et al. Contrast research on removal of phosphorous and nitrogen by immobilized and free Chlorella vulgaris as well as the metal cadmium on the absorption rate of phosphorous[J]. Progress in Textile Science & Technology, 2009(5): 10-14. [颜胜华, 鲁敏, 陆世雄, 等. 固定化与游离态小球藻脱氮除磷对比以及金属镉对吸收磷速率的影响[J]. 纺织科技进展, 2009(5): 10-14. DOI:10.3969/j.issn.1673-0356.2009.05.004] |
| [39] |
Yan Q, Sun L P. Contrast research on removal of phosphorous and nitrogen by immobilized and free Chlorella vulgaris[J]. Energy Environmental Protection, 2008, 22(3): 20-24. [严清, 孙连鹏. 固定化与游离态小球藻脱氮除磷对比研究[J]. 能源环境保护, 2008, 22(3): 20-24. DOI:10.3969/j.issn.1006-8759.2008.03.005] |
| [40] |
Tam N F Y, Wong Y S. Effect of immobilized microalgal bead concentrations on wastewater nutrient removal[J]. Environmental Pollution, 2000, 107(1): 145-151. DOI:10.1016/S0269-7491(99)00118-9 |
| [41] |
Zheng Y T, Wu X P, Gao S F. Studies on the immobilization of bacteria and alga applied to removal of ammonia[J]. Acta Agriculturae Universitatis Jiangxiensis (Natural Sciences Edition), 2003, 25(1): 99-102. [郑耀通, 吴小平, 高树芳. 固定化菌藻系统去除氨氮影响[J]. 江西农业大学学报, 2003, 25(1): 99-102. DOI:10.3969/j.issn.1000-2286.2003.01.024] |
| [42] |
Shen Y, Gao J Q, Li L S. Municipal wastewater treatment via co-immobilized microalgal-bacterial symbiosis:microorganism growth and nutrients removal[J]. Bioresource Technology, 2017, 243: 905-913. DOI:10.1016/j.biortech.2017.07.041 |
| [43] |
Mujtaba G, Rizwan M, Lee K. Removal of nutrients and COD from wastewater using symbiotic co-culture of bacterium Pseudomonas putida and immobilized microalga Chlorella vulgaris[J]. Journal of Industrial and Engineering Chemistry, 2017, 49(25): 145-151. |
| [44] |
Wang L, Liu J L, Zhao Q, et al. Comparative study of wastewater treatment and nutrient recycle via activated sludge, microalgae and combination systems[J]. Bioresource Technology, 2016, 211: 1-5. DOI:10.1016/j.biortech.2016.03.048 |
| [45] |
Gonçalves A L, Pires J C M, Simões M. Wastewater polishing by consortia of Chlorella vulgaris and activated sludge native bacteria[J]. Journal of Cleaner Production, 2016, 133(1): 348-357. |
| [46] |
Ma Z Z. Immobilized culture technology of microalgae and its application prospects[J]. Foreign Fisheries, 1993(3): 1-4. [马志珍. 微藻固定化培养技术及其应用前景[J]. 国外水产, 1993(3): 1-4.] |
| [47] |
Lu H Y, Feng Y F, Wu Y H, et al. Phototrophic periphyton techniques combine phosphorous removal and recovery for sustainable salt-soil zone[J]. Science of the Total Environment, 2016, 568: 838-844. DOI:10.1016/j.scitotenv.2016.06.010 |
| [48] |
Wang F, Zheng T L, Hong H S. Ecological function of bacterial extracellular enzymes[J]. Marine Sciences, 1999, 23(3): 33-36. [王斐, 郑天凌, 洪华生. 细菌胞外酶的生态作用[J]. 海洋科学, 1999, 23(3): 33-36. DOI:10.3969/j.issn.1000-3096.1999.03.015] |
| [49] |
Lin W, Zhou M J. Effect of marine bacteria on harmful algal blooms[J]. Marine Science, 2001, 25(3): 34-38. |
| [50] |
Liu B, Liu W B. Biological treatment of fishery water using Bacillus sphaericus[J]. Fisheries Modernization, 2004(2): 7-8. [刘波, 刘文斌. 芽孢杆菌对水产养殖环境的净化作用[J]. 渔业现代化, 2004(2): 7-8. DOI:10.3969/j.issn.1007-9580.2004.02.004] |
| [51] |
Xu Y F. Research progress on application of Bacillus licheniformis in aquaculture[J]. Journal of Fisheries Research, 2018, 40(1): 83-88. [徐亚飞. 地衣芽孢杆菌在水产养殖中的应用研究进展[J]. 渔业研究, 2018, 40(1): 83-88.] |
| [52] |
Qin P W, Wu K M, Liu J Z, et al. Effects of exogenous organic carbon concentration on the algae-bacteria relationship and removal of nitrogen and phosphorus[J]. Journal of Wuhan University of Science and Technology, 2018, 41(3): 195-200. [秦攀伟, 吴克明, 刘俊琢, 等. 外源有机碳浓度对藻菌关系及氮磷去除的影响[J]. 武汉科技大学学报, 2018, 41(3): 195-200. DOI:10.3969/j.issn.1674-3644.2018.03.007] |
| [53] |
Meng R, He L S, Xi B D, et al. Purifying deteriorated aquacultural water with a bacteria-alga system[J]. Research of Environmental Sciences, 2009, 22(5): 511-515. [孟睿, 何连生, 席北斗, 等. 利用菌-藻体系净化水产养殖废水[J]. 环境科学研究, 2009, 22(5): 511-515.] |
| [54] |
Zhao X X, Yang K, Fang T, et al. Growth feature and nitrogen and phosphorus removal characteristics of three microalgae in turtle breeding wastewater[J]. Water Resources Protection, 2018, 34(1): 83-87, 94. [赵秀侠, 杨坤, 方婷, 等. 3种微藻在龟鳖养殖废水中的生长与脱氮除磷特性[J]. 水资源保护, 2018, 34(1): 83-87, 94.] |
| [55] |
Xie H, Qiu H D, Wang X B, et al. Studies on the characteristics of degrading survival feeds in the aquaculture by Bacillus licheniformis[J]. Journal of Fujian Fisheries, 2008, 30(3): 31-35. [谢航, 邱宏端, 王秀彬, 等. 地衣芽孢杆菌降解水产养殖中残余饵料的特性研究[J]. 福建水产, 2008, 30(3): 31-35. DOI:10.3969/j.issn.1006-5601.2008.03.008] |
 2019, Vol. 26
2019, Vol. 26

