2. 中国水产科学研究院, 北京 100141;
3. 上海海洋大学, 水产科学国家级实验教学示范中心, 上海 201306;
4. 农业农村部淡水水产种质资源重点实验室, 上海 201306;
5. 北京鑫洋水产高新技术有限公司, 北京 102488
2. Chinese Academy of Fishery Sciences, Beijing 100141, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
4. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
5. Beijing Seasun Aquaculture BioTech. Co. Ltd., Beijing 102488, China
定植能力是益生菌筛选的重要标准之一[1-3]。地衣芽孢杆菌(Bacillus Licheniformis, Bli)作为常用的益生菌菌种, 其促进鱼类生长[4-7]和提高抗病能力[6-9]的研究已多有报道。但对其黏附定植相关的研究数据却很少。Merrifield等[4-5]研究发现, 给虹鳟(Oncorhynchus mykiss)投喂Bli和枯草芽孢杆菌后, 通过洗涤肠道去除非黏附菌, 培养出的芽孢菌占总菌量的36~75%, 提示其可以黏附于肠道粘膜。而之后的电镜研究则出现了相反的结果, 在肠粘膜上皮没有发现这两种芽孢菌的黏附[10]。
Bli定植相关研究多存在以下问题: (1)未有效监测和控制水体和饲料中存在的Bli; (2)停止外源补充后的观察期短, 缺乏长期监测数据; (3)检测肠道Bli的方法灵敏度和特异度不理想。
鉴于上述既往研究存在的诸多问题, 本文通过控制水体和饲料中的Bli数量, 并采用高温选择性培养长期监测, 开展了Bli在斑点叉尾鮰(Ictaluru punctaty)肠道定植规律的研究工作。以期进一步了解Bli在鱼类肠道中的定植规律, 从而更好的理解其益生机制。
1 材料与方法 1.1 实验鱼管理斑点叉尾鮰购自北京龙池养殖场, 选择体重为30~50 g的健康叉尾鮰作为实验鱼, 饲养于300 L循环水水族缸。所有实验均维持水温24~26℃, 溶氧 > 5 mg/L; 每周更换循环水量的100%, 市政自来水使用前平衡温度至24~26℃, 曝气48 h以上; 鱼缸每周使用氯制剂消毒1次, 清洗过滤棉并高压蒸汽灭菌后使用; 实验前禁食2周, 基础投喂饲料为无菌饲料, 按体重1%计算, 每日一次。
1.2 肠内容物和肠壁匀浆液的制备参考Merrifield等[4]的方法并加以改动, 具体为:解剖针毁脑处死实验鱼, 75%乙醇清洗消毒鱼体后超净台内取出肠道, 上至幽门下1 cm, 下至肛门上1 cm。剪开肠管, 刮下内容物, 20倍体积冷生理盐水洗涤肠壁3次以去除非黏附菌, 洗涤液离心的沉淀合并到内容物中。加入冷生理盐水, 玻璃匀浆器制备20% (w/w)肠内容物和肠壁匀浆液。
1.3 地衣芽孢杆菌和嗜热脂肪地芽孢杆菌的选择性培养Bli-A1菌种(以下简称为Bli)分离自北京鑫洋水产高新技术有限公司利生素商品制剂, 形态学、生理学结合16S测序鉴定后保存。Bli最高生长温度50~55℃[11], 营养肉汤37℃培养过夜, 生理盐水洗涤2次, 4℃保存备用。嗜热脂肪地芽孢杆菌(Geobacillus stearothermophilus, Gs) ATCC7953, 可生长温度40~70℃[12], 使用含18 mmol/L硫酸锰的营养琼脂52℃培养5 d后刮取菌苔, 生理盐水洗涤2次, 90℃水浴30 min灭活营养体, 生理盐水洗涤2次, 4℃保存备用。调整Bli和Gs菌悬液至合适浓度, 按1%接种量(v/v)分别接种至20%肠内容物匀浆液、20%肠壁匀浆液和生理盐水中, 使菌含量在1.0×103 cfu/mL左右。取100 μL涂布于营养琼脂平板。Bli生理盐水对照分别培养于37℃和52℃, 余均培养于52℃。培养48 h后计数菌落, 统计生长率。实验重复4次。
1.4 水体中地衣芽孢杆菌含量的监测实验期间每3天取鱼缸水1 mL, 涂布于2个营养琼脂平板, 每个平板500 μL, 52℃培养48 h后统计菌落数, 16S rDNA测序, 使用NCBI的BLAST工具进行序列比对, 鉴定细菌种属。检出限为1 cfu/mL。
1.5 饲料Co60辐照灭菌和菌含量检测商品配合颗粒饲料购自北京康特奇饲料有限公司, 委托北京鸿仪四方辐照技术有限公司进行Co60辐照灭菌, 最小吸收剂量为26.0 kGy。取灭菌前后的饲料, 制备10%匀浆液, 梯度稀释后涂布营养琼脂平板, 25℃培养72 h后计数。16S rDNA测序鉴定同1.4。
1.6 地衣芽孢杆菌在斑点叉尾鮰肠道的定植规律设置喂食组和禁食组。投喂灭菌饲料驯养1周后开始在水体中添加过夜培养的地衣芽孢杆菌, 使水体菌含量在1.0×105 cfu/mL左右。每天喂食前加菌1次, 连续7 d。最后1次添加的次日作为第0天, 此日起, 喂食组继续投喂灭菌饲料, 禁食组不再投喂饲料。每周解剖3条鱼, 取肠道制备20%肠内容物匀浆液, 禁食组第14天和第21天额外制备20%肠壁匀浆液, 将所有匀浆液涂布于营养琼脂平板, 每个平板涂布100 μL, 使检出限接近1 cfu/肠。52℃培养48 h后, 统计菌落数, 所有平板菌落数之和即肠道内的Bli总数。
1.7 含菌饲料的制备Bli芽孢制备:使用营养肉汤培养, 37℃, 150 rpm震荡培养3天, 离心, 生理盐水洗涤2次, 80℃水浴20 min, 生理盐水洗涤2次, 4℃保存备用。Gs芽孢制备参见1.3。调整Bli和Gs芽孢悬液至合适浓度, 均匀喷涂在饲料表面, 使饲料最终菌含量在1.0×107 cfu/g左右, 室温风干后, 4℃保存。实验前后检测菌含量无明显衰减, Bli为1.1×107 cfu/g, Gs为5.9×106 cfu/g。
1.8 地衣芽孢杆菌对肠粘膜的黏附斑点叉尾鮰投喂灭菌饲料驯养1周后改为含Bli和Gs芽孢的饲料, 连续投喂7 d。最后1次喂食含菌饲料的次日为第0天, 于第0天恢复投喂无菌饲料。每周解剖3条鱼, 制备20%肠内容物和肠壁匀浆液。除第0天的匀浆液10倍梯度稀释涂板计数外, 其余时间点将所有匀浆液原液涂布于营养琼脂平板, 每个平板涂布100 μL。52℃培养48 h, 统计菌落数。其中, 第0天肠壁匀浆液涂板后于25℃培养72 h统计肠壁黏附相关总活菌数。Gs作为黏附定植实验的惰性对照[13-14], 以其含量为参照, 定义Bli的相对丰度=Bli菌含量/Gs菌含量×100%。统计饲料、肠内容物和肠壁Bli的相对丰度。
1.9 地衣芽孢杆菌在肠内容物中的生长取6条斑点叉尾鮰, 制备3份20%肠内容物匀浆液和3份肠内容物原液, 密封后高压蒸汽灭菌。调整生理盐水洗涤的Bli至适宜浓度, 按1% (v/v或v/w)接种到营养肉汤、20%内容物匀浆液和内容物原液中, 使菌含量在1.0×102 cfu/mL(g)左右。营养肉汤和20%匀浆液于25℃, 150 rpm震荡培养72 h; 内容物原液于25℃静置培养72 h。稀释平板法检测菌含量。
1.10 统计分析数据以平均值±标准差表示, 用SPSS 21软件进行统计分析, 多组间比较采用单因素方差分析, 两两比较采用LSD检验, 差异显著度为0.05。
2 结果与分析 2.1 水体中地衣芽孢杆菌含量的监测实验前2周禁食期和1周无菌饲料驯养期均未检测到Bli (< 1 cfu/mL); 外泼和拌饵投喂Bli期间, 水体中可分别检测到3×104~6×104 cfu/mL和0.6×102~3.8×102 cfu/mL的Bli; 完全换水1次, 即停止外源添加Bli后, 直至实验结束水体中未检测到Bli (< 1 cfu/mL)。
2.2 饲料Co60辐照灭菌和菌含量检测Co60辐照灭菌饲料, 最小吸收剂量为26.0 kGy。取灭菌前后的饲料, 检测菌含量。辐照前, 饲料含5.5×104 cfu/g的芽孢菌属细菌, 包括1.4×104 cfu/g的Bli; 辐照后, 无活菌检出(表 1)。
|
|
表 1 饲料Co60辐照灭菌前后菌含量 Tab.1 Bacteria concentration of feed before and after Co60 irradiation |
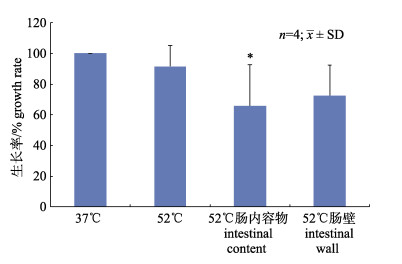
采用52℃高温选择性培养Bli和Gs。实验期间使用该培养方法仅偶尔能在水体样品中检测到Anoxybacillus flavithermus (≤5 cfu/mL), 肠道样品中未检测到Bli和Gs以外的菌种。Bli生长率以悬浮于生理盐水时37℃平板计数的结果为对照; Bli在52℃的生长率为91.5%, 仅略低于37℃; 悬浮于20%肠内容物和肠壁匀浆时, 52℃生长率分别为65.9% (P < 0.05)和72.5% (图 1)。结果说明52℃高温培养法可以选择性的培养Bli, 但在肠内容物和肠壁匀浆液中生长率略低, 特别是在肠内容物匀浆液中。
|
图 1 地衣芽孢杆菌在52℃培养条件下的生长率 *与37℃组比较P < 0.05. Fig.1 Growth rate of Bacillus licheniformis under 52℃ *compared with 37℃ group P < 0.05. |
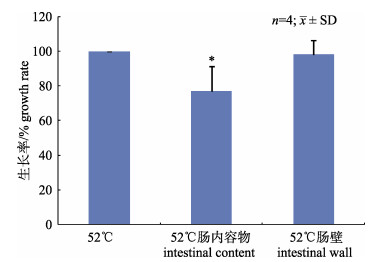
Gs重悬于20%肠内容物匀浆和肠壁匀浆时, 生长率分别为77.2% (P < 0.05)和98.2% (图 2)。结果说明52℃高温培养法可以选择性的培养Gs, 但在肠内容物中生长率略低。
|
图 2 嗜热脂肪地芽孢杆菌在52℃培养条件下的生长率 *与52℃组比较P < 0.05. Fig.2 Growth rate of Geobacillus stearothermophilus under 52℃ *compared with 52℃group P < 0.05. |
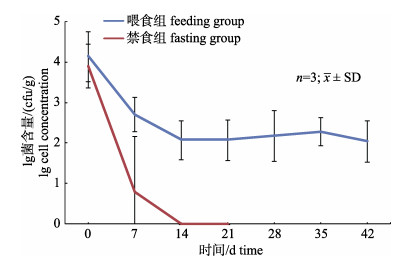
实验前无菌饲料驯养期肠道内容物未检测到Bli (< 1 cfu/g)。水体中每日添加Bli菌液7 d后为第0天, 肠道内容物Bli含量约2.4×104 cfu/g。停止外源添加Bli的14天后, 持续喂食组Bli含量降至1.7×102 cfu/g, 此后维持这一数量级水平至42 d, 提示Bli在叉尾鮰持续进食条件下可以长期定植于肠道; 而禁食组在第7天检测的3条鱼肠内容物中, 仅1条鱼有Bli检出, 14 d之后所有鱼的肠内容物均无Bli检出(< 1 cfu/g) (图 3)。此外, 禁食组第14天和第21天的肠壁匀浆液也没有Bli检出(< 1 cfu/g), 提示Bli在斑点叉尾鮰禁食条件下不能长期定植于肠道。
|
图 3 地衣芽孢杆菌在肠道内容物的消长规律 在第7天, 禁食组3条鱼仅1条鱼有Bli检出. Fig.3 Dynamics of Bacillus licheniformis in intestine At day 7, Bli was only detected in 1/3 intestinal content preparations of fasting group. |
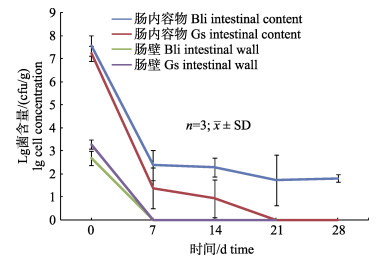
拌饵投喂Bli和Gs芽孢的实验中, Bli在肠内容物中的含量在第7天之后同样维持在约1.3×102 cfu/g左右至28 d, 提示Bli可以长期定植于肠道; 而惰性对照Gs在第7天, 3条鱼中仅2条鱼的肠内容物中有检出, 在第14天, 3条鱼中仅1条鱼检测到Gs, 在第21天及之后无Gs检出(< 1 cfu/g) (图 4), 提示肠道需要21 d才能完全排空惰性对照。
|
图 4 地衣芽孢杆菌和嗜热脂肪地芽孢杆菌在肠道内容物和肠壁的消长规律 在第7天, 3条鱼中仅2条鱼的内容物检测到Gs; 在第14天, 3条鱼中仅1条鱼的内容物检测到Gs. Fig.4 Dynamics of Bacillus licheniformis and Geobacillus stearothermophilus in intestinal content and wall At day 7, Gs was detected in 2/3 intestinal content preparations; at day 14, Gs was detected in 1/3 intestinal content preparations. |
实验前无菌饲料驯养期肠道内容物未检测到Bli和Gs (< 1 cfu/g)。拌饵投喂含Bli和Gs芽孢的饲料7天后为第0天, 恢复投喂无菌饲料。每周检测肠内容物和肠壁上的Bli和Gs (图 4)。在第0天, 肠道内容物Bli含量高达3.5×107 cfu/g, 而在肠壁上黏附相关Bli含量仅4.7×102 cfu/g。在第7天之后, Bli在内容物中含量维持在约1.3×102 cfu/g, 而肠壁上已无Bli检出(< 1 cfu/g), 提示Bli存在于肠内容物中而不能有效黏附于肠粘膜。
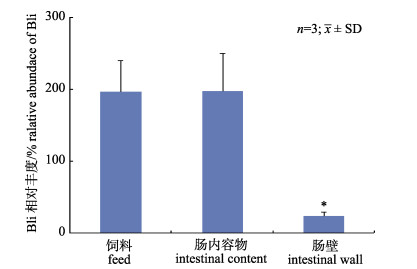
进一步分析第0天肠内容物和肠壁中Bli和Gs的比例(图 5)。以Gs的数量为内参, 肠内容物中Bli的相对丰度为197.9%, 略高于饲料中的186.4%;而肠壁上Bli相对丰度仅为23.7% (P < 0.05), 明显低于饲料和肠内容物中的丰度。即便考虑到Bli在20%肠壁匀浆的生长率小于Gs (72.5% Vs 98.2%, P < 0.05) (图 1, 图 2), 肠壁上的Bli相对丰度也远低于饲料。此外, 分析肠壁上黏附相关细菌的组成, Bli占总活菌数的比例仅为0.6±0.4% (n=3; x±SD)。提示Bli不能有效黏附于肠粘膜。
|
图 5 地衣芽孢杆菌在肠内容物和肠壁上的相对丰度 *与饲料组比较P < 0.05. Fig.5 Relative abundance of Bacillus licheniformis in intestinal content and wall * compared with feed group P < 0.05. |
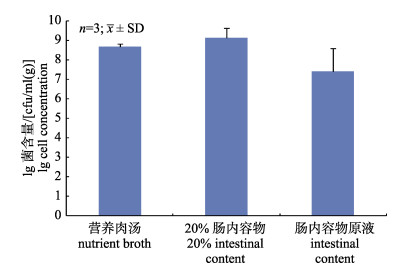
使用肠内容物为培养基在试管中培养Bli, 初始接种量约1.0×102 cfu/mL。Bli在20%肠内容物匀浆液中可生长至1.9×109 cfu/mL, 略高于营养肉汤的4.9×108 cfu/mL; 在肠内容物原液中可生长至2.0×107 cfu/g (图 6)。提示Bli在肠内容物中具有很强的增殖潜能。
|
图 6 地衣芽孢杆菌在肠内容物中的生长 Fig.6 Growth of Bacillus licheniformis in intestinal content |
相比陆生动物, 鱼类肠道菌群更容易受环境影响[2, 15]。Merrifield等[4-5]在研究拌饵投喂Bli和枯草芽孢杆菌时发现, 72 h换水15%的循环水系统中仍含有7.4×103 cfu/mL芽孢菌, 并建议应提高换水量以减少背景影响。通过每周100%换水, 可以将水体中Bli含量减少至低于检出限(< 1 cfu/mL)。当然, 完全换水必然会增加环境应激, 其对微生物定植的影响有待进一步研究。
3.2 Co60辐照灭菌能够消除饲料中芽孢杆菌对实验的干扰食物中的微生物是鱼类肠道微生物的重要来源, 特别是对严苛自然环境和鱼类胃肠环境均有较强耐受性的芽孢菌属。我国饲料卫生标准规定饲料菌含量 < 2×106 cfu/g即合格[16], 而实验中所用饲料含5.5×104 cfu/g的芽孢菌属细菌, 包括1.4×104 cfu/g的Bli。Merrifield等[4-5]研究拌饵投喂芽孢菌和屎肠球菌对虹鳟肠道菌群的影响, 发现投喂了对照饲料的鱼肠道也检出了芽孢菌和屎肠球菌。Balcázar等[17]研究外源添加乳酸菌在鱼肠道的动态变化时, 发现未添加乳酸菌的对照组鱼肠道也偶有乳酸菌检出。Merrifield等[5]认为对照组肠道内分离到的芽孢菌和乳酸菌有可能是鱼的内源性定植菌, 但我们认为不能排除是经饲料摄入的过路菌。所以, 益生菌定植研究最好使用Co60辐照灭菌处理的饲料, 从而减少实验的干扰因素。
3.3 52℃高温选择性培养地衣芽孢杆菌的方法具有较高的灵敏度和特异度52℃高温培养法可以有效抑制Bli以外的肠道和水体细菌的生长, 实验期间仅偶尔能在水体中检测到Anoxybacillus flavithermus; 以37℃菌落数为对照, 52℃生长率达91.5%, 在20%内容物和肠壁匀浆液中也能达到65.9%和72.5%, 说明此方法可以灵敏而特异的检测肠道和水体中Bli。这样一来, 1 g肠道样品制备成约5 mL的20%匀浆液, 100 μL涂板50个, 检出限就可以接近1 cfu/g, 只要控制实验鱼规格以控制肠道样品的重量, 肠道中存在1个活菌, 就可以被检出。Almeida等[18]报道了一种基于qPCR监测鱼肠道Bli数量的方法, 检出限为2.5×102 cfu/reaction。其它方法如PCR变性梯度凝胶电泳(PCR denaturing gradient gel electrophoresis, PCR-DGGE)[19]、荧光原位杂交(fluorescence in situ hybridization, FISH)和高通量测序[20]用于检测鱼类肠道中细菌数量的灵敏度能达到何种程度仍是个疑问, 尚未见资料给出明确的检出限。且也有研究提示PCR-DGGE的灵敏度尚不及传统培养法[19]。
3.4 喂食/禁食条件下地衣芽孢杆菌定植性的区别在于其不能黏附于肠粘膜但可以在肠内容物中增殖Marteau和Vesa[13]指出, 研究益生菌在肠道的定植能力有必要使用惰性对照, 益生菌在肠道内的维持时间需要比惰性对照长才能认为是可以定植的。Gs芽孢是惰性对照的优秀候选, 因其在肠道内既不会萌发生长也不会被破坏, 且可以很容易地通过50~70℃高温选择性培养进行平板计数[13-14]。在持续进食无菌饲料的条件下, 经水体外源添加的Bli可以在叉尾鮰肠道内维持至少42 d; 拌饵投喂的Bli同样在叉尾鮰肠道内维持至少28 d, 而一同拌饵投喂的惰性对照Gs芽孢则21 d后就从肠道彻底消失了。这些数据提示Bli可以长期定植于肠道。但是在禁食状态下, 经水体外源添加的Bli在14 d后就被彻底从肠道内清除了, 又提示Bli不能定植于叉尾鮰肠道。
微生物能否定植于肠道取决于两个因素——黏附能力和繁殖能力, 其增殖速度不低于肠道排泄速度就可以长期定植于肠道[2]。Merrifield等[4-5]拌饵投喂Bli和枯草芽孢杆菌后, 培养法检测虹鳟肠粘膜上黏附的芽孢杆菌, 含量为5.5~7.1×103 cfu/g, 占粘膜总菌量的36~75%, 提示其可以有效黏附于肠粘膜。但这很可能是肠壁粘膜洗涤不充分造成的假象。因为Merrifield等[10]使用透射电镜并未在肠道上皮细胞表面观察到Bli的黏附。且我们的实验数据也显示肠粘膜上的Bli仅占粘膜总菌量的(0.6±0.4)%。此外, 在以Gs为惰性对照的拌饵投喂实验中, Bli在内容物中相对丰度为197.9%, 略高于饲料中的186.4%, 而在肠壁粘膜上Bli相对丰度仅为23.7%, 同样说明Bli不能有效黏附于肠粘膜。但是, 这一数据也提示了惰性对照Gs在斑点叉尾鮰肠道并非完全“惰性”, 可能存在一定本底黏附力。最后, 长期监测数据显示7天后仅能在内容物中检出Bli, 而肠壁上无Bli检出, 也说明Bli只存在于内容物而不能有效黏附于肠粘膜。Merrifield等[10]提出假说认为不能黏附于上皮细胞的Bli可能通过在粘液层中快速增殖以维持稳定的种群数量。我们发现经灭菌的肠内容物原液可以有效支持Bli由1.0×102 cfu/g生长至2.0×107 cfu/g, 提示Bli在肠内容物中有很强的增殖潜能。这一数据支持Merrifield提出的假说。今后使用非灭菌肠内容物体外培养Bli, 或是更进一步直接观察Bli在体内的增殖情况将为这一假说提供更有说服力的证据。需要指出的是, 在肠道上皮和内容物之间尚有一层厚度不一的黏液层, 是肠道微生物定植的重要位置。我们制备的肠道内容物很可能包含了大部分的黏液层物质, 也就是说, 在进食状态下, Bli究竟定植于粘液层还是内容物仍有待进一步的研究。
综上所述, 因为Bli不能有效黏附于肠粘膜但可以在肠内容物中增殖, 所以在进食条件下, Bli利用丰富的食糜通过较强的繁殖能力弥补黏附能力的不足, 最终定植于肠道; 而在禁食条件下, 本就缺乏黏附能力的Bli又缺乏用于增殖的营养, 最终不能定植于肠道。
| [1] |
Gatesoupe F J. The use of probiotics in aquaculture[J]. Aquaculture, 1999, 180(1-2): 147-165. DOI:10.1016/S0044-8486(99)00187-8 |
| [2] |
Li X M, Ringø E, Hoseinifar S H, et al. The adherence and colonization of microorganisms in fish gastrointestinal tract[J]. Reviews in Aquaculture. (2018-03-25)[2019-03-07]. https://onlinelibrary.wiley.com/doi/10.1111/raq.12248.
|
| [3] |
Merrifield D L, Dimitroglou A, Foey A, et al. The current status and future focus of probiotic and prebiotic applications for salmonids[J]. Aquaculture, 2010, 302(1-2): 1-18. DOI:10.1016/j.aquaculture.2010.02.007 |
| [4] |
Merrifield D L, Bradley G, Baker R T M, et al. Probiotic applications for rainbow trout (Oncorhynchus mykiss Walbaum) Ⅱ. Effects on growth performance, feed utilization, intestinal microbiota and related health criteria postantibiotic treatment[J]. Aquaculture Nutrition, 2010, 16(5): 496-503. DOI:10.1111/j.1365-2095.2009.00688.x |
| [5] |
Merrifield D L, Dimitroglou A, Bradley G, et al. Probiotic applications for rainbow trout (Oncorhynchus mykiss Walbaum):Ⅰ. Effects on growth performance, feed utilization, intestinal microbiota and related health criteria[J]. Aquaculture Nutrition, 2010, 16(5): 504-510. DOI:10.1111/j.1365-2095.2009.00689.x |
| [6] |
Gobi N, Vaseeharan B, Chen J C, et al. Dietary supplementation of probiotic Bacillus licheniformis Dahb1 improves growth performance, mucus and serum immune parameters, antioxidant enzyme activity as well as resistance against Aeromonas hydrophila in tilapia Oreochromis mossambicus[J]. Fish & Shellfish Immunology, 2018, 74: 501-508. |
| [7] |
Gobi N, Malaikozhundan B, Sekar V, et al. GFP tagged Vibrio parahaemolyticus Dahv2 infection and the protective effects of the probiotic Bacillus licheniformis Dahb1 on the growth, immune and antioxidant responses in Pangasius hypophthalmus[J]. Fish & Shellfish Immunology, 2016, 52: 230-238. |
| [8] |
Raida M K, Larsen J L, Nielsen M E, et al. Enhanced resistance of rainbow trout, Oncorhynchus mykiss (Walbaum), against Yersinia ruckeri challenge following oral administration of Bacillus subtilis and B. licheniformis (BioPlus2B)[J]. Journal of Fish Diseases, 2003, 26(8): 495-498. DOI:10.1046/j.1365-2761.2003.00480.x |
| [9] |
El-Haroun E R, Goda A M A S, Kabir Chowdhury M A. Effect of dietary probiotic Biogen®; supplementation as a growth promoter on growth performance and feed utilization of Nile tilapia Oreochromis niloticus (L.)[J]. Aquaculture Research, 2006, 37(14): 1473-1480. DOI:10.1111/j.1365-2109.2006.01584.x |
| [10] |
Merrifield D L, Harper G M, Dimitroglou A, et al. Possible influence of probiotic adhesion to intestinal mucosa on the activity and morphology of rainbow trout (Oncorhynchus mykiss) enterocytes[J]. Aquaculture Research, 2010, 41(8): 1268-1272. |
| [11] |
Vos D P, Garrity M G, Jones D, et al. Bergey's Manual of Systematic Bacteriology[M]. New York: Springer Science/Business Media, 2009: 108.
|
| [12] |
Vos D P, Garrity M G, Jones D, et al. Bergey's Manual of Systematic Bacteriology[M]. New York: Springer Science/Business Media, 2009: 154.
|
| [13] |
Marteau P, Vesa T. Pharmacokinetics of probiotics and biotherapeutic agents in humans[J]. Bioscience and Microflora, 1998, 17(1): 1-6. DOI:10.12938/bifidus1996.17.1 |
| [14] |
Vesa T, Pochart P, Marteau P. Pharmacokinetics of Lactobacillus plantarum NCIMB 8826, Lactobacillus fermentum KLD, and Lactococcus lactis MG 1363 in the human gastrointestinal tract[J]. Alimentary Pharmacology and Therapeutics, 2000, 14(6): 823-828. DOI:10.1046/j.1365-2036.2000.00763.x |
| [15] |
Ringø E, Zhou Z, Vecino J L G, et al. Effect of dietary components on the gut microbiota of aquatic animals. A never ending story?[J]. Aquaculture Nutrition, 2016, 22(2): 219-282. DOI:10.1111/anu.12346 |
| [16] |
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Hygienical Standard for Feeds: GB 13078-2017[S]. Beijing: Standards Press of China, 2018: 5. [中华人民共和国国家质量监督检验检疫总局.饲料卫生标准: GB 13078-2017[S].北京: 中国标准出版社, 2018: 5.]
|
| [17] |
Balcázar J L, de Blas I, Ruiz-Zarzuela I, et al. Changes in intestinal microbiota and humoral immune response following probiotic administration in brown trout (Salmo trutta)[J]. British Journal of Nutrition, 2007, 97(3): 522-527. DOI:10.1017/S0007114507432986 |
| [18] |
Almeida E, Serra C R, Albuquerque P, et al. Multiplex PCR identification and culture-independent quantification of, Bacillus licheniformis, by qPCR using specific DNA markers[J]. Food Microbiology, 2018, 74: 1-10. DOI:10.1016/j.fm.2018.02.016 |
| [19] |
Ferguson R M W, Merrifield D L, Harper G M, et al. The effect of Pediococcus acidilactici on the gut microbiota and immune status of on-growing red tilapia (Oreochromis niloticus)[J]. Journal of Applied Microbiology, 2010, 109(3): 851-862. DOI:10.1111/j.1365-2672.2010.04713.x |
| [20] |
Xia Y, Lu M X, Chen G, et al. Effects of dietary Lactobacillus rhamnosus JCM1136 and Lactococcus lactis subsp. lactis JCM5805 on the growth, intestinal microbiota, morphology, immune response and disease resistance of juvenile Nile tilapia, Oreochromis niloticus[J]. Fish & Shellfish Immunology, 2018, 76: 368-379. |
 2019, Vol. 26
2019, Vol. 26

