2. 南京师范大学, 生命科学学院, 江苏 南京 210023
2. College of Life Science, Nanjing Normal University, Nanjing 210023, China
暗纹东方鲀(Takifugu fasciatus)俗称河鲀, “长江三鲜”之一, 是一种营养丰富、经济价值很高的硬骨鱼类, 在中国主要分布于渤海、东海、黄海及通海的江河中下游[1-5]。暗纹东方鲀在中国养殖和食用广泛, 其养殖基地主要分布在江苏、广东、上海、福建等一些省份[6]。根据河鲀产业调研报告(2017), 我国暗纹东方鲀的养殖年产量超过5万t, 河鲀养殖年产值在10亿~20亿元[7]。暗纹东方鲀作为中国重要的养殖鱼类之一, 具有广阔的开发和利用前景。
目前, 随着工农业大量的污染物排放到海洋和河口中加之含铜药物在水产养殖过程中大量的不规范使用, 致使养殖水体铜污染现象时有发生, 且已经严重威胁了水产养殖业的健康可持续发展[7-8]。研究表明铜是鱼类所必须的微量元素之一, 可作为细胞色素氧化酶、过氧化物歧化酶等酶的辅助因子广泛参与到鱼体内的许多生理生化过程中[9-10], 但过量的铜会对鱼类产生毒害作用。当前, 国内外有关水体铜暴露对鱼类的毒性作用及其机理已成为许多学者研究的重点和热点之一, 而且也已取得了诸多的研究成果。如华中农业大学的罗智教授系统地研究了铜暴露对黄颡鱼(Pelteobagrus fulvidraco)脂代谢的影响, 揭示了铜对黄颡鱼脂质代谢的调控机制以及内质网对于脂肪代谢的重要作用[11]。杨志彪等[12]以中华绒螯蟹(Eriocheir sinensis)为实验对象探究水体铜对中华绒螯蟹消化酶的影响, 得出水体铜对脂肪酶有诱导作用, 对类胰蛋白酶/胃蛋白酶/淀粉酶和纤维素酶活力有抑制作用。近年来国外学者也相继研究了铜暴露对鱼类的毒性作用, 总体归纳为铜暴露能够抑制鱼类的生长、激活抗氧化及免疫系统、诱导细胞凋亡等方面[9, 13-14]。在暗纹东方鲀养殖业中, 铜作为饲料添加剂、杀菌藻剂等被广泛使用, 但铜暴露对暗纹东方鲀毒性作用的研究还未见报道。本研究通过急性毒性实验研究水体铜暴露对暗纹东方鲀组织铜积累、氧化应激、消化酶、组织病变及脂代谢相关基因表达的影响, 通过本实验揭示铜对暗纹东方鲀的毒性作用, 确定铜对暗纹东方鲀的安全浓度, 为暗纹东方鲀养殖过程中铜的合理使用提供指导, 也为生产中更好地监控重金属污染提供一定的技术指标参考。
1 材料与方法 1.1 水体铜暴露处理实验用鱼采购自江之源渔业科技有限公司(江苏, 镇江)。正式实验之前将其饲养于南京师范大学的自动循环水系统中14 d, 进行驯化。驯化之后, 选择生理状态良好、统一规格的暗纹东方鲀225尾, 进行正式实验。鱼体重为(7.8±0.4) g, 体长(6.7±0.1) cm。将其随机平均分配到9个缸中(25尾/缸, 100 L)。根据前期预实验水体铜对暗纹东方鲀的96 h的半数致死浓度(96-h LC50)为0.2 mg/L。实验设置对照组、0.1 mg/L (50% 96-h LC50)和0.2 mg/L (96-h LC50)3个处理组, 每个处理组设3个重复。本实验以硫酸铜(CuSO4.5H2O, 分析纯)作为铜源, 溶解在超纯水中配置成浓度为1 g Cu/L的母液, 通过准确加入适当体积的母液到养殖水体中, 使离子铜的终浓度分别达到设置水平。实验进行96 h, 每天每缸换100%预配好的含离子铜的水。养殖期间水体温度为(27.3± 0.8)℃, pH 7.2, 持续曝气使水体中溶解氧 > 5 mg/L。
1.2 样品采集取样前每缸随机选取3条活鱼, 用10 mg/L MS-222进行麻醉, 迅速在冰上解剖, 取出肝和肠组织, 并用生理盐水(0.8%, 4℃)冲净血渍。将肝和肠的样本放置于–80℃冰箱保存, 用于酶活及脂代谢相关基因表达的测定。实验结束后, 每缸再取3尾鱼, 取出肝、肌肉及剩余组织保存于–20℃冰箱用于铜积累分析。将每缸剩余的鱼取出, 迅速在冰上解剖, 剪下肝小叶、左二鳃弓, 并用4%多聚甲醛固定液进行固定, 放置于4℃保存, 用于组织切片等分析。
1.3 组织铜含量的测定将冷冻样品取出, 烘干至恒重。准确称取干重0.1 g, 加2 mL浓硝酸(优级纯), 采用微波消解法消解, 消化条件为220℃, 30 min, 消化完全后定容至10 mL。电感耦合等离子体发射光谱仪(ICP-OES, Optima 7000, PerkinElmer, 美国)测定不同组织中铜含量, 结果以每克组织干重所含铜的微克数表示(μg/g)。
1.4 组织切片的病理学观察病理学观察采用苏木精—伊红染色法(HE染色法)观察。将固定好的组织在乙醇中脱水, 经二甲苯透明后, 将组织用石蜡包埋, 并使之冷却凝固成块, 在切片机上进行切片, 切片厚度为5~ 7 μm。切片用苏木精溶液、酒精伊红染料进行染色, 染色后切片经酒精脱水, 再经二甲苯使切片透明, 最后用树胶封片。在光学显微镜(Nikon Eclipse TE2000-U, NIKON, Japan)下拍照观察组织结构和细胞形态。
1.5 酶活性测定 1.5.1 抗氧化酶活性测定准确称取适量的组织, 按重量体积比加入9倍体积的浓度为8.6 g/L的生理盐水(经4℃预冷)后立即进行冰浴匀浆。匀浆结束后, 将匀浆液于4℃下850 g离心10 min, 收集上清液。上清液收集完毕后, 测定肝中的丙二醛(MDA)含量, 以及谷胱甘肽过氧化物酶(GSH-PX)、总超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性。
氧化指标MDA、GSH-PX、SOD和CAT的测定采用南京建成生物工程研究所试剂盒测定[15]。具体方法见试剂盒说明书。MDA单位定义为:每毫克组织蛋白中含MDA的纳摩尔数。GSH-PX酶活力定义为:每毫克蛋白质, 每分钟扣除非酶反应的作用, 使反应体系中GSH浓度降低1 μmol/L为1个酶活力单位。SOD酶活力定义为:每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个酶活力单位。CAT酶活力定义为:每毫克组织蛋白酶分解1 μmol H2O2的量为1个酶活力单位。匀浆液蛋白含量的测定采用Bradford的方法[16]。
1.5.2 消化酶活性测定蛋白酶、脂肪酶和淀粉酶活性的测定均采用试剂盒的方法(购自南京建成生物工程研究所, 江苏, 南京)。具体方法见试剂盒说明书。蛋白酶活力单位定义:在37℃, pH为8.0条件下, 每毫克蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003, 即为1个酶活力单位。脂肪酶活力单位定义为:在37℃条件下, 每毫升酶液在反应体系中与底物反应1 min, 每消耗1 mmol底物为1个酶活力单位。淀粉酶活力单位定义:组织中每毫克蛋白在37℃, pH为7.0条件下与底物作用30 min, 水解10 mg淀粉定义为1个淀粉酶活力单位。蛋白含量的测定采用Bradford的方法[16]。
1.6 肝脏脂代谢相关基因的表达参照我们近期发表的文章[17], 采用实时荧光定量PCR (qPCR)方法检测, 荧光定量引物见表 1。qPCR反应体系为20 μL, 其中上下游引物各1 μL, cDNA 4 μL, SYBR Green 10μL, RNase free H2O 4 μL。反应参数为: 95℃预变性30 s, 95℃变性5 s, 62℃变性20 s, 40个循环。选用18S RNA作为内参基因进行标准化, 相对表达水平采用2–ΔΔCt方法计算[18]。
|
|
表 1 暗纹东方鲀脂代谢相关基因的荧光定量PCR引物 Tab.1 Primers used for qPCR analysis of genes related to lipid metabolism |
实验数据采用Microsoft Excel 2016进行统计和作图, 采用SPSS 20.0进行单因素方差分析和Tukey多重比较检验不同处理的均值差异, 显著水平为P < 0.05。数据以平均值±标准误(mean±SE, n=3)表示。
2 结果与分析 2.1 铜积累如表 2所示, 随着铜处理浓度的提高, 铜在暗纹东方鲀肝、肌肉和全鱼中的积累量也提高。同等浓度处理下, 铜在暗纹东方鲀组织中的积累量为肝脏 > 全鱼> 肌肉。
|
|
表 2 急性铜胁迫96 h后对暗纹东方鲀组织铜积累的影响 Tab.2 Effects of acute Cu stress on tissues Cu accumulation in Takifugu fasciatus |
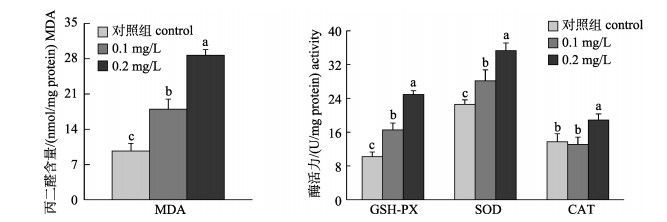
急性铜胁迫对暗纹东方鲀抗氧化系统产生了显著的影响。随着铜处理浓度的提高, 肝脏中MDA含量及抗氧化酶活性(GSH-PX, SOD和CAT)总体呈显著上升趋势(图 1)。
|
图 1 急性铜胁迫96 h后对暗纹东方鲀肝脏中丙二醛(MDA)含量及抗氧化酶活性[谷胱甘肽过氧化物酶(GSH-PX), 超氧化物歧化酶(SOD)和过氧化氢酶(CAT)]的影响 不同处理中含相同字母者表示差异不显著(P > 0.05). Fig.1 Effects of 96 h acute Cu stress on malondialdehyde (MDA) concentration and antioxidant enzyme activity (GSH-PX, SOD and CAT) in liver of Takifugu fasciatus The treatment with the same letter indicated that the difference is not significant (P > 0.05). |
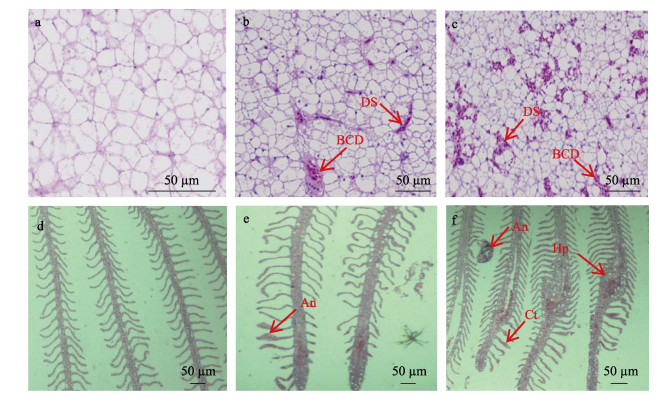
经过96 h的水体铜急性暴露后, 暗纹东方鲀的肝脏和鳃从外观上具有明显的病变特征。对照组的肝细胞结构和形态规则, 水体铜急性暴露诱发肝脏有血细胞沉积以及血窦扩张的症状。在鳃中, 水体铜急性暴露也诱发鳃上皮细胞增生, 顶部棒状以及产生动脉瘤等。随着处理浓度的提高, 这些症状愈加明显(图 2)。
|
图 2 暗纹东方鲀经96 h的水体铜急性暴露后肝脏和鳃的显微结构
a-c肝脏, d-f鳃。a、d:对照组; b、e : 0.1 mg/L铜处理; c、f : 0.2 mg/L铜处理. An表示动脉瘤, BCD表示血细胞沉积, Ct表示顶部棒状, DS表示血窦扩张, Hp表示上皮细胞增生.切片厚度为5~7 μm.切片用苏木精和伊红染料进行染色(HE染色). Fig.2 Effects of acute Cu stress on liver and gills morphology of Takifugu fasciatus after 96 h exposure a-c liver, d-f gills. a, d: control; b, e: 0.1 mg/L Cu treatment; c, f: 0.2 mg/L Cu treatment. An: aneurism, BCD: blood cell deposition in veins, Ct: clubbed tips, DS: dilatation of sinusoids, Hp: hyperplasia. Sections were 5-7 μm thick and stained with haematoxylin and eosin (HE). |
如表 3所示, 急性铜胁迫96 h后, 暗纹东方鲀肠道中的淀粉酶活性显著上升, 但脂肪酶活性显著下降。在0.1 mg/L处理组, 肠道中的蛋白酶活力显著高于对照组和0.2 mg/L处理组。在暗纹东方鲀肝脏中, 急性铜胁迫96 h后, 随着处理浓度的提高, 淀粉酶、蛋白酶和脂肪酶活性显著降低。
|
|
表 3 急性铜胁迫对暗纹东方鲀肠道中消化酶活性的影响 Tab.3 Effect of acute Cu stress on digestive enzyme activities in gut and liver of Takifugu fasciatus |
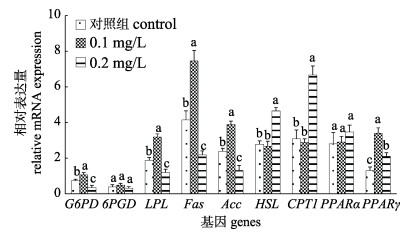
急性铜胁迫96 h后对暗纹东方鲀脂代谢相关基因的表达产生了显著影响。在0.1 mg/L处理组, 脂肪合成相关基因(G6PD、6PGD、LPL、Fas和Acc)的表达高于对照组和0.2 mg/L处理组, 其中0.2 mg/L处理组中脂肪合成基因表达量最低。但在0.2 mg/L处理组中, 脂肪分解相关基因(HSL和CPT 1)的表达显著高于对照组和0.1 mg/L处理组。急性铜胁迫96 h后对转运因子PPAR α的影响不显著, 但转运因子PPAR γ的表达量显著上升, 在0.1 mg/L处理组中有着最大的表达量(图 3)。
|
图 3 急性铜暴露96 h后对暗纹东方鲀肝脏中脂代谢相关基因表达的影响 脂肪合成相关基因(G6PD、6PGD、LPL、Fas和Acc), 脂肪分解相关基因(HSL和CPT 1)以及脂肪转运因子(PPAR α和PPAR γ)。不同处理中含相同字母者表示差异不显著(P > 0.05). Fig.3 Effects of acute Cu stress on the mRNA expression of genes involved in lipid metabolism in the liver of Takifugu fasciatus The genes involved in lipogenesis (G6PD, 6PGD, LPL, Fas and Acc), lipolytic (HSL and CPT 1) and transcription factors (PPAR α and PPAR γ). The treatment with the same letter indicated that the difference is not significant (P > 0.05). |
为了解铜在暗纹东方鲀体内的积累情况, 我们分析了肝脏、肌肉和全鱼中的铜的含量。在本研究中, 铜在肝脏、肌肉和全鱼中的积累量随着处理浓度的提高而提高, 说明铜在暗纹东方鲀体内的积累具有剂量依赖效应。此外, 96 h急性铜暴露之后, 肝中积蓄着最高浓度的铜, 这说明了肝是铜积累的靶器官。这些与Wang等[15]和Al-Bairuty等[19]研究结果一致。值得注意的是, 在肌肉中铜的积累量最低, 可能是由于铜在进入肌肉之前被首要的吸收和转运到其他组织, 例如肝。有研究表明, 肌肉中缺少铜结合蛋白[20]。因此, 肌肉不是主要的器官来存储铜, 这对人类食物安全至关重要。
3.2 急性铜暴露诱导暗纹东方鲀氧化应激动植物细胞在代谢过程中不断产生的自由基会被细胞本身具有的防御体系所清除, 在正常的生理条件下二者之间始终处于动态平衡, 一旦平衡状态被打破, 组织内的活性氧自由基会不断的聚积, 导致组织代谢出现异常并发生组织过氧化现象, 从而诱导产生一系列的病理及生理变化[21]。因此, 抗氧化酶系统对维持机体正常代谢和功能有着非常重要的作用[22]。铜在鱼类生理代谢过程中起着重要的作用, 然而, 当铜含量过高时会引起鱼体氧化胁迫和脂质过氧化作用[14]。鱼类抗氧化系统对水环境污染反应灵敏; 重金属与其他环境污染物类似, 通过氧化胁迫驱动毒性效应[13]。MDA被普遍用来评估脂质过氧化程度[23]。在本研究中, 肝脏中的MDA含量随着铜处理浓度的升高而升高, 说明了铜处理能够诱导暗纹东方鲀肝中的脂质过氧化作用, 引起组织损伤(图 2)。研究表明铜通过Fenton-type反应能够产生ROS, 从而诱导产生氧自由基激活抗氧化防御系统[24]。SOD酶和GSH能够转化超氧离子成为毒性较低的过氧化氢和水, 因此能够维持细胞内适当浓度的超氧离子, 从而保护细胞免受损伤[25]。Almeida等[26]报道镉离子能够提高大菱鲆(Scophthalmus maximus)肌肉中的GSH-PX和SOD活性。Sanchez等[13]报道铜离子能够诱导三棘鱼(Gasterosteus aculeatus)中的SOD和CAT活性提高。本研究显示在肝脏中, SOD、CAT和GSH-PX活性随着铜处理浓度的升高而升高, 说明了铜处理能够引起暗纹东方鲀肝脏的氧化胁迫, 激活体内的抗氧化防御系统, 但这种防御作用似乎弱于铜诱导的机体损伤, 对暗纹东方鲀产生了毒害作用。
3.3 急性铜暴露诱导暗纹东方鲀组织病变肝脏是鱼体代谢铜的中心组织, 并且肝组织损伤已经被作为一种参考来分析环境的污染程度[27]。在本研究中, 急性铜暴露96 h后, 肝组织显示出不同程度的损伤。这些损伤主要包括:血窦扩张和血细胞沉积在静脉中。有研究表明血窦扩张是铜诱导肝损伤的有力信号[9]。Al-Bairuty等[19]研究表明100 μg/L离子铜诱导虹鳟(Oncorhynchus mykiss)肝细胞坏死、血窦扩张及血细胞的沉积。王海涛等[28]研究表明0.88 mg/L铜诱导细鳞鲑(Brachymystax lenok)幼鱼肝脏血窦扩张, 这些与本研究结果类似, 说明铜诱导不同品种鱼类肝组织损伤的症状大体一致。
鳃是鱼类呼吸和渗透调节的器官, 重金属离子主要是由鳃吸收进入血淋巴, 其对鱼类的损害首先是从鳃开始的。已有的研究表明, 离子铜能对虹鳟的鳃造成严重的伤害, 并且能引起鳃生理功能的改变[19]。在本研究中, 离子铜处理诱导鳃上皮细胞増生, 二次片层顶部棒状, 鳃丝上动脉瘤。随着处理浓度的提高, 鳃的损伤程度越明显。这些结果和Al-Bairuty等[19]和Gomes等[23]报道一致。Griffitt等[29]认为二次片层基部増生増加了气体传送的距离, 甚至很小的増生都会影响氧气穿过鳃进入到体内的效率。因此, 本研究中离子铜处理可能会引起暗纹东方鲀的缺氧症状。Lappivaara等[30]认为这种缺氧根据鳃的损伤程度是可以恢复的。关于鳃的病变引起的游泳行为的改变需要进一步的研究。
3.4 急性铜暴露扰乱了暗纹东方鲀消化系统消化酶由消化腺和消化系统分泌, 主要功能是将食物分解成可吸收的小分子, 进而为机体的生理活动提供物质与能量。消化酶的活性会直接影响机体的消化能力以及对环境适应的能力, 同时也能直观的反映机体的生理状态。目前已发现重金属离子会影响到鱼类的消化酶活性。崔丽丽等[31]发现过量的铜离子对无齿相手蟹(Sesarma dehaani)的肝胰腺中的蛋白酶、淀粉酶、纤维素酶和类胰蛋白酶四种消化酶酶活表现出不同程度的抑制作用。铜离子浓度越高, 对酶的抑制作用越明显。陈肖肖等[8]利用不同浓度铜离子对泥蚶(Tegillarca granosa)进行处理, 表明实验后期内脏团消化酶活力与重金属浓度呈现负相关性。在本研究中, 急性铜胁迫96 h后, 随着处理浓度的提高, 暗纹东方鲀肝脏中的淀粉酶、蛋白酶和脂肪酶活性显著降低, 说明水体铜暴露抑制了暗纹东方鲀肝脏中的消化酶的分泌能力和消化能力。但是, 在暗纹东方鲀肠道中, 随着铜离子处理浓度的提高, 淀粉酶和蛋白酶活性呈先升高再下降的趋势, 此结果与张华等[32]报道铜离子对杂交鲟肠组织的消化酶影响的结果一致。这些结果表明(1)铜诱导的蛋白酶、脂肪酶和淀粉酶的变化具有组织特异性; (2)在低浓度胁迫下, 铜对暗纹东方鲀肠道中淀粉酶和蛋白酶活性表现为诱导作用, 当铜离子达到一定浓度时又对消化酶产生抑制作用, 会影响鱼类的摄食和对食物的消化。因此在水产养殖过程中, 一定要注意重金属离子的浓度。具体的0.1 mg/L铜处理组显著提高肠道淀粉酶和蛋白酶活性的原因还有待进一步研究, 比如:肠道微生物的作用。
3.5 急性铜暴露扰乱了暗纹东方鲀肝脏脂肪代谢脂类是鱼类主要的能源物质, 在生长、发育和繁殖的过程中发挥重要的作用。肝脏是脂类代谢最主要的部位, 脂肪的合成代谢与分解代谢的失衡会导致肝脏病变[7, 33]。大量的研究表明, 水体重金属暴露能够诱导鱼类脂代谢的失衡[9, 10, 33], 这些与本研究中的结果一致。但在本研究中发现, 在0.1 mg/L处理组, 脂肪合成相关基因(G6PD、6PGD、LPL、Fas和Acc)的表达显著高于对照组和0.2 mg/L处理组, 同时脂肪分解(HSL和CPT 1)相关基因的表达在0.1 mg/L处理组与对照组间差异不显著, 说明0.1 mg/L铜处理能够诱导暗纹东方鲀肝脏脂肪沉积。有关研究表明, 黄颡鱼肝脏中脂肪生成相关基因(6PGD、G6PD和Fas)的表达随着水体铜浓度的升高而逐渐降低[34], 这与本研究结果有些差异, 可能是由物种不同造成的。值得注意的是, 在0.2 mg/L铜处理组中, 暗纹东方鲀肝脏中脂肪合成基因的表达量最低, 并且脂肪分解相关基因的表达显著高于0.1 mg/L处理组和对照组。这些结果暗示着暗纹东方鲀可能通过分解脂肪提供能量来抵御高浓度铜的胁迫, 这与Wang等[15]和O'Brien等[35]研究结果一致。Chen等[34]通过慢性铜毒性实验研究表明, 与对照组比摄食量差异是黄颡鱼脂代谢合成基因表达下降的一个重要因素, 但在本实验96 h急性铜胁迫过程中, 暗纹东方鲀未经投喂(摄食量无差异), 但与对照组比0.2 mg/L铜处理仍显著抑制脂肪合成基因的表达。这些结果的差异可能是由急性毒性实验和慢性毒性实验的差异造成的。在本实验中, 急性铜胁迫96 h后对转运因子PPAR α的影响不显著, 但转运因子PPAR γ的表达量显著上升。研究表明, 动物的体脂沉积及脂类代谢受PPAR α和PPAR γ的调控。其中, PPAR α主要通过诱导脂肪酸氧化基因的表达从而调控脂肪的分解代谢; 而PPAR γ主要调节脂类的合成代谢, 促进体脂沉积。这与Zheng等[33]对黄颡鱼进行锌暴露后的研究结果相似。相关研究认为PPAR α基因的表达水平并没有显著变化, 但这并不足以排除其可能参与铜暴露影响鱼类脂类代谢的过程[33-34]。
4 小结急性铜暴露条件下, 离子铜能够积累在暗纹东方鲀组织中, 肝脏是铜积累的靶器官。急性铜胁迫能够诱导暗纹东方鲀肝脏氧化应激以及肝和鳃中的组织病变。同时暗纹东方鲀体内的消化酶活性及肝脂代谢相关基因的表达也被急性铜胁迫所扰乱。
| [1] |
Dai Y H, Zhan C F, Zhu A Q. Healthy and efficient culture experiment of Siniperca chuatsi in Takifugu obscurus scorpion[J]. Scientific Fish Farming, 2013(5): 34-35. [戴玉红, 展翠芬, 朱爱琴. 暗纹东方鲀套养鳜鱼健康高效养殖试验[J]. 科学养鱼, 2013(5): 34-35.] |
| [2] |
Cheng C H, Zhang M Y, Xu D P, et al. Analysis of genetic diversity in four Takifugu obscurus populations[J]. Journal of Huazhong Agricultural University, 2012, 31(5): 634-640. [程长洪, 张敏莹, 徐东坡, 等. 4个暗纹东方鲀群体的遗传多样性分析[J]. 华中农业大学学报, 2012, 31(5): 634-640. DOI:10.3969/j.issn.1000-2421.2012.05.021] |
| [3] |
Yang Z, Chen Y F. Induced ovulation in obscure puffer Takifugu Obscurus by injections of LHRH-A[J]. Aquaculture International, 2004, 12(2): 215-223. DOI:10.1023/B:AQUI.0000032082.17825.f2 |
| [4] |
Shi Y H, Zhang G Y, Zhu Y Z, et al. Effects of photoperiod, temperature, and salinity on growth and survival of obscure puffer Takifugu obscurus larvae[J]. Aquaculture, 2010, 309(1-4): 103-108. DOI:10.1016/j.aquaculture.2010.09.004 |
| [5] |
Yang Z, Chen Y F. Length-weight relationship of obscure puffer (Takifugu Obscurus) during spawning migration in the Yangtze River, China[J]. Journal of Freshwater Ecology, 2003, 18(3): 349-352. DOI:10.1080/02705060.2003.9663969 |
| [6] |
Wen X, Zhang X Y, Hu Y D, et al. iTRAQ-based quantitative proteomic analysis of Takifugu fasciatus liver in response to low-temperature stress[J]. Journal of Proteomics, 2019, 201: 27-36. DOI:10.1016/j.jprot.2019.04.004 |
| [7] |
Wang T, Wei X Z, Chen T Q, et al. Studies of the mechanism of fatty liver formation in Takifugu fasciatus following copper exposure[J]. Ecotoxicology and Environmental Safety, 2019, 181: 353-361. DOI:10.1016/j.ecoenv.2019.06.013 |
| [8] |
Chen X X. Effects of heavy metal Cd and Cu on toxicity of Tegillarca granosa[D]. Shanghai: East China University of Science and Technology, 2013. [陈肖肖.重金属Cd和Cu对泥蚶(Tegillarca granosa)的毒理学效应[D].上海: 华东理工大学, 2013.] http://cdmd.cnki.com.cn/Article/CDMD-10251-1013154808.htm
|
| [9] |
Shaw B J, Handy R D. Physiological effects of nanoparticles on fish:a comparison of nanometals versus metal ions[J]. Environment International, 2011, 37(6): 1083-1097. DOI:10.1016/j.envint.2011.03.009 |
| [10] |
Chen Q L, Luo Z, Pan Y X, et al. Differential induction of enzymes and genes involved in lipid metabolism in liver and visceral adipose tissue of juvenile yellow catfish Pelteobagrus fulvidraco exposed to copper[J]. Aquatic Toxicology, 2013, 136-137: 72-78. DOI:10.1016/j.aquatox.2013.04.003 |
| [11] |
So ng, Y F, Luo Z, Zhang L H, et al. Endoplasmic reticulum stress and disturbed calcium homeostasis are involved in copper-induced alteration in hepatic lipid metabolism in yellow catfish Pelteobagrus fulvidraco[J]. Chemosphere, 2016, 144: 2443-2453. DOI:10.1016/j.chemosphere.2015.11.031 |
| [12] |
Yang Z B. Studies on the toxic mechanism of water-borne Cu2+ on Eriocheir sinensis[D]. Shanghai: East China Normal University, 2005. [杨志彪.水体Cu2+对中华绒螯蟹(Eriocheir sinensis)毒性作用机制的研究[D].上海: 华东师范大学, 2005.]
|
| [13] |
Sanchez W, Palluel O, Meunier L, et al. Copper-induced oxidative stress in three-spined stickleback:relationship with hepatic metal levels[J]. Environmental Toxicology and Pharmacology, 2005, 19(1): 177-183. DOI:10.1016/j.etap.2004.07.003 |
| [14] |
Adeyemi J A, Klerks P L. Occurrence of copper acclimation in the least killifish Heterandria formosa, and associated biochemical and physiological mechanisms[J]. Aquatic Toxicology, 2013, 130-131: 51-57. DOI:10.1016/j.aquatox.2013.01.001 |
| [15] |
Wang T, Long X H, Cheng Y Z, et al. The potential toxicity of copper nanoparticles and copper sulphate on juvenile Epinephelus coioides[J]. Aquatic Toxicology, 2014, 152: 96-104. DOI:10.1016/j.aquatox.2014.03.023 |
| [16] |
Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1-2): 248-254. DOI:10.1016/0003-2697(76)90527-3 |
| [17] |
Wang T, Wen X, Hu Y D, et al. Copper nanoparticles induced oxidation stress, cell apoptosis and immune response in the liver of juvenile Takifugu fasciatus[J]. Fish & Shellfish Immunology, 2019, 84: 648-655. |
| [18] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT Method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [19] |
Al-Bairuty G A, Shaw B J, Handy R D, et al. Histopathological effects of waterborne copper nanoparticles and copper sulphate on the organs of rainbow trout (Oncorhynchus mykiss)[J]. Aquatic Toxicology, 2013, 126: 104-115. DOI:10.1016/j.aquatox.2012.10.005 |
| [20] |
Zhao J, Wang Z Y, Liu X Y, et al. Distribution of CuO nanoparticles in juvenile carp (Cyprinus carpio) and their potential toxicity[J]. Journal of Hazardous Materials, 2011, 197: 304-310. DOI:10.1016/j.jhazmat.2011.09.094 |
| [21] |
Griffitt R J, Weil R, Hyndman K A, et al. Exposure to copper nanoparticles causes gill injury and acute lethality in zebrafish (Danio rerio)[J]. Environmental Science & Technology, 2007, 41(23): 8178-8186. |
| [22] |
Hao L H, Wang Z Y, Xing B S. Effect of sub-acute exposure to TiO2 nanoparticles on oxidative stress and histopathological changes in juvenile carp (Cyprinus carpio)[J]. Journal of Environmental Sciences, 2009, 21(10): 1459-1466. DOI:10.1016/S1001-0742(08)62440-7 |
| [23] |
Gomes T, Pinheiro J P, Cancio I, et al. Effects of copper nanoparticles exposure in the mussel Mytilus galloprovincialis[J]. Environmental Science & Technology, 2011, 45(21): 9356-9362. |
| [24] |
Heinlaan M, Ivask A, Blinova I, et al. Toxicity of nanosized and bulk ZnO, CuO and TiO2 to bacteria Vibrio fischeri and crustaceans Daphnia magna and Thamnocephalus platyurus[J]. Chemosphere, 2008, 71(7): 1308-1316. DOI:10.1016/j.chemosphere.2007.11.047 |
| [25] |
Cao J L, Chen J J, Wang J D, et al. Effects of fluoride on liver apoptosis and Bcl-2, Bax protein expression in freshwater teleost, Cyprinus carpio[J]. Chemosphere, 2013, 91(8): 1203-1212. DOI:10.1016/j.chemosphere.2013.01.037 |
| [26] |
Almeida J A, Diniz Y S, Marques S F G, et al. The use of the oxidative stress responses as biomarkers in Nile tilapia (Oreochromis niloticus) exposed to in vivo cadmium contamination[J]. Environment International, 2002, 27(8): 673-679. DOI:10.1016/S0160-4120(01)00127-1 |
| [27] |
Amaral A F, Alvarado N, Marigomez I, et al. Autometallography and metallothione in immunohistochemistry in hepatocytes of turbot (Scophthalmus maximus L.) after exposure to cadmium and depuration treatment[J]. Biomarkers, 2002, 7(6): 491-500. DOI:10.1080/1354750021000034843 |
| [28] |
Wang H T, Xu G F, Tang S Z. Acute toxicity of copper to gill and liver of Juvenile Brachymystax lenok[J]. Chinese Journal of Fisheries, 2017, 30(2): 22-25. [王海涛, 徐革锋, 汤施展. 铜对细鳞鲑幼鱼鳃和肝组织的急性毒性[J]. 水产学杂志, 2017, 30(2): 22-25. DOI:10.3969/j.issn.1005-3832.2017.02.005] |
| [29] |
Griffitt R J, Weil R, Hyndman K A, et al. Exposure to copper nanoparticles causes gill injury and acute lethality in zebrafish (Danio rerio)[J]. Environmental Science & Technology, 2007, 41(23): 8178-8186. |
| [30] |
Lappivaara J, Nikinmaa M, Tuurala H. Arterial oxygen tension and the structure of the secondary lamellae of the gills in rainbow trout (Oncorhynchus mykiss) after acute exposure to zinc and during recovery[J]. Aquatic Toxicology, 1995, 32(4): 321-331. |
| [31] |
Cui L L. Studies on the toxic mechanism of water-borne Cu2+ on Searma dehaani[D]. Shanghai: East China Normal University, 2008. [崔丽丽.水体Cu2+对无齿相手蟹(Sesarma dehaani)毒性作用机制的研究[D].上海: 华东师范大学, 2008.] http://cdmd.cnki.com.cn/Article/CDMD-10269-2008146694.htm
|
| [32] |
Zhang H. Effect of four kinds of heavy metal ions on the behavioral and physiological index of hybrid sturgeon[D]. Baoding: Hebei Agricultural University, 2014. [张华.四种重金属离子对杂交鲟行为及生理指标的影响[D].保定: 河北农业大学, 2014.] http://cdmd.cnki.com.cn/Article/CDMD-10086-1015525877.htm
|
| [33] |
Zheng J L, Luo Z, Liu C X, et al. Differential effects of acute and chronic zinc (Zn) exposure on hepatic lipid deposition and metabolism in yellow catfish Pelteobagrus fulvidraco[J]. Aquatic Toxicology, 2013, 132-133: 173-181. DOI:10.1016/j.aquatox.2013.02.002 |
| [34] |
Chen Q L, Gong Y, Luo Z, et al. Differential effect of waterborne cadmium exposure on lipid metabolism in liver and muscle of yellow catfish Pelteobagrus fulvidraco[J]. Aquatic Toxicology, 2013, 142-143: 380-386. DOI:10.1016/j.aquatox.2013.09.011 |
| [35] |
O'Brien A J, Villani L A, Broadfield L A, et al. Salicylate activates AMPK and synergizes with metformin to reduce the survival of prostate and lung cancer cells ex vivo through inhibition of de novo lipogenesis[J]. Biochemical Journal, 2015, 469(2): 177-187. DOI:10.1042/BJ20150122 |
 2019, Vol. 26
2019, Vol. 26

